Способ получения вещества, обладающего антимикробной, противовирусной и иммуностимулирующей активностью, в частности, в отношении дендритных клеток, вещество, полученное этим способом, и фармацевтическая композиция на его основе
Иллюстрации
Показать всеИзобретения относятся к фармацевтической промышленности, в частности к способу получения вещества; к веществу, обладающему антимикробной, противовирусной и иммуностимулирующей активностью в отношении дендритных клеток, и к фармацевтической композиции, обладающей антимикробной, противовирусной и иммуностимулирующей активностью в отношении дендритных клеток. Способ получения вещества заключается в том, что проростки картофеля подвергают водной экстракции, затем водный экстракт отделяют от осадка, добавляют солевой агент с последующим концентрированием, раствор замораживают, размораживают, фильтруют, осадок удаляют, а из раствора кислым солевым агентом осаждают комплексный биополимер-сырец с последующей обработкой его раствором щелочи, затем щелочной раствор диализуют против дистиллированной воды на фильтре и из полученного раствора с помощью гель-проникающей хроматографии выделяют комплексный биополимер. Вещество, полученное вышеуказанным способом, представляет собой комплексный биополимер, содержащий полисахаридную, пептидную и липидную части. Фармацевтическая композиция содержит активное вещество, указанное выше, в эффективном количестве и фармацевтически приемлемый носитель или наполнитель. Вышеописанные изобретения позволяют получить вещество растительного происхождения полисахаридной природы с хорошим выходом, хорошо растворимое в воде и обладающее высокой антивирусной, антимикробной и иммуностимулирующей активностью в отношении дендритных клеток, а также приготовить фармацевтическую композицию на его основе, обладающую высоким фармакологическим действием. 3 н. и 7 з.п. ф-лы, 9 ил., 8 табл., 14 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к медицине, а именно к химико-фармацевтической промышленности и касается способа получения из растительного сырья вещества, обладающего антимикробной, противовирусной и иммуностимулирующей активностью в отношении дендритных клеток; вещества, полученного этим способом, и фармацевтической композиции на его основе.
Предшествующий уровень техники
Многие полисахариды растительного происхождения обладают несомненной биологической активностью и широко используются в лечебных целях. [Bhushan Patwardhan and Manish Gautam. Botanical immunodrugs:scope and opportunities. // Reviews • DRUG DISCOVERY TODAY. 2005. Vol. 10. P. 495-502]. По сравнению с бактериальными и синтетическими аналогами полисахариды растений не имеют побочных эффектов и характеризуются низкой токсичностью, что дает им значительные преимущества при разработке иммуномодулирующих, противоопухолевых и ранозаживляющих средств [Schepetkin I.A., Quinn М.Т.
Botanical polysaccharides: macrophage immunomodulation and therapeutic potential. // Int. Immunopharmacol. 2006. Vol. 6. P. 317-333.].
Роль дендритных клеток в иммунном ответе впервые была изучена Ральфом Штайнманом [Jacques Banchereau & Ralph М. Steinman Dendritic cells and the control of immunity, 1998, 19 MARCH, NATURE, VOL 392: 245-52]. Дендритные клетки играют ключевую роль в управлении иммунным ответом, они поглощают чужеродные антигены и стимулируют Т клеточный ответ. От них зависят результаты вакцинации и ответ иммунной системы на инфекции [Howard CJ, Charleston В, Stephens SA, Sopp P, Hope JC. The role of dendritic cells in shaping the immune response. Anim Health Res Rev. 2004 Dec; 5(2):191-5]. В связи с этим дендритные клетки привлекают пристальное внимание, как мишень для иммуномодулирующих лекарств [Mohty, М.; Gaugler, В.; Mami, N. В.; Olive, D. Regulation of Dendritic Cell Function with Immunomodulatory Drugs Current Medicinal Chemistry - Anti-Inflammatory & Anti-Allergy Agents, Volume 4, Number 2, April 2005, pp. 169-175(7)]
Известен способ получения из растительного сырья полисахаридов, обладающих иммуностимулирующим действием, путем обработки растительного сырья водным раствором формалина, выдерживания в подкисленной воде, с последующей экстракцией пектиновых полисахаридов водным раствором оксалата аммония, обработкой экстракта известным способом и лиофильной сушкой целевого продукта. В качестве растительного сырья используют пресноводные цветковые растения, например, любой вид ряски Lemna spp., предварительно измельченную свежую надземную часть высших растений, например, смолевки обыкновенной Oberna behen(L) (Ru 2149642 C1, A61 35/78, 27.05.2000). Однако полученные пектиновые вещества обладают очень низкой иммуностимулирующей активностью: индекс стимуляции нейтрофилов составлял от 1,09 до 1,12, а макрофагов - от 1,12 до 1,39 и не обладают активности относительно дендритных клеток.
Известно вещество, полученное из делящихся растительных клеток (кукурузы, картофеля, гриба), обладающее противоинфекционным действием и не обладающее гемагглютинирующим действием, названное гамма-плантом (γ-PL) (Л.А. Чекановская, Ru 2028303 C1, С08В 37/00). Описаны физико-химические характеристики биологически активного препарата «Гамма-плант». Вещество представляет собой гликопротеин с молекулярной массой 900-2000 кД, состоящий из углеводной и белковой частей в процентном массовом отношении 90:10. При этом углеводная часть гамма-планта на 70-80% состоит из глюкозы и 12-18% из уроновых кислот.
К недостаткам известного решения следует отнести митогенную активность вещества, которая может привести к поликлональной активации клеток, что делает опасным использование вещества в качестве лекарства, и отсутствие иммуностимулирующей активности в отношении дендритных клеток и макрофагов.
Известен также способ получения вещества, обладающего иммуностимулирующей, противовирусной и антибактериальной активностью, вещество, полученное этим способом и фармацевтическая композиция на его основе (RU №2195308 А61К 35/78, 27.12.2002). Данный способ получения включает в себя экстракцию измельченного растительного сырья водой, центрифугирование водного экстракта, его концентрирование, осаждение, очистку и сушку целевого продукта. В качестве растительного сырья используют растения семейства Dioscoreaceae, Plantaginaceae, Solanaceae. Осаждение проводят 96% этиловым спиртом в присутствии хлористого натрия. Полученный осадок повторно осаждают солевым или кислым агентом с последующей обработкой выделенного кислого пептидогликана-сырца раствором щелочи или насыщенным раствором соли щелочного металла. Очистку целевого продукта проводят с помощью гель-проникающей хроматографии. Вещество, полученное этим способом, представляет собой водорастворимый кислый пептидогликан с молекулярной массой 1200 кД - 40000 кД и массовым отношением между глюкозой и уроновыми кислотами, равным 1:2-4, пептидная часть молекулы кислого пептидогликана составляет 13±3 мас. %.
К недостаткам известного решения следует отнести сложность выделения (двойное переосаждение с использованием этилового спирта). Известное вещество не обладает иммуностимулирующей активностью в отношении дендритных клеток.
Раскрытие изобретения
Задачей данного изобретения является получение нового вещества растительного происхождения полисахаридной природы из доступного сырья с хорошим выходом, хорошо растворимого в воде и обладающего не только высокой антивирусной и антимикробной активностью, но и иммуностимулирующей активностью, особенно, в отношении дендритных клеток, а также разработка эффективного и технологичного способа его получения, и приготовления фармацевтической композиции на его основе, обладающей высоким фармакологическим действием.
Техническая задача решается за счет того, что разработан способ получения вещества, обладающего антимикробной, противовирусной и иммуностимулирующей активностью в отношении дендритных клеток, заключающийся в том, что измельченное растительное сырье, в качестве которого используют проростки картофеля, подвергают водной экстракции, затем водный экстракт отделяют от осадка, к нему добавляют солевой агент с последующим концентрированием полученного солевого раствора ультрафильтрацией на фильтре с порами пропускания 300 килодальтон (кД), после чего раствор замораживают на сутки, размораживают, фильтруют, полученный при этом осадок удаляют, а из раствора кислым солевым агентом осаждают водорастворимый комплексный биополимер (ВКБП) сырец с последующей обработкой его раствором щелочи, затем щелочной раствор диализуют против дистиллированной воды на фильтре и из полученного раствора с помощью гель - проникающей хроматографии выделяют комплексный биополимер. При этом в качестве солевого агента используют, преимущественно, хлористый натрий, в качестве кислого солевого агента на стадии осаждения используют неорганическую соль, например, хлористый аммоний либо сульфат аммония, а щелочной раствор диализуют против дистиллированной воды на фильтре с порами пропускания 12 кД.
Полученное вещество, обладает антимикробной, противовирусной и иммуностимулирующей активностью в отношении дендритных клеток, и представляет собой комплексный биополимер, содержащий полисахаридную, пептидную и липидную части.
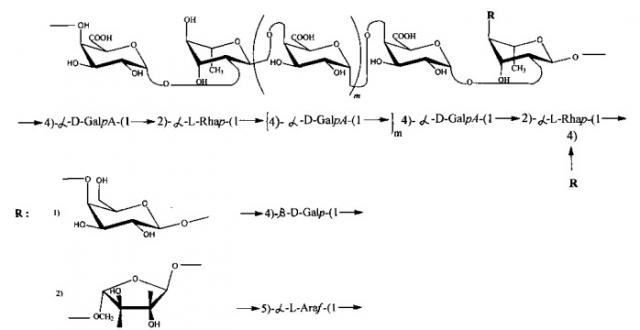
Полисахаридная часть молекулы составляет 40-60% и имеет следующую структуру:
где m=3 - 5, каждый второй остаток α-L-Rhap несет заместитель R,
где R - моносахаридные или олигосахаридные остатки β-D-галактопиранозы, несущие, в свою очередь, моносахаридные или олигосахаридные остатки α-L-арабинофуранозы, при массовом соотношении между рамнозой и галактуроновой кислотой от 1:6 до 1:4.
Пептидная часть молекулы кислого комплексного биополимера составляет от 4 до 20%. Липидная часть молекулы представлена жирными кислотами и составляет от 2 до 7%. При этом молекулярная масса вещества составляет 500-17000 кД. Создана фармацевтическая композиция, обладающая антимикробной, противовирусной и иммуностимулирующей активностью в отношении дендритных клеток, характеризующаяся тем, что она содержит созданное активное вещество в эффективном количестве и фармацевтически приемлемый носитель или наполнитель.
Описание фигур
Фиг. 1.
Типичный для ВКБП ЯМР 13С спектр 3-5% раствора в D2O при 55°C. Прибор DRX 600 MHz NMR Spectrometer фирмы Bruker (Германия).
По данным ЯМР 13C и 1Н ПМР спектров, а также по данным двумерных спектров COSY, TOCSY, ROESY и HSQC были сделаны отнесения химических сдвигов полисахаридной части молекулы водорастворимого кислого комплексного биополимера (таблица 3) и на основании этого выведена структурная формула полисахаридной части ВКБП
Фиг. 2.
Типичный для ВКБП 1Н ПМР спектр 3-5% раствора в D2O при 55°C. Прибор DRX 600 MHz NMR Spectrometer фирмы Bruker (Германия) (внутренний стандарт - ТМСП). Также использован для построения структурной формулы ВКБП.
Фиг. 3.
Структурная формула полисахаридной части ВКБП. Спектры расшифрованы с применением двумерных гомоядерных спектров COSY. TOCSY. ROESY и гетероядерного спектра 1Н/13С HMQS/
где: m=3-5, каждый второй остаток α-L-Rhap несет заместитель R,
где R - моносахаридные или олигосахаридные остатки β-D-галактопиранозы, несущие, в свою очередь, моносахаридные или олигосахаридные остатки α-L-арабинофуранозы, при массовом соотношении между рамнозой и галактуроновой кислотой от 1:6 до 1:4.
Фиг. 4.
Влияние ВКБП на сортированные дендритные клетки селезенки мыши. А - чистота сортированных дендритных клеток. В - гистограмма экспрессии CD80, С - гистограмма экспрессии CD86, черная линия - инкубация с ВКБП, серая линия - контроль (инкубация без добавления ВКБП), прерывистая линия - изотипический контроль для ВКБП, точечная линия - изотипический контроль для инкубации без ВКБП. D - нормированные данные по увеличению экспрессии CD80 и CD86 под влиянием ВКБП. Приведены средние значения и стандартные отклонения по 3 экспериментам. Достоверность отличия *Р<0.05.
Фиг. 5.
ВКБП индуцирует выработку цитокинов IL-6, МСР-1, TNF-α макрофагами мыши in vitro. А - TNF-alpha (1) и IL-6 (2), В - МСР-1, ось абсцисс - ВКБП, мкг/мл, ось ординат - пг/мл. Приведены средние значения и стандартные отклонения по 3 экспериментам.
Фиг. 6.
ВКБП индуцирует выработку NO в культуре макрофагов мыши in vitro.
Фиг. 7.
ВКБП усиливает экспрессию CD86 и CD69 на дендритных клетках человека. А - анализ методом проточной цитометрии, выделение миелоидных дендритных клеток (mDC) как LinlnegCDllchighCD123negHLA-DRhlgh, В - гистограммы экспрессии CD86 и CD69 на популяции mDC дендритных клеток человека.
Фиг. 8.
Фармацевтическая композиция ВКБП в изотоническом растворе хлорида натрия (А), в изотоническом растворе хлорида натрия с глюкозой (В) и в растворе Рингера (С) индуцирует продукцию цитокинов МСР-1 (1) и IL-6 (2) в организме мышей. Ось абсцисс - часы после введения препарата, ось ординат - концентрация (пг/мл) цитокина в культуральной жидкости. Приведены средние значения и стандартные отклонения по 3 мышам.
Фиг. 9.
ВКБП обладает противовирусным действием в отношении вируса ЦМВ. Клетки ФЛЭЧ в концентрации 2×105 кл/мл инкубировали в течение 5 суток в присутствии 10-4 БОЕ/кл цитомегаловируса и различных концентраций ВКБП. Определяли количество ЦМВ-инфицированных бляшек иммунопероксидазным методом с использованием моноклональных антител к белкам вируса. Ингибирующее действие определяли путем вычисления процентного отношения количества инфицированных клеток (бляшек) в опытной культуре, предварительно обработанной тестируемым веществом, к количеству бляшек в культуре контрольных необработанных клеток.
Предлагаемый способ получения вещества, обладающего высокой антимикробной, противовирусной и иммуностимулирующей активностью в отношении дендритных клеток, заключается в том, что измельченное растительное сырье, в качестве которого используют проростки картофеля, подвергают водной экстракции, затем водный экстракт центрифугируют, добавляют солевой агент, с последующим концентрированием полученного солевого раствора ультрафильтрацией на фильтре с порами пропускания 300 кД, после чего раствор замораживают на сутки, размораживают, фильтруют, полученный при этом осадок удаляют, а из раствора кислым солевым агентом осаждают комплексный биополимер-сырец с последующей обработкой его раствором щелочи, затем щелочной раствор диализуют против дистиллированной воды на фильтре с порами пропускания 12 кД, и из полученного раствора методом гель-проникающей хроматографии выделяют комплексный биополимер с молекулярной массой 500-17000 кД.
В качестве солевого агента используют, преимущественно, хлористый натрий, а в качестве кислого солевого агента на стадии осаждения используют кислую неорганическую соль.
Отличительной особенностью способа от известного (RU №2195308 А61К 35/78) является проведение стадии концентрирования путем ультрафильтрации именно солевого раствора, в частности, содержащего NaC(, водного экстракта на фильтре с порами пропускания 300 кД, проведение дополнительной стадии замораживания раствора, полученного после ультрафильтрации, а также проведение стадии осаждения только кислым солевым агентом и проведение дополнительной стадии диализа перед хроматографической очисткой.
Совокупность особенностей предложенного способа и осуществление указанной выше последовательности операций позволило получить новое вещество, хорошо растворимое в воде, с хорошим выходом и обладающее иммуностимулирующей активностью в отношении дендритных клеток и сильно выраженной противовирусной и антимикробной активностью. Полученное новое вещество (его изученная часть) - это водорастворимый кислый комплексный биополимер с молекулярной массой 500-17000 кД, содержащий полисахаридную, пептидную и липидную части, где полисахаридная часть составляет 40-60%, пептидная часть составляет от 4 до 20%, липидная часть составляет от 2 до 7% и содержит жирные кислоты, в основном, пальмитиновую кислоту.
По данным ЯМР 13С (типичный ЯМР 13С спектр - фигура 1) и 1Н ПМР спектроскопии (типичный 1Н ПМР спектр - фигура 2), а также по данным двумерных спектров COSY, TOCSY, ROESY и HSQC были сделаны отнесения химических сдвигов полисахаридной части молекулы ВКБП (таблица 3) и определена следующая структурная формула ВКБП, приведенная на фигуре 3, а именно:
где: m=3-5, а каждый второй остаток α-L-Rhap несет заместитель R,
где R - моносахаридные или олигосахаридные остатки β-D-галактопиранозы, несущие, в свою очередь, моносахаридные или олигосахаридные остатки α-L-арабинофуранозы, при массовом соотношении между рамнозой и галактуроновой кислотой от 1:6 до 1:4.
Проведение стадии ультрафильтрации именно солевого раствора (NaCl) водного экстракта на фильтре с порами пропускания 300 кД позволило устранить нековалентное взаимодействие внутри полимеров и мономеров водного экстракта, тем самым более тщательно удалить многочисленные низкомолекулярные (меньше 300 кД) примеси и выделить более чистыми полимерные вещества с молекулярной массой выше 300 кД.
При дополнительном введении стадии замораживания-оттаивания удалось очистить кислый комплексный биополимер от неактивных, труднорастворимых полимеров, например, глюканов, что в дальнейшем позволило получить комплексный биополимер, не содержащий глюкозу, и тем самым повысить его чистоту и гомогенность, а соответственно и активность.
Осаждение полимеров проводили в одну стадию, без спиртового высаживания и в качестве солевого агента использовали кислую неорганическую аммониевую соль. Предложенная нетрадиционная ультрафильтрация на стадии концентрирования и дополнительная стадия замораживания-оттаивания позволили также исключить спиртовое высаживание.
Осаждение кислым солевым агентом и удаление осадка после замораживания-оттаивания позволило выделить кислый комплексный биополимер-сырец, отделив его от многочисленных сопутствующих примесей - полисахаридов, белков и иных полимеров с молекулярной массой выше 300 кД.
При очистке целевого продукта с помощью гель-проникающей хроматографии на колонках с TSK HW-75F или TSK HW-65F собирают целевой продукт с молекулярной массой от 500 кД до 17000 кД.
Вещество (ВКБП), полученное настоящим способом новое по своим структурным частям, является комплексным биополимером, содержащим полисахаридную, пептидную и липидную части, и отличается от известного кислого пептидогликана (патент RU №2195308 А61К 35/78, 27.12.2002), при этом имеет следующие характерные признаки:
1. Полисахаридная часть не содержит глюкозу. В полисахаридную часть молекулы входят галактуроновая кислота как главный моносахарид, галактоза, арабиноза, рамноза (см. структурную формулу на фигуре 3).
Массовое отношение между рамнозой и галактуроновой кислотой, по данным ЯМР спектров, составляет от 1:6 до 1:4, тогда как для известного кислого пептидогликана (патент RU №2195308 А61К 35/78) это отношение составляет около от 1:12 до 1:8,5.
2. Пептидная часть молекулы ВКБП составляет 4-20 мас. %, тогда как для известного кислого пептидогликана (патент RU №2195308 А61К 35/78) она составляла 13+3%.
3. Липидная часть молекулы состоит из жирных кислот.Количество жирных кислот в образце составляет 2-7%, преимущественно, пальмитиновая кислота (С-16). Известный же пептидогликан (патент RU №2195308 А61К 35/78) не содержит липидной части.
Кроме изученных структурных частей, новое вещество (ВКБП) содержит неизвестные новые химические структурные элементы, которые и составляют остальное процентное содержание вещества.
4. Новое вещество (ВКБП), полученное по описанному выше способу, обладает такими свойствами, как иммуностимулирующая активность в отношении дендритных клеток, высокая антимикробная и противовирусная активность. Вещество характеризуется хорошей растворимостью в воде, что позволило создать фармацевтическую композицию из заявленного вещества с использованием фармацевтически приемлемых носителей или наполнителей, взятых в эффективном количестве.
5. Способ позволяет получать целевой продукт с хорошим выходом.
Примеры осуществления заявленного изобретения
Пример 1.
Получение вещества ВКБП.
5 кг проростков картофеля (партия №1) измельчают, прибавляют 10 литров воды и экстрагируют при комнатной температуре при перемешивании в течение 2 часов. Смесь отжимают с помощью механического пресса. К водному экстракту прибавляют 500 г. хлористого натрия, растворяют его и раствор концентрируют до объема 1 литр путем ультрафильтрации на фильтре 300 кД.
Раствор замораживают на сутки. После размораживания и фильтрации проводят осаждение комплексного биополимера кислым солевым агентом -хлористым аммонием. Для этого к 1 литру концентрата прибавляют 1 литр насыщенного солевого раствора хлористого аммония. Выпавший осадок отделяют центрифугированием, к нему прибавляют 50 мл дистиллированной воды и при перемешивании прикапывают 25% раствор аммиака до полного растворения осадка. Раствор диализуют против дистиллированной воды через мембрану с порами пропускания 12 кД.
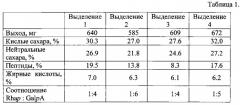
Полученный раствор наносят на колонку TSK HW-75F. Колонку элюируют дистиллированной водой. Собирают высокомолекулярный пик с молекулярной массой от 500 кД до 17000 кД. Раствор концентрируют на роторном испарителе и сушат лиофильно. Выход целевого продукта (ВКБП) составляет 640 мг.
Количество кислых сахаров определяют по цветной реакции с 3,5-диметилфенолом в концентрированной серной кислоте (A.I. Usov, M.I. Bilan, N.G. Klochkova. - Botanica Marina, 1995, 38, 43-51). Количество кислых сахаров, составляет 30,3%.
Количество нейтральных сахаров определяют методом ГЖХ в виде их ацетатов полиолов (P. Albersheim. - Methods Enzymol., 1987, 118, 3-40). Количество нейтральных сахаров в ВКБП составляет 26,9%.
Количество пептида определяют методом Лоури с использованием бычьего сывороточного альбумина в качестве стандарта (О.Н. Lowry, N.J. Rosenbrough et al., J. Biol. Chem., 1951, 193, 265-275). Количество пептида, в ВКБП составляет 19,5%.
Жирные кислоты определяют методом ГЖХ в виде метиловых эфиров жирных кислот, полученных метанолизом полисахарида 1М HCl в метаноле (100°C, 5 ч). В качестве внутреннего стандарта прибавляют метиловый эфир лауриновой кислоты (С-12). Количество жирных кислот в образце составляет 7%, преимущественно пальмитиновая кислота (С-16).
По ПМР спектру рассчитываем отношение Rhap:GalpA как 1:6 (химический сдвиг 5,67 и 1,60).
Анализ молекулярной массы проводят методом гель-проникающей хроматографии: колонка d=10 mm, L=500 mm, наполнитель - Toyopearl HW75F, жидкая фаза - 0,05% азид натрия в воде деионизированной, скорость элюции 0,6 мл/мин, RI-детектор Gilson 131. Калибровка построена на основе стандартных декстранов 500 кД, 1500 кД, 3000 кД, 17000 кД (Polymer Standards Service GmbH, Германия). В указанных условиях хроматографии молекулярная масса ВКБП лежит в диапазоне от 500 до 17000 кД.
В таблице 1 представлены данные о выходе и составе ВКБП, полученного из четырех партий ростков картофеля способом, описанным в данном примере.
Пример 2. Получение вещества ВКБП
Этот пример аналогичен примеру 1, но в качестве солевого агента используют хлористый калий.
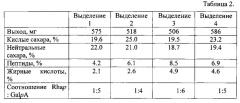
Выход целевого продукта составляет 575 мг. Количество кислых сахаров составляет 19,6%, нейтральных сахаров - 22,0%, пептида (по методу Лоури) - 4,2%, жирных кислот - 2,1%. По ПМР спектру рассчитываем соотношение Rhap:GalpA как 1:5 (химический сдвиг 5,66 и 1,60).
Процедура выделения целевого продукта повторяется еще на трех партиях ростков картофеля.
В таблице 2 представлены данные о выходе и составе ВКБП, полученного из четырех партий ростков картофеля способом, описанным в данном примере.
Пример 3. Получение вещества ВКБП
Этот пример аналогичен примеру 1, но после размораживания и фильтрации осаждение ВКБП проводят кислым солевым агентом -сульфатом аммония.
Выход целевого продукта составляет 509 мг. Количество кислых сахаров составляет 19,6%, нейтральных сахаров - 20,5%, пептида (по методу Лоури) - 5,1%, жирных кислот - 5,6%. По ПМР спектру рассчитываем соотношение Rhap:GalpA как 1:4 (химический сдвиг 5,66 и 1,60).
Пример 4. Получение вещества ВКБП
Этот пример аналогичен примеру 1.. Выпавший осадок после солевого высаживания отделяют центрифугированием, растворяют путем прибавления 50 мл дистиллированной воды и при перемешивании прикапывают 10% раствор щелочи (гидроксида натрия) до полного растворения осадка. Раствор диализуют против дистиллированной воды через мембрану с порами пропускания 12 кД.
Выход целевого продукта составляет 593 мг. Количество кислых сахаров составляет 26,6%, нейтральных сахаров - 20,3%, пептида (по методу Лоури) - 6,7%, жирных кислот - 8,4%. По ПМР спектру рассчитываем соотношение Rhap:GalpA как 1:6 (химический сдвиг 5,66 и 1,60).
Пример 5.
Структурный анализ полисахаридной части ВКБП.
ЯМР 13С спектры растворов ВКБП концентрации 3-5% в D2O снимали на приборе DRX 600 MHz NMR Spectrometer фирмы Bruker (Германия) при 55°C (внутренний стандарт-ТМСП). При снятии двумерных спектров COSY, TOCSY, ROESY и HSQC использовали стандартные методики фирмы Bruker.
Отнесение химических сдвигов проводили согласно справочным данным (Advances in carbohydrate chemistry and biochemistry, vol. 42, 1984, p.193-225), и последним литературным данным в области ЯМР спектроскопии полисахаридов.
По данным ЯМР 13С (типичный ЯМР 13С спектр - фигура 1) и 1Н ПМР спектроскопии (типичный 1Н ПМР спектр - фигура 2), а также по данным двумерных спектров COSY, TOCSY, ROESY и HSQC были сделаны отнесения химических сдвигов полисахаридной части молекулы ВКБП (таблица 3). В таблице 3 представлены химические сдвиги фрагментов полисахаридной части молекулы ВКБП.
ВКБП имеет полисахаридную часть со структурой, приведенной на фигуре 3.
где: m=3-5, каждый второй остаток α-L-Rhap несет заместитель R,
где R - моносахаридные или олигосахаридные остатки β-D-галактопиранозы, несущие, в свою очередь, моносахаридные или олигосахаридные остатки α-L-арабинофуранозы, при массовом соотношении между рамнозой и галактуроновой кислотой от 1:6 до 1:4.
Пример 6. Приготовление фармацевтической композиции ВКБП
Фармацевтическую композицию создают путем смешивания сухого лиофилизированного препарата ВКБП с фармацевтическими изотоническими растворами. Концентрации активного вещества ВКБП были использованы в диапазоне от 0,3 мкг/мл до 3000 мкг/мл. В качестве изотонических растворов используют физиологический раствор (0,9 г хлорида натрия на 100 мл воды для инъекций), фармацевтический изотонический раствор хлорида натрия с глюкозой (состав: 9,0 г хлорида натрия; 50,0 г глюкозы в 1000 мл воды для инъекций), фармацевтический раствор Рингера (состав: натрия хлорид 8,6 г, кальция хлорид 0,33 г калия хлорид 0,3 г в 1000 мл мл воды для инъекций).
Навеску каждой соли и в конце активное вещество последовательно полностью растворяют в примерно 90 мл воды для инъекций и доводят вес раствора до 100 г водой для инъекций.
Растворы стерилизуют путем фильтрования через фильтр 0,22 мкм.
В примерах 7-9 показано, что ВКПБ в фармацевтической композиции оказывает активирующее действие на дендритные клетки и макрофаги мыши и человека, повышая экспрессию поверхностных ко-стимуляторных молекул и стимулируя выработку цитокинов.
В примерах 10-12 показано, что фармакологическая композиция ВКПБ стимулирует выработку цитокинов в организме животного.
В примере 13 показано, что фармакологическая композиция ВКПБ обладает антимикробным действием.
В примере 14 показано, что фармакологическая композиция ВКПБ обладает противовирусным действием.
Пример 7.
ВКБП оказывает иммуностимулирующее действие на дендритные клетки, выделенные из селезенки мыши.
Фармацевтическую композицию создают путем растворения 0,015 г ВКБП в 100 мл физиологического раствора (0,9 г хлорида натрия на 100 мл воды для инъекций).
Для опытов были использованы лабораторные мыши линии BALB/c, самки весом 18-20 г, полученные из питомника «Столбовая». Мышей умерщвляли в камере с СО2. В асептических условиях извлекали и измельчали селезенку, мононуклеарные клетки выделяли на фиколле 1,09 г/см (1500 об/мин, при 15°C, 25 мин), затем дважды отмывали центрифугированием (1200 об/мин, при 4°C, 10 мин) в фосфатном солевом буфере (10 мМ Na2HPO4, 137 мМ NaCl, и 2,7 мМ KCl), дополненном 0,5% БСА, 1% глюкозы, 10 mM HEPES, pH 7.3-7.5 (полный ФСБ). Выделенные мононуклеарные клетки селезенки ресуспензировали в полном ФСБ и окрашивали смесью антител CD19 FITC, I-A РЕ, CD11c PerCP-Cy5-5 (BD Biosciences) в течение 20 мин при 4°C, отмывали полным ФСБ, ресуспензировали в этом же растворе в концентрации 20-30 млн/мл. Дендритные клетки сортировали на приборе BD FACSAria™ II Cell Sorter (BD Biosciences) по сочетанию маркеров CD19-, CD11c+, I-A+. Чистота сортированных дендритных клеток составляла 97-99%. (фигура 4). Выделенные дендритные клетки суспензировали в полной культуральной среде (RPMI-1640 с добавлением 10% эмбриональной телячьей сыворотки, ЭТС, 2 мМ L-глютамина, заменимых аминокислот, 1 мМ пирувата натрия, 50 мкМ β-меркаптоэтанола, 100 ЕД/мл пеницллина и 100 ЕД/мл стрептомицина) в концентрации 105 клеток в 1 мл и вносили в лунки 96-луночной панели по 20000 клеток в 200 мкл среды на лунку в дуплетах.
В опытные культуры дендритных клеток вносили ВКБП в концентрации 10 мкг/мл. В контрольные культуры дендритных клеток вносили соответствующий объем физиологического раствора. Культуры инкубировали в течение 20 часов (37°C, 5% СО2). После окончания инкубации содержимое лунок промывали полным ФСБ, переносили в центрифужные микропробирки, центрифугировали 1200 об/мин в течение 8 мин. К осадку добавляли смесь антител CD80 FITC и CD86 АРС, инкубировали 20 мин при 4°C, отмывали полным ФСБ, и клетки ресуспензировали в 200 мкл этого же раствора с добавлением 2 мкг/мл DAPI. Экспрессию CD80 и CD86 на дендритных клетках анализировали на приборе BD FACSAria™ II Cell Sorter (BD Biosciences). Результаты экспериментов (табл. 4) свидетельствуют, что под влиянием ВКБП на поверхности дендритных клеток достоверно (р<0.05) увеличивается экспрессия костимуляторных молекул CD80 и CD86, необходимых для представления дендритными клетками антигенов Т клеткам с последующей активацией последних. Повышение экспрессии костимуляторных молекул CD80 и CD86 на дендритных клетках мыши под влиянием ВКБП представлено в таблице 4.
Примечание. Приведены средние значения и стандартные отклонения по трем образцам, нормированные на соответствующие средние значения по трем контрольным образцам. Контрольные образцы дендритных клеток инкубировали в полной культуральной среде без каких-либо стимулирующих лигандов.
Пример 8.
ВКБП активирует экспрессию костимуляторной молекулы CD86, продукцию цитокинов IL-12, IL-6, МСР-1, TNF-α и выработку NO дендритными клетками и макрофагами мыши костномозгового происхождения.
Фармацевтическую композицию создают путем растворения 0,015 г ВКБП в 100 мл физиологического раствора (0,9 г хлорида натрия на 100 мл воды для инъекций).
Повышение экспрессии молекул CD86 на поверхности дендритных клеток мыши при воздействии ВКБП.
Для опытов были использованы лабораторные мыши линии BALB/c, самки весом 18-20 г, полученные из питомника «Столбовая». Мышей умерщвляли в камере с CO2, В асептических условиях из бедренных костей мыши с помощью полного ФСБ и шприца с иглой G25 вымывали костный мозг.Клетки суспензировали в полном ФСБ, осаждали в центрифуге (1200 об/мин 10 мин), эритроциты лизировали гипотоническим шоком, добавляя 9 мл стерильной дистиллированной воды на 15 сек, останавливали лизис добавлением 1 мл 10-кратного раствора Хэнкса, затем 20 мл раствора полного ФСБ. Клетки осаждали, суспензировали в полном ФСБ. Подсчет концентрации и жизнеспособности клеток осуществляли методом проточной цитометрии с использованием калибровочных шариков и красителя пропидиум иодид (2 мкг/мл) на приборе BD FACSAria™ II Cell Sorter (BD Biosciences).
10 млн клеток костного мозга в 10 мл полной культуральной среды (DMEM, дополненная 10% ЭТС, 2 мМ L-глютамина, заменимыми аминокислотами, 1 мМ пирувата натрия, 50 мкМ β-меркаптоэтанола, 100 ЕД/мл пенициллина и 100 ЕД/мл стрептомицина) с добавлением 10 нг/мл GM-CSF (GIBCO) культивировали в 90 мм чашках Петри в течение 9 дней.
Замену среды (с добавлением GM-CSF) производили на 3-й и 6-ой дни после начала культивирования. На 9-й день из культуры собирали фракцию неадгезионных клеток, осаждали центрифугированием (1200 об/мин, 10 мин), суспензировали в полном ФСБ, определяли концентрацию и жизнеспособность клеток методом проточной цитометрии с использованием калибровочных шариков и красителя пропидиум йодид (2 мкг/мл) на приборе BD FACSAria™ II Cell Sorter (BD Biosciences). Дендритные клетки идентифицировали методом проточной цитометрии по экспрессии на клеточной поверхности молекул CD11c и МНС класса II. Содержание дендритных клеток в использованных суспензиях составляло 70-80%.
Дендритные клетки в концентрации 1 млн в 1 мл полной культуральной среды DMEM помещали в лунки 24-луночной панели для культивирования (Nunclon). В три лунки панели вносили ВКБП в концентрации 10 мкг/мл. Отрицательным контролем служили три лунки с дендритными клетками без добавления каких либо эффекторов. Через 18 часов инкубации при 37°C в атмосфере 5% CO2 клетки переносили в центрифужные пробирки, содержимое лунок промывали полным ФСБ и переносили в те же пробирки, клетки осаждали центрифугированием при 1200 об/мин, 10 мин. Клеточный осадок окрашивали смесью меченых флуорохромом моноклональных антител CD11c-PE и CD86-APC (BD Biosceinces), клетки анализировали на проточном питометре BD FACSAria™ II Cell Sorter (BD Biosciences). Результаты исследования показали (табл. 5), что под влиянием ВКБП в дендритных клетках мыши в 5,9 раз повысилась экспрессия костимуляторных молекул CD86, необходимых для выполнения этими клетками антиген-презентирующей функции и активации Т клеток. Повышение экспрессии ко-стимуляторных молекул CD86 на дендритных клетках мыши под влиянием ВКБП представлено в таблице 5.
Примечание. Приведены средние значения и стандартные отклонения по трем образцам, нормированные на соответствующие средние значения в контрольных образцах. Контрольные дендритные клетки инкубировали в полной культуральной среде без каких-либо стимулирующих лигандов.
Усиление продукции цитокина IL-12 в дендритных клетках мыши под влиянием ВКБП.
Дендритные клетки костномозгового происхождения получали путем культивирования клеток костного мозга в присутствии 10 нг/мл GM-CSF в течение 9 дней, как описано выше в данном примере. В лунки 24-луночной панели для культивирования клеток (Nunclon) вносили по 1 мл полной среды DMEM, содержащей 2 млн дендритных клеток в 1 мл. В две лунки вносили 10 мкг ВКБП, в две другие лунки, служившие отрицательным контролем, вносили соответствующий объем физиологического раствора. Планшет инкубировали 18 часов в СО2-инкубаторе, затем добавляли brefeldin-A в конечной концентрации 5 мкМ и инкубировали еще 6 часов.
После окончания инкубации в лунки заливали по 2 мл холодного полного ФСБ, тщательно пипетировали и переносили в 4,5-миллилитровые пробирки BD Biosceinces. Клетки осаждали центрифугированием (10 мин, 1200 об/мин), к клеточному осадку приливали 1 мл полного ФСБ, суспензировали и переносили в микропробирки объемом 1,2 мл. Клетки осаждали центрифугированием (10 мин, 1200 об/мин). К клеточному осадку 50 мкл приливали смесь антител I-A FITC и CD11c PerCP-Cy5-5 (BD Biosciences), инкубировали 20 мин в темноте при 4°C, отмывали полным ФСБ. Осадок встряхивали и приливали 100 мкл раствора FixPerm (BD Biosciences), инкубировали 20 мин, дважды отмывали раствором PermWash (BD Biosciences). Осадок клеток суспензировали в 50 мкл PermWash, делили на две аликвоты по 20 мкл, добавляли антитела IL-12 РЕ (BD Biosciences), инкубировали 30 мин. Клетки дважды отмывали раствором PermWash, суспензировали в 200 мкл полного ФСБ и анализировали на проточном цитофлуориметре BD FACSAria™ II Cell Sorter (BD Biosciences). В таблице 6 представлены полученные результаты исследования, показывающие, что под влиянием ВКБП в дендритных клетках достоверно повышается выработка цитокина IL-12, в частности, в 4,3 раза (р<0.01) увеличивается содержание клеток, синтезирующих IL-12. Повышение продукции IL-12 дендритными клетками мыши под влиянием ВКБП представлено в таблице 6.
Усиление секреции макрофагами цитокинов IL-6, МСР-1, TNF-α и выработки NO под влиянием ВКБП.
Макрофаги костномозгового происхождения получали путем инкубации костного мозга в присутствии 10 нг/мл GM-CSF в течение 9 дней, как описано выше в данном примере. На 9-й день из культуры собирали фракцию адгезионных клеток, осаждали центрифугированием (1200 об/мин, 10 мин), суспензировали в полном ФСБ, определяли концентрацию и жизнеспособность клеток методом проточной цитометрии с использованием калибровочных шариков и красителя пропидиум йодид (2 мкг/мл) на приборе BD FACSAriaTM II Cell Sorter (BD Biosciences). В лунки 24-луночной панели для культивирования (Nunclon) вносили по 1 млн макрофагов в 1 мл полной среды DMEM. ВКБП вносили в концентрации 10 мкг/мл, 1 мкг/мл, 0,1 мкг/мл в триплетах. В три лунки, служившие отрицательным контролем, вносили соответствующий объем физиологического раствора. Панель инкубировали 24 часа в СО2-инкубаторе. После окончания инкубации отбирали пробы культуральной среды для определения концентрации цитокинов и NO. Концентрацию цитокинов ФНО-α, IL-6, МСР-1 измеряли на приборе BD FACSAria™ II (BD Biosciences) с помощью набора BD™ Cytometric Bead Array, Mouse Inflammation Kit (BD Biosciences), согласно инструкции фирмы-производителя. Концентрацию цитокинов рассчитывали с помощью программы FCAP Array™ Software v1 (BD Biosciences).
Как показано на фигуре 5, ВКБП значительно стимулирует выработку цитокинов ФНО-α, IL-6 и МСР-1. В частности, под влиянием ВКБП концентрация IL-6 в культуральной среде выросла в 186 раз, МСР-1 - в 8 раз, TNF-α - в 54 раза.
Выработку оксида азота (NO) оценивали по накоплению нитрита натрия в культуральной среде с использованием реакции Грисса (L.C.Green, 1982). Реактив Грисса готовили непосредственно перед проведением реакции, смешивая в равных объемах раствор А (0,1% раствор дигидрохлорида нафтилэтилендиамина в воде) и раствор Б (1% раствор сульфаниламида в 5% Н3РО4). Для определения концентрации нитрита натрия культуральную жидкость (50 мкл) вносили в лунки плоскодонного 96-луночного планшета (Медполимер), в каждую лунку добавляли по 150 мкл реактива Грисса. Реакционную смесь инкубировали в течение 10 мин при комнатной температуре и измеряли оптическую плотность на спектроф