Лекарственные формы цитрата железа (iii)
Иллюстрации
Показать всеИзобретение относится к железо(III)цитратным таблеткам для профилактики или лечения гиперфосфатемии. Указанные таблетки включают ядро, содержащее цитрат железа (III), связующее, лубрикант, а также покрытие, и характеризуются тем, что, по меньшей мере, 80% цитрата железа (III) в них растворимо за или менее 60 мин, % воды в таблетках находится в интервале от 5 до 12%, а истираемость таблеток равна 1 мас./мас.% или менее. Также изобретение относится к способам получения и применения указанных таблеток. Изобретение обеспечивает получение таблеток цитрата железа (III) с немедленным высвобождением активного компонента. 17 н. и 50 з.п. ф-лы, 9 ил., 35 табл., 13 пр.
Реферат
Перекрестная ссылка на родственные заявки
Данная заявка РСТ заявляет приоритет предварительной патентной заявки США No 61/227,124, поданной 21 июля 2009 года, которая включена в настоящий документ ссылкой полностью и для любых целей.
Область техники, к которой относится изобретение
В целом, область настоящего раскрытия относится к фармацевтическим композициям цитрата железа (III), к способам применения данных композиций при лечении медицинских состояний и к способам получения данных композиций.
Предшествующий уровень техники
В патенте US 5753706 раскрыто, что соединения цитрата железа (III) можно применять для контроля фосфатного метаболизма и для профилактики метаболического ацидоза у пациентов. Содержание патента US 5753706 включено в настоящий документ ссылкой полностью. Соединения цитрата железа (III) могут быть использованы пациентами, страдающими от почечной недостаточности, связанной с гиперфосфатемией или пациентами, предрасположенными к развитию гиперфосфатемического состояния. Цитрат железа (III) также применяют в качестве биологически активной или пищевой добавки. Цитрат железа (III) описан как порошок от светло-коричневого до бежевого цвета, без запаха, с незначительным привкусом железа. Согласно «Merck Index», цитрат железа (III) медленно, но полностью растворяется в холодной воде, легко растворяется в горячей воде, при этом со временем его растворимость снижается.
В патенте US 6903235 раскрыто, что цитрат железа (III) коммерчески доступен в форме неопределенной композиции из комбинации железа и лимонной кислоты. Содержание патента US 6903235 включено в настоящий документ ссылкой полностью. В патенте '235 объясняется, что неопределенная композиция получается из-за трудностей, которые возникают при ее приготовлении, при этом специалисты в данной области понимают и, в силу необходимости, признают, что коммерчески доступный цитрат железа (III) содержит разные молярные соотношения железа и лимонной кислоты, а также содержит разные количества гидрата.
В WO 2004/074444 раскрыты способы изготовления органических соединений железа, таких как цитрат железа (III), с повышенными скоростями растворения. WO 2007/022435 является частичным продолжением заявки WO 2007/074444 и в нем раскрыты способы изготовления железосодержащих органических соединений, которые растворимы в широком диапазоне рН и имеют большую площадь поверхности. WO 2007/089577 направлен на способы лечения кальцификации мягких тканей с помощью железосодержащих органических соединений, таких как соединения цитрата железа (III). WO 2007/089571 направлен на способы лечения хронического заболевания почек с помощью железосодержащих органических соединений, таких как соединения цитрата железа (III).
Раскрытие изобретения
В одном аспекте изобретение направлено на таблетку, включающую цитрат железа (III). В некоторых воплощениях таблетка может включать, по меньшей мере, 65 массовых процентов цитрата железа (III).
В другом аспекте изобретение направлено на таблетку, содержащую гранулированные частицы. Гранулированные частицы включают цитрат железа (III) и связующее, и среднее отношение площади поверхности к массе гранулированных частиц равно 1 м2 на грамм или больше. В различных воплощениях среднее отношение площади поверхности к массе указанных гранулированных частиц равно либо 5 м2 на грамм, либо 10 м2 на грамм или превышает эти значения.
В другом аспекте таблетка может включать, по меньшей мере, 70 массовых процентов цитрата железа (III), по меньшей мере, 80 массовых процентов цитрата железа (III) или, по меньшей мере, 90 массовых процентов цитрата железа (III).
В другом аспекте связующее может быть одним или более из числа гидроксипропилцеллюлозы (НРС), гидроксипропилметилцеллюлозы (НРМС), альгината натрия, альгиновой кислоты, гуаровой камеди, аравийской камеди, ксантановой камеди, карбопола, гуммицеллюлозы (карбоксиметилцеллюлозы), этилцеллюлозы, мальтодекстрина, ПВП/ВА, повидона, микрокристаллической целлюлозы, крахмала (частично или полностью прежелатинизированного крахмала) и метилцеллюлозы.
В другом аспекте таблетка может включать различные дополнительные компоненты, которые включают, например, один или несколько разрыхлителей и/или одно или несколько смазывающих веществ. Разрыхлитель может быть представлен одним или несколькими из числа микрокристаллической целлюлозы, кроскармеллозы натрия, кросповидона, натриевой соли гликолята крахмала, и крахмала. Смазывающее вещество может быть представлено одним или несколькими из числа стеарата магния, стеарата кальция, стеарил фумарата натрия, полиэтиленгликоля (с молекулярной массой свыше 3350), лаурилсульфата натрия, талька, минерального масла, лейцина и полоксамера. В некоторых воплощениях таблетка может включать приблизительно 65%-92% цитрата железа (III), приблизительно 4,5%-30% связующего и приблизительно 0,5%-3% смазывающего вещества. Связующее может иметь свойства разрыхлителя. Связующее может быть прежелатинизированным крахмалом.
В другом аспекте таблетка может содержать приблизительно 65%-92% цитрата железа (III), приблизительно 4,5%-30% связующего, приблизительно 1,5%-15% разрыхлителя, и приблизительно 0,5%-3% смазывающего вещества.
В другом аспекте таблетка может включать различные дополнительные компоненты: микрокристаллическую целлюлозу, прежелатинизированный крахмал и стеарил фумарат натрия. В одном воплощении цитрат железа (III) может составлять приблизительно 85 масс.%, микрокристаллическая целлюлоза - приблизительно 4 масс.%, прежелатинизированный крахмал - приблизительно 9 масс.% и стеарил фумарат натрия - приблизительно 2 масс.%.
В другом аспекте таблетка может содержать приблизительно 10%-60% цитрата железа (III), растворимого примерно за 15 минут, приблизительно 30%-90% цитрата железа (III), растворимого примерно за 30 минут и, по меньшей мере, приблизительно 60% цитрата железа (III), растворимого примерно за 60 минут в тесте растворения в соответствии с методикой USP <711>. Таблетка может продемонстрировать растворение, по меньшей мере, 90% в пределах 30 минут в тесте растворения в соответствии с методикой USP <711>. Таблетка может продемонстрировать растворение, по меньшей мере, 90% в пределах 60 минут в тесте растворения в соответствии с методикой USP <701>.
Таблетка может показать время распадаемости меньше 30 минут в тесте распадаемости в соответствии с методикой USP <701>. Таблетка может показать время распадаемости больше, чем 30 минут в тесте распадаемости в соответствии с методикой теста USP <701>.
Таблетка может включать приблизительно 1000 мг цитрата железа (III), приблизительно 667 мг цитрата железа (III), приблизительно 500 мг цитрата железа (III), приблизительно 250 мг цитрата железа (III) или приблизительно 125 мг цитрата железа (III).
В различных аспектах, % потерянной при сушке (англ. LOD%, Loss on Drying) воды в таблетке составляет меньше, чем 20 масс./масс.%. В других аспектах % потерянной при сушке воды в таблетке составляет меньше, чем 15 масс./масс.%. В других аспектах, % потерянной при сушке воды в таблетке составляет меньше 10 масс./масс.%.
В различных аспектах, по меньшей мере, 80% цитрата железа (III) в таблетке растворяется в течение периода времени меньшего или равного 60 минутам, при измерении в тесте USP <711>.
В другом аспекте таблетка включает разрыхлитель. В некоторых воплощениях разрыхлитель может быть выбран из одного или нескольких из числа микрокристаллической целлюлозы, кроскармеллозы натрия, кросповидона, натриевой соли гликолята крахмала и крахмала.
В другом аспекте, таблетка включает смазывающее вещество. В некоторых воплощениях смазывающее вещество может быть выбрано, из одного или нескольких из числа стеарата магния, стеарата кальция и стеарил фумарата натрия.
В другом аспекте раскрытие изобретения направлено на способ приготовления таблетки цитрата железа (III). Способ включает смешивание цитрата железа (III) с одним или несколькими связующими в условиях, при которых % воды, измеренный по потере при сушке, не превышает 25%, с образованием гранул цитрата железа (III). Грануляция может быть осуществлена любым известным в данной области способом (например, грануляцией в псевдоожиженном слое или грануляцией с большим усилием сдвига). После этого из гранул цитрата железа (III) изготовляют таблетки.
В другом аспекте, таблетки нагревают до температуры выше 50°С после таблетирования.
Таблетки можно применять при профилактике или при лечении различных заболеваний или болезненных состояний, включающих, без ограничения, гиперфосфатемию.
Воплощения способа могут включать один или несколько признаков, описанных выше или далее в данном документе.
Детали различных воплощений изобретения изложены ниже в чертежах и описании. Признаки и преимущества различных воплощений очевидны из настоящего описания, фигур и формулы изобретения.
Краткое описание фигур
Специалистам в данной области техники должно быть понятно, что фигуры, описанные в данном документе, представлены только в иллюстративных целях. Фигуры не предназначены для ограничения объема настоящего изобретения.
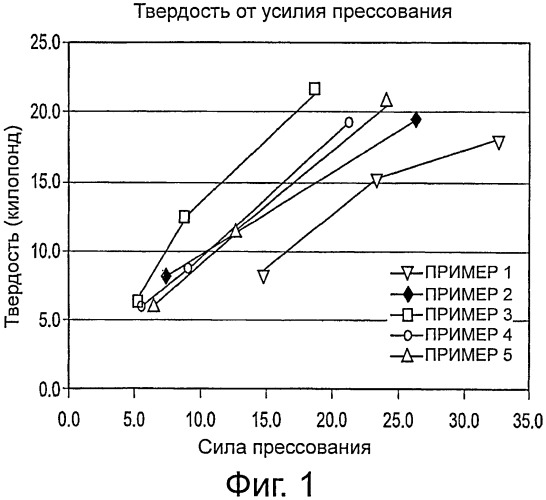
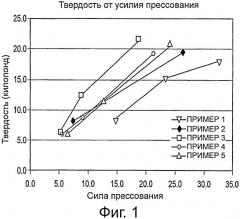
Фиг.1 представляет собой график, демонстрирующий зависимость твердости от усилия прессования для композиций 1-5.
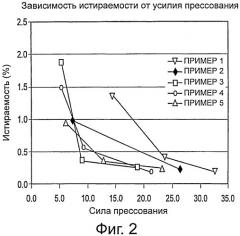
Фиг.2 представляет собой график, демонстрирующий зависимость истираемости от усилия прессования для композиций 1-5..
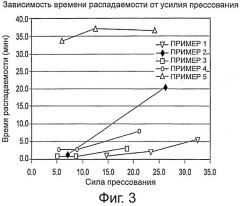
Фиг.3 представляет собой график, демонстрирующий зависимость времени распадаемости от усилия прессования для композиций 1-5.
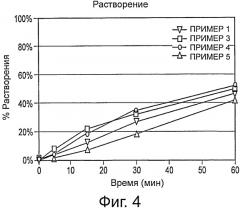
Фиг.4 представляет собой график, демонстрирующий время растворения композиций 1 и 3-5.
Фиг.5 представляет собой график, демонстрирующий зависимость твердости от силы сжатия композиций 6-8 и 11.
Фиг.6 представляет собой график, демонстрирующий зависимость истираемости от силы сжатия композиций 6-8 и 11.
Фиг.7 представляет собой график, демонстрирующий зависимость времени распадаемости от силы сжатия композиций 6-8 и 11.
Фиг.8 представляет собой график, демонстрирующий время растворения композиций 6-8 и 11.
Фиг.9 демонстрирует время растворения разных таблеток до сушки и после сушки.
Осуществление изобретения
В настоящем документе описаны таблетки, содержащие цитрат железа (III). В различных воплощениях таблетки включают композиции цитрата железа (III), которые соответствуют определенным стандартам растворения, таблетирования и распадаемости. В различных аспектах рецептуры таблеток могут включать цитрат железа (III) в качестве активного ингредиента и связующее. Композиции также могут включать смазывающее вещество и/или разрыхлитель (который в некоторых воплощениях, может быть тем же самым компонентом, что и связующее).
Таблетки
В одном аспекте композиция представляет собой таблетку, которая включает цитрат железа (III) и связующее. При использовании в данном документе, «таблетка» представляет собой материал, полученный сжатием, например, с помощью таблеточной машины. В других вариантах осуществления изобретения, композиция или таблетка могут включать цитрат железа (III), связующее, смазывающее вещество и разрыхлитель. Таблетку или композицию можно применять при профилактике или при лечении гиперфосфатемии, путем введения таблетки или композиции в эффективном количестве или количествах, известных в данной области.
Композиция может быть охарактеризована как лекарственный препарат с высокой концентрацией цитрата железа (III), присутствующего в композиции в количестве больше, чем приблизительно 65% от массы композиции, больше, чем приблизительно 70% от массы композиции и вплоть до приблизительно 92% от массы композиции. Также могут быть использованы промежуточные величины, такие как приблизительно 80 масс.% цитрата железа (III), приблизительно 85 масс.% цитрата железа (III) и приблизительно 90 масс.% цитрата железа (III). Характеристики таблетки с указанными высокими массовыми процентами цитрата железа (III), контролируются за счет переменных, таких как вид связующего, количество связующего, вид разрыхлителя, количество разрыхлителя, способ, используемый при получении композиции (например, грануляция, прямое сжатие), параметры таблетирования и т.д. Таким образом, если таблетка при изготовлении имеет незначительное расслоение или кэппинг (отслоение верхней части), то изменив одну или несколько указанных выше переменных, можно исправить слоистость структуры или кэппинг.
В различных воплощениях, композиция таблетки содержит один или несколько компонентов, выбранных из одного или нескольких связующих, одного или нескольких смазывающих веществ и одного или нескольких разрыхлителей.
Связующее может быть любым известным в данной области. Примеры связующего могут включать, без ограничения перечисленным, одно или несколько из числа гидроксипропилцеллюлозы (НРС), гидроксипропилметилцеллюлозы (НРМС), альгината натрия, альгиновой кислоты, гуаровой камеди, аравийской камеди, ксантановой камеди, карбопола, гуммицеллюлозы (карбоксиметилцеллюлозы), этилцеллюлозы, мальтодекстрина, ПВП/ВА (PVP/VA), повидона, микрокристаллической целлюлозы, крахмала (частично или полностью прежелатинизированного) и метилцеллюлозы. При использовании в композициях цитрата железа (III) мальтодекстрин, ПВП/ВА и метилцеллюлоза действуют как связующее с немедленным высвобождением.
Следует также понимать, что для контроля и изменения влияния связующего могут быть использованы комбинации связующих. Например, система связующего может быть составлена из гидроксипропилцеллюлозы и поливинилпирролидона (повидона) с микрокристаллической целлюлозой или без нее. Гидроксипропилцеллюлоза и/или повидон могут быть замещены прежелатинизированным крахмалом.
В различных аспектах таблетка может включать смазывающее вещество. Например, в качестве смазывающего вещества для композиций цитрата железа (III) могут быть использованы стеарат магния, стеарат кальция, стеарил фумарат натрия и комбинации. Другие подходящие смазывающие вещества включают одно или несколько веществ из числа полиэтиленгликоля (молекулярная масса выше 3350), лаурилсульфата натрия, талька, минерального масла, лейцина и полоксамера.
В различных аспектах таблетка может включать разрыхлитель. В композицию может быть включен разрыхлитель. Разрыхлитель может быть связующим или отличаться от него. Неограничивающим примером является микрокристаллическая целлюлоза, которая обладает как свойствами связующего, так и свойствами разрыхлителя, и может быть использована в композиции в качестве единого связующего/разрыхлителя. Примеры других подходящих разрыхлителей включают кроскармеллозу натрия, кросповидон, натриевую соль гликолята крахмал и крахмал.
Связующее может быть представлено в композиции в диапазоне от приблизительно 4,5 масс.% до приблизительно 30 масс.%. Разрыхлитель может быть представлен в композиции в диапазоне от приблизительно 1,5% масс.% до приблизительно 15 масс.%. В различных вариантах осуществления изобретения, некоторые не крахмальные разрыхлители являются часто используемыми при более низких значениях, например, до 0,25% и, таким образом, в некоторых условиях присутствие разрыхлителя в настоящей композиции может быть таким низким как 0,25%.
Смазывающее вещество может присутствовать в композиции в диапазоне от приблизительно 0,5 масс.% до приблизительно 3 масс.%. Следует понимать, что некоторые компоненты, такие микрокристаллическая целлюлоза, могут выполнять роль как разрыхлителя, так и связующего.
Масса индивидуальных таблеток может зависеть от получаемой конечной дозы, например, 125 мг, 250 мг, 500 мг, 667 мг, 750 мг и 1000 мг цитрата железа (III).
В различных воплощениях при нанесении покрытия суспензией «Опадрай» или эквивалентом в дражировочном котле с перфорированным внешним кожухом масса таблетки увеличивается приблизительно от 2% до 5%. Как отмечено выше, стеарат кальция и «Опадрай пурпурный» могут быть замещены с или использованы с различными смазывающими веществами или системами покрытия, соответственно.
Таблетки, имеющие высокую площадь поверхности на единицу массы
В одном варианте описанные таблетки содержат гранулированные частицы с размером, имеющим значительно более высокую среднюю площадь поверхности на единицу массы, чем ранее существовавшие рецептуры цитрата железа (III). Было обнаружено, что увеличенная площадь поверхности на единицу объема приводит к немедленному высвобождению (больше чем 80% за 60 минут после введения, при определении в тесте Фармакопеи США (USP) <711>, описанном в United States Pharmacopeia Compendium of Standards, USP 30 NF 25, Vol.1 p.276-284 (2007), который включен в настоящее описание полностью ссылкой). Не желая быть ограниченными конкретной теорией или механизмом действия, считаем, что увеличенная гранулярная площадь поверхности гранул в таблетке приводит к увеличению выделения цитрата железа (III) в растворитель. Время немедленного высвобождения при растворении значительно снижено у таблетки уменьшенного размера.
В дополнительных вариантах, таблетки, описанные в настоящей заявке, могут быть разработаны таким образом, чтобы иметь отношение средней площади поверхности гранулированной частицы к массе равное 1 квадратному метру на грамм или больше этого значения. В дополнительных вариантах таблетка имеет отношение средней площади поверхности гранулированной частицы к массе равное 2 квадратных метрам на грамм или больше этого значения. В дополнительных вариантах имеет отношение средней площади поверхности гранулированной частицы к массе равное 4 квадратным метрам на грамм или больше этого значения. В дополнительных вариантах композиция имеет отношение средней площади поверхности гранулированной частицы к массе равное 6 квадратным метрам на грамм или больше этого значения. В дополнительных вариантах композиция имеет отношение средней площади поверхности гранулированной частицы к массе равное 8 квадратным метрам на грамм или больше этого значения. В дополнительных вариантах композиция имеет отношение средней площади поверхности гранулированной частицы к массе равное 10 квадратным метрам на грамм или больше этого значения. В дополнительных вариантах композиция имеет отношение средней площади поверхности гранулированной частицы к массе равное 15 квадратным метрам на грамм или больше этого значения. В дополнительных вариантах композиция имеет отношение средней площади поверхности гранулированной частицы к массе равное 20 квадратным метрам на грамм или больше этого значения. В дополнительных вариантах имеет отношение средней площади поверхности гранулированной частицы к массе равное 30 квадратным метрам на грамм или больше этого значения. В дополнительных вариантах композиция имеет отношение средней площади поверхности гранулированной частицы к массе равное 40 квадратным метрам на грамм или больше этого значения. В дополнительных вариантах композиция имеет отношение средней площади поверхности гранулированной частицы к массе равное 50 квадратным метрам на грамм или больше этого значения. Увеличенная площадь поверхности на частицу в таблетке приводит к значительному увеличению скорости растворения.
В других вариантах таблетки умеют пониженное содержание воды. В одном воплощении влагосодержание гранул, при измерении % потерь при сушке (англ. LOD%, Loss on Drying), составляет меньше, чем 20%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 19%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 18%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 17%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 16%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 15%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 14%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 13%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 12%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 11%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 10%.. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 9%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 8%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 7%. В воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 6%. В другом воплощении, влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 5%.
Специалистам в данной области техники понятно, что в различных вариантах осуществления изобретения измерение воды, потерянной при сушке (LOD), представляет собой способ термогравиметрического определения влагосодержания: В термогравиметрических способах влага материала включает и вещества, которые испаряются во время нагревания и поэтому способствуют потере массы материала. Кроме воды эти вещества могут включать спирт или продукт распада. При использовании способов термогравиметрических измерений (сушка с помощью инфракрасных ламп, галогеновых ламп, микроволн или термошкафа) между водой и другими летучими компонентами никакого разграничения не делается.
Истиравмостъ
Истираемость, в общем, является мерой механической прочности таблеток. В ходе нанесения покрытия, транспортировки, упаковки и других процессов, таблетки могут терять некоторое количество массы. Чтобы измерить массовые потери, образцы подсчитывают и взвешивают.
В различных воплощениях тест на истираемость осуществляют как описано в «United States Pharmacopeia Compendium of Standards» (2007), который включен в данный документ полностью ссылкой.
Способ изготовления таблеток
В одном способе таблетирования таблетки могут быть приготовлены в три стадии. На первой стадии формируют гранулы цитрата железа (III) и связующего. На второй, к композиции перед таблетированием добавляют смазывающее вещество. На третьей, таблетку сушат после необязательной стадии нанесения покрытия.
Грануляция
Цитрат железа (III), такой как цитрата железа (III) фармацевтической чистоты, описанный, например, в патенте US №6903235 В2, может быть гранулирован любым известным в данной области способом. Типичные способы грануляции включают грануляцию в псевдоожиженном слое, грануляцию с большим усилием сдвига и грануляцию прямым прессованием.
В воплощениях, в которых влагосодержание композиции доводилось до уровня выше 25%, определяемых по потере при сушке, частицы в любой точке имели существенно более низкое отношение площади поверхности на грамм. Это достигалось, например, ограничением количества вводимой воды или продувкой воздуха и мониторингом количество воды в композиции.
Для повышения у частиц цитрата железа (III) отношения площади поверхности к массе до значения более чем 1 квадратный метр на грамм, или в других воплощениях, более чем 10 квадратных метров на грамм, влагосодержание гранул в течение всего периода образования поддерживают на уровне ниже 25%, вычисляемых по потере при сушке. В определенных вариантах, влагосодержание гранул в течение всего периода образования поддерживают на уровне ниже 24%, 23%, 22%, 21% или 20%.
Не будучи связанными конкретным механизмом или способом действия, авторы предполагают, что поддержка количества воды в ходе грануляции ниже 25%, вычисляемых по потере при сушке, приводит к сохранению гранул с высоким отношением площади поверхности к массе. Добавление больших количеств воды в любой момент в ходе грануляции приводит к образованию более крупных гранул с более низким отношением площади поверхности к массе. Более низкое отношение площади поверхности к массе снижает скорость растворения до уровня ниже скорости растворения композиции для немедленного высвобождения. Измеренное более низкое отношение средней площади поверхности к массе гранул приводит к более медленному растворению и высвобождению.
В различных воплощениях было отмечено, что уменьшение отношения площади поверхности к массе композиции цитрата железа (III) является необратимым после добавления влаги выше 25%, вычисляемых по потере при сушке. Соответственно, в различных вариантах осуществления изобретения в ходе грануляции процент воды поддерживают ниже 25%.
Смешивание
В различных воплощениях, одно или несколько смазывающих веществ могут быть смешаны с гранулами. В различных воплощениях, не ограничивающий перечень смазывающих веществ включает стеараты, такие как стеарат кальция и стеарат магния, стеарил фумарат натрия, стеариновую кислоту, тальк, полиэтиленгликоль, гидрогенизированные растительные масла, стеарат алюминия, бензоат натрия, ацетат натрия, хлорид натрия, лейцин, «Карбовакс» и лаурилсульфат магния. В качестве смазывающих веществ могут быть рассмотрены определенные крахмалы, такие как крахмал 1500, поскольку они при использовании при прямом прессовании до некоторой степени обладают смазывающими свойствами. Можно применить любое смазывающее вещество, известное в данной области техники, включая любые из веществ, описанных в руководстве «Handbook of Pharmaceutical Excipients, fifth edition», включенного в данный документ полностью ссылкой. Возможно объединение множества смазывающих веществ.
В определенных воплощениях возможно применение большего количества смазывающего вещества, чем обычно используется в данной области технике. К удивлению авторов было обнаружено, что для снижения количество налипаний на таблетках цитрата железа (III) количество смазывающего вещества должно быть выше, чем рекомендовано или принято в данной отрасли.
В определенных вариантах в качестве связующего применяют комбинацию стеарата магния или стеарата кальция и стеарил фумарата натрия. В дополнительных воплощениях смазывающее вещество представляет собой комбинацию стеарата кальция и стеарил фумарат натрия. В различных воплощениях возможно применение стеарата кальция в количестве большем, чем рекомендуется в данной области техники. В руководстве «Handbook of Pharmaceutical Excipients, fifth edition» описано рекомендованное количество стеарата кальция, которое максимально составляет 1,0 масс./масс.%. В одном воплощении количество стеарата кальция равно 2,0 масс./масс.% или превышает это значение. В другом воплощении, количество стеарата кальция равно 2,2 масс./масс.% или превышает это значение. В другом воплощении, количество стеарата кальция равно 2,4 масс./масс.% или превышает это значение.
Более того, в различных воплощениях возможно применение стеарил фумарата натрия в количестве, превышающем рекомендованную концентрацию 0,5-2,0 масс./масс.%. В одном воплощении количество стеарил фумарата натрия равно 2,1 масс./масс.% или превышает это значение. В другом воплощении количество стеарил фумарата натрия равно 2,2 масс./масс.% или превышает это значение. В другом воплощении количество стеарил фумарата натрия равно 2,3 масс./масс.% или превышает это значение. В другом воплощении количество стеарил фумарата натрия равно 2,4 масс./масс.% или превышает это значение. В другом воплощении количество стеарил фумарата натрия равно 2,5 масс./масс.% или превышает это значение. В другом воплощении количество стеарил фумарата натрия равно 2,6 масс./масс.% или превышает это значение. В другом воплощении количество стеарил фумарата натрия равно 2,7 масс./масс.% или превышает это значение.
Сушка после таблетирования
После таблетирования возможно проведение стадии сушки. Было обнаружено, что без сушки после таблетирования скорость растворения таблеток возрастает с течением времени. Сушка позволяет сохранить немедленное высвобождение цитрата железа (III) из таблеток, раскрытых в данном документе. Не желая быть ограниченным конкретным механизмом или способом действия, авторы считают, что размер гранулы растет из-за наличия остаточной воды, а стадия сушки обеспечивает большую площадь поверхности на единицу массы исходных гранул.
В одном воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке (англ. LOD%, Loss on Drying), составляет меньше, чем 20%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 19%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 18%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 17%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 16%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 15%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 14%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 13%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 12%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 11%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 10%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 9%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 8%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 7%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 6%. В другом воплощении, конечное влагосодержание гранул, при измерении % потерь при сушке, составляет меньше, чем 5%.
Примеры
В примерах ниже дано описание получения и свойств различных лекарственных форм и способов, представленных в данном документе. Для специалистов в данной области технике будет очевидна возможность практического осуществления модификаций как веществ, так и способов без нарушения объема притязаний данной заявки.
Пример 1
В следующих типичных примерах композиций и способов получения композиций цитрата железа (III) представлены данные, демонстрирующие характеристики композиций или таблеток, в том числе такие данные, как растворение, распадаемость и истираемость.
Некоторые вещества были получены из следующих источников: цитрат железа (III) из «Biovectra»; силикатизированная микрокристаллическая целлюлоза (Prosolv SMCC 50 и Prosolv SMCC HD90, которая состоит из микрокристаллической целлюлозы, NF, и коллоидного диоксида кремния, NF) из «JRS Pharma»; крахмал прежелатинизированный, NF (крахмал 1500) из «Colorcon»; повидон, NF (Plasdone K-29/32) из «ISP»; гидроксипропилцеллюлоза, NF (Klucel EF) из «Hercules»; кроскармеллоза натрия, NF (Ас-Di-Sol SD-711) из «FMC Biopolymer»; и стеарат магния, NF из «Mallinckrodt».
Оборудование, используемое приготовления лекарственных форм состояло из: гранулятора «FLM1» с псевдоожиженным слоем, «Vector Corporation», Марион, Айова; конусной мельницы «Comil», «Quadro Engineering», Миллбурн, Нью-Джерси; гранулятора «GMX» с большим усилием сдвига с чашей 4L, «Vector Corporation» Марион, Айова; V-образного смесителя объемом 2 кварты, «Patterson Kelley», Восточный Строудсбург, Пенсильвания; таблеточного пресса «XL100 Pro», «Korsch», Южный Истон, Массачусетс; пресс-формы в виде капсул, «Elizabeth Carbide», Лексингтон, Северная Каролина; звуковой просеиватель с сепаратором, «Advanctech Manufacturing», Нью-Берлин, Висконсин.
Оборудование, используемое для аналитического исследования композиций, состояло из: тестера таблеток «8М» (твердомера), «Dr.Schleuniger», Манчестер, Нью-Хэмпшир; фриабилятора, «VanKel», Пало-Алто, Калифорния; установки для измерения насыпной плотности «Flodex», «Hanson Research», Чатсворт, Калифорния; непогружной системы проверки распадаемости, модель 3106, и непогружной системы проверки распадаемости «Evolution 6100», «Distek», Северный Брансуик, Нью-Джерси; и спектрофотометра модели 8453 Uv-Vis (ультрафиолетовая и видимая часть спектра), «Agilent», Санта-Клара, Калифорния.
Грануляция с большим усилием сдвига
Чтобы определить возможность применения гранулятора с большим усилием сдвига проводили серии экспериментов для получения таблеточной смеси, обладающей подходящими характеристиками. Композиции 1-3 представлены ниже в таблицах 1-3.
| Таблица 1 | ||
| (Композиция 1) | ||
| Компонент | мг/таблетку | масс./масс.% |
| Измельченный цитрат железа (III) | 1190,3 | 75,0 |
| Силикатированная микрокристаллическая целлюлоза (Prosolv SMCC 50) | 238,1 | 15,0 |
| Кроскармеллоза натрия | 47,6 | 3,0 |
| Гидроксипропилцеллюлоза | 95,2 | 6,0 |
| Стеарат магния | 15,9 | 1,0 |
| Всего | 1587,0 | 100,0 |
| Таблица 2 | ||
| (Композиция 2) | ||
| Компонент | мг/таблетку | масс./масс.% |
| Измельченный цитрат железа (III) | 1190,4 | 60,0 |
| Силикатированная микрокристаллическая целлюлоза (Prosolv SMCC 50) | 595,2 | 30,0 |
| Кроскармеллоза натрия | 59,5 | 3,0 |
| Гидроксипропилцеллюлоза | 119,0 | 6,0 |
| Стеарат магния | 19,8 | 1,0 |
| Всего | 1984,0 | 100,0 |
| Таблица 3 | ||
| (Композиция 3) | ||
| Компонент | мг/таблетку | масс./масс.% |
| Измельченный цитрат железа (III) | 1190,3 | 69,0 |
| Силикатированная микрокристаллическая целлюлоза (Prosolv SMCC 50) | 258,8 | 15,0 |
| Кроскармеллоза натрия | 86,3 | 5,0 |
| Гидроксипропилцеллюлоза | 172,5 | 10,0 |
| Стеарат магния | 17,3 | 1,0 |
| Всего | 1725,0 | 100,0 |
Процедуру получения композиций 1-3 проводили следующим образом. Измельченный цитрат железа (III), гидроксипропилцеллюлозу, силикатированную микрокристаллическую целлюлозу и кроскармеллозу натрия смешивали в течение 15 минут при 500 об./мин. в 4 л резервуаре гранулятора «GMX» с большим усилием сдвига. Деионизированную воду добавляли приблизительно со скоростью 18 г/мин, в течение 10 минут, с одновременным смешиванием на скорости 900 об./мин. со скоростью измельчающего ножа 1500 об./мин. Измеренное конечное (наивысшее) влагосо держание составляло 24,3%, 23,8% и 24,4%, соответственно. Гранулы сушили в грануляторе «FLM1» с псевдоожиженным слоем в течение 5-8 минут при температуре на входе 65°С. Влагосодержание, при измерении % потерь при сушке, составляло 14,3%, 15,5% и 15,9%, соответственно. Гранулы просеивали через ручное сито 16 меш, затем через ручное сито 25 меш, для удаления гранул слишком большого размера и комков. Стеарат магния просеивали через ручное сито 25 меш. Гранулы и стеарат магния смешивали в течение 2 минут в V-образном смесителе объемом 2 кварты. Таблетирование осуществляли на таблеточном прессе «Korsch» с пресс-формами в виде капсул.
Было установлено, что из-за неправильной формы гранул полученные смеси для изготовления таблеток показали плохую текучесть через загрузочный люк. Тем не менее, на оборудовании для таблетирования смогли изготовить превосходные таблетки.
Пример 2
Чтобы определить возможность применения способа грануляции с псевдоожиженным слоем при создании таблеток проводили следующие серии экспериментов:
| Таблица 4 | ||
| (Композиции 4 и 5) | ||
| Компонент | мг/таблетку | масс./масс.% |
| Измельченный цитрат железа (III) | 1190,7 | 90,0 |
| Прежелатинизированный крахмал | 119,1 | 9,0 |
| Стеарат магния | 13,2 | 1,0 |
| Всего | 1323,0 | 100,0 |
Процедуру получения композиций 4 и 5, описанных в таблице 4, проводили следующим образом:
Измельченный цитрат железа (III) добавляли в гранулятор «FLM1» с псевдоожиженным слоем. Для композиции 4, Прежелатинизированный крахмал добавляли в виде 10 масс./масс.% раствора со скоростью распыления, которая возрастала от 24 г/мин до 52 г/мин в течение прогона. [Температура на входе = 64-77°С; Температура продукта = 25-35°С; рабочий воздух = 29-35 CFM (кубических футов в минуту)]. Измеренное конечное (наивысшее) влагосодержание составляло 32,5%.
Для