Применение 4-аминопиридина для улучшения состояния при нейрокогнитивном и/или нейропсихиатрическом нарушении у пациентов с демиелинизирующими и другими заболеваниями нервной системы
Иллюстрации
Показать всеНастоящая группа изобретений относится к медицине, а именно к неврологии, и касается применения 4-аминопиридина для улучшения состояния при нейрокогнитивном и/или нейропсихиатрическом нарушении у пациентов с рассеянным склерозом. Для этого вводят эффективное количество композиции с замедленным высвобождением, содержащей 4-аминопиридин. Это обеспечивает уменьшение таких когнитивных нарушений как устойчивость внимания, нарушения памяти и беглости речи и др. у больных рассеянным склерозом. 3 н. и 32 з.п. ф-лы, 3 ил., 2 пр.
Реферат
Настоящая заявка испрашивает приоритет одновременно рассматриваемой предварительной заявки на патент США 61/233069, поданной 11 августа 2009 года; предварительной заявки на патент США 61/233077, поданной 11 августа 2009 года; и предварительной заявки на патент США 61/239877, поданной 4 сентября 2009 года, все содержание которых настоящим включено путем отсылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к заболеваниям, которые нарушают функцию мозга. В конкретном варианте осуществления изобретение относится к применению 4-аминопиридина с замедленным высвобождением для улучшения или стабилизации состояния при нейрокогнитивном и/или нейропсихиатрическом нарушении у пациентов с рассеянным склерозом (РС).
Уровень техники
РС, как считают, является аутоиммунным заболеванием и характеризуется областями демиелинизации (очагами разрушения миелина) в ЦНС. Указанная особенность демиелинизации и сопутствующий воспалительный ответ приводит к нарушению проводимости нервного импульса или блокаде проводимости в нервных волокнах, пересекающих очаговые поражения. Очаговые поражения могут присутствовать во всей ЦНС, но особенно чувствительными представляются некоторые участки, такие как зрительный нерв, ствол головного мозга, спинной мозг и перивентрикулярная область. Нарушение проводимости потенциала действия, вероятно, является основным фактором в наиболее часто описываемых симптомах (например, паралич, нарушения зрения, слабость мышц, нистагм, нарушения чувствительности и нарушения речи).
С прогрессом в понимании заболеваний, когнитивная дисфункция стала рассматриваться как существенная проблема для пациентов с РС. Контролируемые нейропсихологические исследования показали, что существенная доля пациентов с рассеянным склерозом имеет когнитивное нарушение. Кратковременная память, длительное внимание, концептуально-абстрактное мышление и скорость обработки информации нарушены приблизительно у 50% пациентов, тогда как языковые функции в целом сохранены (Rao S.M., Reingold S.C., Ron M.A., Lyon-Caen O., Comi G. Conference report: workshop on neurobehavioral disorders in multiple sclerosis. Arch. Neurol. 1993; 50:658-662). Рао с сотр. продемонстрировал, что подгруппа пациентов с РС, имеющих когнитивную дисфункцию, с меньшей вероятностью будет приниматься на работу, с меньшей вероятностью будет участвовать в культурных и развлекательных мероприятиях, и в большей степени нуждается в личной помощи, чем подгруппа пациентов с РС с нормальной когнитивной функцией, несмотря на то, что обе подгруппы имеют равную степень физической недееспособности (Rao S.M., Leo G.J., Ellington L., Nauertz T., Bernardin L., Unverzagt F. Cognitive dysfunction in multiple sclerosis. 11. Impact on employment and social functioning. Neurology 1991; 41:692-696).
Были проведены исследования фампридина (4-аминопиридина) с использованием внутривенного (в/в) введения и лекарственных форм в виде пероральных капсул с немедленным высвобождением (НВ) в дополнение к лекарственным формам с контролируемым высвобождением или замедленным высвобождением. Введение капсул НВ приводило к быстрым и кратковременным пикам фампридина в плазме. Первые фармакокинетические исследования проводили с использованием лекарственных форм с немедленным высвобождением (НВ) для перорального введения, которые состояли из порошка фампридина в капсуле на желатиновой основе или перорального раствора. Введение приводило к быстрому изменению уровней фампридина в плазме, что плохо переносилось. Тогда разработали матричные таблетки с замедленным высвобождением (Фампридин-SR). Матричные таблетки Фампридин-SR показали повышенную стабильность и фармакокинетический профиль, подходящий для приема два раза в день.
Исследования на людях с рассеянным склерозом (РС), включающие клинические испытания фазы 1, 2 и 3, показывают, что лекарственное средство фампридин улучшает различные неврологические функции, которые нарушены при данном заболевании.
Действующая терминология характеризует симптоматический РС либо рецидивирующим течением, либо более тяжелым прогрессирующим течением. В следующей таблице 1 представлены четыре клинических подтипа и их преобладание/частота возникновения. Следует отметить, что частота первых трех подтипов отражает начало заболевания. Клиническому течению вторично-прогрессирующего РС всегда предшествует ремиттирующе-рецидивирующая болезнь.
| Таблица 1Клинические подтипы РС | |
| Подтип РС | Преобладание/частота возникновения |
| Ремиттирующий-рецидивирующий(РР) РС | 85% |
| Первично-прогрессирующий (ПП) РС | 10% |
| Прогрессирующий-рецидивирующий (ПР) РС | 5% |
| Вторично-прогрессирующий (ВП) РС | 30% всех пациентов с РС; до 80% рецидивирующего РС без лечения |
В уровне техники сохраняется потребность в способах устранения проблемы мозговых эффектов, таких как когнитивное нарушение при РС, а также в других группах пациентов, страдающих демиелинизирующими и травматическими заболеваниями.
Сущность изобретения
В одном аспекте изобретение относится к применению аминопиридина, такого как фампридин или Фампридин-SR, в схеме дозирования, которая служит для улучшения или стабилизации параметра психического состояния у пациента. Пациент может иметь демиелинизирующее заболевание, травматическое повреждение головного мозга, церебральный паралич или постлучевую энцефалопатию. В одном варианте осуществления демиелинизирующим заболеванием является РС. В частности, раскрыта схема дозирования, которая, как установили, вызывает улучшение(я) одного или более параметров функции мозга, таких как депрессия, либидо, эйфория, ослабление умственного процесса, утомляемость или когнитивное нарушение. В некоторых вариантах осуществления композиции или способы по изобретению применяют, предписывают, вводят в комбинации с другим терапевтическим средством, направленным на нейрокогнитивное или нейропсихиатрическое нарушение; другое терапевтическое средство, направленное на нейрокогнитивное или нейропсихиатрическое нарушение, может включать другие лекарственные средства, схемы лечения, протоколы и/или психологические или психиатрические воздействия, известные специалистам в данной области техники. В одном варианте осуществления способ по изобретению включает введение, где пациент имеет РС; способ включает введение в комбинации с другим терапевтическим средством, направленным на РС.
Способы, предложенные в настоящей заявке, могут применяться при каждом из 4 клинических подтипов РС. Способы, предложенные в настоящей заявке, могут применяться при ремиттирующем-рецидивирующем (РР) РС. Способы, предложенные в настоящей заявке, могут применяться при первично-прогрессирующем (ПП) РС. Способы, предложенные в настоящей заявке, могут применяться при прогрессирующем-рецидивирующем (ПР) РС. Способы, предложенные в настоящей заявке, могут применяться при вторично-прогрессирующем (ВП) РС. Способы, предложенные в настоящей заявке, могут применяться при прогрессирующей и непрогрессирующей болезни, настоящие способы могут применяться у пациентов, чувствительных к температуре, и пациентов, которые не имеют чувствительного к температуре заболевания. Способы, предложенные в настоящей заявке, эффективны независимо от продолжительности болезни РС. Способы, предложенные в настоящей заявке, эффективны независимо от тяжести РС. Способы, предложенные в настоящей заявке, могут применяться, когда другие симптомы РС не затрагиваются клинически значимым путем при какой-либо терапии аминопиридином.
В описании, фигурах и таблицах в настоящей заявке используется множество терминов. Чтобы обеспечить четкое и согласованное понимание описания и формулы, приводятся следующие определения:
Определения:
Используемый в настоящей заявке термин "приблизительно" означает плюс или минус 15, 14, 13, 12, 11, 10% или менее 10% от значения, с которым он используется. "Приблизительно" является включающим. Таким образом, в одном примере, где приблизительно означает 10%, "приблизительно 50%" означают в пределах 45%-55% включительно. В рамках настоящего изобретения значение "приблизительно" для любого из значений нг/мл, приведенных в настоящей заявке, включено в объем изобретения; следует понимать, что, без ограничения, значение "приблизительно", в частности для нг/мл, включает плюс или минус 0,6, 0,5, 0,4, 0,3, 0,2 или 0,1 нг/мл.
При использовании в сочетании со словом "включающий" или другим открытым выражением в формуле, формы единственного числа в тексте заявки обозначают "один или более".
"Введение", при использовании в сочетании с терапевтическим средством, означает введение терапевтического средства непосредственно в или на целевую ткань, или введение терапевтического средства пациенту, где терапевтическое средство положительно действует или воздействует, или влияет на ткань, для которой предназначено средство. Таким образом, используемый в настоящей заявке термин "введение", при использовании в сочетании с соединением, может включать, помимо прочего, доставку соединения в или на целевую ткань; системную доставку соединения пациенту, например, внутривенную инъекцию (например, парентеральную) или пероральное введение (например, энтеральное), или местное (например, трансдермальное, чрескожное, пластырь, суппозиторий), или ингаляционное (например, трансмукозальное) введение, при котором терапевтическое средство достигает целевой ткани. "Введение" композиции может быть выполнено различными способами, как описано в настоящей заявке. Кроме того, "введение" относится к акту назначения или предоставления композиции или соединения пациенту самим пациентом непосредственно, или лицом, осуществляющим уход за пациентом, таким как медицинский работник; включая акт приема или применения пациентом и т.п., где композиция или соединение могут проявлять свои эффекты.
Термин "животное", используемый в настоящей заявке, включает, помимо прочего, людей и не относящихся к человеку позвоночных, таких как дикие, домашние и сельскохозяйственные животные.
Кроме того, соединения по настоящему изобретению могут существовать как в несольватированных, так и в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. В большинстве случаев сольватированные формы в рамках настоящего изобретения приравниваются к несольватированным формам.
Термин "улучшение" обозначает изменение параметра в требуемом направлении. Используемое в настоящей заявке "улучшение" также включает стабилизацию параметра, который в ином случае мог бы ухудшиться или измениться в нежелательном направлении.
Термин "ингибирование" включает введение соединения по настоящему изобретению с целью предотвращения развития симптомов, облегчения симптомов или устранения заболевания, патологического состояния или нарушения.
"Местное введение" означает прямое введение несистемным путем на участок повреждения, нарушения или ощущаемой боли, или вблизи него.
Под "фармацевтически приемлемым" подразумевается, что носитель, разбавитель или эксципиент должны быть совместимыми с другими компонентами лекарственной формы и не вызывать нежелательных эффектов у ее реципиента.
Термин "пролекарство" относится к соединениям, которые подвергаются быстрому превращению in vivo с образованием исходных соединений вышеуказанной формулы, например, при гидролизе в крови. Подробное описание приведено в T. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems," Vol. 14, A.C.S. Symposium Series, а также в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, которые включены в настоящую заявку путем отсылки.
Термины "пациент" и "субъект" означают животных, включая млекопитающих, а также, в одном варианте осуществления, людей. Примеры пациентов или субъектов включают людей, коров, собак, кошек, коз, овец и свиней.
Используемый в настоящей заявке термин "респондер" в целом является статистическим термином и не предназначен для отражения существования или отсутствия применимости или обеспечения результата изобретения. Таким образом, индивид может демонстрировать полезную реакцию на способ изобретения, но в то же время не удовлетворять специфическому набору статистических критериев в качестве "респондера".
Термин "соли" относится к относительно нетоксичным солям присоединения неорганических и органических кислот соединений по настоящему изобретению. Указанные соли могут быть получены in situ в ходе окончательного выделения и очистки соединений или путем отдельного взаимодействия очищенного соединения в форме свободного основания с подходящей органической или неорганической кислотой и последующего выделения образующейся в результате соли. Репрезентативные соли включают гидробромид, гидрохлорид, сульфат, гидросульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептаноат, лактобионат и лаурилсульфат и т.п. Они могут включать катионы щелочных и щелочноземельных металлов, такие как катионы натрия, лития, калия, кальция, магния и т.п., а также нетоксичный аммоний, тетраметиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. (см., например, S. M. Barge et al., "Pharmaceutical Salts," J. Pharm. Sci., 1977, 66:1-19, включенный в настоящую заявку путем отсылки).
Используемый в настоящей заявке термин "стационарное состояние" обозначает систему, которая имеет одно или более свойств, которые остаются неизменными с течением времени, или "стационарное состояние" обозначает систему, которая имеет одно или более свойств, которые изменяются в пределах ограниченного диапазона с течением времени. Как правило, стационарное состояние является более распространенной ситуацией, чем динамическое равновесие. Если система находится в стационарном состоянии, то недавно наблюдаемые характеристики системы будут, как правило, сохраняться в будущем. Во многих системах стационарное состояние не достигается, пока не проходит некоторый период времени после задействования или инициации системы. Указанную начальную ситуацию часто называют переходным состоянием, периодом титрования, начальным периодом или периодом разогрева.
Используемый в настоящей заявке термин "замедленное высвобождение", относящийся к композициям аминопиридина, включает высвобождение аминопиридина из дозированной лекарственной формы с замедленной скоростью, в результате чего терапевтически эффективный уровень в крови сохраняется в течение, по меньшей мере, приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 часов, или более чем 18 часов, или более чем 24 часов, или более чем 30 часов. Предпочтительно, количество аминопиридина в дозированных лекарственных формах для перорального применения согласно вариантам осуществления настоящего изобретения обеспечивает терапевтически эффективную концентрацию в плазме или ЦНС при введении фармацевтической композиции три раза в день, два раза в день или один раз в день. Термины "замедленное высвобождение" и "длительное высвобождение" в целом являются синонимичными, если из контекста прямо не следует иное.
Используемый в настоящей заявке термин "терапевтическое средство" означает средство, применяемое для лечения, борьбы, уменьшения интенсивности, облегчения, предотвращения или улучшения нежелательного состояния или заболевания у пациента. Частично варианты осуществления настоящего изобретения направлены на лечение рассеянного склероза и/или любого его симптома. Частично варианты осуществления настоящего изобретения направлены на способ достижения терапевтического результата при рассеянном склерозе и/или любом его симптоме.
"Терапевтически эффективное количество" является количеством, достаточным для достижения лечебного или терапевтического результата. В одном варианте осуществления "терапевтически эффективное" количество соединения необязательно включает физиологически переносимый эксципиент(ы). В одном варианте осуществления "терапевтически эффективное" количество достаточно для достижения эффективной системной концентрации или локальной концентрации в ткани. В одном варианте осуществления "терапевтически эффективное" количество достаточно для достижения улучшения одного или более симптомов, которые, как известно, ассоциируются с рассеянным склерозом; такие симптомы включают без ограничения: вегетативные нарушения, дисфункцию мочевого пузыря, дисфункцию кишечника, половую дисфункцию, силу, энергию, боль, слабость и утомляемость (снижение выносливости), мышечную слабость, симптомы, связанные с чувствительностью и движением, парестезию, тремор, расстройства речи, изменение диапазона перемещения, зрения, зрительные нарушения и нарушения движения глаз, симптомы, связанные с координацией и равновесием, атаксию, точную координацию движений рук, функцию верхних конечностей, ходьбу, спастичность, когнитивные и психические расстройства, настроение, когнитивные функции и/или психиатрические/психологические факторы.
Используемое в настоящей заявке "лечение" включает любое из следующего: продолжающийся процесс или результат, который уменьшает интенсивность, облегчает, уменьшает или предотвращает симптомы, связанные с заболеванием или недомоганием; продолжающийся процесс или результат, нормализующий функции организма при заболевании или расстройствах, которые приводят к нарушению определенных физиологических функций; или продолжающийся процесс или результат, который вызывает улучшение одного или более клинически измеряемых параметров заболевания. В одном варианте осуществления цель лечения состоит в предотвращении или замедлении (уменьшении) нежелательного физиологического состояния, нарушения или заболевания, или в получении выгодного или желаемого результата. Результатом может быть, например, медицинская, физиологическая, клиническая, физическая терапия, профессиональная терапия, производимая медицинским работником или пациентом; или параметр, известный в уровне техники как "качество жизни" или "активность повседневной жизни". В рамках настоящего изобретения выгодные или желаемые клинические результаты включают, помимо прочего, облегчение симптомов; уменьшение степени тяжести состояния, нарушения или заболевания; стабилизацию (то есть, не ухудшение) состояния, нарушения или заболевания; задержку развития или замедление прогрессии состояния, нарушения или заболевания; уменьшение интенсивности или облегчение состояния, нарушения или заболевания; и ремиссию (частичную или полную), выявляемую или невыявляемую; или улучшение состояния, нарушения или заболевания. В одном варианте осуществления лечение включает индукцию клинически значимого ответа без превышения уровней побочных эффектов. В одном варианте осуществления лечение также включает увеличение продолжительности жизни по сравнению с ожидаемой продолжительностью жизни без получения лечения. В одном варианте осуществления лечение относится к введению лекарственного средства или предоставлению медицинских процедур пациенту. Используемое в настоящей заявке лечение может служить для профилактики (предотвращения), для лечения недомогания или болезни, либо улучшения клинического состояния пациента, включая уменьшение продолжительности заболевания или тяжести заболевания, либо для субъективного улучшения качества жизни пациента или увеличения продолжительности жизни пациента.
Кроме того, термины "лечить", "подвергаемый лечению", "лечение" или "терапия", как правило, являются синонимами, если из контекста не следует иное; используемые в настоящем описании, они в общем относятся к любой из терапевтических, профилактических или превентивных, или лечебных мер. Необходимо понимать, что один или более вариантов осуществления "лечить", "подвергаемый лечению", "лечение", "терапевтический" или "терапевтически эффективный" могут существовать вместе.
В сущности говоря, термин "ткань" относится к любому скоплению клеток аналогичной специализации, которые объединены при выполнении конкретной функции.
| Сокращение или специализированный термин | Объяснение |
| ADME | Абсорбция, распределение, метаболизм и выделение |
| Ae | Количество выделенного лекарственного средства |
| APD30, APD50, APD90 | Потенциальная продолжительность действия 30%, 50%, 90% |
| AUC | Площадь под кривой динамической концентрации |
| AUC(0-t), AUC(0-∞) или AUC(0-inf) | Площадь под кривой зависимости концентрации в плазме от времени, до последнего измеримого уровня, и экстраполируемая до бесконечности |
| AUC(0-12), AUC(0-24) | Площадь под кривой зависимости концентрации в плазме от времени, 0-12 часов, 0-24 часа |
| b.i.d. (bid) | Два раза в день |
| 14C | Радиоактивный углерод 14 |
| CHO | Яичник китайского хомячка |
| CI | Доверительный интервал |
| CL/F | Кажущийся общий клиренс после введения |
| ClR | Почечный клиренс |
| см | Сантиметр |
| Cmax | Максимальная измеренная концентрация в плазме |
| ЦНС | Центральная нервная система |
| CR | Контролируемое высвобождение |
| CrCl | Клиренс креатинина |
| CumAe | Выделенное кумулятивное количество лекарственного средства |
| CYP, CYP 450 | Изофермент цитохром p450 |
| ЭКГ | Электрокардиограмма |
| ЭЭГ | Электроэнцефалограмма |
| F | Женщина |
| FOB | Серия функциональных тестов |
| 4AP | 4-аминопиридин |
| г, кг, мг, мкг, нг | Грамм, килограмм, миллиграмм, микрограмм, нанограмм |
| GABA | Гамма-аминомасляная кислота |
| GLP | Надлежащая лабораторная практика |
| ч | Час |
| HDPE | Полиэтилен низкого давления |
| hERG | Ген специфических калиевых каналов сердца человека |
| ВЭЖХ | Высокоэффективная жидкостная хроматография |
| IC50 | 50%-ая ингибирующая концентрация |
| IKr | Калиевый ионный канал, активность которого измеряют в анализе hERG |
| Улучшение | Обозначает изменение параметра в нужном направлении. Используемое в настоящем описании "улучшение" также включает стабилизацию параметра, который в ином случае ухудшался или изменялся в нежелательном направлении. |
| IND | Заявка на регистрацию нового лекарственного средства |
| IR | Немедленное высвобождение |
| в/в (iv) | Внутривенный |
| K+ | Калий |
| Kel | Константа выведения |
| л, мл | Литр, миллилитр |
| ЖХМС, ЖХ/МС/МС | Жидкостная хроматография/масс-спектрометрия |
| LD50 | Средняя летальная доза |
| Ln | Натуральный логарифм |
| LOQ | Предел измерения |
| М | Мужчина |
| мин | Минута |
| мМ, мкМ | Миллимолярный, микромолярный |
| MRT | Среднее время пребывания |
| РС | Рассеянный склероз |
| MTD | Максимальная переносимая доза |
| NA | Не применимо |
| ND | Не обнаружено |
| NDA | Применение нового лекарственного средства |
| NE | Не поддающийся оценке |
| NF | Национальный формуляр |
| NOAEL | Уровень отсутствия заметных нежелательных эффектов |
| NOEL | Уровень отсутствия заметных эффектов |
| norm | Нормализованный |
| NZ | Новая Зеландия |
| Papp | Кажущийся коэффициент проницаемости |
| p.o. | Пероральный |
| SAE | Серьезное нежелательное явление |
| SCI | Повреждение спинного мозга |
| SD | Стандартное отклонение |
| сек | Секунда |
| SEM | Стандартная ошибка среднего |
| SPF | Несодержащий специфических патогенов |
| SR | Замедленное высвобождение |
| SS | Стационарное состояние |
| t½ | Кажущийся конечный элиминационный период полувыведения |
| t.i.d. (tid) | Три раза в день |
| TK | Токсикокинетика |
| ТСХ | Тонкослойная хроматография |
| Tmax | Период достижения максимальной измеряемой концентрации в плазме |
| USP | Фармакопея США |
| UTI | Инфекция мочевыводящих путей |
| Vd | Объем распределения |
| Vdss | Объем распределения в стационарном состоянии |
Краткое описание чертежей
Следующие фигуры являются частью настоящего описания и включены с целью более подробной демонстрации некоторых аспектов настоящего описания. Изобретение может быть лучше понято при обращении к одной из представленных фигур, в сочетании с подробным описанием определенных вариантов осуществления, представленных в настоящей заявке.
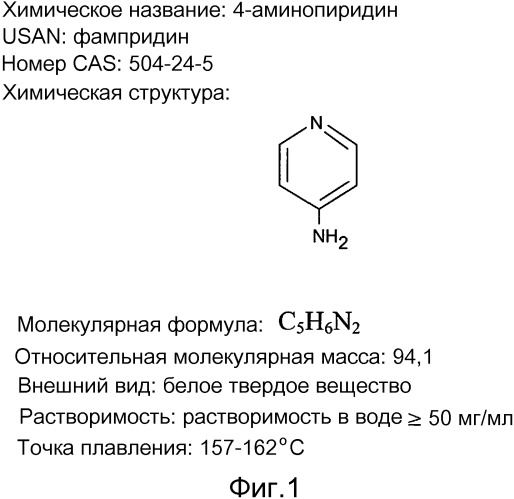
На фиг. 1 показана информация, касающаяся фампридина.
На фиг. 2 показана информация, касающаяся примерных тестируемых параметров Протокола оценки когнитивной функции при РС.
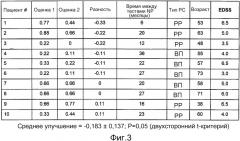
На фиг. 3. Данные для десяти пациентов. Для указанных пациентов среднее улучшение=-0,183±0,137; P=0,05 (двусторонний t-критерий). EDSS=Расширенная шкала оценки статуса инвалидности; РР=ремиттирующий-рецидивирующий; ВП=вторично-прогрессирующий.
Подробное описание изобретения
Фампридин является общим наименованием для соединения 4-аминопиридин (4 AP). Фампридин представляет собой блокатор калиевых (K+) каналов, который был успешно идентифицирован в качестве терапии для улучшения неврологической и мускульной функции у пациентов с рассеянным склерозом (РС). Фампридин известен как далфампридин в США, поскольку далфампридин является официальным наименованием в США (USAN) для химического соединения 4-аминопиридин (4 AP), которое имеет молекулярную формулу C5H6N2 и молекулярную массу 94,1. Термины "далфампридин", "фампридин" и "4-аминопиридин" используются или могут использоваться по всему тексту настоящего описания для обозначения активного вещества лекарственного средства. Фампридин приготавливали в виде матричной таблетки с замедленным высвобождением (SR) при различных дозировках, например, от 5 до 40 мг.
Фампридин-SR (доступный в США под торговым наименованием Ampyra®, Acorda Therapeutics, Hawthorne NY) доступен в таблетках с дозировкой 10 мг. В одном варианте осуществления в каждую таблетку обычно включены следующие наполнители: гидроксипропилметилцеллюлоза, USP; микрокристаллическая целлюлоза, USP; коллоидный диоксид кремния, NF; стеарат магния, USP; и опадрай белый.
Фармакологически, блокирующие свойства 4-аминопиридина в отношении K+-каналов и его эффекты в отношении передачи потенциала действия в препаратах демиелинизированных нервных волокон были широко описаны. При низких концентрациях, которые согласуются с клиническим опытом, в диапазоне 0,2-2 мкМ (18-180 нг/мл), 4-аминопиридин способен блокировать некоторые потенциалозависимые К+-каналы в нейронах. Именно эта особенность, вероятно, объясняет способность указанного лекарственного средства восстанавливать передачу потенциалов действия в демиелинизированных нервных волокнах. При более высоких (миллимолярных) концентрациях фампридин действует на другие типы K+-каналов, как в нервных тканях, так и в других типах тканей. Блокада реполяризационных K+-токов может усиливать синаптическую передачу по всей нервной системе, увеличивая продолжительность пресинаптического потенциала действия. Диапазон неврологических эффектов, согласуемых с увеличенной возбудимостью пресинаптических нервных окончаний, наблюдается при клинически релевантных дозах фампридина.
Эффекты в отношении блокады аксональной проводимости
K+-каналы, блокируемые 4-аминопиридином при низких концентрациях, частично ответственны за реполяризацию нейронных потенциалов действия. Они, вероятно, включают каналы, обнаруженные под миелиновыми оболочками в миелинизированных нервных волокнах зрелых особей млекопитающих. Указанные каналы расположены, прежде всего, в паранодальной и интернодальной мембране аксона (Waxman and Ritchie, 1993), где они не активируются в значительной степени при передаче потенциала действия, поскольку миелиновые оболочки действуют как электрический экран. Поэтому потенциал действия нормальных зрелых миелинизированных аксонов демонстрирует низкую чувствительность или отсутствие чувствительности к 4-аминопиридину при концентрациях ниже 100 мкМ (9,4 мкг/мл) (Shi and Blight, 1997). Концентрации выше 1 мМ (94,1 мкг/мл) склонны вызывать постепенную деполяризацию потенциала покоя аксона, возможно, при взаимодействии с каналами утечки (Shi and Blight, 1997).
Когда аксон демиелинизирован, интернодальная мембрана и ее ионные каналы подвергаются более высоким кратковременным электрическим токам во время потенциала действия. Утечка ионного тока через K+-канал, при описанных условиях, может вносить свой вклад в явление блокады передачи потенциала действия (Waxman and Ritchie, 1993). 4-Аминопиридин может увеличивать продолжительность потенциалов действия нерва, блокируя указанные открытые каналы и ингибируя реполяризацию (Sherratt et al., 1980). Это согласуется со способностью указанного лекарственного средства снимать блокаду проводимости и повышать защищенность проводимости в некоторых аксонах с критической демиелинизацией (Bostock et al., 1981; Targ and Kocsis, 1985), включая аксоны в поврежденном в течение длительного периода и частично ремиелинизированном спинном мозге млекопитающих (Blight, 1989; Shi and Blight, 1997). Дополнительное исследование (Shi et al., 1997) показало, что данный эффект 4-аминопиридина в поврежденном в течение длительного периода спинном мозге морских свинок наблюдался при пороговой концентрации 0,2-1 мкМ (19,1-94,1 нг/мл), хотя в данной ткани он наиболее эффективен при концентрации приблизительно 10 мкМ (941 нг/мл).
Повторная импульсная активность, спонтанная или в ответ на единичные стимулы, наблюдается в некоторых демиелинизированных аксонах, подвергнутых действию 4-аминопиридина при более высоких уровнях [0,1-1 мМ (9,4-94,1 мкг/мл)] in vitro (Blight, 1989; Bowe et al., 1987; Targ and Kocsis, 1985). Подобный эффект при более низких концентрациях в чувствительных нейронах или нервных окончаниях может объяснять парестезию и боль в области внутривенной инфузии, о которых сообщали, как о побочных эффектах при клиническом воздействии 4-аминопиридина на пациентов. Впрочем, нет никаких опубликованных данных, указывающих, что повторная спонтанная активность наблюдается в таких нервных волокнах при более низких, клинически релевантных концентрациях в диапазоне 0,25-1 мкМ (23,5-94,1 нг/мл).
Необходимо понимать, что блокада K+-токов усиливает синаптическую передачу по всему головному и спинному мозгу. Целый ряд нейрологических эффектов наблюдается при повышении концентраций 4-аминопиридина в центральной нервной системе (ЦНС), вплоть до возникновения судорог. Различные эксперименты in vitro на срезах мозга показали эпилептиформные разряды в миндалине (Gean, 1990) и гиппокампе (Rutecki et al., 1987) крыс при нанесении на ткань растворов, содержащих 5-500 мкМ (0,47-47 мкг/мл) 4-аминопиридина. Судорожную активность у животных наблюдали после больших доз 4-аминопиридина, при этом судорожная активность является частью токсикологического профиля данного лекарственного средства. Синхронную разрывную активность в спинном мозге децеребрированных кошек регистрировали после введения очень высоких доз 4-аминопиридина (5-20 мг/кг), которые предположительно дают уровни в плазме в области нескольких сотен нг/мл (Dubuc et al., 1986). Впервые в настоящей заявке указанные неврологические эффекты раскрыты в качестве аспекта в лечении нейрокогнитивного нарушения (и сопутствующих психоневрологических проблем) и устранены с помощью способов в соответствии с изобретением.
Абсорбция
4-Аминопиридин быстро абсорбируется после приема внутрь. В исследовании in situ 4-аминопиридин быстрее абсорбировался из тонкой кишки, чем из желудка. Полупериод абсорбции составил 108,8 минуты и 40,2 минуты для желудка и тонкой кишки, соответственно. В исследовании in vitro с васкулярно перфузированными сегментами кишечника крысы, коэффициент регионарной кажущейся проницаемости (papp×10-6 см/сек) 4-аминопиридина был высоким в верхнем отделе тонкой кишки (22,7 см/сек) и уменьшался дистально в направлении толстой кишки (2,9 см/сек) по сравнению с плохо проникающим маркером (атенолол; 1,9 см/сек в верхнем отделе тонкой кишки и 0 см/сек в толстой кишке) (Raoof et al., 1997).
После перорального введения (немедленное высвобождение) 4-аминопиридина у животных, пиковые концентрации в плазме наблюдаются в течение 1 часа после дозирования. На основе сравнений площадей под кривой зависимости концентрации в плазме от времени (AUC(0-∞)) после в/в и перорального введения 4-аминопиридина (2 мг/кг), биодоступность 4-аминопиридина, как сообщали, составляла приблизительно 66,5% у самцов крыс и 55% у самок крыс (M 2001-03). После перорального введения пиковые концентрации в плазме у самок были на 38% ниже, чем у самцов, хотя (AUC(0-∞)) и масса тела были аналогичны; значения AUC у самцов и самок после в/в введения не отличались.
Исследования проводили на крысах и собаках, используя 14C-меченный 4-аминопиридин (1 мг/кг), который давали через зонд в виде разовой пероральной дозы в растворе. У обоих видов 14C 4-аминопиридин быстро абсорбировался. Пиковые уровни в плазме достигались в пределах 0,5-1 часа у обоих видов. Пиковые уровни в плазме (Cmax) и степень абсорбции, как отражено AUC, у собаки были приблизительно в четыре раза выше, чем у крысы, после введения равных доз, на основании мг/кг. В данных исследованиях в обоих видах не было никаких очевидных половых различий. Полученные результаты приведены в таблице 1.
| Таблица 1Итоговые данные по абсорбции для крыс и собак после разового перорального введения 1 мг/кг 14C-4-аминопиридина (Исследования HWI 6379-101 и HWI 6379-102) | ||||
| Параметр | Крысы(Исследование HWI 6379-101) | Собаки(Исследование HWI 6379-102) | ||
| Самцы (N=31) | Самки (N=31) | Самцы (N=3) | Самки (N=3) | |
| Cmax (мкг/г) | 0,189±0,0202 | 0,168±0,0157 | 0,574±0,1230 | 0,635±0,1028 |
| Tmax (ч) | 1,0 | 0,5 | 1,0±0 | 0,8±0,3 |
| AUC (мкг·ч/мл) | 0,498±0,0176 | 0,506±0,0633 | 2,03±0,406 | 1,92±0,150 |
| t½ (ч) | 1,1±0,04 | 1,4±0,17 | 2,1±0,14 | 1,8±0,04 |
| 1. На момент времени |
При пероральном введении 4-аминопиридин полностью абсорбируется из желудочно-кишечного тракта. Абсолютная биодоступность IR таблеток двух составов, как сообщали, составила 95% (Uges et al., 1982). Абсолютную биодоступность таблеток Фампридина-SR не оценивали, однако относительная биодоступность (по сравнению с водным раствором для перорального введения) составила 95%. Абсорбция проходит быстро, кроме введения в модифицированной матрице. При введении одной таблетки Фампридина-SR с дозой 10 мг здоровым добровольцам натощак средние пиковые концентрации, варьирующие в различных исследованиях от 17,3 нг/мл до 21,6 нг/мл, наблюдали через 3-4 часа после введения (Tmax). В сравнении, Cmax, достигнутая при такой же дозе 10 мг раствора фампридина для перорального введения, составила 42,7 нг/мл и наблюдалась через приблизительно 1,1 часа после введения дозы. Воздействие возрастало пропорционально с дозой, при этом максимальные концентрации в стационарном состоянии были приблизительно на 29-37% выше, чем для разовых доз.
В таблице 2 показана пропорциональность дозы 10 мг и 25 мг разовых доз и относительная биоэквивалентность твердой пероральной дозированной лекарственной формы и перорального раствора.
| Таблица 2Итоговые результаты исследования биодоступности/биоэквивалентности, проведенного на здоровых взрослых добровольцах (N=26 с данными) | ||||
| Параметр | Доза | 10 мг в сравнении с раствором | 10 мг в сравнении с 25 мг | |
| Доза Фампридина SR в таблетке | Буфер-ный раствор (0,83 мг/мл) | Отношение геометрич. средних | 90% CI | Отношение геометрич. средн |