Пептоидные лиганды для выделения и обработки аутоиммунных т-клеток
Иллюстрации
Показать всеГруппа изобретений относится к области молекулярной биологии, иммунологии и медицины и предназначена для идентификации популяций аутореактивных Т-клеток у индивидуумов с аутоиммунными заболеваниями. Для взятия аутоиммунных Т-клеток у индивидуума, страдающего аутоиммунным заболеванием, получают пептоид, который специфически связывается с аутоиммунными Т-клетками. Указанный пептоид связан с носителем. Выполняют контактирование образца, взятого от указанного индивидуума, с указанным пептоидом, связанным с носителем, в течение периода времени, достаточного для связывания аутоиммунных Т-клеток с указанным пептоидом, связанным с носителем. Затем отделяют указанный носитель от указанного образца. В других воплощениях обеспечиваются способы уничтожения аутоиммунных Т-клеток, взятых у индивидуума, страдающего аутоиммунным заболеванием. Использование группы изобретений обеспечивает более эффективную идентификацию аутоиммунных заболеваний различного типа и проведение терапии, направленной против таких популяций. 4 н. и 46 з.п. ф-лы, 15 ил., 1 табл., 3 пр.
Реферат
В настоящей заявке испрашивается приоритет предварительной заявки на патент США рег. № 61/182368, поданной 29 мая 2009 г., и предварительной заявки на патент США рег. № 61/260608, поданной 12 ноября 2009 г., каждая из которых полностью включена в настоящее описание посредством ссылки.
Настоящее изобретение было создано при финансовой поддержке правительства, выдавшего грант № N01-HV28185 Национальному институту заболеваний сердца, легких и крови, и грант № DP10D00066301 Национальному институту здравоохранения. Правительство имеет определенные права на данное изобретение.
Предшествующий уровень техники
1. Область, к которой относится изобретение
Настоящее изобретение главным образом относится к области молекулярной биологии, иммунологии и медицины. Более конкретно, настоящее изобретение относится к идентификации пептоидов, распознаваемых аутоиммунными Т-клетками. Такие пептоиды могут быть использованы для идентификации индивидуумов, страдающих аутоиммунным заболеванием или подверженных риску развития аутоиммунного заболевания, а также для нацеливания на клетки-мишени в целях их удаления, ингибирования или разрушения.
2. Описание предшествующего уровня техники
Этиология многих аутоиммунных заболеваний на молекулярном уровне пока неясна. Из-за отсутствия достаточной информации о таких заболеваниях на молекулярном уровне, существующая ситуация в отношении разработки диагностических средств и эффективной терапии аутоиммунных заболеваний далека от оптимальной. Так, например, в настоящее время еще не найдены маркеры сывороточного белка, которые позволяли бы с высокой степенью надежности диагностировать большинство аутоиммунных заболеваний. Почти без исключения все лекарственные средства, используемые для лечения таких состояний, либо подавляют результат самого аутоиммунного ответа, такой как воспаление, либо направлены на неселективную модуляцию или супрессию всей иммунной системы (Hemmer & Hartung, 2007) со значительными нежелательными побочными эффектами. Для диагностики и терапии было бы идеально получить молекулы, которые будут нацелены на аутореактивные В-клетки (и на антитела, которые они продуцируют) и непосредственно на Т-клетки, но не на В- и Т-клетки, которые распознают чужеродные антигены. Такие молекулы могли бы быть использованы в качестве диагностических средств и аналитических инструментов для детектирования и обогащения аутоиммунных антител, В-клеток и Т-клеток. Кроме того, эти молекулы могли бы служить в качестве фундамента для разработки новой программы по поиску лекарственных средств, направленных на уничтожение этих аутореактивных клеток, но не влияющих на нужные функции иммунной системы.
Таким образом, для диагностики указанных заболеваний необходимо разработать способы, которые были бы (i) точными и объективными, (ii) простыми и воспроизводимыми и (iii) эффективными для использования, как на ранней, так и на поздней стадии заболевания.
Описание сущности изобретения
Настоящее изобретение относится к способам применения синтетических молекул, то есть лигандов, которые связываются с лиганд-связывающими молекулами, такими как белки, нуклеиновые кислоты, углеводы или н-адгезивные клетки, присутствующие в сложных биологических смесях, в качестве биомаркеров для оценки конкретного(ых) физиологического(их) состояния(й). В некоторых аспектах изобретения лигандом является пептоид.
Таким образом, настоящее изобретение относится к способу идентификации лиганда или пептоида, которые специфически распознаются аутоиммунными Т-клетками, включающему: (a) получение первой популяции Т-клеток от здорового индивидуума, где указанную популяцию метят первой детектируемой меткой; (b) получение второй популяции Т-клеток от индивидуума с аутоиммунным заболеванием, где указанную популяцию метят второй детектируемой меткой; (c) контактирование указанных первой и второй Т-клеточных популяций с множеством указанных пептоидов-кандидатов; и (d) оценку связывания указанных первой и второй Т-клеточных популяций с указанным пептоидом-кандидатом, где, в случае, если указанный пептоид связывается с указанной второй Т-клеточной популяцией, но не с указанной первой Т-клеточной популяцией, указанный пептоид распознается аутоиммунными клетками, но не распознается нормальными Т-клетками.
Аутоиммунным заболеванием может быть рассеянный склероз или ревматоидный артрит. Лигандом или пептоидом может быть 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер. Первая и вторая метки могут быть флуоресцентными или хемилюминесцентными, либо они могут представлять собой квантовые точки. Пептоид может быть связан с носителем, таким как гранула, чип, фильтр, тест-полоска, мембрана, полимерная матрица или лунка. Стадия контактирования может включать приведение указанного носителя в контакт с указанными первой и второй Т-клеточными популяциями одновременно. T-клеточная популяция может включать CD4+-T-клетки. Индивидуумами могут быть человек или мышь.
В другом своем варианте настоящее изобретение относится к способу взятия аутоиммунных T-клеток у индивидуума, страдающего аутоиммунным заболеванием, включающему: (a) получение лиганда или пептоида, который специфически связывается с аутоиммунными Т-клетками, где указанный лиганд или пептоид связан с носителем; (b) контактирование образца, содержащего Т-клетки и взятого у указанного индивидуума, с указанным пептоидом, связанным с носителем, в течение периода времени, достаточного для связывания аутоиммунных Т-клеток с указанным лигандом или пептоидом, связанным с носителем; и (c) отделение указанного носителя от указанного образца. Этот способ может дополнительно включать возращение образца со стадии (c) указанному индивидууму. Аутоиммунным заболеванием может быть рассеянный склероз или ревматоидный артрит.
Лигандом или пептоидом может быть 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер. Носителем может быть гранула, чип, фильтр, тест-полоска, мембрана, полимерная матрица или лунка. Образцом может быть кровь, цереброспинальная жидкость или сперма. Если образцом является кровь, то она может быть взята у указанного индивидуума, обработана ex vivo и возвращена указанному индивидууму, после чего эта кровь может быть пропущена через связанный с носителем лиганд или пептоид и возвращена индивидууму по замкнутой цепи кровообращения. Указанный способ может дополнительно включать получение указанного образца от указанного индивидуума. Указанным индивидуумом может быть человек или мышь.
В другом своем варианте настоящее изобретение относится к способу уничтожения аутоиммунных Т-клеток, полученных от индивидуума, страдающего аутоиммунным заболеванием, где указанный способ включает: (a) получение лиганда или пептоида, который специфически связывается с аутоиммунными Т-клетками, где указанный лиганд или пептоид конъюгирован с токсином; и (b) контактирование образца, содержащего Т-клетки и взятого у указанного индивидуума, с указанным конъюгатом в течение периода времени, достаточного для связывания по меньшей мере одной аутоиммунной Т-клетки с указанным конъюгатом, где указанный конъюгат вызывает гибель указанных аутоиммунных Т-клеток. Образец может быть обработан ex vivo, а указанный способ может дополнительно включать возвращение данного образца указанному индивидууму. Указанным аутоиммунным заболеванием может быть рассеянный склероз или ревматоидный артрит.
Лигандом или пептоидом может быть 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер. Токсином может быть рицин, дифтерийный токсин или холерный токсин. Альтернативно, токсином может быть фотоактивируемый токсин, такой как трис-бипептидил-рутений(II), а стадия (b) может дополнительно включать облучение указанного образца видимым светом. Образцом может быть кровь, цереброспинальная жидкость или сперма. Указанный способ может дополнительно включать получение указанного образца от указанного индивидуума. Указанным индивидуумом может быть человек или мышь.
В другом своем варианте настоящее изобретение относится к способу уничтожения аутоиммунных Т-клеток, полученных от индивидуума, страдающего аутоиммунным заболеванием, где указанный способ включает: (a) получение лиганда или пептоида, который специфически связывается с аутоиммунными Т-клетками, где указанный лиганд или пептоид конъюгирован с Fc-содержащими молекулами IgG; и (b) контактирование популяции аутоиммунных Т-клеток с указанным конъюгатом в течение периода времени, достаточного для связывания по меньшей мере одной аутоиммунной Т-клетки с указанным конъюгатом, где указанный конъюгат индуцирует приток иммунных эффекторов в указанную популяцию аутоиммунных Т-клеток, что приводит к их гибели. Популяция аутоиммунных Т-клеток может быть обработана ex vivo, а указанный способ может дополнительно включать возвращение данного образца, полученного в стадии (b), указанному индивидууму. Указанным аутоиммунным заболеванием может быть рассеянный склероз или ревматоидный артрит.
Лигандом или пептоидом может быть 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер. Fc-содержащей молекулой IgG может быть антитело, одноцепочечное антитело или Fc-фрагмент, например, антитела или одноцепочечного антитела, где указанный лиганд или пептоид присоединяют к антигенсвязывающему сайту указанного антитела или его Fc-фрагмента, не содержащего вариабельных областей IgG, и где указанный лиганд или пептоид присоединяют к карбокси-концу указанного Fc-фрагмента. Образцом может быть кровь, цереброспинальная жидкость или сперма. Указанный способ может дополнительно включать получение указанного образца от указанного индивидуума. Указанным индивидуумом может быть человек или мышь.
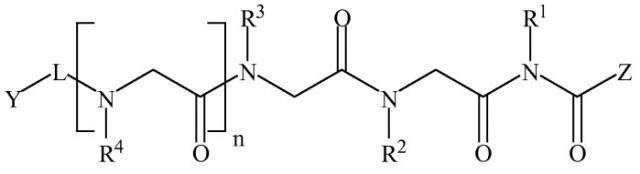
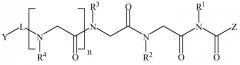
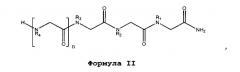
В некоторых вариантах изобретения соединение согласно изобретению имеет нижеследующие формулы, включая их фармацевтически приемлемые соли:
Формула I
,
Формула II
где n равно 0-8; L представляет собой линкер; Y представляет собой токсин или фрагменты антител; Z представляет собой NH2, N(C1-C6алкил)2, OH или O(C1-C6алкил)); а Rl, R2, R3, R4, R5, R6, R7, R8 (где к формуле I или формуле II с каждым значением n больше 4 добавляется следующая группа R в порядке нумерации), могут представлять собой водород; алкил; аллил; метил; этил; н-пропил; изопропил; н-бутил; изобутил; втор-бутил; трет-бутил; пентил; гексил; изопентил; арил; гетероарил; фуранил; индолил; тиофенил; тиазолил; имидазолил; изоксазоил; оксазоил; пиперонил; пиразоил; пирролил; пиразинил; пиридил; пиримидил; пиримидинил; пуринил; циннолинил; бензофуранил; бензотиенил; бензотриазолил; бензоксазолил; хинолин; изоксазолил; изохинолин-циклоалкил; алкенил; циклоалкенил; фенил; пиридил; метоксиэтил; (R)-метилбензил; C1-C6алкил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, О(C1-C6алкил) или S(C1-C6алкил); C2-C6алкинил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил) или S(C1-C6алкил); C2-C6алкенил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил) или S(C1-C6алкил).
В некоторых аспектах изобретения Rl, R2 и/или R3 может независимо представлять собой C1-C6алкил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил), или S(C1-C6алкил); C2-C6алкинил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил) или S(C1-C6алкил); C2-C6алкенил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил) или S(C1-C6алкил).
В некоторых аспектах изобретения R1 представляет собой C1-C6алкил, замещенный по концу группой NH2, а в частности, 4-аминобутан.
В других аспектах изобретения R2 представляет собой C1-C6алкил, замещенный по концу группой NH2, а в частности, 4-аминобутан.
В других аспектах изобретения R3 представляет собой C1-C6алкил, C2-C6алкинил или C2-C6алкенил. В некоторых аспектах изобретения R3 представляет собой изобутил.
В некоторых аспектах изобретения R4 представляет собой C1-C6алкил, замещенный по концу группой NH2, а в частности, 4-аминобутан.
В других аспектах изобретения R5 представляет собой (R)-метилбензил.
В других аспектах изобретения R6 представляет собой фуранил.
В некоторых аспектах изобретения R7 представляет собой C1-C6алкил, замещенный по концу группой NH2, а в частности, 4-аминобутан.
В других аспектах изобретения R8 представляет собой C1-C6алкил, а в частности изобутил.
В некоторых своих вариантах настоящее изобретение включает 8-мер, где Rl, R2, R4 и R7 представляют собой 4-аминобутан; R3 и R8 представляют собой изобутил; R5 представляет собой (R)-метилбензил, а R6 представляет собой фуранил (соединение AG12A). AG12A может содержать на своем конце лизильную группу (4-аминобутан), гидроксильную группу или карбоксильную группу.
В других аспектах изобретения концевая группа R заканчивается лизильной, карбоксильной или гидроксильной группой.
Следует отметить, что любой описанный здесь способ или любая описанная здесь композиция могут быть применены с использованием любого другого описанного здесь способа или любой другой описанной здесь композиции.
Употребление существительного единственного числа в сочетании со словом «включающий», используемым в формуле изобретения и/или в описании настоящей заявки, может означать какой-либо «один» элемент, а также «один или более» элементов, «по меньшей мере один» элемент и «один либо более чем один» элемент.
При этом подразумевается, что любой вариант, обсуждаемый в настоящем описании, может быть осуществлен с применением любого способа или любой композиции согласно изобретению и наоборот. Кроме того, композиции и наборы согласно изобретению могут быть использованы для осуществления способов согласно изобретению.
Термин «примерно», употребляемый в настоящем описании, относится к величине, включающей присущую этой величине дисперсию ошибок, а именно, инструментальных ошибок, ошибок метода, применяемого для определения этой величины, или вариабельность, существующая между обследуемыми индивидуумами.
Краткое описание графического материала
Описанный ниже графический материал составляет часть настоящего описания и приводится для дополнительной иллюстрации некоторых аспектов настоящего изобретения. Для лучшего понимания настоящего изобретения оно проиллюстрировано ниже со ссылками на одну или несколько фигур в комбинации с подробным описанием представленных здесь конкретных вариантов.
Фиг. 1A-D: Идентификация пептоидов, связывающихся с аутореактивными Т-клетками, в соответствии с протоколом скрининга с использованием двухцветных гранул. (Фиг. 1A) Схематическое представление протокола скрининга пептоидов. (Фиг. 1B) Изображения, полученные на флуоресцентном микроскопе для пептоидных гранул после скрининга и промывки (100х увеличение; DAPI-фильтр); (i) и (ii): две гранулы, которые были выбраны как «наилучшие» и которые, как наблюдалось, связываются только с клетками, окрашенными красным красителем; (iii): гранулы, связывающиеся с CD4+-T-клетками, взятыми у здоровых мышей и у мышей с EAE. (Фиг. 1C) Химические структуры двух «наилучших» величин, идентифицированных в этом скрининге. (Фиг. 1D) Изображения, полученные на флуоресцентном микроскопе для гранул Tentagel, на которых представлен AG12A, связанный с аутореактивными T-клетками; (i): CD4+-T-клетки, которые были взяты у контрольных B10.PL-мышей дикого типа и которые не связываются с пептоидными гранулами AG12A; (i)i: CD4+-T-клетки, которые были взяты у Vα2.3/Vβ8.2 MBP Ас-1-11 TCR-трансгенных мышей и которые связываются с пептоидными гранулами AG12A.
Фиг. 2A-C: AG12A связывается с MBP Acl-11-специфическими T-клетками со средней микромолярной аффинностью и с высокой специфичностью. (Фиг. 2A) Проточный цитометрический анализ CD4+-T-клеток, взятых у Vα2.3/Vβ8.2 MBP Ac1-11 TCR-трансгенных мышей и мышей B10.PL дикого типа в присутствии возрастающих концентраций биотин-DOPA-AG12A. Клетки предварительно инкубировали с концентрациями 1 мкM, 10 мкM, 100 мкM, 250 мкM или 500 мкM биотин-DOPA-AG12A, подвергали перекрестному связыванию и окрашивали анти-CD4-PerCP-Cy5.5 антителом и антителом против стрептавидина-аллофикоцианина (APC). Двухцветную проточную цитометрию проводили для определения аффинности связывания биотинилированного AG12A с аутореактивными CD4+-T-клетками. Результаты представлены в виде перекрывающихся гистограмм, где зеленая линия соответствует Vα2.3/Vβ8.2 MBР Ac1-11 TCR-трансгенным T-клеткам, а синяя линия соответствует CD4+-T-клеткам дикого типа B10.PL. Красная линия и соответствует непептоидному негативному контролю. Среднюю интенсивность флуоресценции (MFI) определяли для каждой концентрации пептоида, тестируемого с помощью компьютерной программы Flowjo. Было обнаружено, что только Vα2.3/Vβ8.2 MBP Ac1-11 TCR-трансгенные T-клетки связываются с AG12A. Полученные результаты были репрезентативными для трех независимых экспериментов. (Фиг. 2B) Изотерму связывания AG12F c Vα2.3/Vβ8.2 MBP Ac1-11 TCR-трансгенными T-клетками оценивали с помощью проточной цитометрии. Строили график зависимости MFI от концентрации каждого тестируемого пептоида для TCR-трансгенных T-клеток + AG12A, Т-клеток дикого типа + AG12A, TCR-трансгенных T-клеток + контрольный пептоид, и Т-клеток дикого типа + контрольный пептоид. Величину Kd вычисляли с помощью компьютерной программы Graphard Prism, и эта величина составляла приблизительно 40 мкM. (Фиг. 2C) После индуцированного периодатом перекрестного связывания биотин-DOPA-AG12A с Vα2.3/Vβ8.2 MBP Ac1-11-TCR-трансгенными T-клетками и последующего электрофореза в ДСН-геле и вестерн-блот-анализа, проводимого с использованием нейтравидина-ПХ (НА-ПХ), получали главный перекрестно-связанный продукт с молекулярной массой приблизительно 45 кДа (правая сторона). Этот продукт не наблюдался при использовании CD4+-T-клеток, взятых у мышей дикого типа или CD4-негативных спленоцитов, взятых у TCR-трансгенных мышей. Дорожка 1: CD4+-T-клетки дикого типа, дорожка 2: Vα2.3/Vβ8.2 трансгенные Т-клетки, дорожка 3: CD4-негативные спленоциты. Правая сторона: аналогична левой стороне, за исключением того, что блот зондировали анти-Vα2 TCR антителом. Полученные результаты являются репрезентативными для двух независимых экспериментов.
Фиг. 3A-C: AG12A ингибирует пролиферацию аутореактивных T-клеток в зависимости от дозы. (Фиг. 3A) СD4+ MBP Ac1-11-специфичные мышиные TCR-трансгенные T-клетки выделяли, метили CFSE и инкубировали с возрастающими концентрациями пептоида AG12A или контрольного пептоида. Клетки разводили антигенпрезентирующими клетками, выделенными из селезенки мышей B10.PL дикого типа, и стимулировали пептидом MBP Ac1-11 в конечной концентрации 10 мкг/мл. Клетки окрашивали анти-CD4+-PerCP-CY5.5 антителом и анализировали с помощью проточной цитометрии для определения процента делящихся клеток. Результаты представлены в виде линейной кривой, где на оси X отложена концентрация пептоида, а на оси Y отложен процент деления клеток. Клетки, обработанные пептоидом AG12A, обозначены квадратами, а клетки, обработанные контрольным пептоидом, обозначены треугольниками. (Фиг. 3B) B-клетки выделяли у мышей B10.PL дикого типа и обрабатывали, как описано на фиг. 3A. Клетки стимулировали LPS и осуществляли проточную цитометрию, описанную выше. (Фиг. 3C) CD4+-T-клетки, полученные от MOG 35-55 TCR-трансгенных мышей, выделяли и обрабатывали, как описано выше, за исключением того, что указанные клетки стимулировали пептидом MOG 35-55 в присутствии антигенпрезентирующих клеток. Все результаты являются репрезентативными для трех независимых экспериментов.
Фиг. 4A-D: Добавление радиоактивного рутения приводит к повышению активности AG12A и к предупреждению адоптивной передачи EAE. (Фиг. 4A) График иллюстрирует фотокаталитическую деструкцию аутореактивного TCR. AG12A был химически связан с Ru2+. После инкубирования с комплексом «рутений-пептоид», клетки облучали видимым светом (<380 нм). Облучение приводило к образованию синглетного кислорода, который инактивирует рецептор-мишень. (Фиг. 4B) CD4+-MBP Ac1-11-специфические мышиные TCR-трансгенные T-клетки выделяли у мышей B10.PL и инкубировали с AG12A-Ru2+, контрольным Ru2+-пептоидом в концентрациях 1 мкM или 100 нM, или только с растворителями (PBS или ДМСО). Клетки либо облучали при <380 нм в течение 10 минут (заштрихованные столбцы), либо не облучали (черные столбцы). Культуры разводили антигенпрезентирующими клетками, выделенными из селезенки мышей дикого типа B10.PL, и стимулировали пептидом MBP Ac1-11 в конечной концентрации 10 мкг/мл. Пролиферацию определяли путем добавления [3H]тимидина к клеткам в течение последних 16 часов культивирования. Фоновые уровни пролиферации клеток, которые не были стимулированы антигеном, вычитали из полученных результатов. (Фиг. 4C) Панель, аналогичная панели B, за исключением того, что используемые CD4+-T-клетки выделяли у MOG 35-55-специфических TCR-трансгенных мышей. AG12A-Ru2+ не оказывал негативного влияния на пролиферацию этих клеток. (Фиг. 4D) Обработка пептоидом AG12A-Ru2+ приводит к предупреждению адоптивной передачи EAE. CD4+-T-клетки выделяли у MBP Ac1-11-специфических TCR-трансгенных мышей, инкубировали со 100 нМ пептоида AG12A-Ru2+ или контрольного Ru2+-пептоида, а затем облучали. После этого клетки стимулировали антигенпрезентирующими клетками и 10 мкг/мл пептида MBP Ac1-11 в течение 72 часов, и переносили путем i.р.-инъекции мышам B10.PL, которые ранее не подвергались обработке. Мышей ежедневно обследовали на клинические признаки EAE, и полученные средние клинические оценки использовали для построения графика для групп, обработанных AG12A-Ru2+ (незаштрихованные кружки), контрольным Ru2+-пептоидом (незаштрихованные квадраты), только антигеном (незаштрихованные треугольники), и не обработанных антигеном (звездочки). Все результаты являются репрезентативными для 2 независимых экспериментов.
Фиг. 5A-B: Средние клинические оценки, полученные у мышей с EAE, используемых в целях скрининга и структурной иллюстрации пептоидной библиотеки, применяемой в этом скрининге. (Фиг. 5A) Мышей B10.PL иммунизировали 50 мкг пептида MBP Ac1-11, эмульгированного в полном адъюванте Фрейнда (CFA) для индуцирования EAE. Мышей ежедневно обследовали на клинические признаки заболевания и присваивали клиническую оценку исходя из стандартных критериев. Контрольных мышей иммунизовали только CFA, и у этих мышей не развивался EAE. Когда заболевание достигало своего пика, мышей умерщвляли, и у этих мышей выделяли CD4+-T-клетки, которые затем использовали для скрининга пептоидной библиотеки. Оценки для мышей с EAE (квадраты) и контрольных мышей (треугольники) представлены на графике. (Фиг. 5B) Проиллюстрирована пептоидная библиотека, используемая для скрининга. Верхняя часть: общая химическая структура соединений в библиотеке. Три остатка у С-конца оставались неизменными, а остальные 6 остатков варьировались. В рамке: амины, используемые для создания библиотеки.
Фиг. 6: Структуры контрольного пептоида и контрольного Ru 2+ -пептоида. На данной фигуре представлены химические структуры контрольных пептоидов, используемых для этих исследований.
Описание репрезентативных вариантов осуществления настоящего изобретения
Авторами настоящего изобретения описаны способы идентификации синтетических молекул, которые связываются с аутореактивными CD4+-T-клетками с высокой специфичностью. Для осуществления протокола исследования, проводимого авторами на животных с экспериментальным аутоиммунным энцефаломиелитом (EAE) и на животных с моделью человеческого рассеянного склероза (MS), не требовалось каких-либо предварительных знаний о природе нативного(ых) антигена(ов). Вместо этого была разработана стратегия конкурентного связывания, в которой проводили одновременную оценку способности каждого соединения библиотеки связываться с аутореактивными Т-клетками и нормальными Т-клетками в нативной популяции. В качестве «наилучших соединений» были выбраны только те соединения, которые обладали высокой специфичностью к аутореактивным Т-клеткам. Подробная характеризация одного «наилучшего соединения» в скрининге EAE позволяет предположить, что он связывается с T-клеточным рецептором (TCR). Кроме того, было обнаружено, что это соединение является антагонистом индуцируемой антигеном пролиферации T-клеток in vitro. И наконец, в случае конъюгирования этого соединения с рутениевым комплексом, способным опосредовать окислительное разрушение молекулы с образованием родственных белков при ее фотолизе (Lee et al., 2008), такой конъюгат будет ингибировать способность аутореактивных T-клеток опосредовать развитие заболевания в эксперименте по адоптивной передаче заболевания. В целом, полученные данные подтверждают возможность применения данного метода для идентификации синтетических соединений, обладающих способностью связываться с антиген-специфическими аутореактивными T-клетками и ингибировать эти клетки.
I. Аутоиммунные заболевания
Как обсуждалось выше, настоящее изобретение относится к идентификации молекул, которые могут связываться с аутоиммунными Т-клетками, взятыми у пациентов с различными патологическими состояниями. Хотя примеры описаны для EAE, на моделях животных с MS, однако, настоящее изобретение может быть применено к различным аутоиммунным заболеваниям, некоторые из которых обсуждаются ниже. В некоторых аспектах изобретения такими патологическими состояниями являются, но не ограничиваются ими, острый диссеминированный энцефаломиелит (ADEM), острый некрозирующий геморрагический лейкоэнцефалит, болезнь Аддисона, агаммаглобулинемия, аллергическая астма, аллергический ринит, гнездная аллопеция, амилоидоз, анкилозирующий спондилит, нефрит, вызываемый анти-GBM/анти-TBM антителами, антифосфолипидный синдром (APS), аутоиммунная апластическая анемия, аутоиммунная диссинергия, аутоиммунный гепатит, аутоиммунная гиперлипидемия, аутоиммунный иммунодефицит, аутоиммунное заболевание внутреннего уха (AIED), аутоиммунный миокардит, аутоиммунный панкреатит, аутоиммунная ретинопатия, аутоиммунная тромбоцитопеническая пурпура (АTP), аутоиммунное заболевание щитовидной железы, невропатии аксонов и нервных тканей, болезнь Бало, болезнь Бехчета, буллезный пемфигоид, кардиомиопатия, болезнь Кастлемана, кишечная спру (не трофическая), болезнь Шагаса, синдром хронической усталости, хроническая воспалительная демиелинизирующая полиневропатия (CIDP), хронический рецидивирующий мультифокальный остеомиелит (CRMO), синдром Черга-Штраусса, рубцующийся пемфигоид/доброкачественный пемфигоид слизистой, болезнь Крона, синдром Когана, болезнь холодовых агглютининов, застойная сердечная недостаточность, миокардит Коксаки, болезнь CREST, эссенциальная смешанная криоглобулинемия, демиелинизирующие невропатии, дерматомиозит, болезнь Девика (нейромиелит зрительного нерва), дискоидная волчанка, синдром Дресслера, эндометриоз, эозинофильный фасцит, нодозная эритема, экспериментальный аллергический энцефаломиелит, синдром Эванса, фибромиалгия, фиброзирующий альвеолит, гигантоклеточный артериит (височный артериит), гломерулонефрит, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре, энцефалит Хашимото, тиреоидит Хашимото, гемолитическая анемия, пурпура Геноха-Шенлейна, герпес беременных, гипогаммаглобулинемия, идиопатическая тромбоцитопеническая пурпура (ITP), IgA-нефропатия, заболевание, вызываемое иммунорегуляторными липопротеинами, миозит, вызываемый тельцами включения, инсулинозависимый диабет (типа 1), кишечный цистит, юношеский артрит, юношеский диабет, синдром Кавазаки, синдром Ламберта-Итона, лейкоцитокластический васкулит, плоский лишай, склеротический лишай, фиброзный конъюнктивит, болезнь линейных цепей IgA (LAD), волчанка (SLE), болезнь Лайма, болезнь Меньера, микроскопический полиангит, смешанная болезнь соединительных тканей (MCTD), язва Мурена, болезнь Мухи-Хабермана, рассеянный склероз, тяжелая миастения, миозит, нарколепсия, нейромиелит зрительного нерва (болезнь Девика), нейтропения, рубцующийся пемфигоид зрачка, нейрит зрительного нерва, палиндромный ревматизм, PANDAS (детские аутоиммунные нервно-психические расстройства, вызываемые стрептококками), паранеопластическая дегенерация мозжечка, пароксизмальная ночная гемоглобинурия (PNH), синдром Парри-Ромберга, синдром Персонейджа-Тернера, заболевание ресничного кружка (периферический увеит), пемфигоид, периферическая нейропатия, околовенозный энцефаломиелит, пернициозная анемия, синдром POEMS, нодозный полиартериит, аутоиммунные полигландулярные синдромы типа I, II и III, ревматический полимиалгит, полимиозит, постинфарктный синдром, посткардиомиотомный синдром, дерматит, вызываемый прогестероном, первичный билиарный цирроз, первичный склерозирующий холангит, псориаз, псориатический артрит, идиопатический фиброз легких, гангренозная пиодермия, истинная эритроцитарная аплазия, болезнь Рейно, рефлекторная симпатетическая дистрофия, синдром Рейтера, рецидивирующий полихондрит, синдром «усталых ног», ретроперитонеальный фиброз, ревматическая лихорадка, ревматоидный артрит, саркоидоз, синдром Шмидта, склерит, склеродермия, синдром Сьегрена, аутоиммунная реакция, направленная на аутоантигены спермы и яичек, синдром «негнущегося человека», подострый бактериальный эндокардит (SBE), симпатический иридоциклит, артериит Такаясу, височный артериит/гигантоклеточный артериит, тромбоцитопеническая пурпура (TPP), синдром Толосы-Ханта, поперечный миелит, язвенный колит, недифференцированное заболевание соединительной ткани (UCTD), увеит, васкулит, везикулобуллезный дерматоз, витилиго или гранулематоз Вегенера, или хронический активный гепатит, первичный билиарный цирроз, сердечная кардиомиопатия, миокардит, аутоиммунный полиэндокринный синдром типа I (APS-I), фиброзно-кистозный васкулит, приобретенный гипопаратиреоидит, ишемическая болезнь сердца, листовидная пузырчатка, вульгарная пузырчатка, энцефалит Расмуссена, аутоиммунный гастрит, синдром инсулиновой гипогликемии (болезнь Хираты), инсулинорезистентность типа B, акантоз, системная красная волчанка (SLE), пернициозная анемия, резистентный к лечению артрит Лайма, полиневропатия, демиелинизирующие заболевания, атопический дерматит, аутоиммунный гипотиреоидит, витилиго, офтальмопатия, ассоциированная с заболеванием щитовидной железы, аутоиммунная глютеновая болезнь, заболевание, вызываемое дефицитом ACTH, дерматомиозит, синдром Сьегрена, системный склероз, прогрессирующий системный склероз, кольцевидная склеродермия, первичный антифосфолипидный синдром, хроническая идиопатическая крапивница, синдромы соединительных тканей, некрозирующий и серповидный гломерулонефрит (NCGN), системный васкулит, синдром Рейно, хроническое заболевание печени, висцеральный лейшманиоз, заболевание, вызываемое дефицитом аутоиммунных анти-Cl антител, мембранозный пролиферирующий гломерулонефрит (MPGN), заболевание, вызываемое замедленным свертыванием крови, иммунодефицит, атеросклероз, нейронопатия, паранеопластическая пузырчатка, паранеопластический синдром «негнущегося человека», паранеопластический энцефаломиелит, подострая вегетативная невропатия, ассоциированная с раком ретинопатия, паранеопластическая атаксия, а именно, синдром «пляшущих глаз», синдром поражения нижних двигательных нейронов и миастения Ламберта-Итона.
A. Анкилозирующий спондилит
AS представляет собой подгруппу заболеваний, входящих в более широкую группу заболеваний, классифицированную как спондилоартропатия. У пациентов, страдающих спондилоартропатией различных типов, этиология этого заболевания часто варьируется в очень широких пределах, от бактериальных инфекций до врожденного заболевания. Но, в конечном счете, у всех этих индивидуумов, развивается аксиальный артрит. Несмотря на ранние клинические различия этих заболеваний, проявляющиеся у различных групп пациентов, исход многих этих заболеваний, протекающих в течение 10-20 лет, почти идентичен. Недавно проведенные исследования позволяют предположить, что средний период времени от начала заболевания до клинической диагностики анкилозирующего спондилита составляет 7,5 лет (Khan, 1998). Эти же самые исследования позволяют предположить, что симптомы спондилоартропатии могут быть очень похожими на симптомы ревматоидного артрита (Feldtkeller et al., 2003; Doran et al., 2003).
AS представляет собой хроническое системное воспалительное ревматическое расстройство осевого скелета с наличием или отсутствием внескелетных проявлений. При этом, главным образом, поражаются крестцово-подвздошные суставы и позвоночник, но могут быть также поражены бедра и плечи, а в меньшей степени, периферические суставы или некоторые внесуставные структуры, такие как глаза, мускулатура, нервная система и желудочно-кишечный тракт. Этиология данного заболевания пока еще абсолютно не ясна (Wordsworth, 1995; Calin and Taurog, 1998). Это заболевание тесно ассоциируется с аллелем HLA-B27 главного комплекса гистосовместимости класса I (МНС I) (Calin and Taurog, 1998). AS развивается у индивидуумов в начале жизни и представляет опасность из-за возможного возникновения хронических болей и необратимого поражения сухожилий, связок, суставов и костей (Brewerton et al., 1973; Brewerton et al., 1973; Schlosstein et al., 1973). AS возникает независимо или в сочетании с другими формами спондилоартропатии, такими как реактивный артрит, псориаз, псориатический артрит, энтезит, язвенный колит, синдром раздраженного кишечника или болезнь Крона, и в этом случае он классифицируется как вторичный AS.
Обычно поражаемыми участками являются дисковертебральные суставы, апофизарные суставы, ребернопозвоночные суставы и суставы ребер с поперечными отростками позвонков, а также паравертебральные структуры связок. При этом заболевании также явно выражено воспаление энтезисов, которые являются участками сухожильномышечной системы и местом прикрепления связок к кости (Calin and Taurog, 1998). Известно, что на участке энтезиса наблюдается инфильтрация клеток плазмы, лимфоцитов и полиморфонуклеарных клеток. Такой процесс воспаления часто приводит к постепенному развитию фиброзного и костного анкилозита (Ball, 1971; Khan, 1990).
Это заболевание диагностируется поздно, поскольку его симптомы часто ассоциируются с более часто встречающимися заболеваниями в области спины. Ранним признаком AS является потеря гибкости в поясничном отделе позвоночника. Другими распространенными симптомами являются хронические боли и скованность в области поясницы, которые обычно возникают в области соединения поясницы и таза, или в области ребер.
Хотя большинство симптомов возникают в поясничной и в крестцово-подвздошных областях, однако, они могут также наблюдаться и в области шеи и верхнего отдела позвоночника. Артрит может также возникать в области плеч, бедер и ступней. У некоторых пациентов наблюдается воспаление глаз, а в более тяжелых случаях может возникать поражение сердечного клапана.
Наиболее часто встречающимся проявлением являются боли в спине, но заболевание может начинаться атипически в периферических суставах, особенно у детей и у женщин, а в более редких случаях оно может сопровождаться острым иритом (передним увеитом). Другими ранними симптомами и признаками являются патологическое расширение грудной клетки в результате диффузного поражения реберно-позвоночного отдела, субфебрильная температура, усталость, анорексия, снижение массы тела и анемия. Возможными жалобами являются рецидивирующие боли в спине, часто возникающие ночью и варьирующиеся по своей интенсивности, поскольку утренняя скованность обычно сменяется активностью. Боли в спине и параспинальные мышечные спазмы облегчаются при согнутом или сгорбленном положении, а поэтому, при отсутствии лечения, у пациентов часто