Фармацевтические композиции и терапевтические способы, в которых применяется комбинация комплексного соединения марганца и соединения в форме, не являющейся марганцевым комплексом
Иллюстрации
Показать всеИзобретение относится к медицине и описывает способ лечения патологического состояния, вызванного присутствием свободных кислородных радикалов у пациента, включающий введение указанному пациенту первого компонента, где первым компонентом является марганцевый комплекс Формулы I, в количестве, эффективном для лечения патологического состояния, и в качестве второго компонента - не являющийся марганцевым комплекс соединения Формулы I в количестве, эффективном для снижения поглощения марганца мозгом пациента по сравнению с введением первого компонента в отсутствие второго компонента, где второй компонент вводят в количестве от примерно 1 до 20 мкмоль/кг, где первый компонент и второй компонент включены в соотношении первый компонент:второй компонент в диапазоне от примерно 1:1 до 1:10 веса тела и где введение первого компонента и/или введение второго компонента необязательно вместе с одним или несколькими физиологически приемлемыми носителями и/или вспомогательными веществами. Изобретение обеспечивает снижение диссоциации марганца и снижение нейротоксичности. 22 з.п. ф-лы, 12 ил., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим композициям и терапевтическим способам, в которых применяется комбинация марганцевого комплекса дипиридоксильного соединения, например, MnDPDP (марганец-N,N'-бис(пиридоксаль-5-фосфат)этилендиамин-N,N'-диуксусная кислота) или другие марганцевые комплексы Формулы I (здесь далее производные марганец-пиридоксилэтилдиамин или MnPLED-производные), в качестве первого компонента, и не содержащее марганец соединение Формулы I (далее называемое PLED-производное), например DPDP, в качестве второго компонента, в качестве терапевтических агентов. Композиции и способы по изобретению могут применяться в любом способе лечения, в котором для достижения терапевтического эффекта традиционно применяются такие марганцевые комплексы. В конкретном примере осуществления композиции могут применяться при лечении патологических состояний, вызываемых присутствием кислородных свободных радикалов в организме, например, окислительного стресса.
Уровень техники
В медицине известно применение хелатирующих агентов на основе дипиридоксила и их хелаты металлов и некоторых содержащих марганец соединений, в частности, хелатов марганца. Смотри, например, патенты EP 0910360, US 6147094, EP 0936915, US 6258828, EP 1054670, US 6310051, EP 1060174 и US 6391895, в которых раскрывается, что некоторые хелатирующие агенты, в частности, хелатирующие агенты на основе дипиридоксила и аминополикарбоновой кислоты, и их хелаты металлов являются эффективными при лечении или предупреждении антрациклин-индуцируемой кардиотоксичности, токсичности, вызванной облучением, поражений, вызванных ишемией-реперфузией, и атеросклероза или, с общей точки зрения, каждого состояния, вызванного присутствием кислородных свободных радикалов, то есть окислительного стресса, у людей и животных.
Давно известно, что короткоживущие, но высоко реакционно-способные кислородные свободные радикалы участвуют в патологическом повреждении ткани, особенно при лечении с помощью цитотоксических препаратов/цитостатиков и радиотерапии пациентов со злокачественным новообразованием (Towart et al., Arch. Pharmacol, 1998, 358 (Suppl 2):R626; Laurent et al., Cancer Res., 2005, 65:948-956; Karlsson et al., Cancer Res., 2006, 66:598; Alexandre et al., J. Natl. Cancer Inst., 2006, 98:236-244; Doroshow, J. Natl. Cancer Inst., 2006, 98:223-225), индуцированной ацетаминофеном печеночной недостаточности (Bedda et al., J. Hepatol., 2003, 39:765-772; Karlsson, J. Hepatol. 2004, 40:872-873), ишемической болезни сердца (Cuzzocrea et al., Pharmacol. Rev., 2001, 53:135-159) и различных нейродегенеративных заболеваниях, включая болезнь Альцгеймера, боковой амиотрофический склероз (БАС), болезнь Паркинсона и рассеянный склероз (Knight, Ann. Clin. Lab. Sci., 1997, 27:11-25). Повышенное образование кислородных свободных радикалов также вовлечено в патологические состояния перенасыщения железом (Rachmilewitz et al., Ann. N. Y. Acad. Sci., 2005, 1054:118-23), например, при талассемии, серповидноклеточной анемии и трансфузионном гемосидерозе. Кислородные свободные радикалы также вовлечены в вызванный гепатитом цирроз печени (Farrell et al., Anat. Rec., 2008, 291:684-692) и ухудшение слуха в результате воздействия шума (Wong et al., Hear Res., 2010, 260:81-88).
Одно из MnPLED-производных, а именно марганец-N,N'-бис-(пиридоксаль-5-фосфат)-этилендиамин-N,N'-диуксусная кислота (марганец-дипиридоксилдифосфат, MnDPDP), одобрено для применения в качестве контрастного вещества у людей для диагностики с помощью МРТ. Интересно, что на мышах было показано, что MnDPDP обладает защитным действием в отношении серьезных побочных эффектов нескольких цитотоксических/цитостатических лекарственных средств (доксорубицин, оксалиплатин, 5-фторурацил и паклитаксел) без отрицательного влияния на противоопухолевые эффекты данных лекарственных средств (Towart et al., 1998, Laurent et al., 2005, Karlsson et al., 2006, Alexandre et al., 2006, Doroshow, 2006). MnDPDP был протестирован на пациенте с колоректальным раком, проходившем паллиативное лечение с помощью комбинации фолината, 5-фторурацила и оксалиплатина (FOLFOX) (Yri et al., Acta Oncol., 2009, 48:633-635). Данные доклинического исследования и результаты для указанного одного пациента были настолько многообещающими, что в Швеции начались клинические исследования у пациентов со злокачественным новообразованием. Первый этап исследований завершен, и положительные результаты представлены в Агентство по контролю за медицинскими продуктами Швеции.
Также было отмечено, что MnDPDP защищает мышей от индуцированной ацетаминофеном острой печеночной недостаточности у мышей (ОПН) (Bedda et al., 2003; Karlsson, 2004). ОПН характеризуется массовой смертью гепатоцитов, состоянием, вызываемым снижением уровня глутатиона, кислородными свободными радикалами и повреждением митохондрий.
MnDPDP представляет собой пролекарство в том смысле, что вероятно оно должно метаболизировать в N,N'-дипиридоксилэтилендиамин-N,N'-диуксусную кислоту (MnPLED) перед тем, как оно сможет оказать защитные свойства в отношении клеток в условиях in vivo (смотри, например, Karlsson et al., Acta Radiol., 2001, 42:540-547).
Марганец является незаменимым микроэлементом, а также потенциально нейротоксичным металлом. Давно известно, что в условиях хронического воздействия высоких уровней содержания марганца часто встречается экстрапирамидный синдром, сходный с синдромом Паркинсона, хотя клинически другая нозологическая форма (смотри Scheuhammer & Cherian, Arch. Environm. Contam. Toxicol., 1982, 11:515-520). При внутривенной инъекции людям MnDPDP в дозе для диагностики с помощью МР-томографии высвобождается около 80% введенного марганца (Toft et al., Acta Radiol., 1997, 38:677-689). Высвобождение парамагнитного марганца в действительности является необходимым условием для диагностических свойств MnDPDP при МР-томографии (Wendland, NMR Biomed., 2004, 17:581-594). С другой стороны, терапевтическое действие MnDPDP и его дефосфорилированных аналогов MnDPMP (N,N'-дипиридоксилэтилендиамин-N,N'-диацетат-5-фосфат) и MnPLED зависит от недиссоциированного металлокомплекса (Brurok et al., Biochem. Biophys. Res. Commun., 1999, 254:768-721, Karlsson et al., 2001, 42:540-547).
PLED-производные имитируют митохондриальный фермент марганецзависимую супероксиддисмутазу (MnСОД) (Brurok et al., 1999). MnСОД защищает клетки млекопитающих от супероксид-радикала, побочного продукта метаболизма кислорода, который образуется в довольно больших количествах в нормальных аэробных условиях; ни одно животное не выживет без функционирующей MnСОД. MnСОД имеет самую высокую каталитическую активность (скорость реакции с его субстратом) среди известных ферментов (>109 M-1с-1) (Fridovich, J. Exp. Biol., 1998, 201:1203-1209). Низкомолекулярные миметики MnСОД могут обладать каталитической активностью, близкой к таковой для природной MnСОД (Cuzzorea et al., 2001). Интересно, что физиологические буферы, содержащие металлы переменной валентности, подобные марганцу, могут обладать аналогичной высокой каталитической активностью (Culotta et al., Biochim. Biophys. Acta., 2006, 1763:747-758). Однако важное значение природных ферментов СОД связано с процессом селекции, используемого организмами, в результате которого совершенствуется средство локализации каталитического металла переменной валентности для дисмутации супероксида в тех частях клетки, где существует высокая потребность в такой дисмутации. Кроме того, результаты, полученные при ишемии-реперфузии миокарда у свиней под анестезией, неизменно демонстрируют, что от окислительного стресса защищает недиссоциированный MnPLED, а не марганец в чистом виде, что демонстрируется уменьшением размера инфаркта (Karlsson et al., 2001). Эффективная дезактивация супероксида является важной для предотвращения образования очень губительных гидроксильных радикалов и пероксинитрита (Cuzzocrea et al., 2001). При протекании патологического окислительного стресса образование супероксид-радикалов часто превышает способность организма по инактивации. Кроме того, супероксид способствует образованию пероксинитрита, который нитрует эндогенную СОД. Подвергнутые нитрованию MnСОД и/или CuZnСОД теряют ферментативную активность, что в результате способствует накоплению супероксида и вызываемых супероксидом повреждений (Muscoli et al., Br. J. Pharmacol., 2003, 140:445-460). Экзогенное добавление MnPLED-производных в таких случаях может восстановить защитный потенциал. PLED-производные, кроме того, являются сильными железо-связывающими веществами, что описано в патентах EP 1054670, US 6310051 и у Роклажа с коллегами (Rocklage et al., Inorg. Chem., 1989, 28:477-485), а некоторые MnPLED-производные могут обладать каталазной и глутатион-редуктазной активностями (Laurent et al., 2005), что дополнительно может повышать их антиоксидантную способность.
Для применения с целью диагностической визуализации и некоторых других применений высвобождение марганца из MnDPDP не вызывает значительных проблем с токсичностью. Однако вследствие проникновения в ЦНС, в случае более частого применения, например, при терапевтических способах, токсичность накопившегося марганца может представлять серьезную проблему нейротоксичности (Crossgrove & Zheng, NMR Biomed., 2004, 17:544-53). Таким образом, для более частого терапевтического применения следует избегать соединений, которые легко диссоциируют с высвобождением марганца.
Для того чтобы марганец распределился из крови в ткань головного мозга, он должен преодолеть либо гематоэнцефалитический барьер, либо гематоликворный барьер. Механизм, с помощью которого марганец поглощается головным мозгом, изучен плохо. Однако в некоторых литературных источниках предполагают, что марганец поглощается либо в виде свободного иона (Mn2+/Mn3+), либо в виде цитрата марганца и поддерживается гипотеза о том, что транспорт марганца облегчается посредством либо активного, либо пассивного механизма (Rabin et al., J. Neurochem., 1993, 61:509-517; Yokel, Environ. Health. Perspect., 2002, 110 suppl 5:699-704). Марганец может транспортироваться также в ЦНС в связанной с трансферрином форме. Тем не менее, в случае MnDPDP и его дефосфорилированных аналогов (наряду с другими MnPLED-производными) марганец должен, вероятно, диссоциировать из его соответствующего хелатирующего агента DPDP, DPMP или PLED (или других PLED-производных), чтобы получить доступ в ткани головного мозга.
Лечение с помощью хелатирующего металлы агента ЭДТА крыс, которых предварительно регулярно подвергали воздействию марганца в течение многих дней, приводило к значительному повышению экскреции с мочой марганца (Scheuhammer & Cherian, 1982). Аналогичное влияние ЭДТА на концентрацию марганца в моче также наблюдалось у подвергаемых хроническому отравлению сварщиков (смотри Crossgrove & Zheng, 2004). Применение у крыс хлорида марганца(II) (50 мг/кг массы тела, и.п. (интраперитонеально)) один раз в сутки в течение 1 или 4 дней приводило к повышению уровней марганца до 232, 523 и 427% в коре головного мозга, бледном шаре и мозжечке, соответственно. Данные изменения сопровождаются развитием патологических изменений в морфологии глии. Совместное введение с хелатирующим марганец агентом 1,2-циклогексилендинитрилотетрауксусной кислотой (CDTA) полностью препятствовало возникновению данной патологии (смотри Hazell et al., Neurosci. Lett., 2006, 396:167-71), хотя авторы не сообщают, был ли данный эффект CDTA благодаря непосредственному ингибированию поглощения марганца головным мозгом.
Таким образом, хотя известны комплексные соединения марганца, обеспечивающие терапевтические эффекты при различных способах лечения, существует необходимость в разработке средств для обеспечения таких терапевтических эффектов, наряду со снижением нежелательных побочных эффектов, связанных с такими способами лечения.
Сущность изобретения
В настоящем изобретении предлагаются усовершенствованные фармацевтические композиции и терапевтические способы для лечения патологических состояний у человека и не являющегося человеком пациента, и, в частности, предлагаются такие фармацевтические композиции и терапевтические способы, которые преодолевают различные недостатки прототипа. Фармацевтические композиции и способы могут применяться в любой терапии, при которой описываемый здесь марганцевый комплекс Формулы I является эффективным. В конкретном варианте осуществления фармацевтические композиции и способы могут применяться в терапии для лечения состояния, вызванного присутствием кислородных свободных радикалов, то есть, окислительного стресса.
В одном варианте осуществления изобретение относится к фармацевтическим композициям для лечения патологического состояния у пациента, содержащим, в качестве первого соединения, марганцевый комплекс Формулы I и, в качестве второго компонента, не являющееся марганцевым комплексом соединение Формулы I, необязательно вместе с одним или несколькими физиологически приемлемыми носителями и/или вспомогательными веществами,
Формула I
где
X представляет собой CH или N,
каждый R1 независимо представляет собой водород или -CH2COR5;
R5 представляет собой гидрокси, необязательно гидроксилированный алкокси, амино или алкиламидо;
каждый R2 независимо представляет собой ZYR6, где Z представляет собой связь или C1-3 алкилен или оксоалкиленовую группу, необязательно замещенную R7;
Y представляет собой связь, атом кислорода или NR6;
R6 является атомом водорода, COOR8, алкилом, алкенилом, циклоалкилом, арилом или аралкилом, группой, необязательно замещенной одной или несколькими группами, выбранными из COOR8, CONR8 2, NR8 2, OR8, =NR8, =O, OP(O)(OR8)R7 и OSO3M; R7 представляет собой гидрокси, необязательно гидроксилированную, необязательно алкоксилированную алкильную или аминоалкильную группу;
R8 является атомом водорода или необязательно гидроксилированной, необязательно алкоксилированной алкильной группой;
M является атомом водорода или одним эквивалентом физиологически приемлемого катиона;
R3 представляет собой C1-8 алкиленовую, 1,2-циклоалкиленовую или 1,2-ариленовую группу, необязательно замещенную R7; и
каждый R4 независимо представляет собой водород или C1-3 алкил.
В другом варианте осуществления изобретение относится к способам лечения патологического состояния у пациента, включая, в качестве неограничивающих примеров, патологическое состояние, вызываемое присутствием кислородных свободных радикалов. Способы включают введение пациенту первого компонента и второго компонента, описанных здесь, например, в фармацевтической композиции по изобретению.
Фармацевтические композиции и способы по настоящему изобретению обладают неожиданным преимуществом, что раскрывается и демонстрируется здесь. Например, композиции и способы могут приводить к увеличению количества экскретируемого марганца, снижению количества свободного марганца у пациента и/или повышению количества терапевтически активного метаболита, образуемого in vivo, по сравнению с эффектами, получаемыми при введении только первого компонента - марганцевого комплекса, в отсутствие второго компонента, не содержащего марганец. Дополнительные преимущества и варианты осуществления заявляемых фармацевтических композиций и способов изобретения очевидны из следующего ниже подробного описания.
Краткое описание чертежей
Следующее ниже подробное описание будет очевидно при рассмотрении чертежей, где:
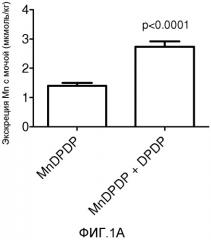
На Фиг.1A и 1B показано содержание Mn в моче через 0-24 ч у крыс, которым инъецировали один MnDPDP или комбинацию MnDPDP и DPDP, выраженное в виде мкмоль/кг массы тела (Фиг.1A) или в процентах от введенной инъекцией дозы (Фиг.1B); среднее ± S.E.M. (среднее ± стандартная ошибка среднего); n=7 в каждой группе.
На Фиг.2 показано содержание Mn в головном мозге у крыс, которым инъецировали один MnDPDP или комбинацию MnDPDP и DPDP, выраженное в виде увеличения в процентном выражении Mn в головном мозге/г общей массы; среднее ± S.E.M.; n=4 в каждой группе.
На Фиг.3A и 3B показано содержание Mn в головном мозге у крыс, которым инъецировали один MnDPDP или комбинацию MnDPDP и DPDP, выраженное в виде увеличения в мкг Mn в головном мозге/г общей массы (Фиг.3A) и в виде увеличения в процентном выражении Mn в головном мозге (Фиг.3B); среднее ± S.E.M.; n=5 в каждой группе, и на Фиг.3C показано содержание Zn в головном мозге у крыс, которым инъецировали один MnDPDP или MnDPDP плюс DPDP; среднее ± S.E.M.; n=3 в каждой группе.
На Фиг.4A и 4B представлены кривые зависимости доза-эффект у крыс для экскреции Zn и Mn за 0-24 ч при увеличении доз DPDP (Фиг.4A); среднее ± S.E.M. (n=10), и экскреция Zn за 0-24 ч при инъецировании одного MnDPDP или комбинации MnDPDP и DPDP, выраженная в виде мкмоль/кг массы тела (Фиг.4B); среднее ± S.E.M.; n=2 в каждой группе.
На Фиг.5A-5D представлены результаты подсчета клеток крови (количество лейкоцитов (WBC), абсолютное число нейтрофилов (ANC), моноцитов и лимфоцитов, соответственно) после обработки только паклитакселем или комбинацией MnDPDP + DPDP; среднее ± S.E.M.; n=3-5 в каждой группе.
Чертежи будут более понятны при рассмотрении Примеров.
Подробное описание
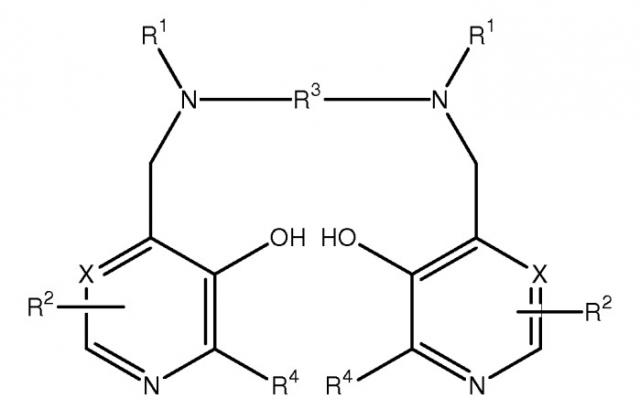
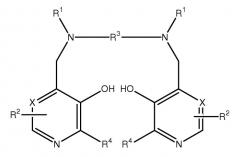
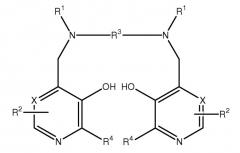
Настоящее изобретение относится к фармацевтическим композициям и терапевтическим способам, в которых применяется комбинация, где в качестве первого компонента выступает марганцевый комплекс Формулы I, определенный здесь, а в качестве второго компонента - не являющееся марганцевым комплексом соединение Формулы I. Соединения Формулы I являются дипиридоксильными соединениями и называются здесь как PLED (пиридоксил-этилдиамин)-производные, хотя известно, что производные действуют как пролекарства PLED, так как они могут метаболизировать с образованием PLED in vivo. Такие соединения в виде металлокомплексов называются здесь как МеталлPLED-производные, то есть MnPLED-производные, и МеталлPLED хелаторы.
В настоящих фармацевтических композициях применяется, в качестве первого компонента, марганцевый комплекс Формулы I и, в качестве второго компонента, не являющееся марганцевым комплексом соединение Формулы I:
Формула I
где
X представляет собой CH или N,
каждый R1 независимо представляет собой водород или -CH2COR5;
R5 представляет собой гидрокси, необязательно гидроксилированный алкокси, амино или алкиламидо;
каждый R2 независимо представляет собой ZYR6, где Z представляет собой связь или C1-3 алкилен или оксоалкиленовую группу, необязательно замещенную R7;
Y представляет собой связь, атом кислорода или NR6;
R6 является атомом водорода, COOR8, алкилом, алкенилом, циклоалкилом, арилом или аралкилом, группой, необязательно замещенной одной или несколькими группами, выбранными из COOR8, CONR8 2, NR8 2, OR8, =NR8, =O, OP(O)(OR8)R7 и OSO3M; R7 представляет собой гидрокси, необязательно гидроксилированную, необязательно алкоксилированную алкильную или аминоалкильную группу;
R8 является атомом водорода или необязательно гидроксилированной, необязательно алкоксилированной алкильной группой;
M является атомом водорода или одним эквивалентом физиологически приемлемого катиона;
R8 представляет собой C1-8 алкилен, 1,2-циклоалкилен или 1,2-ариленовую группу, необязательно замещенную R7; и
каждый R4 независимо представляет собой водород или C1-3 алкил.
В конкретном варианте осуществления R5 представляет собой гидрокси, C1-8 алкокси, этиленгликоль, глицерин, амино или C1-8 алкиламидо; Z является связью или группой, выбранной из CH2, (CH2)2, CO, CH2CO, CH2CH2CO и CH2COCH2; Y является связью; R6 представляет собой моно- или поли(гидрокси или алкоксилированную)алкильную группу или формулы OP(O)(OR8)R7; и R7 представляет собой гидрокси или незамещенный алкил или аминоалкильную группу. В еще одном варианте осуществления R3 является этиленом и каждая группа R1 представляет собой -CH2COR5, где R5 представляет собой гидрокси. В еще других вариантах осуществления первым компонентом является марганец-N,N'-бис-(пиридоксаль-5-фосфат)этилендиамин-N,N'-диуксусная кислота или ее соль (MnDPDP) и вторым компонентом является N,N'-бис-(пиридоксаль-5-фосфат)этилендиамин-N,N'-диуксусная кислота (DPDP) или ее соль или ее комплекс, не являющийся марганцевым комплексом. В более конкретных вариантах осуществления вторым компонентом является DPDP, кальций-DPDP (CaDPDP) или магний-DPDP (MgDPDP) или комбинация двух или нескольких из них.
В дополнительных вариантах осуществления изобретения, первый компонент имеет значение Ka в диапазоне от 108 до 1024. В еще одном варианте осуществления второй компонент имеет более низкое значение Ka для Mn2+, чем соответствующее значение Ka в случае цинка (Zn2+) по меньшей мере в десять раз.
Первый компонент и второй компонент могут применяться в различных количествах, что будет описано более подробно далее. Единственно необходимо, чтобы наряду с содержащим марганец соединением присутствовало свободное от марганца соединение, то есть «избыток» соединения, не являющегося комплексом производного. Однако в конкретном варианте осуществления второй компонент включен в эквимолярном или большем количестве относительно первого компонента. В другом варианте осуществления изобретения, второй компонент включен в большем количестве, из расчета по молям, относительно первого компонента. В более конкретном варианте осуществления первый компонент и второй компонент включены в молярном отношении первый компонент:второй компонент в пределах около 1:1-1:20, 1:1-1:10 или 1:1-1:5. В еще более конкретном варианте осуществления первый компонент и второй компонент включены в молярном отношении первый компонент:второй компонент в пределах около 1:2-3:4. В конкретном варианте осуществления например, для лечения злокачественного новообразования, количество первого компонента, например MnDPDP, может составлять 10 мМ MnDPDP, а количество второго компонента, например DPDP, может составлять 50 мМ DPDP, 0,2 мл/кг будет приводить к дозе 2 мкмоль/кг массы тела MnDPDP + 10 мкмоль/кг массы тела DPDP, обеспечивая молярное отношение 1:5. В дополнительных вариантах осуществления доза Mn-содержащего соединения, такого как MnDPDP, может быть уменьшена. Если доза MnDPDP уменьшается, может применяться меньшее чем 1:5 соотношение.
Высвобождение марганца in vivo из MnPLED-производных, включая марганец-N,N'-бис(пиридоксаль-5-фосфат)этилендиамин-N,N'-диуксусную кислоту (MnDPDP), зависит от присутствия в организме свободного или легко диссоциируемого цинка. Цинк обладает в приблизительно 1000 раз более высоким аффинитетом, чем марганец, в отношении DPDP или его дефосфорилированных аналогов (Rocklage et al., 1989). Экспериментальные исследования показывают, что высвобождение марганца in vivo достигает насыщения, когда дозу MnDPDP повышают в приблизительно два-четыре раза относительно дозы 5-10 мкмоль/кг для диагностической визуализации (Southon et al., Acta Radiol., 1997, 38:708-716). Визуализация сердца и печени с помощью MnDPDP у здоровых добровольцев показывает дозу насыщения у людей 10-20 мкмоль/кг (Skjold et al., J. Magn. Reson. Imaging, 2004, 20:948-952, Toft et al., 1997).
В соответствии с изобретением было обнаружено, что, удивительно, добавление избытка не содержащего марганец PLED-производного, например DPDP, при лечении с помощью MnPLED-производного, например, с помощью MnDPDP, предотвращает высвобождение нейротоксичного марганца из MnDPDP. Хотя механизм, обуславливающий накопление марганца в головном мозге, мало изучен, как указано ранее, избыток не содержащего марганец PLED-производного, такого как DPDP, вводимого в комбинации с марганец-содержащим PLED-производным, таким как MnDPDP, значительно снижает накопление марганца в головном мозге. Низкомолекулярные хелаты марганца, подобные MnPLED-производным, и их Zn-аналоги будут легко экскретироваться почками, подчиняясь скорости гломерулярной фильтрации (СГФ), в то время как марганец, не связанный с низкомолекулярным хелатирующим агентом, будет задерживаться в организме довольно долго и экскретироваться медленно и главным образом посредством желчевыводящей системы (Toft et al., 1997). Не ограничиваясь предположением, существует мнение, что комбинация по настоящему изобретению поддерживает форму хелатирующего агента MnPLED, тем самым повышая количество хелатов, доступных для экскреции, и уменьшая количество свободного Mn для накопления в головном мозге.
В одном варианте осуществления способов по изобретению, экскреция Mn, то есть с мочой, повышается по меньшей мере на приблизительно 100% (смотри далее Пример 1) при комбинировании введения марганцевого комплекса пиридоксильного соединения, то есть первого компонента, с введением не содержащего марганец дипиридоксильного соединения, то есть второго компонента. Пример 1 демонстрирует, что экскреция марганца в мочу увеличивается от 1,41 мкмоль/кг до 2,73 мкмоль/кг, то есть приблизительно на 100%. Однако исходя из Примера 4 ожидают, что при более низких и может быть более терапевтически значимых дозах MnDPDP (в недавно оконченном в Швеции клиническом исследовании на пациенте со злокачественным новообразованием применяли 2 мкмоль/кг) соответствующее увеличение будет значительно больше. В дополнительных вариантах осуществления экскреция Mn увеличивается по меньшей мере на приблизительно 200% или по меньшей мере на 300%, все из расчета по молям, при комбинировании введения марганцевого комплекса пиридоксильного соединения, то есть первого компонента, с введением не содержащего марганец дипиридоксильного соединения, то есть второго компонента. В дополнительных вариантах осуществления экскреция Mn увеличивается по меньшей мере на приблизительно 400% или по меньшей мере на 500%, все из расчета по молям, при комбинировании введения марганцевого комплекса пиридоксильного соединения, то есть первого компонента, с введением не содержащего марганец дипиридоксильного соединения, то есть второго компонента. Таким образом, в конкретном варианте осуществления настоящего изобретения решается проблема нейротоксичности MnDPDP или его дефосфорилированных аналогов при частом применении путем добавления избытка DPDP или его дефосфорилированных аналогов в композицию.
Еще одно преимущество возникает в результате того, что поддерживается повышенный уровень терапевтической формы хелатирующего агента, так что в комбинации может вводиться более низкая доза хелата с получением такого же терапевтического эффекта, как при более высокой дозе хелата, вводимого в одиночку, то есть в отсутствие не содержащего марганец соединения.
Когда в клинике доза MnPLED-производного, такого как MnDPDP (то есть 5-10 мкмоль/кг массы тела, внутривенное введение), вводится в качестве контрастного агента для МРТ у человека, более 80% марганца, связанного с DPDP, обменивается на цинк (Toft et al., 1997). При введении меньших доз MnDPDP процент марганца, который диссоциирует, будет дальше больше, что будет обсуждаться ниже. В этом отношении MnDPDP ведет себя аналогичным образом у крыс и собак (Hustvedt et al., Acta Radiol., 1997, 38:690-699), однако почти весь марганец в MnDPDP обменивается на цинк, когда соединение вводиться свиньям, и следовательно у свиней отсутствуют цитопротекторные эффекты (Karlsson et al., 2001). Обмен марганца является предварительным условием и поэтому желательным для применения в качестве контрастирующего агента для МРТ, как обсуждается выше. Однако недиссоциированный марганцевый комплекс MnPLED-производного, например MnDPDP и его дефосфорилированных аналогов, необходим для получения терапевтического эффекта, например, в отношении различных форм окислительного стресса (Brurok et al., 1999; Karlsson et al., 2001). Так, например, принимая во внимание, что введение MnDPDP in vivo позволяет защищать от различных вызывающих окислительный стресс факторов, например, ишемии-реперфузии, цитотоксических/цитостатических препаратов и интоксикации ацетаминофеном, оно не защищает сердце свиньи от вызванного ишемией-реперфузией инфаркта миокарда (Karlsson et al., 2001), из чего можено сделать заключение, что цитопротективные эффекты in vivo MnDPDP обусловлены свойствами, присущими недиссоциированному марганцевому комплексу.
Добавление не являющегося марганцевым комплексом соединения, такого как DPDP, чтобы сделать устойчивым марганцевое соединение, такое как MnDPDP или его дефосфорилированные аналоги, в отношении высвобождения марганца, в соответствии с настоящим изобретением, таким образом, обеспечивает другое важное преимущество, а именно, терапевтическую эффективность. Так например, когда доза MnDPDP (5-10 мкмоль/кг) для клинически значимой визуализации вводится внутривенной инъекцией, более 80% марганца, первоначально связанного с DPDP, высвобождается, внося вклад в эффект визуализации. Следовательно, менее 20% остается связанным с DPDP или его дефосфорилированными аналогами, внося вклад в терапевтическую активность MnDPDP. В соответствии с настоящим изобретением, что иллюстрируется Примером 1, когда количество марганца, которое высвобождается из комплекса, уменьшается от 85% до 70% при добавлении DPDP к вводимому MnDPDP, около 30% инъецируемой дозы MnDPDP будет вносить вклад в терапевтическую активность, таким образом, увеличивая вдвое количество оказывающего терапевтическое действие Mn-хелата. Место высвобождения марганца также регулируется главным образом путем добавления DPDP, отсюда следует, что доза MnDPDP в присутствии добавленного DPDP может быть уменьшена на 50% с достижением равносильного терапевтического эффекта. Однако, как обсуждается ниже, при более низких и, в некоторых вариантах осуществления более терапевтически значимых дозах MnDPDP действие добавленного DPDP будет усиливаться даже больше. Это в свою очередь означает, что добавление DPDP к MnDPDP будет оказывать сильное влияние на степень токсичности MnDPDP.
Цинк присутствует во всех тканях и жидкостях организма. Было установлено, что общее содержание цинка в организме человека составляет 2-3 г (Folin et al., BioMetals, 1994, 7:75-79). В плазме цинк представлен в количестве 0,1% от общего содержания цинка в организме, и главным образом эта небольшая фракция цинка конкурирует с марганцем для связывания с DPDP или его дефосфорилированными аналогами - DPMP и PLED, после введения. Организм человека обладает очень высокой эффективностью в поддержании гомеостаза цинка посредством синергического регулирования поглощения и экскреции в желудочно-кишечном тракте (King et al., J. Nutr., 2000, 130:1360S-1366S). Поэтому не существует или существует очень низкая степень риска, что повторяющиеся инъекции клинически значимых доз MnDPDP, содержащих избыток DPDP, могут индуцировать дефицит цинка. В случае любой тенденции к возникновению дефицита цинка такие проблемы могут быть легко решены путем добавления в диету цинка между введениями MnDPDP.
На основании доклинических исследований (Southon et al., 1997) и клинических исследований (Skjold et al., 2004) есть основания предполагать, что в организме содержится 10-20 мкмоль/кг массы тела цинка, который легко обменивается с марганцем в MnPLED-производном, таком как MnDPDP. Это по существу соответствует содержанию цинка в плазме (смотри выше). PLED-производные, такие как DPDP, содержат один сайт связывания для марганца/цинка в молекуле. Таким образом, принимая во внимание, что цинк обладает в 1000 раз более высоким аффинитетом к хелатирующему агенту, в одном варианте осуществления изобретения, добавление не содержащего марганец соединения, такого как DPDP, в дозе 1-100 мкмоль/кг массы тела к композиции MnPLED-производного, такого как MnDPDP, будет предотвращать высвобождение марганца после введения пациенту.
Результаты доклинических исследований демонстрируют, что внутривенное введение MnDPDP в дозах в диапазоне 1-30 мкмоль/кг массы тела уменьшает индуцированную доксорубицином кардиомиопатию у мышей и инфаркт миокарда у свиней (смотри патенты EP 0910360, US 6147094, EP 0936915, US 6258828, Karlsson et al., 2001; Towart et al., 1998). Другие MnPLED-производные демонстрируют эффект при различных уровнях доз, и дозы в 10-100 раз меньшие, чем в упомянутом выше интервале доз, также охватываются фармацевтическими композициями и способами по настоящему изобретению (EP 0910360, US 6147094). Принимая во внимание различие в типе, различия в эффективности разных MnPLED-производных, различия в поверхности тела и различные пути введения, подходящая доза для первого компонента, в соответствии с конкретным вариантом осуществления изобретения, при введении пациенту будет в пределах приблизительно 0,01-10 мкмоль/кг массы тела и подходящая доза для второго компонента, в соответствии с конкретным вариантом осуществления изобретения, будет в пределах приблизительно 1-100 мкмоль/кг массы тела. В более конкретном варианте осуществления второй компонент вводится в эквимолярном или большем количестве относительно первого компонента и находится в пределах приблизительно 1-20 мкмоль/кг массы тела. В еще одном конкретном варианте осуществления первый компонент вводится в количестве приблизительно 1-2 мкмоль/кг массы тела.
Фармацевтические композиции могут быть готовыми композициями, содержащими как первый компонент, то есть MnPLED-производное, так и второй компонент, то есть PLED-производное, или фармацевтическая композиция может содержать первый компонент и второй компонент по отдельности, но в соединенных упаковках для введения в комбинации. В этой связи, первый компонент и второй компонент может вводиться в комбинации или раздельно, одновременно или последовательно.
В фармацевтические композиции по настоящему изобретению необязательно могут быть включены один или несколько физиологически приемлемых носителей и/или вспомогательных веществ способом, хорошо известным специалистам в данной области техники. В одном варианте осуществления соединения Формулы I могут, например, быть суспендированы или растворены в водной среде, необязательно с добавлением фармацевтически приемлемых вспомогательных веществ. Подходящие вспомогательные вещества для фармацевтических композиций включают любые традиционные вспомогательные вещества для фармацевтического или ветеринарного препарата, включая, в качестве неограничивающих примеров, стабилизаторы, антиоксиданты, регулирующие осмотическое давление раствора агенты, буферы, регулирующие величину pH агенты, связующие, наполнители и тому подобное. Фармацевтические композиции могут быть в форме, подходящей для введения, включая, в качестве неограничивающих примеров, парентеральное и энтеральное введение. В конкретном варианте осуществления композиция находится в форме, подходящей для, например, инъекции или инфузии. Таким образом, фармацевтические композиции по настоящему изобретению могут находиться в традиционной фармацевтической форме для введения, такой как таблетка, капсула, порошок, раствор, суспензия, дисперсия, сироп, суппозитория и тому подобное.
Фармацевтические композиции в соответствии с настоящим изобретением могут вводиться различными способами, например, перорально, трансдермально, ректально, интратекально, местно или посредством ингаляции или инъекции, в частности, инъекцией подкожно, внутримышечно, интраперитонеально или внутрисосудисто. Также могут использоваться другие способы введения, включая интратимпанальное введение, и предпочтительными являются способы введения, которые повышают эффективность, биодоступность и переносимость фармацевтических продуктов. Наиболее подходящий способ может быть выбран специалистом в данной области техники в соответствии с конкретной лекарственной формой, которая используется.
Как указано ранее, композиции могут вводиться для терапевтического воздействия на патологическое состояние у пациента и, в частности, в любом способе, где известно применение Mn-комплекса. В конкретном варианте осуществления композиции могут вводиться для терапевтического воздействия на патологическое состояние у пациента человека или другого млекопитающего. В другом конкретном варианте осуществления композиция по настоящему изобретению вводится для лечения патологического состояния, вызываемого присутствием кислородных свободных радикалов, то есть окислительного стресса. В одном варианте осуществления фармацевтические композиции применяются при лечении цитотоксическим или цитостатическим препаратом, где MnPLED-производное вводится для обеспечения защиты от нежелательных побочных эффектов цитотоксических/цитостатических препаратов, например, у пациентов со злокачественным новообразованием. В более конкретном варианте осуществления цитотоксический или цитостатический препарат включает по меньшей мере один из следующих: доксорубицин, оксалиплатин, 5-фторурацил или паклитаксел. Спосо