Применение протатран 4-хлор-2-метилфеноксиацетата (хлоркрезацина) для угнетения активности холестеролэстеразы
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, а именно к терапии, и касается коррекции патологических процессов, обусловленных повышенной активностью холестеролэстеразы. Для этого применяют протатран 4-хлор-2-метилфеноксиацетат (хлоркрезацин). Применение этого соединения позволяет повышать устойчивость сосудистой системы к холестерину при развитии атеросклеротического процесса. 2 табл.
Реферат
Изобретение относится к медицине, фармакологии и биологии и касается нового средства, влияющего на активность холестеролэстеразы.
Холестеролэстераза играет важную роль в обмене липидов в живых организмах. Составной частью многих тканей и секретов живых организмов является холестеролэстераза, выделенная из поджелудочной железы ряда животных и человека; она представлена мономером с M=65000-69000, склонным к олигомеризации (М=300000-800000); оптимальная каталитическая активность проявляется при pH - 4,25 (для лизосомальных ферментов). Холестеролэстераза гидролизует эфиры холестерина до свободного холестерина и жирных кислот. Доказано, что холестеролэстераза является биомаркером активности атеросклеротического процесса и эффективности проводимого лечения как больных атеросклерозом, так и больных с осложнениями атеросклероза, в частности - больных ишемической болезнью сердца (стенокардией напряжения II ФК) - ИБС (Васильев А.В., Варсанович Е.А., Погожева А.В., Самсонов М.А., Бобкова CH.: Липолитические ферменты лизосом тромбоцитов и мононуклеаров в патогенезе ИБС // «Вопр. мед. химии» 1992, №5. С. 27-29) [1].
Известно, что нарушения липидного обмена в виде атерогенных гиперхолестеринемий сопровождаются повышением свертываемости крови, что оправдывает применение в этих условиях препаратов с антикоагулянтным и липолитическим действием, например, гепарина. В свою очередь, коагуляционный гемостаз и липидный профиль в значительной мере определяется состоянием тромбоцитов, их ферментативными реакциями. В этом плане заслуживают внимания исследования и разработки средств, изменяющих активность липаз тромбоцитов, в частности - холестеролэстеразы (ХЭ) тромбоцитов (КФ 3.1.1.13) с оптимумом pH - 4,25, участвующей в регуляции катаболизма ЛПНП, гидролизует ЭХС полиеновых ЖК с длинной цепью (C18, С20). Среди насыщенных эфиров ХЭ гидролизует с большой скоростью холестериновый эфир меристиновой кислоты (С14), катализирует гидролиз эфиров холестерина, а также их синтез из холестерина и свободных жирных кислот в лизосомах различных клеток (А.А. Покровский, В.А. Тутелъян. Лизосомы. - Наука, 1976, 380 с.; X. Брокерхоф, Р. Дженсен. Липолитические ферменты, пер. с англ., М., 1978, с. 242-356) [2, 3].
В литературе имеются сведения о возможности активации холестеролэстеразы химическими соединениями (А.В. Ефремов и др. Роль лизосомальных ферментов в генезе ведущих клинико-патофизиологических синдромов: факты и гипотезы // Патологическая физиология и экспериментальная терапия. - 2007. - N1. - С. 18-21; О.В. Цыганкова, Л.А. Руяткина, З.Г. Бондарева. Лизосомальные ферменты. Новый взгляд на фундаментальные материи с позиций кардиолога // Ж. Цитокины и воспаление. 2009, Т. 8, №4, с. 17-24; Venu Τ Tadiboyina, Dora M Liu, Brooke A Miskie, Jian Wang, Robert A Hegele Treatment of dyslipidemia with lovastatin and ezetimibe in an adolescent with cholesterol ester storage disease.// Lipids Health Dis. 2005; 4: 26) [4, 5, 6].
Известно также, что при введении некоторых препаратов, например, липостабила, оказывающего гиполипидемическое действие, происходит активация холестеролэстеразы (М.А. Самсонов, А.В. Васильев, А.В. Погожева, С.Н. Бобкова. Сравнительная оценка гиполипидемического действия ПНЖК w-3 и липостабила // Вопр. Питания, 1996, №4. с. 12-16) [7].
Известно, что некоторые соединения не активируют, а ингибируют активность холестеролэстеразы. Так, при исследовании субстратной специфичности установлено, что галактозилцереброзид и фосфатидилсерин активируют активность холестеролэстеразы, а ганглиозид и лизолецитин, наоборот, ингибируют ее (Ф. Хухо. Нейрохимия, основы и принципы, М., Мир, 1990 г, стр. 32) [8]. В качестве ближайшего аналога может быть указан источник: Расулов М.М., Зверева М.В., Нурбеков М.К., Адамович C.H., Мирскова А.Н., Мирсков Р.Г., Воронков М.Г. Комплекс трис-(2-гидроксиэтил)амина с бис-(2-метилфенокси-ацетатом) цинка, повышающий цитокинную активность суммарной триптофанил-тРНК-синтетазы // патент RU №2457837 C1 от 10.08.2012, Бюлл. №22 [9].
Однако существует потребность в поиске и внедрении в практику новых диагностических и лекарственных средств, обладающих активностью в отношении данного фермента.
Задачей изобретения является разработка нового средства, понижающего активность холестеролэстеразы (ХЭ).
Поставленная задача решается тем, что в качестве средства, понижающим общую активность холестеролэстеразы, предлагается использовать синтезированное нами ранее [Воронков М.Г., Адамович C.H., Мирское Р.Г., Мирскова А.Н. Синтез новых биологически активных О-гидрометаллоатранов // ЖОХ, 2009, т. 79, №1, С.1 62-163] [10] биологически активное соединение - протатран 4-хлор-2-метилфеноксиацетат (хлоркрезацин), формулы: 4-Cl-2-CH3C6H3OCH2COO-[NH(CH2CH2OH)3]+
Заявляемая биологическая активность хлоркрезацина не была известна. Возможность осуществления изобретения может быть проиллюстрирована следующими представленными ниже примерами.
Пример 1
К раствору 1.66 г 2-метил-феноксиуксусной кислоты в 10 мл диэтилового (серного) эфира, содержащему 0.01 г порошкообразного Al, при перемешивании прибавляют 1.35 г хлористого сульфурила. Реакционную смесь нагревают до кипения в течение 4 ч и горячей фильтруют. Фильтрат охлаждают до 0-5°C. Выпавший белый кристаллический осадок отсасывают, промывают эфиром и сушат в вакууме. Выход 2-метил-4-хлор-феноксиуксусной кислоты с т.пл. 111-112°C 2.9 г (98%).
Найдено, %: C 53.23; H 4.31; Cl 17.72. C9H9O3Cl
Вычислено, %: C 53.86; H 4.49; Cl 17.71. [Воронков М.Г., Власова Н.Н., Григорьева О.Ю., Патент №2427568, Способ получения 2-метил-4-галоген-феноксиацетатов трис-(2-гидроксиэтил)аммония(2-метил-4-галоген-феноксиацетоксипротатранов), 2011, Б.И. 24]
Пример 2
К раствору 4.0 г 2-метил-4-хлор-феноксиуксусной кислоты в 10 мл ацетона при перемешивании прибавляют 3.0 г триэтаноламина. Реакционную смесь выдерживают 0.5 ч, выпавший осадок отфильтровывают, промывают эфиром и сушат в вакууме. Получено 6.8 г (98%) хлоркрезацина с т.пл. 87-88°C [лит. данные 91-92°C, Софьина З.П., Воронков М.Г., Дьяков М.Г. и др. // Хим.-фарм. журн., 1978. Т. 12, №4. С. 74-77].
Найдено, %: C 51.43; H 6.87; N 4.20; Cl 10.10. C15H24O6NCl
Вычислено, %: C 51.50; H 6.90; Ν 4.01; Cl 10.16. [Колесникова О.П., Мирскова А.Н.. Адамович C.H., Мирсков Р.Г., Кудаева О.Т., Воронков М.Г., ДАН, 2009, Т. 425, №4, с. 556-560].
Впервые показано, что введение хлоркрезацина снижает активность лизосомального липолитического фермента из класса гидролаз (КФ 3.1.1) - холестеролэстеразы (КФ 3.1.1.13).
Новая, ранее неизвестная физиологическая активность хлоркрезацина - угнетение активности холестеролэстеразы (ХЭ). Возможность осуществления изобретения может быть проиллюстрирована ниже представленными данными.
Пример 3
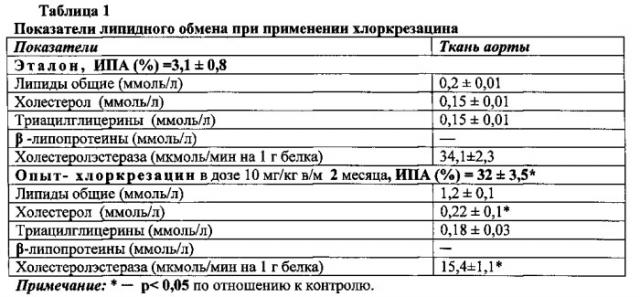
Эксперименты проводят на кроликах породы Шиншилла с исходной массой тела 1,8-2,0 кг. Кроликам опытных групп (10 животных) вводят внутримышечно свежеприготовленный водный раствор хлоркрезацина (Хк) в дозе 10 мг/кг, в течение 2 мес. В конце экспериментов, у животных в грудном отделе аорты стандартными методами определяют содержание липидов, триацилглицеринов, β-липопротеинов и холестерина. Планиметрически оценивают индекс ее пораженности атеросклеротическими бляшками (ИПА). Для определения активности ХЭ из кусочков грудной аорты диспергированием выделяют клетки интимы методом (Haley N.J., Powler S., De Duve С. Lysosomal and cholesteryl esterase activity in normal and lipid laden aortic cells // J. Lipid Research. - 1980. - N 8. - P. 961-969) [11]. Для этого используют раствор (0,5 мл), содержащий коллагеназу тип 4 и эластазу тип 3 («sigma», США). Время диспергирования - 75 мин при 37°C (1 мл/50 мг ткани). Полученную суспензию клеток промывают холодным раствором Хенкса. Осадок при последней промывке гомогенизируют в 2 мл 0,25М раствора сахарозы pH 7,4 с 0,001 м ЭДТА. Конечное разведение гомогенатов аорты соответствует 1:20 (вес: объем). Супернатант используют для исследования активности ХЭ. Активность ХЭ определяют по методу (Меньшиков В.В. Лабораторные методы исследования в клинике. М.: Медицина. (1987), С. 106-174 [12], в модификации (Friedwald W.T., Levy R.I., Fredrickson D.S Estimation of plasma low density lipoprotein cholesterol concentration with use of the preparative ultracentrifuge. // Clin Chem (1972); V. 18, P. 499-502) [13], используя в качестве субстрата 12,7 мкмолей холестерол-(1-14с)-олеата (удельная мКи/ммоль («Amershem», Англия). Субстрат предварительно освобождают от загрязнения жирными кислотами экстракцией, затем добавляют в небольшое количество бензола, содержащего 1,25 ммоль немеченого холестерол-олеата и 127 ммоль яичного лецитина. Растворитель упаривают в токе азота. Несколько раз промывают хлороформом при 37°C. Затем в колбу, содержащую субстратную смесь, заливают 10 мл 10 мм тирс-HCl буфера pH 7,0 с 100 мм ЛСД. Суспензию переносят в 15 мл сосуд с охлаждением (или баню со льдом) и озвучивают 12 мин на Brenson W-350 дезинтеграторе со стандартным диаметром наконечника 0,5-дюймовым и мощностью около 100 Вт. Полученную опалесцирующую суспензию центрифугируют в течение 15 мин при 30000 об/мин («Beckmen» L-5). Препарат хранят при 4°C в течение 2 нед.
Источник фермента - суспензия клеток (аорта) разбавляют в 3 раза буфером pH 7,4 (среда выделения с дигитоником), субстрат разводят в 0,1 M ацетатном буфере pH 3,9 с 5,0 мм таурохолатом натрия в соотношении 1:4 (об./об.). К 0,1 мл материала добавляют 0.1 мл раствора субстрата, инкубируют на водяной бане при 37 градусах С 90 мин и останавливают реакцию органической смесью, состоящей из метанола, хлороформа и гептана (2,5 мл) в соотношении 1,4:1,3:1 (об./об.) соответственно, после чего добавляют 0,1 M боратный буфер pH 10,0 (1,05 мл) и проводят активное смешивание на встряхивателе «Vortex» в течение 5 мин. Далее смесь центрифугируют в течение 10 мин при 2500-3000 об/мин на центрифуге РС-6. После разделения фаз отбирают 0,5 мл верхней светлой фазы и подсчитывают ее в сцинциляционной жидкости (на 1 л толуола - 4 г РРО и 0,2 г РОРОР) на счетчике «Mark-З» (Голландия).
Активность холестеролэстеразы (А) рассчитывают по формуле:
,
где СРМ - счет в импульсах/мин; 1,27 - количество немеченого холестерол-олеата в пробе, мкмоль; 40 - разведение в ходе энзиматической реакции; 4,9 - коэффициент фазового распределения меченого холестерол-олеата; t-время инкубации, мин.
Активность выражают в количестве образующихся микромолей холестерол-олеата с учетом распределения в фазах под действием холестеролэстеразы в мин на 1 г белка. Результаты обрабатывают статистически.
Результаты ферментативного анализа иллюстрирует табл. 1.
Корреляционный анализ указывает на связь между уровнем активности ХЭ и показателями липидного обмена после введения хлоркрезацина (табл. 2).
Активацию системы лизосомального липолиза можно рассматривать как компенсаторную реакцию ферментных систем на фоне преобладания неспецифического, нерегулируемого эндоцитоза модифицированных липопротеинов низкой плотности (ЛПНП) или надмолекулярных ЛПНП- содержащих комплексов. При этом в условиях субстратного насыщения может возникнуть относительная недостаточность отдельных лизосомальных ферментов (в частности, ХЭ), гидролизующей эфиры холестерина (ЭХС), что приводит к аккумуляции ЭХС и триглицеридов в клетках крови и повышению риска развития атеросклероза (Packard R.R., Libby P. Inflammation in atherosclerosis: from vascular biology to biomarker discovery and risk prediction // Clin Chem. (2008). Vol. 54, №1. P. 24-38) [14]. Наряду с этим, изменения в состоянии лизосомального аппарата интимы можно расценивать и как адаптационные перестройки на стадии липоидоза, и как результат функциональной недостаточности на стадии образования фиброзной бляшки.
Таким образом, реакции холестеролэстеразы указывают на структурно-функциональные нарушения в деятельности субклеточных структур при развитии атеросклероза и соответственно полезными могут быть средства, активные в отношении таких реакций.
Установление новых свойств хлоркрезацина позволит использовать его, например, для повышения устойчивости сосудистой системы к холестерину при развитии атеросклеротического процесса. Также он может быть использован для образования вторичных посредников или предшественников в синтезе биологически активных веществ - эйкозаноидов. Ввиду важности выявленного механизма корреляции активности ферментной системы в зависимости от состояния организма, хлоркрезацина можно использовать не только для профилактики и/или лечения состояний, связанных с нарушением нормальной функции холестеролэстеразы, но и при диагностике структурно-функциональных нарушений в деятельности субклеточных структур при развитии атеросклероза, а также при скрининге, соединений, обладающей аналогичной активностью.
Литература
1. Васильев А.В., Варсанович Е.А., Погожева А.В., Самсонов М.А., Бобкова C.H.: Липолитические ферменты лизосом тромбоцитов и мононуклеаров в патогенезе ИБС // «Вопр. мед. химии» 1992, №5. С. 27-29.
2. А.А. Покровский, В.А. Тутельян. Лизосомы. - Наука, 1976, 380 с.
3. X. Брокерхоф, Р. Дженсен. Липолитические ферменты, пер. с англ., М., 1978, с. 242-356.
4. А.В. Ефремов [и др.] Роль лизосомальных ферментов в генезе ведущих клинико-патофизиологических синдромов: факты и гипотезы // Патологическая физиология и экспериментальная терапия, 2007. - N1. - С. 18-21.
5. О.В. Цыганкова, Л.А. Руяткина, З.Г. Бондарева Лизосомальные ферменты. Новый взгляд на фундаментальные материи с позиций кардиолога //Ж. Цитокины и воспаление. 2009, Т. 8, №4, с. 17-24.
6. Venu Τ Tadiboyina, Dora M Liu, Brooke A Miskie, Лап Wang,Robert A Hegele Treatment of dyslipidemia with lovastatin and ezetimibe in an adolescent with cholesterol ester storage disease77 Lipids Health Dis. 2005; 4: 26.
7. М.А.Самсонов, A.B. Васильев, A.B. Погожева, С.Н.Бобкова. Сравнительная оценка гиполипидемического действия ПНЖК w-3 и липостабила // Вопр. Питания, 1996, №4. с.12-16.
8. Ф. Хухо. Нейрохимия, основы и принципы, М., Мир, 1990 г., стр.32.
9. Расулов М.М., Зверева М.В., Нурбеков М.К., Адамович CH., Мирскова А.Н., Мирсков Р.Г., Воронков М.Г. Комплекс трис-(2-гидроксиэтил)амина с бис-(2-метилфенокси-ацетатом) цинка, повышающий цитокинную активность суммарной триптофанил-тРНК-синтетазы // патент RU №2457 837 C1 от 10.08.2012, Бюлл. №22.
10. Воронков М.Г., Адамович CH., Мирсков Р.Г., Мирскова А.Н. Синтез новых биологически активных О-гидрометаллоатранов / /ЖОХ, 2009, т. 79, №1, С. 162-163
11. Haley N.J., Powler S., De Duve С.Lysosomal and cholesteryl esterase activity in normal and lipid laden aortic cells // J. Lipid Research. - 1980. - N 8. - P. 961-969.
12. Меньшиков B.B. Лабораторные методы исследования в клинике. M.: Медицина. (1987), с. 106-174.
13. Friedwald W.T., Levy R.I., Fredrickson D.S Estimation of plasma low density lipoprotein cholesterol concentration with use of the preparative ultracentrifuge. // Clin Chem (1972); V. 18, P. 499-502.
14. Packard R.R., Libby P. Inflammation in atherosclerosis: from vascular biology to biomarker discovery and risk prediction // Clin Chem. (2008). Vol. 54, №1. P. 24-38.
Применение вещества протатран(4-хлор-2-метилфеноксиацетата) в качестве средства, снижающего активность холестеролэстеразы.