Композиция для подавления экспрессии гена цитокина интерлейкина-4
Иллюстрации
Показать всеИзобретение относится к медицине и касается композиции для подавления экспрессии гена цитокина интерлейкина-4 посредством механизма интерференции РНК, состоящей из катионного дендримерного пептида LTP с формулой (Arg)8(Lys)4(Lys)2Lys-Ala-Cys-NH2, выступающего в качестве носителя, и двух молекул siRNA с формулами 5-UUGAUGAUCUCCUGUAAGGtt-3 и 5-AAAGAUGUCUGUUACGGUCtt-3. Изобретение обеспечивает создание малотоксичной композиции, подавляющей экспрессию гена интерлейкина-4. 2 з.п. ф-лы, 18 ил., 14 табл., 4 пр.
Реферат
Изобретение относится к области медицины и генной терапии, и может быть использовано для лечения аллергической бронхиальной астмы и аллергического ринита путем регуляции генной экспрессии про-воспалительного цитокина интерлейкина-4 (IL-4).
Предпосылками изобретения явилось следующее. Бронхиальная астма (БА) - это хроническое воспалительное заболевание дыхательных путей, характеризующееся приступами удушья, экспираторной одышки, кашля, свистящих хрипов и эмфиземой легких (Global Inititative for Asthma). В основе этих симптомов лежат специфические (иммунные) и неспецифические механизмы, к которым относятся нарушения равновесия между отделами вегетативной нервной системы, повышенная способность клеток отвечать высвобождением медиаторов на неспецифические стимулы создавая при этом состояние гиперреактивности различных систем организма.
Многие пациенты с астмой имеют атопию, т.е. они генетически предрасположены к синтезу антител IgE после контакта с аллергенами, такими как аллерген клещей домашней пыли, пыльца растений и перхоть животных и др. Известно, что около 60-70% случаев заболевания БА связано с атопической предрасположенностью (Humbert М., Menz G., Ying S. et al. The immunopathology of extrinsic (atopic) and intrinsic (non-atopic) asthma: more similarities than differences. Immunol. Today, 1999; 20: 528-533). Повторяющиеся контакты с такими аллергенами могут индуцировать IgE-опосредованную реакцию гиперчувствительности, которая характеризуется проницаемостью кровеносных сосудов, расширением сосудов, сокращением гладкой мускулатуры, бронхоконстрикцией и воспалением дыхательных путей. При этом, дыхательные пути астматиков подвергаются структурным изменениям (ремоделированию), с изменением в эпителии, увеличением гладкой мускулатуры, отложением белков внеклеточного матрикса и гиперплазией дыхательных путей.
В настоящее время астма представляет глобальную проблему здравоохранения. По данным Всемирной организации здравоохранения (ВОЗ) на 2008 год, в мире около 300 миллионов человек, страдающих этим заболеванием, из которых примерно 5-6 млн. - в субрегионе ВОЗ Euro-C (к нему отнесена и Россия) (www.ginasthma.org). По оценкам ВОЗ, ежегодно астма обусловливает потерю 15 миллионов так называемых DALY (Disability Adjusted Life Year - дословно «год жизни, измененный или потерянный в связи с нетрудоспособностью»), что составляет 1% от общего всемирного ущерба от болезней.
По данным отчета GINA (Global Initiative for Asthma) (www.ginasthma.org), страны с наибольшей распространенностью бронхиальной астмы - это Великобритания (частота бронхиальной астмы в популяции - от 18,4% до 15,3% в зависимости от региона), Новая Зеландия - 15,1%, Австралия - 14,7%, Ирландия - 14,6%, Канада - 14,1%, Перу - 13%, Тринидад и Тобаго - 12,6%, Коста-Рика - 11,9%, Бразилия - 11,4%, США - 10,9%, Фиджи - 10,5%, Парагвай - 9,7%, Уругвай - 9,5%, Израиль - 9%, Барбадос - 8,9%, Панама - 8,8%, Кувейт - 8,5%, Украина - 8,3%, Эквадор - 8,2%, ЮАР - 8,1%, Чехия - 8%, Финляндия - 8%, Мальта - 8%, Республика Берег Слоновой Кости - 7,8%, Колумбия - 7,4%, Турция - 7,4%, Кения - 7%, Германия - 6,9%, Франция - 6,8%, Норвегия - 6,8%, Япония - 6,7%, Швеция - 6,5%, Таиланд - 6,5%, Филиппины - 6,2%, ОАЭ - 6,2%, Бельгия - 6%, Австрия - 5,8%, Испания - 5,7%, Саудовская Аравия - 5,6%, Аргентина - 5,5%, Иран - 5,5%, Эстония - 5,4%, Нигерия - 5,4%, Чили - 5,1%. Распространенность астмы в России - 5-7% (Revised Global Burden of Disease (GBD) 2008).
Смертность от БА значительно варьирует в разных странах, по-видимому, не коррелируя с распространенностью этой нозологии. Так, например, в США в 2002 г. от бронхиальной астмы умерло более 4000 чел. (14 чел. на 1 млн. населения) (National Surveillance for Asthma), а в субрегионе ВОЗ SEARO-D за тот же период смертность составила почти 77000 чел. (более 59 чел. на 1 млн). По данным специалистов, в мире от астмы умирают 250 тысяч человек в год (Revised Global Burden of Disease (GBD)).
Таким образом, БА оказывает выраженные отрицательные эффекты на общественное здоровье и экономику всего мира. В настоящее время ведутся многочисленные клинические и фундаментальные исследования, конечной целью которых является уменьшение бремени этого заболевания.
На сегодняшний день поддерживающая терапия астмы включает применение противовоспалительных лекарств, включая ингаляцию кортикостероидов, применение ингибиторов лейкотриенов (5-липоксигеназные ингибиторы и антагонисты лейкотриеновых рецепторов), и бронходилататоров. Эти препараты снижают проявления симптомов астмы и являются достаточными для лечения значительной доли пациентов, но они не воздействуют на первопричины патогенетических звеньев заболевания. Для лечения атопической БА успешно применяют аллерген-специфическую иммунотерапию (АСИТ), которая является единственным патогенетическим видом лечения атопических аллергических болезней, влияющим на саму природу заболевания. Однако АСИТ имеет ряд недостатков, основным из которых является опасность возникновения местных и системных реакций на проводимое лечение за счет сохранения B-клеточных эпитопов в препаратах нативного аллергена. B-клеточные эпитопы аллергена обусловливают IgE-опосредованное высвобождение медиаторов (гистамина, лейкотриенов и др.) из клеток-мишеней аллергии (в основном тучных клеток, базофилов крови) в основном на начальных этапах лечения, что приводит к серьезным осложнениям лечения (в ряде случаев с угрозой для жизни) примерно у 3,7% пациентов (156. Williams А.Р., Krishna М.Т., Frew A.J. The safety of immunotherapy // Clin Exp Allergy. - 2004. -34. - P. 513-514).
Распространенность аллергического ринита в популяции человека в 3-5 раз выше, чем аллергической бронхиальной астмы, однако выявляемость данного заболевания низкая по причине редких обращений пациентов с соответствующими симптомами к врачам-специалистам. Стоит отметить, что развитие аллергической бронхиальной астмы в подавляющем большинстве случаев начинается с развития аллергического ринита, поскольку данные патологии имеют сходный молекулярный механизм. Это подтверждается и тем фактом, что 75-90% пациентов с аллергической бронхиальной астмой, страдают также и от аллергического ринита.
Таким образом, разработка новых подходов к лечению и профилактике аллергической бронхиальной астмы и ринита остается актуальной задачей.
Один из базовых подходов к лечению аллергической бронхиальной астмы и ринита это анти-IL-4 терапия, где применяются различные ингибиторы как самого IL-4, так и компонентов его сигнального пути. Еще два десятилетия назад было предположено, что IL-4 играет ключевую роль в патогенезе астмы (Steinke J.W. and Borish L. Th2 cytokines and asthma. Interleukin-4: its role in the pathogenesis of asthma, and targeting it for asthma treatment with interleukin-4 receptor antagonists // Respir. Res. 2001. V. 2. P. 66-70). Было показано, что астматики имеют повышенный уровень белка IL-4 как в сыворотке крови, так и в бронхоальвеолярном лаваже (БАЛ) (Daher S., Santos L.М., Sole D., De Lima M.G., Naspitz С.K., Musatti C.C. Interleukin-4 and soluble CD23 serum levels in asthmatic atopic children // J. Investig. Allergol. Clin. Immunol. 1995. V. 5. P. 251-254), а также увеличенный уровень mRNA IL-4 и самого белка в бронхиальной биопсии пациентов (Humbert М., Durham S.R., Ying S., Kimmitt P., Barkans J., Assoufi В., Pfister R., Menz G., Robinson D.S., Kay A.B., Corrigan C. J. IL-4 and IL-5 mRNA and protein in bronchial biopsies from patients with atopic and nonatopic asthma: evidence against "intrinsic" asthma being a distinct immunopathologic entity // Am. J. Respir. Crit Care Med. 1996. V. 154. P. 1497-1504). Также важным доказательством участия IL-4 в патогенезе бронхиальной астмы являлся тот факто, что аэрозольное введение IL-4 индивидуумам с легкой астмой индуцировало у них гиперреактивность бронхов (ГРБ) и эозинофилию (Shi H.Z., Deng J.M., Xu Н., Nong Z.X., Xiao C.Q., Liu Z.M., Qin S.M., Jiang H.X., Liu G.N., Chen Y.Q. Effect of inhaled interleukin-4 on airway hyperreactivity in asthmatics // Am. J. Respir. Crit Care Med. V. 157. 1998. P. 1818-1821).
Для выяснения точной роли IL-4 в патогенезе астмы были использованы экспериментальные модели на животных, таких как мыши, крысы, морские свинки и приматы. Особый вклад в понимание биологической роли IL-4 внесли эксперименты с трансгенными мышами, у которых был полностью инактивирован ген il-4. Стандартное моделирование признаков бронхиальной астмы на таких IL-4-дефектных мышах показало, что происходит редукция аллергического воспаления, что выражалось в снижении количества эозинофилов в ткани легких и перибронхиального воспаления в сравнении с мышами, имеющих функциональный ген il-4. Кроме того, IL-4-дефектные мыши не продуцировали аллерген-специфические IgE антитела (Ат) и не развивали ГРБ (Brusselle G.G., Kips J.C., Tavernier J.H., van der Heyden J.G., Cuvelier C.A., Pauwels R.A., Bluethmann H. Attenuation of allergic airway inflammation in IL-4 deficient mice // Clin. Exp. Allergy. 1994. V. 24. P. 73-80).
Экспериментально установлено, что в патогенезе бронхиальной астмы IL-4 обеспечивает дифференциацию про-аллергические Th2-клеток из нативных Th0-клеток, индуцирует переключение синтеза B-клетками антител с IgM на про-аллергические IgE. В последствии синтезированные IgE антитела способствуют высвобождению тучными клетками и базофилами крови про-воспалительных медиаторов гистамина, лейкотриенов, простагландинов. В нескольких независимых исследованиях было установлено, что IL-4, вместе с IL-13, увеличивают экспрессию в эндотелии адгезионной молекулы VCAM-1, которая способствует миграции про-воспалительных клеток эозинофилов, T-лимфоцитов, моноцитов и базофилов, привлекаемых хемокинами тучных клеток, тем самым IL-4 вносит вклад в локальное воспаление в дыхательных путях (Schleimer R.P., Sterbinsky S.A., Kaiser J., Bickel C.A., Klunk D.A., Tomioka K., Newman W., Luscinskas F.W., Gimbrone M.A., Jr., McIntyre B.W.. IL-4 induces adherence of human eosinophils and basophils but not neutrophils to endothelium. Association with expression of VCAM-1 // J. Immunol. 1992. V. 148. P. 1086-1092).
Что касается источников IL-4 в организме, то этот цитокин продуцируется Th2 клетками, но может высвобождаться также и тучными, базофилами, эозинофилами и альвеолярными макрофагами (Gessner А., Mohrs K., Mohrs M. Mast cells, basophils, and eosinophils acquire constitutive IL-4 and IL-13 transcripts during lineage differentiation that are sufficient for rapid cytokine production // J. Immunol. 2005. V. 174. P. 1063-1072). IL-4 специфически связывается с IL-4Rα цепью, которая экспрессируется на T-лимфоцитах, B-лимфоцитах, эозинофилах, фагоцитах, эндотелиальных клетках, легочных фибробластах, эпителиальных клетках бронхов, и клетках гладкой мускулатуры (Kotsimbos Т.С., Ghaffar О., Minshall Е.М., Humbert М., Durham S.R., Pfister R., Menz G., Kay A.B., Hamid Q.A. Expression of the IL-4 receptor alpha-subunit is increased in bronchial biopsy specimens from atopic and nonatopic asthmatic subjects // J. Allergy Clin. Immunol. 1998. V. 102. P. 859-866).
IL-4Rα вовлечен в образование трех рецепторных комплексов: IL-4Rα/(γc)/IL-4 (Рецептор I типа), IL-4Rα/IL-13Rα1/IL-4 и IL-4Rα/IL-13Rα1/IL-13 комплекс (рецепторы II типа). Рецептор I типа связывается исключительно с IL-4, комплекс II типа связывается как с IL-4, так и с IL-13. Это объясняет перекрывание некоторых биологических функций IL-4 и IL-13. Рецептор I типа типично встречается у гематопоэтических клетках и вовлечен в развитие Th2-ответа, тогда как рецептор II типа обнаруживается как у гематопоэтических так и у негематопоэтических клеток. Передача сигнала IL-4, и IL-13, посредством рецептора II типа на негематопоэтических клетках дыхательных путей, таких как клетки гладкой мускулатуры и эпителиальные клетки, может напрямую индуцировать ГРБ и секрецию слизи (Kuperman D.A., Schleimer R.P. Interleukin-4, interleukin-13, signal transducer and activator of transcription factor 6, and allergic asthma // Curr. Mol. Med. 2008. V. 8. P. 384-392).
Связывание лиганда (IL-4 или IL-13) с I или II типом рецептора инициирует активацию протеинкиназ семейства Janus (Jak). В частности, IL-4Rα, ус и IL-13Rα1 активируют Jak1, Jak3 и Tyk2 соответственно. Это, в свою очередь, приводит к активации нескольких внутриклеточных сигналов посредством фосфорилирования специфических тирозиновых остатков в цитоплазматическом домене IL-4Rα, и к фосфорилированию фактора транскрипции - белка Stat6. Фосфорилированный Stat6 димеризуется и транслоцируется в ядро, где связывается со специфическими участками ДНК и индуцирует так называемые IL-4/IL-13-стимулируемые гены, вовлеченные в Th2 ответ, переключение синтеза с IgM на IgE, ГРБ и продукцию слизи. Более того субъединица IL-13Rα1 в комплексе II типа может также инициировать другие сигнальные пути, привлекая другие белки Stat (например, Stat3, Stat1). При этом происходит развитие Stat6-независимой, но IL-13-зависимой ГРБ, что было показано на мышиных моделях хронической бронхиальной астмы.
Таким образом, экспериментально доказана роль гена IL-4 в формировании бронхиальной астмы, что делает данный ген привлекательной мишенью при разработке новых лекарственный препаратов.
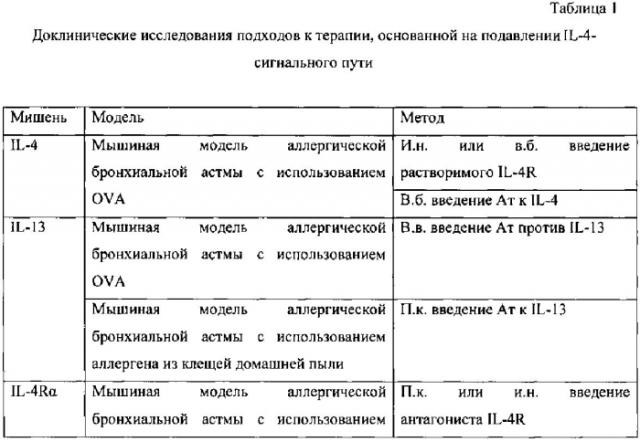
К настоящему времени создан ряд лекарственных средств и терапевтических подходов для подавления данного гена, которые апробированы в доклинических и клинических исследованиях. Так, например, растворимый белок-рецептор - sIL-4R является естественным белком - секретируемой формой рецептора IL-4R, который содержит внеклеточную часть цепи IL-4Rα, но утративший трансмембранный и цитоплазматический домены, благодаря этому sIL-4R способен связываться с IL-4, но при этом не активирует сигнальный путь, т.е. функционирует как «ловушка», связывающаяся с IL-4 и нейтрализующая его (табл. 1, табл. 2). В экспериментах на мышиной модели астмы, sIL-4R значительно ингибировал ГРБ и продукцию IgE при введении в период сенсибилизации. Более того, когда sIL-4R вводился во время стадии провокации он предотвращал позднюю фазу воспаления в легких, что выражалось в репрессии VCAM-1, инфильтрации эозинофилов в дыхательные пути и снижении гиперсекреции слизи, но при этом не происходило улучшения ГРБ, которая оставалась высокой). Это исследование показало, что блокирование IL-4 может иметь клинический эффект, даже после сенсибилизации организма к аллергену (Renz Н., Bradley K., Enssle K., Loader J.Е., Larsen G.L., Gelfand E.W. Prevention of the development of immediate hypersensitivity and airway hyperresponsiveness following in vivo treatment with soluble IL-4 receptor. Int. Arch. Allergy Immunol. 1996. V. 109. P. 167-176).
Терапевтический потенциал ингаляции рекомбинантного человеческого sIL-4R (Nuvance) был многообещающим на начальной фазе клинических испытаний (Borish L.C., Nelson Н.S., Corren J., Bensch G., Busse W.W., Whitmore J.В., Agosti J.M. Efficacy of soluble IL-4 receptor for the treatment of adults with asthma // J. Allergy Clin. Immunol // 2001. V. 107. P. 963-970). С пролонгированным периодом полу-жизни sIL-4R (примерно 5 дней), применялся для ингаляционной терапии курсом один раз в неделю. Фазы I/II испытаний с прерыванием приема кортикостероидов пациентами, показало, что одиночное ингаляционное введение sIL-4R было безопасным и эффективным при астме средней тяжести, не наблюдалось токсического эффекта, происходило значительное улучшение показателя объема форсированного выдоха в 1 секунду (forced expiratory volume in 1 second (FEV1)), пациентам требовалось принимать меньше β2-агонистов, и снижался уровень воспаления в легких, измеренный по количеству выдыхаемого оксида азота (NO).
Последующие исследования с многократным введением sIL-4R в течение 12 недель по оценке длительной безопасности и эффективности также показали многообещающие результаты при лечении астмы средней тяжести (Immunex Phase II Efficacy Study, 2005). Однако дальнейшие клинические испытания, на астматиках, которые принимали только β2-агонисты, не показали клинического эффекта на FEV1 или симптомы астмы. Отсутствие клинических эффектов наблюдалось и в другом исследовании, когда пациенты принимали sIL-4R при уменьшении приема кортикостероидов. В последующем было показано, что sIL-4Rα стабилизирует взаимодействие IL-13 со своим рецептором, тем самым активируя сигнальный путь IL-13. Это может быть объяснением почему клинические испытания sIL-4R потерпели неудачу (Andrews A.L., Holloway J.W, Holgate S.Т., Davies D.E. IL-4 receptor alpha is an important modulator of IL-4 and IL-13 receptor binding: implications for the development of therapeutic targets // J. Immunol. 2006. V. 176. P. 7456-7461).
Другой подход для блокирования IL-4 это использование гуманизированных моноклональных антител (мАт), например, препарат Pascolizumab, (табл. 1, табл. 2). Препарат Pascolizumab представляет собой мышиные мАт (3B9) со специфичностью к человеческому IL-4, которые были гуманизированы с целью снижения иммуногенности. На мышиных моделях астмы было показано снижение уровня IgE и ГРБ после введения анти-IL-4-мАт. (Zhou C.Y., Crocker I.С, Koenig G., Romero F.A., Townley R.G. Anti-interleukin-4 inhibits immunoglobulin E production in a murine model of atopic asthma // J. Asthma. 1997. V. 34. P. 195-201). Исследования in vitro показали, что Pascolizumab нейтрализовал активность IL-4 в клеточных линиях человека и ингибировал Th2-процесс, например, синтез IL-5, и продукцию IgE. Изучение фармакокинетики и хронической безопасности Pascolizumab in vivo на обезьянах показало хорошую переносимость без побочных эффектов (Hart Т.K., Blackburn М.N., Brigham-Burke М., Dede K., Al-Mahdi N., Zia-Amirhosseini P., Cook R.M. Preclinical efficacy and safety of pascolizumab (SB 240683): a humanized antiinterleukin-4 antibody with therapeutic potential in asthma // Clin. Exp. Immunol. 2002. V. 130. P. 93-100).
Фаза I клинических испытаний при однократном внутривенном введении пациентам с астмой средней тяжести также показала хорошую переносимость препарата, который имел период полу-жизни более чем 2 недели (Shames R.S., Vexler V., Lane N., McClellan M., Shi J., Keller S., The safety and pharmacokinetics of SB240683 (anti-IL-4 humanized monoclonal antibody) in patients with mild to moderate asthma. J. Allergy Clin. Immunol. 2001. V. 163.). Однако последующая II фаза клинических испытаний была прекращена, т.к. Pascolizumab не обеспечивал клинического эффекта даже при многократном введении астматикам, не принимающим кортикостероиды (PDL BioPharma, Inc. Pilot Study, 2008).
Альтернативой использованию моноклональных антител (мАт) служит стратегия применения антисмысловых олигонуклеотидов (АСО). АСО осуществляют деградацию молекул мРНК гена с комплементарной последовательностью. Поэтому в отличие от мАт, которые нейтрализуют IL-4 на белковом уровне, АСО осуществляют сайленсинг на уровне мРНК. Этот подход может быть интересной альтернативой, т.к. несколько копий белка может считываться с одной молекулы мРНК. На крысиной модели астмы с помощью рекомбинантного адено-ассоциированного вируса осуществлялось системное введение АСО, подавляющих IL-4. В результате наблюдали значительное снижение уровня IL-4 в БАЛ, аллергического воспаления и ремоделирования (Cao Y., Zeng D., Song Q., Сао С, Xie M., Liu X., Xiong S., Xu Y., Xiong W. The effects of antisense interleukin-4 gene transferred by recombinant adeno-associated virus vector on the airway remodeling in allergic rats // J. Asthma. 2010. V. 47. P. 951-958). К настоящему моменту данный подход еще не опробован в клинических испытаниях.
Перекрывающиеся биологические функции IL-13, объясняющееся способностью данного цитокина связываться с рецепторными цепями IL-4, свидетельствуют о перспективности стратегии по его блокированию с помощью мАт. Такие мАт против IL-13 использовались как при профилактическом, так при терапевтическом режиме введения на мышиной модели бронхиальной астмы. Анти-IL-13-мАт ингибировали аллергическое воспаление, гиперплазию бокаловидных клеток и ремоделирование у мышей. Однако, тогда как при профилактическом протоколе введения мАт снижалась ГРБ, при терапевтическом введении препарат не ингибировал этот важный клинический признак бронхиальной астмы (Tomlinson K.L., Davies G.С, Sutton D.J., Palframan R.Т. Neutralisation of interleukin-13 in mice prevents airway pathology caused by chronic exposure to house dust mite // PLoS. One. 2010. V. 5).
Некоторые успешные исследования на обезьянах и овцах позволили начать клинические испытания анти-IL-13 Ат субкласса IgG1 (IMA-638 и IMA-026) (Bree A., Schlerman F.J., Wadanoli М., Tchistiakova L., Marquette K., Tan X.Y., Jacobson B.A., Widom A., Cook T.A., Wood N., Vunnum S., Krykbaev R., Xu X., Donaldson D.D., Goldman S.J., Sypek J., Kasaian M.T. IL-13 blockade reduces lung inflammation after Ascaris suum challenge in cynomolgus monkeys // J. Allergy Clin. Immunol. 2007. V. 119. P. 1251-1257). IMA-638 и IMA-026, связываются с разными эпитопами IL-13 и ингибируют аллерген-индуцированный ответ. Антитело IMA-638 блокирует связывание IL-13 с цепью IL-4Rα, а IMA-026 с цепями IL-13Rα1 и IL-13Rα2. Они были тестированы на пациентах с мягкой астмой (табл. 2). Показано, что подкожное введение IMA-638 и IMA-026 на день 1 и 8 не влияло на ГРБ и эозинофилию в слюне, но IMA-638 кратковременно снижал раннюю и позднюю фазы аллергического ответа (Gauvreau G.М., Boulet L.Р., Cockcroft D.W., Fitzgerald J.М., Carlsten С., Davis В.Е., Deschesnes F., Duong M., Durn В.L., Howie K.J., Hui L., Kasaian M.Т., Killian K.J., Strinich Т.X., Watson R.M., Zhou Y N. S., Raible D., O′Byrne P.M. Effects of interleukin-13 blockade on allergen-induced airway responses in mild atopic asthma // Am. J. Respir. Crit Care Med. 2011. V. 183. P. 1007-1014). Однако, при более длительном введении мАт пациентам с неконтролируемой астмой, (12 недель) которые получали кортикостеройды, не было эффекта IMA-638 на симптомы БА в сравнении с плацебо (Study Evaluating the Effect of IMA-638, 2009).
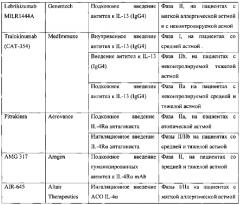
Другой препарат - Lebrikizumab - представляет собой гуманизированные мАт субкласса IgG4, также направленные против IL-13. Lebrikizumab тестировался на пациентах как с мягкой астмой, так и с неконтролируемой астмой посредством подкожного введения в течение нескольких месяцев (вплоть до 6 месяцев) (Genentech, A Study to Evaluate MILR1444A, 2010; Genentech, A Study of Lebrikizumab, 2011; Genentech, A Study to Evaluate Lebrikizumab (MILR1444A) in Adult Patient, 2011). Согласно рабочей гипотезе анти-IL-13 терапия могла бы быть полезной для пациентов с повышенной активностью IL-13. Подгруппа пациентов у которых был доказан Th2 статус (повышенный уровень IgE и эозинофилов в крови, увеличенный уровень периостина - белка, секретируемого в ответ на IL-13) (Corren et al., 2011; Genentech, A Study of Lebrikizumab (MILR1444A) in Adult Patients 2011) хорошо отвечала на препарат. У таких пациентов Lebrikizumab значительно улучшал форсированный объем выдоха (FEV1) на 5.5% к 12-ой неделе. В связи с этим измерение уровня периостина у астматиков могло бы использоваться как биомаркер для поиска пациентов, отвечающих на Lebrikizumab. Несмотря на успех препарата на ограниченной группе пациентов Lebrikizumab не приводил к значительному улучшению большинства симптомов БА (Corren J., Lemanske R.F., Hanania N.A., Korenblat P.E., Parsey M.V., Arron J.R., Harris J.M., Scheerens H., Wu L.C, Su Z., Mosesova S., Eisner M.D., Bohen S.P., Matthews J.G. Lebrikizumab treatment in adults with asthma // N. Engl. J. Med. 2011. V. 365. P. 1088-1098).
Еще один препарат, основанный на гуманизированных мАт субкласса IgG4 - Tralikinumab (САТ-354) - показал эффективность в доклинических моделях, а в клинических испытаниях был безопасен и хорошо переносим как для здоровых индивидуумов, так и для астматиков. Препарат Tralikinumab в настоящий момент находиться на II фазе клинических испытаний (Medimmune, A Phase 2b, Randomized, Double-blind Study 2012; Medimmune, Study to Evaluate the Safety and Efficacy 2011).
Одна из причин неудач анти-IL-4 терапии - это взаимозаменяемость IL-4 и интерлейкина-13 (IL-13), когда при подавлении только IL-4 его функцию может выполнять IL-13. Потому некоторые исследования были сфокусированы на блокировании цепи IL-4Rα, которая входит в состав рецепторов как для IL-4, так и IL-13 и инициирует Stat6-опосредованный сигнальный путь. Для инактивации IL-4Rα разработано несколько подходов: использование IL-4-мутеина (Pitrakinra), использование мАт против IL-4Rα (AMG317) и не так давно стали применять АСО (AIR-645).
Pitrakinra - это рекомбинантная форма человеческого IL-4 с двумя функциональными мутациями в позиции 121 (замена аргинина на аспарагиновую кислоту) и 124 (замена тирозина на аспарагиновую кислоту). Была продемонстрирована высокая афинность связывания Pitrakinra с IL-4Rα цепью, в результате чего препарат действует как конкурентный антагонист и блокирует связывание обоих цитокинов (IL-4 IL-13) с IL-4Rα. Эффективность такого подхода изначально оценена на мышиной модели астмы, где показано ингибирование продукции Th2 цитокинов, эозинофильного воспаления, гиперплазии бокаловидных клеток, ГРБ и специфического IgE. У обезьян, двойной антагонизм IL-4/IL-13 посредством Pitrakinra снижал ГРБ и имел тенденцию к снижению эозинофильного воспаления (Tomlinson K.L., Davies G.С., Sutton D.J., Palframan R.Т. Neutralisation of interleukin-13 in mice prevents airway pathology caused by chronic exposure to house dust mite // PLoS. One. 2010. V. 5).
Многообещающие результаты в доклинических испытаниях были основаниями для проведения клинических исследований Pitrakinra. Два независимых клинических исследования фазы IIa изучили эффект препарата (при подкожном и аэрозольном введении) на позднюю фазу аллергического ответа у атопических астматиков. Независимо от пути введения, препарат Pitrakinra улучшал FEV1, в то же время ингаляционное введение имело большую эффективность в сравнении с подкожным (Wenzel S., Wilbraham D., Fuller R., Getz E.В., Longphre M. Effect of an interleukin-4 variant on late phase asthmatic response to allergen challenge in asthmatic patients: results of two phase 2a studies // Lancet. 2007. V. 370. P. 1422-1431). На текущий момент описана фармакодинамика, фармакокинетика, клиническая эффективность и безопасность препарата (Antoniu S.A., Cojocaru I. Pitrakinra for asthma // Expert. Opin. Biol. Ther. 2010. V. 10. P. 1609-1615). В фазе IIb клинических исследований на астматиках со средней и тяжелой формой астмы изучалась способность Pitrakinra снижать осложнения при постепенном уменьшении приема β-агонистов и кортикостеройдов. Как оказалось, Pitrakinra не имел значительного эффекта в общей популяции астматиков со средней и тяжелой формой, но у подгруппы пациентов с эозинофильной астмой снижались осложнения на 37% (Aerovance Inc. Press release. Phase 2b Clinical Trial, 2010; Aerovance, Inc. A Study of the Treatment-Sparing Effects, 2011). Подобные результаты были получены и при испытании препарата Mepolizumab (мАт против IL-5), который был неэффективен в смешанной (гетерогенной) популяции астматиков, но показал свою эффективность в подгруппе пациентов с тяжелой эозинофильной астмой.
AMG317 - это гуманизированные мАт против IL-4Rα человека, предотвращают связывание как IL-4 так и IL-13 с IL-4Rα (фиг. 1). Доклинические исследования на мышах показали, что AMG317 снижает воспаление дыхательных путей, ГРБ и гиперплазию бокаловидных клеток. В фазах I и II клинических испытаний изучена фармакокинетика и фармакодинамика AMG317 при однократном и многократном введениях посредством внутривенного и подкожного путей. Длительное подкожное введение AMG317 в течение нескольких месяцев показало хорошую переносимость препарата. Фаза II исследований на пациентах со средней и тяжелой астмой выявила отсутствие клинической эффективности во всех группах пациентов (Amgen Inc. Phase II Study, 2009).
Снижение экспрессии IL-4Rα посредством антисмысловых олигонуклеотидов (АСО) приводило к подавлению признаков БА на мышиных моделях. В фазе I клинических исследований была показана хорошая переносимость препарата здоровыми индивидуумами и пациентами с мягкой астмой, что дает возможность его использования для ежедневной терапии (Altair Therapeutics, Inc. A Phase 1 Study 2011; Seguin and Ferrari 2009). Однако в фазе II клинических испытаний препарат не проявил достаточного клинического эффекта, в частности на показатель FEV1, чтобы оправдать дальнейшее развитие (Altair Therapeutics, Inc. Study Evaluating the Effects of AIR645, 2010).
Другим подходом блокирования биологической активности обоих цитокинов IL-4 и IL-13, является подавление фактора Stat6, который необходим для транскрипции генов, отвечающих на IL-4 и IL-13. В доклинических исследованиях использовались несколько разных подходов для подавления Stat6, а именно: использование ингибирующего пептида (AS1517499), и молекул малых интерферирующих РНК (миРНК). Применение обоих подходов в доклинических исследованиях было успешным, т.к. на мышиных моделях продемонстрировано снижение аллергического воспаления дыхательных путей, снижение гиперплазии бокаловидных клеток, продукции слизи и ГРБ (Tian X.R., Tian X.L., Во J.P., Li S.G., Liu Z.L., Niu B. Inhibition of allergic airway inflammation by antisense-induced blockade of STAT6 expression // Chin Med. J. (Engl.) 2011. V. 124. P. 26-31) (табл. 1). Хотя данные исследования подтверждают перспективность мишени Stat6 для лечения астмы, к настоящему моменту нет клинических данных.
Несмотря на существование разных способов антиастматической терапии, все еще существует большое количество пациентов с низким качеством жизни по причине неконтролируемой астмы. Поэтому разработка новых дополнительных способов лечения заболевания остается актуальной. За последние 15 лет получены новые данные о молекулярных механизмах БА, усовершенствована технология получения мАт и открыто явление РНК интерференции. Все это привело к созданию концепции анти-IL-4 терапии для лечения БА. Хотя блокирование IL-4 в доклинических исследованиях показало многообещающие результаты, однако не были оправданы ожидания от клинических испытаний. Этим неудачам есть несколько объяснений. Во-первых, информация о роли IL-4 в астме и в Th2-дифференциации постоянно дополняется. Изначально сигнальный путь IL-4/IL-4Rα/Stat6 считался ключевым в развитии CD4+ T-клеток, a IL-4 единственным инициатором Th2-дифференциации. Сейчас установлено, что Th2-дифференциация представляет собой более сложный процесс, а сигнальный путь IL-4/IL-4Rα/Stat6 может быть необязательным, т.к. открыты иные пути Th2-дифференциации (например, пути опосредуемые IL-25, IL-33). Поэтому стратегия подавление исключительно IL-4 оказалась не оправданной. Во-вторых, блокирование IL-4 для предотвращения Th2-дифференциации может быть успешным в краткосрочных мышиных моделях при терапевтическом введении анти-IL4 препаратов, но в клинической практике пациенты с астмой уже имеют сформированный Th2-ответ, поэтому не удается экстраполировать результаты доклинических исследований на человека.
Обе причины неудачных клинических испытаний в той или иной степени преодолимы. Во-первых, в настоящее время астма у человека больше не рассматривается как исключительно аллергическое Th2-опосредованное, эозинофильное заболевание, но подразделяется на отдельные клинические и молекулярные фенотипы. Такое фенотипическое деление астмы позволит оптимально подбирать группу пациентов, для которых анти-IL-4 терапия будет эффективной. Во-вторых, для корректного проведения доклинических испытаний необходимы более адекватные модели на животных. Учитывая многообразие фенотипов астмы, сложилась необходимость в создании разнообразных мышиных моделей, например, не только с эозинофильным, но и с нейтрофильным воспалением, а также необходимость использования причинно-значимых аллергенов при моделировании. Более того исследуемые препараты в доклинических испытаниях необходимо вводить не в профилактическом, а в терапевтическом режиме, т.е. после того как у животных разовьются признаки БА. Для этих целей разрабатываются хронические модели астмы.
Таким образом, будущее развитие анти-IL-4 терапии будет связано с использованием адекватных моделей для доклинических исследованиях, а также с тщательным отбором респондентов из гетерогенной популяции астматиков для клинических исследований.
Недавнее открытие явления интерференции РНК (РНКи) - одного из основных механизмов посттранскрипционной регуляции генов, дало возможность использовать данный феномен для создания новых лекарственных средств, способных эффективно и безопасно подавлять экспрессию генов-мишеней. РНКи позволяет специфически «выключать» экспрессию генов-мишеней с помощью молекул siRNA (small interfering RNA - малых интерферирующих РНК). Для эффективной доставки siRNA в клетки-мишени применяют специальные молекулы-носители, формирующие комплексы с siRNA. Комплексование приводит к компактизации молекул РНК, их защите от деградации клеточными РНКазами, что в сочетании с позитивным суммарным зарядом, позволяет им эффективно проникать внутрь клетки и достигать нужной мишени.
Главными преимуществами использования препаратов на основе РНКи являются высокая специфичность подавления экспрессии генов, вовлеченных в патогенез, а также высокая эффективность их подавления (до 90%), т.к. вводимые siRNA способны действовать в крайне низких концентрациях. Кроме того, привлекательной является сравнительная дешевизна методики. Синтез олигонуклеотидов в настоящее время вполне доступен и прост в масштабировании. Этот факт дает препаратам, созданным на базе, siRNA, важное конкурентное преимущество, например, по сравнению с моноклональными антителами.
Известны изобретения для лечения аллергических заболеваний, включая аллергическую бронхиальную астму и ринит путем блокирования экспрессии гена про-воспалительного цитокина IL-4.
Известно применение моноклональных и биспецифических антител, которые специфически связываются с IL-4 и/или IL-13 (патент ЕР 2574630). Однако эффективность такого применения не высока, поскольку моноклональные антитела действуют на белковом (т.е. посттрансляционном уровне), в то же время препараты на основе интерференции РНК, к таковым относится и заявляемое изобретение, действуют на уровне мРНК (т.е. на посттранскрипционном уровне), что позволяет более эффективно блокировать ген-мишень за счет того, что с одной копии мРНК может синтезироваться более 1000 копий белка.
Помимо ингибирования путем непосредственного связывания цитокина, можно снижать его активность посредством блокирования соответствующего рецептора. Известно, что сигнальный путь IL-4 опосредован гетеродимерным комплексом двух белков рецептора: IL-4Rα и γ-цепи IL-2-рецептора. Создание моноклонального антитела (imAb) Х2/45, направленного против внеклеточного домена IL-4Rα позволило предположить его для ингибирования IL-4-опосредованных реакций, в том числе и для создания нового способа терапии бронхиальной астмы. Этот подход реализован в одном из изобретений (патент WO 2009121847), который относится к области применения антител или антигенсвязывающих фрагментов, специфичных для человеческого рецептора к IL-4. В данном изобретении также используются моноклональные антитела со всеми присущими им недостатками и ограничениями, описанными выше.
Известно, что связывание IgE с FcεRI-рецепторами эффекторных клеток (тучные клетки, базофилы) индуцирует высвобождение медиаторов воспаления (гистамин, лейкотриены) и вызывает острые симптомы аллергического воспаления. Таким образом, взаимодействие IgE-FcεRI является одним из ключевых в патогенезе бронхиальной астмы. Этот факт был использован при создании изобретения для терапии аллергических воспалений в том числе бронхиальной астмы. Изобретение заключается в использовании Fab фрагмента антитела, который ингибирует IgE-FcεRI взаимодействия (патент WO 2002079257).
Открытие РНК интерференции дало новые возможности для регуляции экспрессии патогенетически-значимых генов, в том числе и генов, вовлеченных в инициацию и развитие БА. РНКи активируется молекулами siRNA, которые имеют нуклеотидную последовательность комплементарную гену-мишени. Несмотря на сравнительно недавнее открытие РНКи уже имеются изобретения по применению данного подхода к терапии бронхиальной астмы. Известно, что CD23 участвует в активации T-лимфоцитов, которые в свою очередь вовлечены в патогенез бронхиальной астмы. Этот факт был использован при создании изобретения (патент US 8461125) для лечения бронхиальной астмы, заключающееся в использовании молекул siRNA для блокирования гена CD23.
Еще одно изобретение заключается в использовании молекул siRNA для снижения синтеза антител класса IgE, как основных про-аллергических медиаторов (патент US 20110112169).
Однако эти изобретения (US 8461125, US 20110112169) направленны на подавление синтеза антител IgE, или препятствие связывания IgE антител с клетками мишенами, в то время как заявляемое изобретение направлено на подавление IL-4, с активации которого запускаются данные процесс, а такде патогенез бронхиальной астмы. В связи с этим ожидается, что заявляемое изобретение будет более эффективно подавлять признаки бронхиальной астмы.
Таким образом, прямых аналогов заявляемого изобретения, представляющего собой композицию, состоящую из катионного дендримерного пептида - LTP и двух молекул siRNA против гена IL-4 для подавления аллергического воспаления путем блокировки экспрессии гена про-воспалительного цитокина IL-4 не выявлено.
Задачей предлагаемого изобретения является создание малотоксичного средства для лечения бронхиальной астмы.
Техническим результатом предлагаемого изобретения является создание малотоксичной композиции, подавляющая экспрессию про-воспалительного гена IL-4.
Указанная задача решается, а технический результат достигается, за счет того, что композиция для подавления экспрессия гена цитокина интерлейкина-4 (IL-4) посредством механизма интерференции РНК состоит из катионного дендримерного пептида LTP с формулой (Arg)8(Lys)4(Lys)2Lys-Ala-Cys-NH2, выступающего в качестве носителя, и двух молекул siRNA с формулами 5-UUGAUGAUCUCCUGUAAGGtt-3 (SEQ ID NO 57) и 5-AAAGAUGUCUGUUACGGUCtt-3 (SEQ ID NO 59).
При отношении количества положительных зарядов пептида к количеству отрицательных зарядов нуклеиновых кислот от 24 до 96 композиция для подавления экспрессия гена цитокина интерлейкина-4 (IL-4) способна эффективно трансфецировать различные типы клеток.
При LD50 равным 325 мг/кг композиция для подавления экспрессия гена цитокина интерлейкина-4 (IL-4) является малотоксичной.
Изобретение поясняется рисунками, где на фиг. 1 представлена диаграмма эффективности трансфекции клеток HEK293T с использованием LTP, при этом условные обозначения приняты следующие: R - соотношение количества положительных зарядов LTP к количеству отрицательных зарядов плазмиды pGL3; pLuc - плазмида pGL3, кодирующая ген люциферазы luc; LU - световые единицы (light units); # - достоверно отличает от Lf2000 (Lipofectamine2000 (Invitrogen, США), использованный в качестве положительного контроля); × - достоверно отличается от pLuc (плазмида pGL3 без каких-либо трансфекционных реагентов); на фиг. 2 представлена диаграмма изменения концентрации IL-4 в супернатантах клеток HEK293T при котрансфекции молекул siRNA и рекомбинантной плазмиды pUCHR IL4 IRES GFP, где приняты следующие условные обозначения: × - достоверно отличается от siP4; на фиг. 3 представлена эффективность трасфекции клеток HelaHI с использованием LTP; на фиг. 4 представлена эффективность трасфекции клеток A549 с использованием LTP; на фиг. 5 изображены защитные группировки 2′-гидроксильной группы мономера РНК; на фиг. 6 изображены мономеры с защитными группировками ТОМ фирмы Glen Research Corporation; на фиг. 7 изображены