Синергические комбинации каротиноидов и полифенолов
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к терапевтической противовоспалительной композиции, которая содержит один или несколько полифенолов и два или более каротиноидов, которые выбирают из группы, состоящей из лютеина, ликопена и β-каротина, где полифенолы выбирают из группы, состоящей из карнозной кислоты, кверцетина, резвератрола и галловой кислоты, в определенном количестве; к способу ингибирования или снижения образования супероксид-ионов, NO, TNF-α и/или PGE2 у субъекта-млекопитающего, которому вводят указанную выше композицию; к способу лечения патологических состояний, в которых супероксид-ионы, NO, TNF-α и/или PGE2 выполняют функцию модулятора или медиатора указанного состояния у субъекта-млекопитающего, которому вводят указанную выше композицию; к применению комбинации одного или нескольких полифенолов и двух или более каротиноидов, которые выбирают из группы, состоящей из лютеина, ликопена и β-каротина, где полифенолы выбирают из группы, состоящей из карнозной кислоты, кверцетина, резвератрола и галловой кислоты, в определенном количестве. Вышеописанные изобретения характеризуются синергетическим взаимодействием полифенольных соединений с каротиноидами при ингибировании путей воспаления. 4 н. и 24 з.п. ф-лы, 11 ил., 4 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции, содержащей синергические комбинации полифенолов и каротиноидов. Более конкретно, настоящее изобретение относится к композиции, содержащей синергическую комбинацию указанных выше соединений, которые можно использовать inter alia для ингибирования образования различных медиаторов воспаления.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Воспалительный процесс, который образует важную часть неспецифической иммунной системы, характеризуется сложным набором химических и клеточных изменений, которые необходимы для защиты организма-хозяина перед лицом микробных агентов и других потенциально опасных факторов окружающей среды. Однако во многих случаях может происходить нецелесообразный запуск воспаления, и/или оно может сохраняться в той степени, которая становится опасной для организма-хозяина. В таких случаях может существовать необходимость ингибировать или предотвращать развитие одного или нескольких аспектов воспалительного процесса, в частности в оазисах неинфекционных воспалительных заболеваний.
Показано, что в развитие и контроль воспалительного процесса вовлечено очень большое число различных химических медиаторов. Недавние исследования во многих различных лабораториях связывают оксид азота (NO) в качестве важного модулятора различных острых и хронических воспалительных нарушений, включая различные типы артрита, желудочно-кишечных заболеваний, воспалительных состояний центральной нервной системы и определенные формы астмы. Таким образом, предполагают, что ингибирование образования NO может предоставить эффективный терапевтический механизм для лечения и/или контроля этих воспалительных нарушений. Кроме того, также показано, что ингибирование синтеза NO можно использовать при некоторых заболеваниях или состояниях, которые не обладают первичной воспалительной природой. Таким образом, например, обнаружено, что ингибирование синтеза NO снижает захват глюкозы в тканях конечностей у индивидуумов с диабетом 2-го типа во время физических нагрузок.
Образование NO in vivo опосредовано ферментами семейства синтазы оксида азота (NOS), включая индуцибельную синтазу оксида азота (iNOS), которую активируют многие различные иммунологические стимулы, включая липополисахарид (ЛПС), γ-интерферон и интерлейкин 1 (IL-1).
Ингибирование NOS можно осуществить как in vitro, так и in vivo путем использования L-NG-монометиларгининцитрата (L-NMMA). Кроме того, также показано, что некоторые другие соединения, включая множество натуральных продуктов, ингибируют образование NO. Последняя группа включает соединения, такие как лютеин [Rafi M. M. et al. Mol Nutr Food Res. 2007 Mar; 51 (3): 333-40; Choi, J. S. Nutrition. 2006 Jun; 22 (6):668-71] и ликопен [Rafi, M. M. et al. J Food Sci. 2007 Jan; 72 (1):S069-74]. Однако доказано, что эффективность и активность многих ингибиторов NO из натуральных продуктов не особенно высока. Следовательно существует необходимость в усовершенствованных ингибирующих образование NO композициях природного происхождения.
Другим крайне важным медиатором воспаления является фактор некроза опухоли α (TNF-α), который представляет собой цитокин, образуемый множеством типов клеток, включая макрофаги, нейтрофилы и лимфоциты. TNF-α занимает ключевое положение на ранней стадии воспалительного процесса и отвечает за стимуляцию образования других факторов, таких как ядерный фактор κB, который в свою очередь вызывает активацию широкого диапазона провоспалительных генов. Таким образом, принимая во внимание его ключевую роль, TNF-α, несомненно, является важной возможной терапевтической мишенью для противовоспалительных средств.
Третьим ключевым медиатором воспаления является простагландин E2 (PGE2), член семейства регулирующих молекул эйкозаноидов. Таким образом, PGE2 образуется в значительных количествах в местах воспаления, где он выполняет функцию вазодилататора, а также (вместе с другими медиаторами, такими как гистамин и брадикинин) вызывает повышение проницаемости сосудов, тем самым внося вклад в большинство классических признаков воспаления.
Наконец, другим провоспалительным медиатором, который высвобождают воспалительные клетки, такие как макрофаги и нейтрофилы, является супероксид-ион. Несмотря на то, что супероксид-ионы очень эффективно убивают микробных возбудителей, в других (в частности, неинфекционных) воспалительных состояниях, эти ионы могут вызывать обширное повреждение тканей организма-хозяина. Следовательно, образование супероксид-ионов является потенциально эффективной терапевтической мишенью при рассмотрении новых средств контроля воспалительных состояний.
Цель настоящего изобретения состоит в том, чтобы предоставить композицию, которую можно использовать для ингибирования образования одного или нескольких ключевых медиаторов воспаления, таких как супероксид-ионы, NO, TNF-α и/или PGE2, в качестве средства лечения или контроля патологических состояний и процессов, в которые вовлечены указанные медиаторы.
Другая цель изобретения состоит в том, чтобы предоставить композицию, которая может ингибировать образование указанных выше медиаторов воспаления с более высокой эффективностью и/или активностью, чем соединения и композиция, о которых сообщалось в предшествующем уровне техники.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Недавно авторы настоящего изобретения неожиданно обнаружили, что полифенольные соединения могут синергически взаимодействовать с каротиноидами при ингибировании некоторых провоспалительных путей. В частности, недавно обнаружено, что полифенольное соединение карнозная кислота вызывает синергическое усиление ингибирующего действия определенных каротиноидов, таких как ликопен, лютеин и β-каротин, на образование медиаторов воспаления NO, TNF-α и PGE2. Кроме того, несмотря на то, что это синергическое действие наблюдали в двойных комбинациях карнозной кислоты вместе с ликопеном, β-каротином или лютеином, синергизм значительно усиливается, когда карнозную кислоту комбинируют двумя указанными выше каротиноидами. Указанное выше синергическое противовоспалительное действие также наблюдают, когда каротиноиды представлены в сочетании с другими полифенолами, такими как кверцетин, резвератрол и галловая кислота.
Следовательно настоящее изобретение главным образом направлено на терапевтическую композицию, которая содержит один или несколько полифенолов и два или более каротиноидов, которые выбирают из группы, состоящей из лютеина, ликопена и β-каротина.
В одном из предпочтительных вариантов осуществления полифенолы, использованные в композициях по настоящему изобретению, выбирают из группы, состоящей из карнозной кислоты, кверцетина, резвератрола, галловой кислоты, цикориевой кислоты, гингерола и куркумина.
В одном особенно предпочтительном варианте осуществления композиции по настоящему изобретению содержат полифенольное соединение карнозную кислоту.
В другом особенно предпочтительном варианте осуществления композиции по настоящему изобретению содержат полифенольное соединение кверцетин.
В другом особенно предпочтительном варианте осуществления композиции по настоящему изобретению содержат полифенольное соединение резвератрол.
В другом особенно предпочтительном варианте осуществления композиции по настоящему изобретению содержат полифенольное соединение галловую кислоту.
В одном из вариантов осуществления указанная выше терапевтическая композиция содержит карнозную кислоту, ликопен и лютеин.
В другом предпочтительном варианте осуществления композиция содержит карнозную кислоту, лютеин и β-каротин.
В еще одном дополнительном предпочтительном варианте осуществления композиция содержит ликопен, β-каротин и карнозную кислоту.
В другом варианте осуществления композиция по существу состоит из ликопена, лютеина и карнозной кислоты.
В дополнительном предпочтительном варианте осуществления композиция по существу состоит из лютеина, β-каротина и карнозной кислоты.
В еще одном дополнительном предпочтительном варианте осуществления композиция по существу состоит из ликопена, β-каротина и карнозной кислоты.
Следует отметить, что термин «по существу состоит из», как используют на всем протяжении этого описания и приложенной формулы изобретения, относится к ситуации, где композиция по настоящему изобретению может содержать, в дополнение к названным компонентам (т.е. карнозная кислота вместе с ликопеном и/или лютеином), другие соединения, вещества и средства, которые существенно не влияют на основные и новые характеристики настоящего изобретения.
В других предпочтительных вариантах осуществления композиции по описанным выше предпочтительным вариантам осуществления могут дополнительно содержать один или несколько дополнительных каротиноидов. В одном особенно предпочтительном варианте осуществления дополнительные каротиноиды выбирают из группы, состоящей из фитоена и фитофлуена.
Активные компоненты описанных выше композиций (т.е. полифенол(ы) и каротиноиды) могут представлять собой очищенные соединения, синтетические соединения или могут быть представлены в смеси с другими компонентами, например, в растительных экстрактах, таких как экстракт розмарина (в случае карнозной кислоты), экстракт календулы (в случае лютеина) или экстракт томата (такой как Lycomato, который коммерчески доступен в компании LycoRed, Be'er Sheva, Israel - в случае ликопена и других каротиноидов).
Следует понимать, что термин «лютеин», как используют в настоящем описании, включает все сложные эфиры лютеина в пределах его объема. Кроме того, в объем термина «лютеин» может входить смесь лютеина и зеаксантина, поскольку указанный последним каротиноид часто присутствует вместе с лютеином (иногда составляет 0,1%-15% и более часто 4%-6% от содержания лютеина).
В другом аспекте настоящее изобретение относится к способу ингибирования или снижения образования супероксид-ионов, NO, TNF-α и/или PGE2 у субъекта-млекопитающего, который содержит введение указанному субъекту терапевтической композиции по любому варианту осуществления, описанному выше в настоящем документе.
Кроме того, настоящее изобретение также относится к способу лечения патологических состояний, в которых супероксид-ионы, NO, TNF-α и/или PGE2 выполняют функцию модулятора или медиатора указанного состояния у субъекта-млекопитающего, нуждающегося в таком лечении, где указанный способ включает в себя введение указанному субъекту терапевтической композиции согласно любому варианту осуществления, описанному выше в настоящем документе. В одном из предпочтительных вариантов осуществления этого способа состояние, подлежащее лечению, выбирают из группы, состоящей из острых воспалительных состояний, хронических воспалительных состояний, ревматоидного артрита, синдрома расстройства дыхания взрослых (СРДВ), астмы, ринита, идиопатического фиброза легких, перитонита, сердечно-сосудистого воспаления, ишемии миокарда, нарушения реперфузии, атеросклероза, сепсиса, травмы, диабета 2-го типа, ретинопатии, псориаза, желудочно-кишечного воспаления, цирроза, перитонита и воспалительного заболевания кишечника и нейродегенеративных заболеваний, таких как, например, болезнь Альцгеймера (БА).
В особенно предпочтительных вариантах осуществления способов, описанных выше в настоящем документе, субъектом-млекопитающим является человеческий субъект.
Несмотря на то, что в описанных выше способах терапевтическую композицию можно вводить любым удобным средством, в одном из предпочтительных вариантов осуществления указанную композицию вводят в фармацевтической лекарственной форме. Однако в другом предпочтительном варианте осуществления терапевтическую композицию включают в продукт питания или напиток.
В другом аспекте настоящее изобретение относится к использованию комбинации одного или нескольких полифенолов и двух или более каротиноидов, которые выбирают из группы, состоящей из ликопена, β-каротина и лютеина, в производстве лекарственного средства для лечения состояний, чувствительных к ингибированию образования NO, TNF-α и/или PGE2.
В одном из предпочтительных вариантов осуществления этого аспекта по изобретению один или несколько полифенолов выбирают из группы, состоящей из карнозной кислоты, кверцетина, резвератрола, галловой кислоты, цикориевой кислоты, гингерола и куркумина.
В одном особенно предпочтительном варианте осуществления этого аспекта по изобретению полифенолом является карнозная кислота.
В другом особенно предпочтительном варианте осуществления этого аспекта по изобретению полифенолом является кверцетин.
В еще одном другом особенно предпочтительном варианте осуществления этого аспекта по изобретению полифенолом является резвератрол.
В еще одном другом особенно предпочтительном варианте осуществления этого аспекта по изобретению полифенолом является галловая кислота.
В одном из предпочтительных вариантов осуществления состоянием, подлежащим лечению, является воспалительное состояние.
В одном из предпочтительных вариантов осуществления описанного выше использования состояние, подлежащее лечению, выбирают из группы, состоящей из острых воспалительных состояний, хронических воспалительных состояний, ревматоидного артрита, синдрома расстройства дыхания взрослых (СРДВ), астмы, ринита, идиопатического фиброза легких, перитонита, сердечно-сосудистого воспаления, ишемии миокарда, нарушения реперфузии, атеросклероза, сепсиса, травмы, диабета 2-го типа, ретинопатии, псориаза, желудочно-кишечного воспаления, цирроза, перитонита и воспалительного заболевания кишечника и нейродегенеративных заболеваний, таких как, например, болезнь Альцгеймера (БА).
В одном особенно предпочтительном варианте осуществления этого аспекта по изобретению, карнозную кислоту используют в сочетании как с ликопеном, так и с лютеином.
В другом особенно предпочтительном варианте осуществления этого аспекта по изобретению, карнозную кислоту используют в сочетании как с ликопеном, так и с β-каротином.
В еще одном дополнительном предпочтительном варианте осуществления этого аспекта по изобретению карнозную кислоту используют в сочетании как с лютеином, так и с β-каротином.
Все указанные выше и другие характеристики и преимущества настоящего изобретения можно глубже понять на основе следующих иллюстративных неограничивающих примеров его предпочтительных вариантов осуществления.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
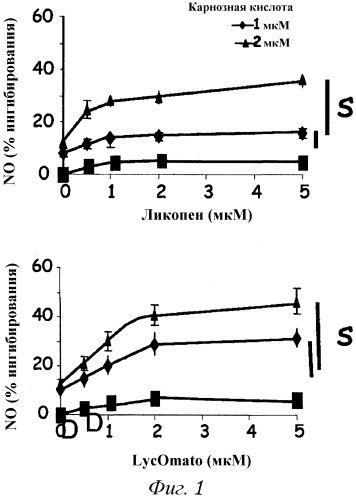
На фиг. 1 графически представлено синергическое взаимодействие карнозной кислоты и ликопена при ингибировании образования NO перитонеальными макрофагами. На верхнем графике показаны результаты, полученные с использованием очищенного ликопена, тогда как на нижнем графике показаны результаты, полученные с использованием обогащенного ликопеном экстракта томата.
На фиг. 2a графически представлено синергическое взаимодействие между карнозной кислотой и очищенным ликопеном (верхний график) и между карнозной кислотой и обогащенным ликопеном экстрактом томата (нижний график) при ингибировании образования NO перитонеальными макрофагами.
На фиг. 2b графически представлено синергическое взаимодействие между ликопеном и различными комбинациями лютеина, карнозной кислоты и β-каротина при ингибировании образования NO перитонеальными макрофагами. На верхнем графике представлены результаты, полученные с использованием очищенного ликопена, тогда как на нижнем графике представлены результаты, полученные с использованием обогащенного ликопеном экстракта томата.
На фиг. 2c дополнительно показано синергическое взаимодействие между ликопеном и различными комбинациями лютеина, карнозной кислоты и β-каротина при ингибировании образования NO перитонеальными макрофагами. На верхнем графике представлены результаты, полученные с использованием очищенного ликопена, тогда как на нижнем графике представлены результаты, полученные с использованием обогащенного ликопеном экстракта томата.
На фиг. 3 графически представлено синергическое взаимодействие между ликопеном и различными комбинациями лютеина, карнозной кислоты и β-каротина при ингибировании образования TNF-α перитонеальными макрофагами. На верхнем графике представлены результаты, полученные с использованием очищенного ликопена, тогда как на нижнем графике представлены результаты, полученные с использованием обогащенного ликопеном экстракта томата.
На фиг. 4 графически представлено синергическое взаимодействие между ликопеном и различными комбинациями лютеина, карнозной кислоты и β-каротина при ингибировании образования PGE2 перитонеальными макрофагами, в сравнении с несинергическим действием комбинаций без ликопена.
На фиг. 5a графически представлено синергическое взаимодействие между очищенным ликопеном и различными комбинациями различных смесей лютеина, карнозной кислоты и β-каротина при ингибировании образования PGE2 перитонеальными макрофагами.
На фиг. 5b графически представлено синергическое взаимодействие между обогащенным ликопеном экстрактом томата и различными комбинациями различных смесей лютеина, карнозной кислоты и β-каротина при ингибировании образования PGE2 перитонеальными макрофагами.
На фиг. 6 графически представлено синергическое взаимодействие между лютеином, β-каротином и карнозной кислотой при ингибировании стимулированного липополисахаридом образования NO перитонеальными макрофагами.
На фиг. 7 графически представлено синергическое взаимодействие между лютеином, β-каротином и карнозной кислотой при ингибировании стимулированного липополисахаридом образования TNF-α перитонеальными макрофагами.
На фиг. 8 графически представлено синергическое взаимодействие между ликопеном, лютеином и различными полифенолами при ингибировании стимулированного липополисахаридом образования NO перитонеальными макрофагами. На диаграмме A представлены результаты использования очищенного ликопена, тогда как на диаграмме B представлены результаты, полученные при использовании содержащего ликопен экстракта томата (Lyc-O-Mato).
На фиг. 9 графически представлено синергическое взаимодействие между ликопеном, лютеином, β-каротином и карнозной кислотой при ингибировании образования супероксида макрофагами. На диаграмме A представлены результаты использования очищенного ликопена, тогда как на диаграмме B представлены результаты, полученные с использованием содержащего ликопен экстракта томата (Lyc-O-Mato).
На фиг. 10 представлено синергическое взаимодействие между ликопеном или Lyc-O-Mato с лютеином и карнозной кислотой при ингибировании фосфорилирования p65-NFκB по серину 536 в клеточных ядерных лизатах, после предварительной инкубации с ЛПС в течение 10 минут. На верхней части фигуры представлены результаты иммуноблоттинга, из которых получали графические данные.
На фиг. 11 графически представлено синергическое взаимодействие между ликопеном или Lyc-O-Mato с лютеином и карнозной кислотой при ингибировании экспрессии белка индуцируемой липополисахаридом синтазы оксида азота (iNOS) и циклооксигеназы-2 (ЦОГ-2) в цельноклеточных лизатах.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Как описано выше в настоящем документе, настоящее изобретение относится к композициям, которые содержат комбинации одного или нескольких полифенолов с одним или несколькими каротиноидами. В особенно предпочтительном варианте осуществления изобретения композиции содержат карнозную кислоту в качестве единственного полифенола и один или несколько каротиноидов, которые выбирают из группы, состоящей из ликопена (или очищенного или содержащегося в экстракте томата), лютеина и β-каротина. В других предпочтительных вариантах осуществления единственный полифенольный компонент выбирают из группы, состоящей из кверцетина, резвератрола и галловой кислоты.
Предпочтительные суточные количества каждого активного средства, присутствующего в композициях, которые вводят субъектам, нуждающимся в таком введении, имеют следующие значения:
| Карнозная кислота | от 0,5 до 30 мг |
| Ликопен | от 0,5 до 30 мг |
| Лютеин | от 0,5 до 30 мг |
| β-каротин | от 0,5 до 30 мг |
Более предпочтительно, суточное количество каждого указанного выше активного средства находится в диапазоне от 1 до 5 мг.
Количество каждого из различных активных компонентов можно выбрать так, чтобы массовые отношения между ними попадали в следующий широкий диапазон:
| Ликопен: | Лютеин: | β-каротин: | Карнозная кислота: |
| 0,1-5,0: | 0,1-5,0: | 0,1-5,0: | 0,1-5,0 |
В одной предпочтительной группе композиций активные компоненты можно комбинировать в следующих диапазонах массовых отношений:
| Ликопен: | Лютеин: | β-каротин: | Карнозная кислота: |
| 0,1-1,0: | 0,1-1,0: | 0,1-1,0: | 0,1-1,0 |
В одном из предпочтительных вариантов осуществления активные компоненты можно комбинировать при следующем отношении:
| Ликопен: | Лютеин: | β-каротин: | Карнозная кислота: |
| 1,0: | 1,0: | 1,0: | 0,5 |
В другом предпочтительном варианте осуществления активные компоненты можно комбинировать при следующем отношении:
| Ликопен: | Лютеин: | β-каротин: | Карнозная кислота: |
| 1,0: | 0,3: | 0,3: | 0,4 |
В еще одном дополнительном предпочтительном варианте осуществления активные компоненты можно комбинировать при следующем отношении:
| Ликопен: | Лютеин: | β-каротин: | Карнозная кислота: |
| 1,0: | 1,0: | 1,0: | 1,0 |
Следует отметить, что композиции, полученные в соответствии с предыдущими примерами предпочтительных массовых отношений не требуют обязательного присутствия всех четырех перечисленных компонентов. Точнее достаточно, чтобы композиция содержала карнозную кислоту (или другой полифенол) вместе с по меньшей мере двумя указанными каротиноидами, где относительное количество каждого из этих компонентов равно указанному с помощью фигур, приведенных непосредственно выше в настоящем документе.
В другой группе предпочтительных вариантов осуществления активные компоненты можно комбинировать в следующих диапазонах массовых отношений:
| Ликопен: | Лютеин: | β-каротин: | Карнозная кислота: |
| 0,1-1,0: | 0,1-5,0: | 0,1-1,0: | 0,1-1,0 |
Более предпочтительно активные компоненты можно комбинировать в следующих диапазонах массовых отношений:
| Ликопен: | Лютеин: | β-каротин: | Карнозная кислота: |
| 0,1-1,0: | 0,1-4,0: | 0,1-1,0: | 0,1-1,0 |
В конкретных предпочтительных вариантах осуществления активные компоненты можно комбинировать при следующих массовых отношениях:
| Ликопен: | Лютеин: | Карнозная кислота: |
| 0,1: | 1,73: | 0,13 |
| Ликопен: | Лютеин: | Карнозная кислота: |
| 0,1: | 1,8: | 0,26 |
| β-каротин: | Лютеин: | Карнозная кислота: |
| 0,29: | 1,29: | 0,1 |
| β-каротин: | Лютеин: | Карнозная кислота: |
| 0,39: | 1,29: | 0,1 |
| β-каротин: | Лютеин: | Карнозная кислота: |
| 0,32: | 3,42: | 0,1 |
| β-каротин: | Лютеин: | Карнозная кислота: |
| 0,16: | 1,71: | 0,1 |
| β-каротин: | Лютеин: | Карнозная кислота: |
| 0,29: | 1,29: | 0,1 |
| β-каротин: | Лютеин: | Карнозная кислота: |
| 0,39: | 1,29: | 0,1 |
Различные активные компоненты можно вводить в составы или для системного, или для местного использования. В случае системного введения полифенол(ы) и каротиноид(ы) можно включать в пероральные лекарственные формы, такие как таблетки, каплеты, капсулы, сиропы, эликсиры, жидкости и т.д.
В других предпочтительных вариантах осуществления композицию по настоящему изобретению можно вводить местно, например на кожу или слизистые оболочки (например, в виде кремов, лосьонов, мазей и т.д.). Дополнительные подробности относительно подходящих способов включения содержащих полифенолы и каротиноиды композиций по настоящему изобретению во многие различные лекарственные формы можно получить из любого стандартного справочника, известного специалистам, включая, например, Remington's Pharmaceutical Sciences, Mack Publishing Co, Easton, Па, USA (1980).
В других предпочтительных вариантах осуществления композицию по настоящему изобретению получают в виде пищевой добавки, которая подходит для непосредственного включения в продукт питания или напиток.
Карнозную кислоту, которую используют для получения композиций по настоящему изобретению, можно получать коммерческим путем от нескольких различных поставщиков, включая Alexis Biochemicals, Lausen, Switzerland. Каротиноиды получали от нескольких различных поставщиков, включая LycoRed Ltd., Be'er Sheva, Israel.
Альтернативно, некоторые компоненты композиции, такие как ликопен, можно включать в указанную композицию в форме обогащенного ликопеном экстракта томата. Один такой экстракт томата коммерчески доступен (например, в форме капсул) из LycoRed Ltd., Beer Sheva, Israel, под торговым названием «Lyc-O-Mato®». Подходящие процессы для получения этого экстракта и схожих экстрактов описаны в US 5837311, описание которого включено в настоящий документ в качестве ссылки в полном объеме. Однако следует учитывать, что любые другие типы процедур получения можно использовать для получения содержащей каротиноид композиции из множества растительных источников. Кроме того, композиции также можно получать из одного или нескольких синтетических каротиноидов.
Следующие примеры приведены в иллюстративных целях и для того, чтобы более конкретно объяснить и описать настоящее изобретение. Однако настоящее изобретение не ограничено конкретными вариантами осуществления, описанными в этих примерах.
ПРИМЕР 1
Ингибирование образования NO, TNF-α и PGE 2 в перитонеальных макрофагах различными комбинациями карнозной кислоты, лютеина, ликопена и β-каротина
Способы и материалы
Выделение и клеточная культура макрофагов. Перитонеальные макрофаги собирали из брюшных полостей самцов мышей ICR в возрасте 6-8 недель (Harlan, Israel), которым вводили интраперитонеальную инъекцию 1,5 мл тиогликолевой жидкой среды (4%) за 4 суток до сбора. Перитонеальные макрофаги отмывали три раза с PBS и, при необходимости, осуществляли гипотонический лизис эритроцитов, получали чистоту 90-95%. Макрофаги идентифицировали в анализе на клеточном сортере с возбуждением флуоресценции с использованием конъюгированных с ФИТЦ антител крысы против F4/80 мыши (MCA497F) (Serotec, Oxford, England) посредством проточной микрофлуорометрии на клеточном сортере с возбуждением флуоресценции (Becton Dickinson, Mountain View, CA). Для каждого образца анализировали 10000 отобранных по светорассеянию жизнеспособных клеток. Перитонеальные макрофаги и клеточную линию макрофагов мыши RAW264,7 культивировали в среде RPMI 1640, содержащей 10% FCS, 2 мМ L-глутамина; 100 Ед/мл пенициллина; 100 мкг/мл стрептомицина (Beit-Haemek, Israel) в 96-луночных плашках (1×106 клеток/лунка) при 37°C в атмосфере с 5% CO2. Клетки стимулировали липополисахаридом (0,1-1 мкг/мл) в присутствии или в отсутствие карнозной кислоты и/или одного или нескольких следующих каротиноидов: карнозная кислота, очищенные ликопен, обогащенный ликопеном экстракт томата (Lyc-O-Mato®; LycoRed Ltd., Be'er Sheva, Israel), лютеин и β-каротин.
Карнозную кислоту и различные каротиноиды растворяли в DMSO (до конечной концентрации 5 мМ). Смесь энергично перемешивали и инкубировали на водяной бане при 37°C (при встряхивании) в течение 10 мин, а затем обрабатывали звуком в ванне для обработки звуком три раза, каждый раз в течение 15 секунд. Используя этот основной раствор, желаемые концентрации получают добавлением соответствующих его объемов в теплую среду для культивирования.
Концентрацию ликопена в растворе определяли после экстракции следующим образом: 0,5 мл изопропанола + 1,5 гексана/дихлорметана (1:5 об./об.), содержащего 0,025% BHT, добавляли в 1 мл свежеприготовленного раствора ликопена с концентрацией 20 мкМ в предварительно нагретой среде. Раствор энергично перемешивали и разделяли фазы посредством центрифугирования на скорости 3000 об./мин в течение 10 мин.
Чтобы измерить содержание ликопена проводили спектральный анализ (пик поглощения 471 нм).
Соответствующие объемы DMSO (0,1-0,2%) добавляли в контроли и процент ингибирования в каждой пробирке вычисляли по отношению к его контролю.
Анализ образования NO. Уровни NO в супернатантах клеточных культур определяли посредством анализа уровней нитрита с использованием реактива Грисса и нитрита натрия в качестве стандарта, как описано в Green, L. C, Wagner, D. A., Glogowski, J., Skipper, P. L., Wishnok, J. S., и Tannenfaaum, S. R. (1982) Anal Biochem. 126: 131-138.
Измерение PGE 2 . Супернатанты покоящихся и стимулированных клеток собирали и незамедлительно сохраняли при -70°C. Уровни PGE2 определяли, используя протокол радиоиммунного анализа с угля, покрытого декстраном, как ранее описано (Dror N, Tveria L, Meniv I, Ben-Shmuel S, Filipovich T, Fleisher-Berkovich S., Regul Pept. 2008 150: 21-5).
В кратком изложении, 100 мкл образца или стандарта PGE2 (Sigma Israel, Rehovot, Israel) инкубировали в присутствии 500 мкл антисыворотки против PGE2 (Sigma Israel, Rehovot, Israel) в течение 30 мин. Затем добавляли [3H]PGE2 (Amersham Biosciences, NJ, USA) в течение 24 ч при температуре 4°C. Через 24 ч 200 мкл холодной суспензии угля, покрытого декстраном, добавляли в каждую пробирку и инкубировали в течение 10 мин на льду. Пробирки центрифугировали на скорости 3500 об/мин в течение 15 мин при температуре 4°C. В 500 мкл супернатантов, содержащих комплексы [3H]PGE2 и антител против PGE2, проводили подсчет (Packard Spectrometry 1900CA) и вычисляли количество PGE2.
Анализ образования TNF-α. Концентрации TNF-α количественно определяли с использованием наборов ELISA (Biolegend Inc., San Diego, CA).
Статистический анализ. Данные представляли в виде среднего значения ± стандартная ошибка среднего. Статистическую значимость для сравнений между группами определяли с использованием двустороннего парного критерия Стьюдента.
Результаты
Фиг. 1
Зависящее от дозы синергическое ингибирование образования NO комбинацией ликопена или Lycomato и карнозной кислоты.
С использованием карнозной кислоты или отдельных каротиноидов самих по себе получены следующие результаты: ликопен или Lycomato в диапазоне 1-5 мкМ вызывали низкий уровень ингибирования образования NO. Карнозная кислота (1 и 2 мкМ) вызывала 12% и 18% ингибирование образования NO, соответственно.
Добавление карнозной кислоты к ликопену или Lycomato вызывало синергическое ингибирование образования NO, которое зависело от дозы.
Более эффективна комбинация карнозной кислоты с Lycomato, чем с очищенным ликопеном.
Результаты, представленные на фиг. 1, представляют собой средние значения ± стандартная ошибка среднего 10 независимых экспериментов, каждый из которых проводили дважды.
Фиг. 2a
Ингибирование образования NO комбинацией оптимальных низких концентраций двух компонентов: ликопена или Lycomato с карнозной кислотой, лютеином и β-каротином.
Комбинация 1 мкМ ликопена или Lycomato с 2 мкМ карнозной кислоты вызывала значимое синергическое ингибирование образования NO, которое было более эффективным в присутствии Lycomato в сравнении с ликопеном.
Комбинация 1 мкМ ликопена или Lycomato с 1 мкМ лютеина или с 2 мкМ β-каротина вызывала аддитивное или не обладающее значимостью синергическое ингибирование образования NO, соответственно.
Комбинация ликопена или Lycomato с карнозной кислотой (т.е. комбинация каротиноида с полифенолом) более эффективна, чем комбинация двух каротиноидов.
Фиг. 2b
Ингибирование образования NO комбинацией оптимальных низких концентрации ликопена или Lycomato с двумя другими компонентами.
Комбинация ликопена или Lycomato с карнозной кислотой и лютеином или с карнозной кислотой и β-каротином (концентрации такие же, как использовали для получения результатов, представленных на фиг. 2a) вызывала значимое и схожее синергическое ингибирование образования NO, тогда как комбинация, не содержащая карнозную кислоту, оказывала только аддитивное действие (обозначено пунктирным эллипсом).
Комбинация четырех компонентов (т.е. ликопена или Lycomato вместе с карнозной кислотой, лютеином и β-каротином) не превосходила комбинацию трех компонентов.
Фиг. 2c
Комбинация карнозной кислоты и каротиноидов, исключая ликопен или Lycomato.
Комбинация или лютеина, или β-каротина с карнозной кислотой вызывала значимое и схожее синергическое ингибирование образования NO (которое схоже с комбинацией ликопена и карнозной кислоты, но ниже, чем наблюдали при использовании комбинации Lycomato и карнозной кислоты). Комбинация лютеина и β-каротина оказывала аддитивное (или более слабое) действие. Эти результаты дополнительно подтверждают то, что как каротиноид(ы), так и полифенол(ы) необходимы для того, чтобы добиться оптимального синергического действия.
Результаты представляют собой средние значения ± стандартная ошибка среднего 3 независимых экспериментов, каждый из которых проводили дважды.
Фиг. 3
Верхний график: Ингибирование образования TNF-α различными комбинациями оптимальных низких концентраций ликопена с карнозной кислотой, лютеином и β-каротином.
Образование TNF-α в том же наборе экспериментов, что и на фиг. 2, менее чувствительно, чем образование NO, поскольку ни одно из этих средств не вызывало какого-либо обнаружимого ингибирования образования TNF-α при использовании по отдельности (т.е. не в сочетании с другими средствами).
Комбинации ликопена с карнозной кислотой или с β-каротином вызывали низкий уровень синергического ингибирования образования TNF-α: 10% и 8% соответственно.
Сходно действию на образование NO, комбинации ликопена или с карнозной кислотой и лютеином или с карнозной кислотой и β-каротином вызывали значимое и схожее синергическое ингибирование образования TNF-α, которое превышало синергическое ингибирование, вызванное комбинацией, не содержащей карнозную кислоту.
Комбинация карнозной кислоты со всеми тремя каротиноидами не превосходила синергический результат, полученный с использованием указанной выше комбинации карнозной кислоты с двумя каротиноидами.
Нижний график: Ингибирование образования TNF-α различными комбинациями оптимальных низких концентраций Lycomato с карнозной кислотой, лютеином и β-каротином.
Образование TNF-α ингибировали (10%) в присутствии Lycomato (в отличие от отсутствия обнаружимого ингибирования в присутствии ликопена). Комбинации Lycomato с каждым другим каротиноидом вызывали синергическое ингибирование, которое было выше в присутствии карнозной кислоты.
Сходно с действием на образование NO, комбинации Lycomato с карнозной кислотой и лютеином или с карнозной кислотой и β-каротином вызывало значимое схожее синергическое ингибирование образования TNF-α, тогда как комбинации, не содержащие карнозную кислоту, оказывали меньшее синергическое действие.
Как и в случае очищенного ликопена, комбинация карнозной кислоты со всеми тремя каротиноидами не превосходила синергический результат, полученный при использовании указанной выше комбинации карнозной кислоты с двумя каротиноидами.
Результаты представляли собой средние значения ± стандартную ошибку среднего 3 независимых экспериментов, каждый из которых осуществляли дважды.
Следует отметить, что комбинации, которые содержали Lycomato, были более эффективны при ингибировании образования TNF-α, чем те, что содержали очищенный ликопен.
Фиг. 4
Ингибирование образования PGE 2 различными комбинациями оптимальных низких концентраций ликоп