Композитные матриксы на основе фиброина шелка, желатина и гидроксиапатита для регенерации костной ткани
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтической промышленности, а именно к композитному матриксу для регенерации костной ткани, способу его получения и применения. Композитный матрикс для регенерации костной ткани, включающий 60% фиброина, 10% желатина и 30% гидроксиапатита, при этом размер пор матрикса составляет 150-300 мкм. Способ получения композитного матрикса, заключающийся в смешивании гидроксиапатита с NaCl, растворении желатина и фиброина в растворе лития хлористого в муравьиной кислоте, центрифугировании раствора, содержащего фиброин и желатин, послойном нанесении супернатанта в форму, смешивая его со смесью гидроксиапатита с NaCl, высушивании образцов, дальнейшем высушивании при комнатной температуре, обработке полученного матрикса этанолом спиртом, промывании бидистиллированной водой, дегазации при определенных условиях. Способ регенерации костной ткани, заключающийся во введении эффективного количества матрикса в область повреждения костной ткани нуждающегося субъекта. Применение композитного матрикса для регенерации костной ткани. Вышеописанный матрикс обладает высокой прочностью и хорошей биосовместимостью, а также биоинертностью и способностью к биодеградации, что позволяет успешно применять их для регенерации костной ткани. 4 н.п. ф-лы, 3 ил., 2 пр.
Реферат
Область техники
Группа изобретений относится к способам получения композитных матриксов на основе фиброина шелка, желатина и гидроксиапатита, которые могут быть использованы в медицине, в частности для регенерации костной ткани.
Уровень техники
В настоящее время чрезвычайно актуальна проблема восстановления дефектов и лечения патологий костной ткани. Переломы костей бывают различной локализации и этиологии. Это могут быть и травматические переломы, и патологические, полученные в результате заболеваний, сопровождающихся изменением структуры костной ткани, что приводит к потере ее прочности. Тяжесть состояния в таких случаях обусловлена в первую очередь размером поврежденных участков кости и их количеством. В результате перелома происходит нарушение целостности кости и кровотечение, возможно также смещение отломков кости. После такой травмы больные восстанавливаются длительное время, которое зависит от возраста, общего состояния организма, типа перелома и расположения отломков кости. В случае переломов бедренных костей возможно возникновение жировой эмболии, приводящей в худшем случае к летальному исходу. В результате перелома шейки бедра умирает до половины пациентов, каждый третий выживший оказывается до конца дней прикованным к кровати, и еще каждый третий умирает в течение года после перелома.
Повреждение лодыжки - частое явление в практике врача-травматолога, такие травмы составляют до 20% патологий опорно-двигательного аппарата. В результате повреждения возможно вторичное смещение отломков в гипсовой повязке, оно наблюдается у 20-25% пациентов. В таком случае необходимо повторное хирургическое вмешательство для восстановления элементов травмированного сустава.
По данным ВОЗ широко распространено хроническое системное заболевание скелета - остеопороз. Согласно статистике в Российской Федерации 14 миллионов человек больны остеопорозом, 20 миллионов - остеопенией: эти люди составляют большую часть группы риска переломов. На IV Российском конгрессе по остеопорозу было озвучено, что в возрастной группе старше 60 лет каждая четвертая женщина и каждый третий мужчина страдают остеопорозом. За одну минуту в России происходит 7 переломов позвонков, вызванных этим заболеванием, каждые 5 минут - перелом шейки бедра.
В настоящее время в костной хирургии для восстановления функций опорно-двигательного аппарата при переломах чаще всего используются металлические конструкции. Такие конструкции направлены на восстановление функции опорно-двигательного аппарата, а не на ускорение регенерации костной ткани. Кроме того, они сохраняются в организме в течение всего времени эксплуатации и часто инкапсулируются. У больных при множественных повреждениях сегментов конечностей металлические фиксирующие конструкции удаляются через 1,5-2 года после остеосинтеза, такой результат является удовлетворительным. Однако при процедуре остеосинтеза возможны и негативные результаты. После закрытого блокирующего остеосинтеза оскольчатого перелома есть вероятность глубокого гнойного воспаления, возникающего в результате нагноения подкожной гематомы в зоне перелома. Это требует широкого вскрытия и дренирования нагноившейся гематомы, удаления металлических фиксаторов и свободнолежащего малого фрагмента кости, а также проведения серьезной антибактериальной терапии.
При разработке имплантируемых материалов для костной хирургии предпочтение отдается биодеградируемым полимерам природного происхождения, а также β-трикальцийфосфату (β-ТКФ) и гидроксиапатиту (ГА). Применение β-ТКФ и ГА ограничивается тем, что процесс деградации этих материалов происходит в течение более одного года. Таким образом, увеличивается риск повторных переломов в зоне имплантации, более того, из этих керамических материалов невозможно сделать структурно-сложные конструкции.
В данной области также используются такие биополимеры, как полимолочная кислота, полигликолевая кислота, коллаген, поли-3-оксибутират и фиброин шелка. Эти материалы поддерживают адгезию клеток и биодеградируемы. Полимолочная и полигликолевая кислоты хороши тем, что можно варьировать их механические свойства путем изменения молекулярной массы и химической конфигурации. Тем не менее, они являются продуктами химического синтеза и имеют низкую биосовместимость, вызывают неинфекционные воспалительные реакции при разложении из-за закисления окружающей имплантат среды компонентами распада [Волков А.В. // Клеточная трансплантология и тканевая инженерия, 2008, Т.3, №2, с.43-45]. Коллаген обладает удовлетворительными, но не лучшими механическими свойствами для создания конструкций для регенерации костей.
Основным преимуществом шелка по сравнению с другими природными биополимерами являются его отличные механические свойства. Другие важные преимущества шелка как материала для регенерации тканей: хорошая биосовместимость, возможность получения водных растворов, способность к биологическому разложению, термостабильность, присутствие легкодоступных химических групп для функциональных модификаций, возможность газовой стерилизации и устойчивость к радиации [Yahong Zhao, et al. // J. Biomedical Science and Engineering, 2011, V.4, P.397-402].
Раскрытие изобретения.
Настоящее изобретение относится к способу получения композитного матрикса, включающему стадии: смешивания гидроксиапатита с NaCl, растворения желатина и фиброина в 10%-ном растворе лития хлористого в 90%-ной муравьиной кислоте в течение 30 минут при температуре 60-70°C, центрифугирования раствора, содержащего фиброин и желатин, послойного нанесения супернатанта в форму, смешивая его со смесью гидроксиапатита с NaCl, высушивания образцов при температуре 75-80°C, дальнейшего высушивания при комнатной температуре, обработки полученных матриксов в течение 120 минут 96%-ным этанолом, промывания бидистиллированной водой, дегазации.
Фиброин шелка по настоящему изобретению может относиться к фиброину шелка каркасной нити пауков, фиброину шелка тутового шелкопряда и других видов шелкопрядов, фиброину рекомбинантного шелка, а также искусственных аналогов шелка.
Изобретение также относится к композитному матриксу, в частности полученному вышеуказанным способом.
В одном из вариантов изобретения матрикс может содержать 60% фиброина, 10% желатина и 30% гидроксиапатита. Размер пор матрикса по настоящему изобретению может составлять 150-300 мкм.
Композитный матрикс по настоящему изобретению может применяться для регенерации костной ткани, в частности ретикулофиброзной и пластинчатой. Композитный матрикс по настоящему изобретению также может применяться для регенерации зубной ткани.
Изобретение также относится к способу регенерации костной ткани, заключающемуся во введении эффективного количества матрикса нуждающемуся в этом пациенту. Более подробно эффективное количество матрикса вводят в область повреждения костной ткани.
Технический результат настоящей группы изобретений относится к разработке способов, позволяющих получать матриксы, которые могут быть использованы для регенерации костной ткани, способные принимать необходимую форму, отличающиеся высокой прочностью и улучшенной биосовместимостью, а также биоинертностью и способностью к биодеградации.
Технический результат заявленной группы изобретений достигается за счет изготовления матриксов, состоящих из фиброина шелка, желатина и гидроксиапатита. Матриксы, созданные на основе комбинации указанных компонентов, обладают способностью принимать необходимую структуру: обладают необходимой плотностью и пористостью, поддерживают свою целостность и не разрушаются при механических воздействиях. Сочетание компонентов: фиброина шелка, желатина и ГА позволяет увеличить адгезию и ускорить пролиферацию клеток, что является важным для скорого и успешного восстановления поврежденной костной ткани наряду с обеспечением необходимых механических свойств материала.
Поскольку кость является специализированной соединительной тканью и состоит из кальцинированного внеклеточного матрикса, содержащего коллаген типа I и гидроксиапатит в качестве основных компонентов, матрикс для регенерации костных тканей должен не только обеспечивать прочность, но и являться источником гидроксиапатита. В этом контексте комбинация фиброина шелка с гидроксиапатитом может обеспечить преимущества ввиду его высокой прочности, а также хорошей биосовместимости. Проведенные эксперименты показали, что включение наночастиц гидроксиапатита в матрицу из фиброина улучшает регенерацию кости у животных in vivo.
Получаемый матрикс имеет незамкнутую структуру, необходимую для трехмерного культивирования клеток. Поры, соединенные отверстиями и каналами, образуют сложную незамкнутую внутреннюю поверхность, способствующую миграции клеток во внутренние слои искусственного матрикса. Незамкнутое строение пор также обеспечивает обмен питательной среды и удаление продуктов метаболизма и, таким образом, способствует созданию гомогенной среды внутри матриксов.
Диаметр пор матрикса обусловливает его механические свойства, скорость биодеградации, взаимодействие клеток с поверхностью матрикса, а также влияет на тканевой ответ после имплантации. Больший размер пор способствует лучшему и более быстрому врастанию новообразованной ткани, ее васкуляризации и более эффективной биорезорбции имплантата.
Для поддержания жизнеспособности субстрат-зависимых клеток в трехмерной культуре необходима их адгезия на поверхности матрикса. Субстрат влияет на продукцию клетками компонентов внеклеточного матрикса, отвечает за его синтез и состав. Способность поддерживать адгезию клеток и их пролиферацию является важным показателем биосовместимости in vitro материала, служащего субстратом. Материал, оказывающий ингибирующее действие, будет замедлять восстановление тканей in vivo.
Краткое описание чертежей (фигур)
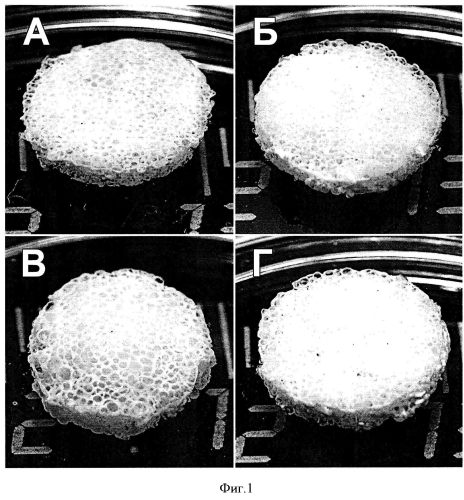
Фигура 1. Внешний вид трехмерных пористых матриксов на основе фиброина шелка (А) и композитных матриксов на основе фиброина шелка и желатина (Б), фиброина шелка и гидроксиапатита (В) и фиброина шелка, желатина и гидроксиапатита (Г). Введение в структуру матрикса желатина и гидроксиапатита не приводит к изменениям его внешнего вида.
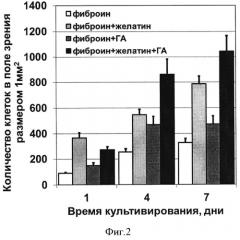
Фигура 2. Увеличение общего количества МЭФ при культивировании на трехмерных пористых матриксах на основе фиброина шелка и композитных материалов.
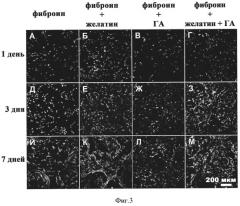
Фигура 3. Мышиные эмбриональные фибробласты (МЭФ), экспрессирующие GFP на матриксах из фиброина шелка (А, Д, И) и композитных матриксах на основе фиброина шелка и желатина (Б, Е, К), фиброина шелка и гидроксиапатита (В, Ж, Л), фиброина шелка, желатина и гидроксиапатита (Г, З, М) через 1 (А-Г), 4 (Д-З) и 7 (И-М) дней культивирования. Представлены изображения проекции серий оптических срезов на плоскость.
Осуществление изобретения
Специалист в данной области техники понимает, что данные примеры не являются ограничивающими группу изобретений.
Пример 1. Получение композитных матриксов.
Для изготовления композитных матриксов на основе фиброина шелка, 10% желатина и 30% ГА навеску ГА смешивают с порообразующим NaCl диаметром 150-300 мкм (100 мг). Желатин и фиброин растворяют в 10%-ном растворе лития хлористого в 90%-ной муравьиной кислоте в течение 30 минут при температуре 60-70°C.
Полученный раствор, содержащий фиброин и желатин, центрифугируют 5 минут при 12100 g и супернатант используют для формирования матриксов. 50 мкл подогретого супернатанта послойно наносят в форму, смешивая со смесью ГА и 100 мг хлорида натрия, варьируя размер частиц. В качестве порообразующего агента используют кристаллы NaCl диаметром 150-300 мкм. Концентрация частиц соли подобрана таким образом, чтобы получить матрикс со сложной внутренней пористой поверхностью, не содержащей изолированных полостей.
Полученные образцы высушивают в течение 3 часов при температуре 75-80°C, далее высушивают при комнатной температуре 16 часов. Полученные матриксы в течение 120 минут обрабатывают 96%-ным этанолом, 120 минут отмывают бидистиллированной водой, после этого дегазируют и хранят в 70%-ном этаноле.
Готовые матриксы в данном примере содержат 60% фиброина, 10% желатина и 30% гидроксиапатита (фиг.1). Диаметр пор матриксов, изготовленных методом выщелачивания, соответствует внесенным частицам порообразователя (150-300 мкм).
Полученные экспериментальные образцы сравнивают с матриксами на основе фиброина шелка и желатина. Последние упруго деформируются при непосредственном механическом нажатии, в то время, как образцы на основе фиброина шелка, желатина и ГА поддерживают свою целостность и не деформируются при непосредственном механическом нажатии.
Показано, что водная среда ни непосредственно после погружения, ни через час, ни через сутки не влияет на целостность и пористость матриксов. Это является очень важным свойством изделий, так как разрушение и изменение базовой структуры и физических свойств имплантата в водной среде может сделать невозможным его применение для работы in vivo. Изделия не обладают какими-либо значительными гигроскопичными свойствами и не набухают, что позволяет им сохранить заданные при изготовлении параметры.
Пример 2. Исследование биологических свойств композитных матриксов.
Получение первичной культуры мышиных эмбриональных макрофагов, экспрессирующих GFP.
МЭФы получают из GFP+ эмбрионов на 13.5 день внутриутробного развития. Для получения датированной беременности двух самок линии С57В1/6 подсаживают к GFP+ самцу на ночь, утром у самок проверяют наличие копулятивной пробки. Момент обнаружения копулятивной пробки считают 0.5-м днем беременности. При достижении 13.5 дней беременности мышь эвтаназируют, извлекают матку, у эмбрионов удаляют голову и внутренние органы, проверяют у них наличие экспрессии GFP на УФ трансиллюминаторе, оставшиеся ткани измельчают глазными ножницами в стерильных условиях, диссоциируют в 0.05%-ном растворе трипсин/ЭДТА и центрифугируют в течение 5 мин при 1000 об/мин, а затем клеточную суспензию переносят во флакон площадью 25 см2 для адгезивных культур (-Grenier). Далее клетки культивируют в среде DMEM, содержащей 4.5 г/л глюкозы (-HyClone) и 10% эмбриональной телячей сыворотки (-HyClone), при 37°C в условиях 5% CO2 и 95%-ной влажности. Каждые три дня при достижении 80-85% монослоя клетки рассевают в соотношении 1:3.
Образцы матрикса помещают в лунки 24-луночного планшета и вносят 1 мл суспензии клеток с концентрацией 50 тыс/мл в среде DMEM с 10% эмбриональной телячьей сыворотки. Инкубируют 16 часов и переносят образцы с прикрепившимися клетками в новые лунки. Каждые 3 дня меняют культуральную среду.
Анализ изменения во времени количества клеток, культивируемых на разных матриксах, показал, что введение в структуру матрикса из фиброина таких компонентов, как ГА и желатин увеличивает адгезию и ускоряет пролиферацию МЭФ (фиг.2, 3). Так через 1 сутки количество клеток на композитном матриксе было в 2,5 раза больше, чем на матриксе из фиброина, а на 4 и 7 день разница увеличилась более чем в 3 раза.
Приведенные примеры позволяют сделать вывод, что полученные вышеуказанным способом матриксы способны принимать и поддерживать необходимую форму, обладают хорошей биосовместимостью, а также биоинертностью и способностью к биодеградации, что позволяет успешно применять их для регенерации костной ткани, в частности лечения травм, устранения дефектов, сращения переломов, ортопедической косметологии, стоматологии.
1. Композитный матрикс для регенерации костной ткани, включающий 60% фиброина, 10% желатина и 30% гидроксиапатита, при этом размер пор матрикса составляет 150-300 мкм.
2. Способ получения композитного матрикса по п. 1, включающий стадии: смешивания гидроксиапатита с NaCl, растворения желатина и фиброина в 10%-ном растворе лития хлористого в 90%-ной муравьиной кислоте в течение 30 минут при температуре 60-70°C, центрифугирования раствора, содержащего фиброин и желатин, послойного нанесения супернатанта в форму, смешивая его со смесью гидроксиапатита с NaCl, высушивания образцов при температуре 75-80°C, дальнейшего высушивания при комнатной температуре, обработки полученного матрикса в течение 120 минут 96%-ным этанолом, промывания бидистиллированной водой, дегазации.
3. Способ регенерации костной ткани, заключающийся во введении эффективного количества матрикса по п. 1 в область повреждения костной ткани нуждающегося субъекта.
4. Применение композитного матрикса по п. 1 для регенерации костной ткани.