Индуктор гамма интерферона
Иллюстрации
Показать всеИзобретение относится к медицине, а именно для использования в области иммунологии, и касается индуктора гамма интерферона. Для этого применяют экзополисахарид бактерий P.nigrifaciens штамма КММ 156 в качестве индуктора IFN-γ. Использование данного полисахарида обеспечивает образование IFN-γ для создания нового препарата. 2 табл.
Реферат
Изобретение предназначено для использования в области биотехнологии, медицины, ветеринарии и касается индуктора гамма-интерферона.
В настоящее время в клинической практике используется большое количество препаратов интерферона и индукторов интерферона, которые применяются как при вирусных инфекциях, так и в онкологической практике, с целью иммуностимуляции, а так же в связи с наличием у них антипролиферативного эффекта.
Индукторы интерферона, стимулирующие выработку в организме человека и животных эндогенного интерферона, имеют ряд преимуществ перед препаратами экзогенного интерферона и являются перспективными средствами профилактики и терапии вирусных инфекций.
Известен индуктор эндогенного интерферона - тилорон (www.amixin.ru), который выпускается в виде перорального препарата (торговое название «Амиксин», Инструкция на препарат http://www.regmed.ru/InstrShow2.asp?InstrLinkNx=41 ba48ba44ba43b и «Лавомакс», Инструкция на препарат, http://www.regmed.ru/InstrShow2.asp?InstrLinkNx=a41 ba48ba44ba43b). Тилорон является низкомолекулярным синтетическим индуктором интерферона, стимулирующим образование в организме интерферонов альфа, бета и гамма.
Известен препарат меглумин акридонацетат (торговое название - циклоферон), являющийся низкомолекулярным индуктором интерферона, который оказывает противовирусное, иммуномодулирующее и противовоспалительное действие. Основными клетками-мишенями препарата являются Т- и В-лимфоциты. Он стимулирует продукцию альфа-, бета- и гамма-интерферонов (до 60-80 ЕД/мл и выше) лейкоцитами, макрофагами, эпителиальными клетками, а также тканями селезенки, печени, легких, мозга, проникает в цитоплазму и ядерные структуры, активирует синтез «ранних» интерферонов. Иммуномодулирующий эффект выражается в коррекции иммунного статуса организма при иммунодефицитных состояниях различного генеза. Указанные препараты стимулируют образование интерферонов альфа, бета и гамма. (Описание препарата, www.biomedservis.ru/preparat/pr_cycloferon_liniment.htm).
Известен индуктор Ридостин, имеющий в своем составе двуспиральную РНК из киллерных штаммов дрожжей Saccharomyces cerevisiae в количестве 5-15% и однонитевую РНК дрожжей как основные компоненты (Патент РФ №2083221 от 12.01.1993, МПК А61К 38/20). В отличие от синтетических полирибонуклеотидов, Ридостин позволяет исключить нежелательную нагрузку на окружающую среду, поскольку РНК природного происхождения легко утилизируется в организме.
Указанные препараты обеспечивают образование интерферонов альфа, бета и гамма, однако наряду с высокой эффективностью их как индукторов интерферона эти препараты обладают высокой токсичностью, проявляют мутагенную активность и быстро выводятся из организма.
Задачей изобретения является применение нового препарата, не обладающего побочными эффектами.
Она решается применением в качестве индуктора интерферона IFN-γ экзополисахарида бактерий Pseudoalteromonas nigrifaciens штамма КММ 156.
Экзополисахарид бактерий P.nigrifaciens штамма КММ 156 и способ его получения известен (Биоорганическая химия, 1993, т. 19, №3, с. 327-336). Однако данный полисахарид в качестве индуктора интерферона-γ до сих пор не применялся в связи с ранее не изученными его свойствами.
Экспериментальным путем было установлено, что экзополисахарид бактерий Pseudoalteromonas nigrifaciens штамма КММ 156, выделенного из ткани желудка дальневосточного двустворчатого моллюска Crenomytilus grayanus, можно использовать в качестве индуктора IFN-γ. При этом первоначально этот вид микроорганизма был определен как Alteromonas haloplanktis (Биоорганическая химия, 1993, т. 19, №3, с. 327-336). Затем, на основании генетического анализа, Alteromonas haloplanktis был переименован в Pseudoalteromonas nigrifaciens (International Journal of Systematic Bacteriology, Oct. 1995, Vol. 45. № 4, p. 775-761; International Journal of Systematic Bacteriology, Jan. 1996, Vol. 46. № 1, p. 223-228).
Нетоксичный, легкорастворимый экзополисахарид имеет идентичное строение с входящим в состав липополисахарида О-специфическим полисахаридом и состоит из тетрасахаридных повторяющихся звеньев, содержащих два остатка L-рамнозы, один остаток 2-ацетамидо-2-дезокси-D-глюкозы и один остаток 3-O-[(R)-1-карбоксиэтил]-D-глюкозы (глюколактиловой кислоты).
Методом определения продукции ИФН-γ лимфоцитами периферической крови определяли суммарную продукцию цитокина разными клетками,
Гепаринизированную венозную кровь здоровых доноров разводили в 3 раза стерильной средой RPMI 1640, содержащей 3% глютамина и 100 мкг/мл гентамицина. Для оценки спонтанной продукции ИФН-γ (контроль) к 0.9 мл разбавленной крови в стерильной закрывающейся пробирке добавляли 0,1 мл среды указанного выше состава. Для оценки стимулированной экзополисахаридом продукции гамма-интерферона в 0,9 мл разведенной крови вносили 0,1 мл разведенного средой экзополисахарида (конечная концентрация 10 мкг/мл и 100 мкг/мл). Пробирки помещали в термостат, через 48 ч инкубации при температуре 37°C кровь центрифугировали в течение 5 мин при 1000 об/мин, супернатант отбирали в пластиковые пробирки, замораживали и хранили до использования при -20°C [2]. Уровень IFN-γ определяли с помощью коммерческих тест-систем «ВЕКТОР-БЕСТ» методом "сэндвич"-варианта твердофазного иммуноферментного анализа с помощью двойных антител, согласно рекомендациям производителей. В качестве стандарта для сравнения в реакции использовались рекомбинантные цитокины, входящие в состав тест-наборов. Концентрацию цитокинов выражали в пикограммах на мл.
Учет результатов производили с помощью иммуноферментного анализатора Multiscan RC (Labsystems) по уровню оптической плотности, измеряемой при 450 нм с длиной волны сравнения 620 нм. Расчеты концентрации тестируемых образцов определяли по калибровочной кривой, построенной на основе результатов измерения стандартов.
Полученные результаты свидетельствуют о том, что экзополисахарид через 48 часов инкубации с цельной кровью дозозависимо увеличивает секрецию IFN-γ.
Следующий, широко используемый в научных целях, метод - это внутриклеточное определение цитокинов методом проточной цитофлюориметрии (J.Immunol., 1995, Vol 154, р. 4294-4394). С помощью этого метода популяцию клеток-продуцентов цитокина можно охарактеризовать фенотипически, дать относительную количественную характеристику этой продукции.
В опытные пробирки помещали по 500 мкл среды, 500 мкл крови, 2 мкл моненсина (Monensin Solution), 10 мкл экзополисахарида. Конечная концентрация экзополисахарида - 10 мкг/мл. В контрольные пробирки помещали по 500 мкл среды RPMI 1640, 500 мкл крови, 2 мкл моненсина (Monensin Solution), 10 мкл раствора Cell WASH. Содержимое всех пробирок перемешивали с помощью вортекса в течение 5 сек. Инкубировали 20 часов в СО2 при температуре +37°C.
Затем в пробирки добавили антиген-специфические моноклональные антитела для окрашивания поверхностных маркеров (CD3, CD56), тщательно перемешали 5 сек на вортексе. Инкубировали 15 мин при комнатной температуре в темном месте.
Добавили 2 мл 1-кратного лизирующего раствора (FACS Lysing Solution) для лизирования эритроцитов, перемешали 5 сек на вортексе, инкубировали 5-10 мин при комнатной температуре в темном месте и затем центрифугировали пробирки в течение 5 минут в режиме 500 об/мин.
Удалив надосадочную жидкость, добавили 500 мкл 1-кратного пермеабилизующего раствора (FACS Permeabilizing Solution), тщательно перемешали 5 сек на вортексе, инкубировали 10 мин при комнатной температуре в темноте.
Добавили 2-4 мл раствора Cell WASH, центрифугировали 5 минут в режиме 500 об/мин. Удалив надосадочную жидкость, перемешали осадок.
Добавили 20 мкл конъюгатов моноклональных антител к IFN-γ-PE, перемешали 5 сек на вортексе, инкубировали 30 мин при комнатной температуре в темноте.
Добавили 2-4 мл раствора Cell WASH, центрифугировали 5 минут в режиме 500 об/мин. Удалив надосадочную жидкость, перемешали осадок.
Ресуспендировали клетки в 500 мкл 1%-ного параформальдегида. Образцы анализировали на проточном цитометре «FACS Calibur» фирмы «Вестоп Dickinson (USA) с использованием наборов моноклональных антител того же производителя.
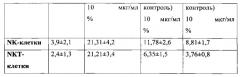
Установлено, что уже через 20 часов под действием экзополисахарида увеличивается количество NK- и NKT-клеток, продуцирующих IFN-γ.
При статистической обработке результатов исследования использовали пакет прикладных программ Statistica 6.0. Результаты считали достоверными при уровне значимости р<0,05.
Результаты исследований показали, что заявляемый экзополисахарид может быть применен в качестве индуктора IFN-γ.
Применение экзополисахарида бактерий P.nigrifaciens штамма КММ 156 в качестве индуктора IFN-γ.