Производные пептидо-нуклеиновых кислот с хорошей клеточной пенетрацией и сильной аффинностью к нуклеиновой кислоте
Иллюстрации
Показать всеИзобретение относится к новому новый классу производных пептидо-нуклеиновых кислот, которые показывают хорошую клеточную пенетрацию и сильную связывающую аффинность к нуклеиновой кислоте. 10 н. и 6 з.п. ф-лы, 10 ил., 2 табл., 73 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к производным пептидо-нуклеиновых кислот, химически модифицированных для обеспечения хорошей клеточной пенетрации и сильной аффинности к нуклеиновой кислоте.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 представлены хроматограммы высокоэффективной жидкостной хроматографии ВЭЖХ до и после очистки Олиго 17 с помощью ВЭЖХ с обращенной фазой. Сокращения, используемые в настоящей заявке, определены в таблице на страницах 27-29.
На Фиг.2 представлен масс-спектр MALDI-TOF для очищенной серии Олиго 17.
На Фиг.3 представлены кривые изменения поглощения в зависимости от температуры для Олиго 17 для комплементарной или с нарушенной комплементарностью ДНК.
На Фиг.4(а) и 4(б) представлены изображения конфокальной микроскопии (при 63-кратном увеличении) для 1, 2, 3 и 24 часов после обработки HeLa клеток Олиго 1 и Олиго 2 при 5 мкМ соответственно.
На Фиг.5(а) и 5(б) представлены изображения конфокальной микроскопии (при 63-кратном увеличении) для 0,5 и 1 часа после обработки MCF-7 клеток Олиго 6 и Олиго 7 при 2,5 мкМ соответственно.
На Фиг.6(а) и 6(б) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 6 или 24 часов после обработки HeLa клеток Олиго 1 и Олиго 6 при 1 мкМ соответственно.
На Фиг.7(а) и 7(б) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 24 часов после обработки JAR клеток Олиго 21 и Олиго 28 при 2 мкМ соответственно.
На Фиг.7(в) и 7(г) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 24 часов после обработки А549 клеток Олиго 21 и Олиго 28 при 2 мкМ соответственно.
На Фиг.7(д) и 7(е) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 12 часов после обработки HeLa клеток Олиго 21 и Олиго 28 при 2 мкМ соответственно.
На Фиг.7(ж) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 24 часов после обработки HeLa клеток Одиго 21 при 2 мкМ.
На Фиг.8(а), 8(б) и 8(в) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 24 часов после обработки HeLa, A549 и JAR клеток Олиго 22 при 2 мкМ соответственно.
На Фиг.9 представлены результаты вестерн-блоттинга для JAR клеток, обработанных Олиго 9 при 5 мкМ или 10 мкМ, Олиго 10 при 5 мкМ или 10 мкМ, при совместной обработке олигомерами при 5 мкМ или 10 мкМ каждый, и контрольный опыт (без обработки олигомером).
На Фиг.10 представлена типичная структура олигомеров ПНК, описанных в данном изобретении.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Олигонуклеотиды были использованы для различных биологических целей, включая антисмысловое ингибирование экспрессии генов, ПЦР (полимеразную цепную реакцию), диагностический контроль с помощью генных чипов и т.д. Поскольку олигонуклеотиды взаимодействуют в определенной последовательности с нуклеиновыми кислотами, такими как ДНК и РНК, они являются весьма полезными для предсказуемого модулирования биологических процессов с участием ДНК или РНК в клетке. Однако, в отличие от малых молекул лекарственных препаратов, олигонуклеотиды не легко пенетрируют через мембрану клеток млекопитающих и, поэтому, вряд ли влияют на биологические процессы внутри клетки, в случае если они соответствующим образом не модифицированы или не входят в состав, дающий возможность им легко пенетрировать через цитоплазматическую мембрану.
Белки в качестве мишеней лекарственных препаратов. Белки являются посредниками различных клеточных функций. Не удивительно, что большинство в настоящее время продаваемых на рынке лекарственных препаратов показывают терапевтическую активность через модулирующие функции белка(ов). Например, нестероидный противовоспалительный лекарственный препарат - аспирин - ингибирует ферменты, названные циклооксигеназами, в отношении их противовоспалительной активности.
Лосартан связывается и является антагонистом функции трансмембранного рецептора, названного рецептором ангиотензина II, в отношении его противогипертонической активности. Росиглитазон селективно активирует внутриклеточный рецептор, названный рецептором γ, активируемым пролифератором пероксисом (PPARγ), с появлением антидиабетической активности. Этанерцепт является слитым белком, который связывает цитокин, названным фактором некроза опухоли-α (tumor necrosis factor-α, TNF-α), и нейтрализует биологическую активность TNF-α в отношении его противоревматической активности. Герцептин является моноклональным антителом для лечения рака молочной железы путем селективного связывания с erbB2, сверхэкспрессированного в некоторых типах клеток рака молочной железы.
Антисмысловое ингибирование синтеза белка. Белки кодируются ДНК (2-дезоксирибонуклеиновая кислота). В ответ на клеточную стимуляцию ДНК транскрибируется с продуцированием пре-мРНК (незрелая рибонуклеиновая кислота) в ядре. Интроновая(ые) часть(и) пре-мРНК ферментативно сплайсируется, давая мРНК (зрелая рибонуклеиновая кислота), которая затем перемещается к питозольному компоненту. В цитозоле комплекс механизма трансляции, называемый рибосомой, связывает мРНК и осуществляет синтез белка, поскольку он сканирует генетическую информацию, закодированную в мРНК. (Biochemistry vol.41, 4503-4510, 2002; Cancer Res. vol.48, 2659-2668, 1988).
Олигонуклеотид, связанный в определенной последовательности с мРНК или пре-мРНК, называется антисмысловым олигонуклеотидом (antisense oligonucleotide, АО). АО может прочно связывать мРНК и ингибировать синтез белка с помощью рибосомы на мРНК в цитозоле. АО должен находиться внутри клетки, чтобы ингибировать синтез его белка-мишени. АО может прочно связывать пре-мРНК в ядре и влиять на сплайсинг пре-мРНК, продуцируя мРНК с измененной последовательностью и, следовательно, измененным белком.
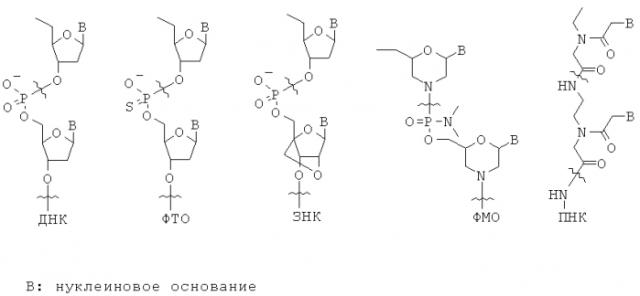
Неприродные олигонуклеотиды. Олигонуклеотиды ДНК или РНК чувствительны к деградации эндогенными нуклеазами, ограничивающими их терапевтическую полезность. На сегодняшний день были разработаны и интенсивно изучены многие типы неприродных олигонуклеотидов. (Clin. Exp. Pharmacol. Physiol. vol.33, 533-540, 2006). Некоторые из них показывают увеличенную метаболическую стабильность по сравнению с ДНК и РНК. Приведенные выше структуры являются химическими структурами некоторых типичных представителей неприродных олигонуклеотидов. Как и ожидалось, такие олигонуклеотиды связывают комплементарную нуклеиновую кислоту, как это делает ДНК или РНК.
Фосфоротиоатный олигонуклеотид - ФТО (phosphorothioate oligonucleotide, РТО) представляет собой аналог ДНК с одним из фосфатных атомов кислорода в остове, замененного на атом серы в расчете на мономер. Такие небольшие структурные изменения делают ФТО сравнительно устойчивым к деградации нуклеазами. (Ann. Rev. Biochem. Vol.54, 367-402, 1985).
Отражая структурное сходство ФТО и ДНК, оба они плохо пенетрируют через клеточную мембрану в большинстве типов клеток млекопитающих. Однако, для некоторых типов клеток, в большом количестве экспрессирующих переносчик(и) ДНК, ДНК и ФТО показывают хорошую клеточную пенетрацию. Известно, что системно введенные ФТО(ы) быстро распределяются в печени и почках. (Nucleic Acids Res. vol.25, 3290-3296, 1997).
В целях облегчения клеточной пенетрации ФТО in vitro на практике обычно осуществляли липофекцию. Однако, липофекция физически изменяет клеточную мембрану, вызывает цитотоксичность, и, следовательно, не будет идеальной при длительном терапевтическом применении.
За последние 20 лет, антисмысловые ФТО(ы) и варианты ФТО(ов) были клинически оценены для лечения злокачественных новообразований, иммунологических нарушений, болезней обмена веществ и так далее. (Biochemistry vol.41, 4503-4510, 2002; Clin. Exp. Pharmacol. Physiol. vol.33, 533-540, 2006). Многие такие антисмысловые кандидаты лекарственных препаратов не были эффективными отчасти из-за плохой клеточной пенетрации ФТО. Для того, чтобы преодолеть плохую клеточную пенетрацию, для проявления терапевтической активности ФТО необходимо вводить в высоких дозах. Однако, известно, что ФТО(ы) связаны с зависимыми от дозы токсичностями, как например увеличенным временем свертывания крови, активацией комплемента, тубулярной нефропатией, активацией клеток Купфера и иммунной стимуляцией, включая спленомегалию, лимфоидную гиперплазию, мононуклеарную клеточную инфильтрацию. (Clin. Exp. Pharmacol. Physiol. vol.33, 533-540, 2006).
Было найдено, что многие антисмысловые ФТО(ы) показывают соответствующую клиническую активность для заболеваний с существенным вкладом печени или почек. ISIS-301012 (мипомерсен) является аналогом ФТО, который ингибирует синтез ароВ-100, белка, вовлеченного в транспорт LDL холестерина (липопротеид низкой плотности, ЛПНП). Мипомерсен проявлял соответствующую клиническую активность у некоторой группы больных атеросклерозом, скорее всего, в силу его преимущественного распределения в печени. (www.medscape.com/viewarticle/556073: имеющий доступ с 19 февраля 2009). ISIS-113715 является аналогом антисмыслового ФТО, ингибирующего синтез протеинтирозинфосфатазы 1В (РТР1В), и было найдено, что он проявляет терапевтическую активность у больных диабетом II типа. (Curr. Opin. Mol. Ther. vol.6, 331-336, 2004).
В фосфорамидитном морфолиновом олигонуклеотиде - ФМО (phosphoroamidite morpholino oligonucleotide, PMO) остов фосфата и 2-дезоксирибозы ДНК заменяются фосфорамидитом и морфолином, соответственно. (Appl. Microbiol. Biotechnol. vol 71, 575-586, 2006). В то время как остов ДНК отрицательно заряжен, остов ФМО является незаряженным. Таким образом, связывание ФМО и мРНК происходит без электростатического отталкивания между остовами и обычно бывает сильнее, чем между ДНК и мРНК. Поскольку ФМО структурно очень отличается от ДНК, ФМО не будет распознаваться гепатическим(ими) переносчиком(ами), распознающим(и) ДНК. Однако, ФМО с трудом пенетрирует через клеточную мембрану.
Пептидо-нуклеиновая кислота - ПНК (peptide nucleic acid, PNA) представляет собой полипептид с N-(2-аминоэтил)глицином в качестве элементарного звена остова, и была описана Nielsen с сотр.. (Science vol.254, 1497-1500, 1991). Подобно ДНК и РНК, ПНК также селективно связывает комплементарную нуклеиновую кислоту [Nature (London) vol.365, 566-568, 1992]. Аналогично ФМО, остов ПНК не заряжен. Таким образом, связывание между ПНК и РНК обычно бывает сильнее, чем между ДНК и РНК. Поскольку ПНК структурно значительно отличается от ДНК, ПНК не будет распознаваться гепатическим(ими) переносчиком(ами), распознающим(и) ДНК, и покажет(ут) профиль распределения в тканях сильно отличающийся от такового для ДНК или ФТО. Однако, ПНК также плохо пенетрирует через мембрану клетки млекопитающего. (Adv. Drug Delivery Rev. vol.55, 267-280, 2003).
В закрытой нуклеиновой кислоте - ЗНК (locked nucleic acid, LNA) рибозное кольцо остова РНК структурно ограничивает увеличение связывающей аффинности к РНК или ДНК. Таким образом, ЗНК(ы) можно рассматривать как производные ДНК или РНК с высокой аффинностью. (Biochemistry vol.45, 7347-7355, 2006).
Антисмысловые механизмы. Антисмысловой механизм отличается в зависимости от типов АО(ов). РНКаза Н распознает дуплекс мРНК с ДНК, РНК или ФТО, и разрушает часть двойной спирали мРНК. Таким образом, антисмысловая активность ФТО существенно амплифицируется РНКазой Н. В то же время, РНКаза Н не распознает дуплекс мРНК с ФМО, ПНК или ЗНК. Иными словами, ФМО, ПНК и ЗНК должны полагаться исключительно на стерическое блокирование мРНК в отношении их антисмысловой активности. (Biochemistry vol.41, 4501-4510, 2002).
Для олигонуклеотидов с такой же связывающей аффинностью к мРНК, ФТО поэтому будет показывать более сильную антисмысловую активность, чем ФМО, ПНК и ЗНК. Для стерического блока АО(ов), как например ФМО, ПНК и ЗНК, для антисмысловой активности желательна сильная аффинность к мРНК.
Антисмысловая активность ПНК. Связывающая аффинность ПНК к мРНК будет возрастать по мере увеличения до определенного момента длины ПНК. Однако, антисмысловая активность ПНК, как представляется, не всегда увеличивается с длиной ПНК. Были случаи, когда антисмысловая активность ПНК достигала максимальной активности при 12-13-мер и после уменьшалась. (Nucleic acids Res. vol.32, 4893-4902, 2004). С другой стороны, оптимальная антисмысловая активность достигалась с 15-18-мер ПНК(ами) по сравнению с конкретной мРНК, отражая то, что структурная доступность направленного связывающего участка (сайта) мРНК будет иметь важное значение. (Biochemistry vol.40, 53-64, 2001).
Во многих случаях сообщалось, что ПНК(ы) ингибируют синтез белка рибосомой при микромолярном уровне при условиях хорошей клеточной пенетрации. (Science vol.258, 1481-85, 1992; Biochemistry vol.40, 7853-7859, 2001; Nucleic acids Res. vol.32, 4893-4902, 2004). Однако, было найдено, что ПНК(ы), нацеленные на весьма доступное положение мРНК, показывают антисмысловую активность при субмикромолярном уровне. (Neuropeptides vol.38, 316-324, 2004; Biochemistry vol.40, 53-64, 2001) или даже при субнаномолярном уровне (Nucleic Acids Res. vol.36, 4424-4432, 2008) при хороших условиях трансфекции.
Кроме того, нацеливание на весьма доступный центр мРНК, сильная связывающая аффинность ПНК к мРНК будет очень необходима для хорошей антисмысловой активности. В отличие от ДНК, ФТО и ЗНК, остов ПНК не заряжен. ПНК проявляет тенденцию к агрегации и становится менее пригодной для связывания с мРНК, поскольку ее размер увеличивается. Желательно улучшить связывающую аффинность ПНК к мРНК без увеличения длины ПНК. Включение мономеров ПНК с точечным зарядом было бы полезным для предотвращения ПНК от агрегации.
Стратегии клеточной пенетрации для ПНК. ПНК(ы) не легко пенетрируют через клеточную мембрану и, как правило, показывают недостаточную антисмысловую активность, если только должным образом не трансфицировались. В начале, антисмысловая активность ПНК оценивалась с помощью микроинъекции (Science vol.258, 1481-85, 1992) или электропорации (Biochemistry vol.40, 7853-7859, 2001). Микроинъекция и электропорация являются инвазивными и неподходящими для применения в терапевтических целях. Чтобы улучшить клеточную пенетрацию, были разработаны различные стратегии. (Adv. Drug Delivery Rev. vol.55, 267-280, 2003; Curr. Top. Med. Chem. vol.7, 727-737, 2007).
ПНК(ы) были эффективно доставлены в клетку с помощью ковалентной инкорпорации пенетрирующих в клетку пептидов (Neuropeptides vol.38, 316-324, 2004), липофекции с последующим образованием дуплекса с комплементарной ДНК (Biochemistry vol.40, 53-64, 2001), липофекции ПНК(т) с ковалентно присоединенным 9-аминоакридином (Nucleic Acids Res. vol.32, 2695-2706, 2004), липофекции ПНК(т) с ковалентно присоединенными фосфонат-анионами (Nucleic Acids Res. vol.36,4424-4432, 2008), и так далее. Клеточная пенетрация также улучшалась при присоединении к ПНК липофильного остатка, как например адамантана (Bioconjugate Chem. vol.10, 965-972, 1999), или амфифильной группы, как например тетрафенилфосфония. (Nucleic Acids Res. vol.29, 1852-1863, 2001). Тем не менее, такая ковалентная модификация вряд ли увеличивает связывающую аффинность к мРНК, несмотря на заметное улучшение в клеточной пенетрации.
ПНК(ы) с ковалетно присоединеным ПКП. Пенетрирующие в клетку пептиды - ПКП(-ы) (cell penetrating peptides, CPPs) представляют собой полипептиды, показывающие хорошую клеточную пенетрацию, и они имеют множество положительных зарядов от остатков аргинина или лизина. На сегодняшний день описаны многие ПКП(-ы), как например транспортан, пенетратин, клеточный сигнал внутриядерной локализации - КСВЛ (nuclear localization signal, NLS) и Tat. Известно, что ПКП(-ы) эффективно несут ковалентно присоединенный груз в клетку. ПНК(-ы) с ковалентно присоединенным ПКП также показали хорошую клеточную пенетрацию.
Хотя некоторые ПНК(-ы) с ковалентно присоединенным ПКП показывали антисмысловую IC50s около 100 нм (Neuropeptides vol.38, 316-324, 2004), для таких ПНК(-т) более распространенной является микромолярная антисмысловая IC50s.
ПНК(-ы) с ковалентно связанным ПКП состоят из двух частей, гидрофобного домена ПНК и положительно заряженного домена ПКП. Такая ПНК имеет тенденцию к агрегации, она захватывается эндосомами внутри клетки и становится недоступной для антисмыслового ингибирования синтеза белка. (Curr. Top. Med. Chem. vol.7, 727-737, 2007; Nucleic Acids Res. vol.33, 6837-6849, 2005). Кроме того, такой ковалентно присоединенный ПКП вряд ли увеличивает связывающую аффинность ПНК к мРНК.
ПНК(-ы) с хиральным остовом. Предпринимались попытки ввести хиральный заместитель на остов 2-аминоэтил-глицина ПНК (2-aminoethyl-glycme, Aeg). Например, растворимость ПНК в воде значительно улучшилась при включении мономера(ов) ПНК с остовом 2-аминоэтил-лизина вместо Aeg. (Angew. Chem. Int. Ed. Engl. vol.35, 1939-1941, 1996).
При включении остова L-(2-амино-2-метил)этил-глицина вместо Aeg, связывающая аффинность ПНК к ДНК и РНК значительно улучшалась. 10-мер ПНК со всем остовом L-(2-амино-2-метил)этил-глицина вместо 2-аминоэтил-глицина показала увеличение температуры плавления (Т. пл.) на 19°С и 10°С по сравнению с комплементарной ДНК и РНК, соответственно. Такое увеличение, по-видимому, не является все же пропорциональным числу замещений L-(2-амино-2-метил)этил-глицином. (J. Am. Chem. Soc. vol.128, 10258-10267, 2006).
GPNA. Сообщалось, что клеточная пенетрация ПНК значительно улучшалась при включении мономеров ПНК с остовом 2-аминоэтил-аргинина вместо Aeg. (J. Am. Chem. Soc. vol.125, 6878-6879, 2003). Такие ПНК(ы) назывались 'GPNA', так как они на остове имеют остаток гуанидиния.
Сообщалось, что GPNAs с остовом 2-аминоэтил- D _ -аргинина имеют более сильную аффинность к ДНК и РНК, чем соответствующие GPNAs с остовом 2-аминоэтил- L _ -аргинина. (Chem. Commun. 244-246, 2005). Для 10-мер GPNA с пятью мономерами GPNA с остовом 2-аминоэтил- D _ -аргинина имелось увеличение Т. пл. на 7°С против комплементарной ДНК по сравнению с соответствующей немодифированной ПНК. (Bioorg. Med. Chem. Lett. vol.16, 4931-4935, 2006).
Сообщалось, что 16-мер антисмысловая GPNA против человеческого EGFR-TK проявляет противоопухолевую активность при перитонеальном введении бестимусным голым мышам, хотя антисмысловая активность для антисмысловой GPNA in vitro в предшествующем уровни техники не документировалась. (WO 2008/061091).
ПНК(-ы) с модифицированным нуклеиновым основанием. Для улучшения аффинности ПНК к нуклеиновым кислотам, как в случае ДНК, были осуществлены модификации нуклеиновых оснований.
ПНК(-ы) с аденином, замещенным 2,6-диаминопурином, оценивались по их аффинности к комплементарной ДНК или РНК. Установлено, что замещение 2,6-диаминопурином вызывает увеличение Т.пл. на 2,5 ~ 6°С на одно замещение. {Nucleic Acids Res. vol.25, 4639-4643, 1997).
ПНК(-ы) с цитозином, замещенным 9-(2-аминоэтокси)феноксазином, оценивались по их аффинности к комплементарной ДНК или РНК. Единственное замещение 9-(2-аминоэтокси)феноксазином вызывало увеличение Т.пл. на 10,7 ~ 23,7°С, хотя такое увеличение существенно зависело от нуклеотидной последовательности. Нуклеиновое основание 9-(2-аминопророкси)феноксазин также вызывал большое увеличение Т. пл.. В связи с огромным увеличением Т.пл., мономер ПНК с 9-(2-аминоэтокси)феноксазином или 9-(2-аминопропокси)-феноксазином, который заменил цитозин, был назван 'G-clamp' (G-зажим) (Org. Lett. vol.4, 4395-4398, 2002). Однако, о данных по клеточной пенетрации для ПНК(-т) с G-зажимом(ами)) не сообщались.
ПНК(-ы) с цитозином, замещенным 6-{2-(2-аминоэтокси)фенил}-пирролоцитозином или 6-{2,6-ди(2-аминоэтокси)фенил}пирролоцитозином, оценивались по их аффинности к комплементарной ДНК или РНК. Единственное замещение 6-{2-(2-аминоэтокси)фенил}-пирролоцитозином или 6-{2,6-ди(2-аминоэтокси)фенил}пирролоцитозином повышало Т. пл. на 3 ~ 11,5°С. (J. Am. Chem. Soc. vol.130, 12574-12575, 2008). Однако, такие ПНК(-ы) не оценивались в отношении клеточной пенетрации.
Другое применение ПНК(-т). При прочном связывании с микроРНК, ПНК может ингибировать регуляторную функцию микроРНК, приводя к увеличению уровня экспрессии белка(ов), непосредственно регулируемого(ых) микроРНК. (RNA vol.14, 336-346, 2008). При прочном связывании с рибонуклеопротеидом, как например теломеразой, ПНК может модулировать клеточную функцию рибонуклеопротеида. (Bioorg. Med. Chem. Lett. vol.9, 1273-78, 1999). При прочном связывании с определенной частью гена в ядре, ПНК может модулировать уровень транскрипции гена. (Biochemistry vol.46, 7581-89, 2007).
Поскольку ПНК прочно связывает ДНК и РНК и конкурентно распознает одно ошибочное спаривание оснований, ПНК будет пригодна для высокоточного обнаружения однонуклеотидного полиморфизма (single nucleotide polymorphism, SNP). Так как ПНК прочно связывает ДНК и РНК с высокой специфичностью, обеспечиваемой последовательностью, ПНК может найти различные другие терапевтические и диагностические приложения с участием ДНК или РНК. (FASEB vol.14, 1041-1060, 2000).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
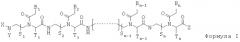
Данное изобретение предлагает новый класс олигомеров ПНК, представленных формулой I, или ее фармацевтически приемлемой соли:
где:
n - целое число, равное или большее 5;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1, и Tn независимо обозначают гидридогруппу, дейтеридогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
Х и Y независимо обозначают гидридогруппу, дейтеридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу, замещенную или незамещенную ацилгруппу, замещенную или незамещенную сульфонилгруппу или замещенную или незамещенную арилгруппу;
Z обозначает гидридогруппу, дейтеридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
B1, B2,…, Bn-1, и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и по меньшей мере одна из B1, B2,…, Bn-1 и Bn независимо обозначает неприродное нуклеиновое основание с замещенной или незамещенной аминогруппой, ковалентно связанной с остатком, ответственным за соответствующие свойства спаривания нуклеиновых оснований.
Олигомер ПНК формулы I показывает улучшенную связывающую аффинность к нуклеиновой кислоте и клеточную пенетрацию по сравнению с соответствующим «немодифицированным» олигомером ПНК. Олигомеры ПНК, описанные в изобретении, пригодны к циклу специфического ингибирования или модулирования клеточных и физиологических функций, обусловленных нуклеиновыми кислотами или физиологически активными молекулами с доменом нуклеиновой кислоты, как например рибонуклеопротеинами. Также олигомеры ПНК, описанные в данном изобретении, пригодны для диагностических целей вследствие их специфической связывающей способности к нуклеиновым кислотам.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
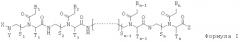
Данное изобретение предлагает новый класс олигомеров ПНК, представленных формулой I, или ее фармацевтически приемлемой соли:
где:
n - целое число, равное или большее 5;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1, и Tn независимо обозначают гидридогруппу, дейтеридогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
Х и Y независимо обозначают гидридогруппу, дейтеридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу, замещенную или незамещенную ацилгруппу, замещенную или незамещенную сульфонилгруппу или замещенную или незамещенную арилгруппу;
Z обозначает гидридогруппу, дейтеридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
B1, B2,…, Bn-1, и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
по меньшей мере одна из B1, B2,…, Bn-1 и Bn независимо обозначает неприродное нуклеиновое основание с замещенной или незамещенной аминогруппой, ковалентно связанной с остатком, ответственным за соответствующие свойства спаривания нуклеиновых оснований.
Олигомер ПНК, описанный в данном изобретении, показывает улучшенную клеточную пенетрацию и связывание с нуклеиновой кислотой по сравнению с «немодифицированным» олигомером ПНК. В данном изобретении «немодифицированный» олигомер ПНК относится к олигомеру ПНК формулы I, где S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1, и Tn представляют собой гидридогруппу; и B1, B2,…, Bn-1, и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин и цитозин.
Олигомер ПНК, описанный в данном изобретении, легко пенетрирует через мембрану клетки млекопитающего и может повлиять или изменить клеточные функции путем последовательного специфического связывания с нуклеиновой кислотой или нуклеопротеином внутри клетки.
Олигомер ПНК формулы I может эффективно ингибировать синтез рибосомных белков прочным связыванием с мРНК. Олигомер ПНК, описанный в данном изобретении, может прочно связывать пре-мРНК и изменять сплайсинг пре-мРНК в мРНК. Кроме того, олигомер ПНК, описанный в данном изобретении, может прочно связывать микроРНК и ингибировать деградацию мРНК, вызванную микроРНК.
Олигомер ПНК формулы I может предсказуемо связывать домен нуклеиновой кислоты рибонуклеопротеина, например, теломеразу, и модулировать ее физиологическую(ие) функцию(и). Олигомер ПНК, описанный в данном изобретении, может связывать ген и модулировать транскрипцию гена. Олигомер ПНК формулы I может связывать вирусный ген или его транскрипт и ингибировать пролиферацию вируса. Олигомер ПНК, описанный в данном изобретении, может повлиять на клеточные функции, отличающиеся от тех, которые описаны выше, путем последовательного специфического связывания нуклеиновой кислоты или нуклеопротеина внутри клетки млекопитающего. Кроме того, олигомер ПНК, описанный в данном изобретении, может прочно связывать бактериальную РНК, нуклеиновую кислоту или ген и ингибировать бактериальную пролиферацию или изменять профили бактериального биосинтеза.
Олигомер ПНК, описанный в данном изобретении, является весьма чувствительным к ошибочному спариванию оснований при связывании с неотъемлемой частью комплементарной ДНК, и будет пригоден для детектирования с высокой точностью однонуклеотидного полиморфизма (SNP). Олигомеры ПНК, описанные в данном изобретении, прочно связывают их комплементарные ДНК(-ы) с высокой специфичностью, обеспечиваемой последовательностью, и могут быть полезны для определения профиля гена. Олигомер ПНК формулы I может быть полезным для зондирования или обнаружения молекулы, содержащей нуклеиновую кислоту, такой как теломер внутри клетки, если метку хромофора, например флуорофора, вводили соответствующим образом. Олигомеры ПНК, описанные в данном изобретении, могут быть полезными для различных диагностических и аналитических целей, отличных от подробно описанных выше.
Олигомер ПНК, описанный в данном изобретении, обладает хорошей растворимостью в воде по сравнению с соответствующим «немодифицированным» олигомером ПНК, и может применяться в виде водного, солевого или буферного раствора. Олигомер ПНК формулы I может входить в состав с катионным липидом, например липофектамином. Олигомер ПНК, описанный в данном изобретении, может образовать дуплекс с комплементарной ДНК и полученный в результате дуплекс может входить в состав с катионным липидом.
Олигомер ПНК, описанный в данном изобретении, может входить в состав различных лекарственных форм, включая инъекционный состав, назальный спрей, таблетку, гранулы, твердую капсулу, мягкую капсулу, липосомный состав, пероральную суспензию, трансдермальный состав и т.д., но выбор ими не ограничивается.
Олигомер ПНК, описанный в данном изобретении, может вводиться субъекту в терапевтически эффективных дозах, которые будут меняться в зависимости от показаний, способа введения, режима дозирования, состояний субъекта и т.д.
Олигомер ПНК, описанный в данном изобретении, может вводиться субъекту различными способами, включая внутривенную инъекцию, подкожную инъекцию, внутрибрюшинную инъекцию, носовую ингаляцию, пероральное введение, трансдермальное применение и т.д., но выбор ими не ограничивается.
Олигомер ПНК формулы I может вводиться субъекту вместе с фармацевтически приемлемым вспомогательным веществом, включая лимонную кислоту, соляную кислоту, винную кислоту, стеариновую кислоту, полиэтиленгликоль, полипропиленгликоль, этанол, бикарбонат натрия, дистиллированную воду, гиалуроновую кислоту, катионный липид, как например липофектамин, крахмал, желатин, тальк, аскорбиновую кислоту, оливковое масло, пальмовое масло, метилцеллюлозу, окись титана, натрий карбоксиметилцеллюлозу, подсластитель, консервант и т.д., но выбор ими не ограничивается.
Олигомер ПНК, описанный в данном изобретении, в зависимости от наличия основной или кислотной функциональной группы (групп), может применяться в виде, нейтрализованном эквивалентным количеством фармацевтически приемлемой кислоты или основания, включая гидроксид натрия, гидроксид калия, соляную кислоту, метансульфоновую кислоту, лимонную кислоту и т.д., но выбор ими не ограничивается.
Предпочтительные олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 5, но меньшее или равное 30;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппы;
X и Y независимо выбраны из гидридогруппы, замещенной или незамещенной алкилгруппы, замещенной или незамещенной ацилгруппы, замещенной или незамещенной сульфонилгруппы и замещенной или незамещенной арилгруппы;
Z обозначает гидридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
B1, B2,…, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и,
по меньшей мере одна из B1, B2,…, Bn-1 и Bn независимо выбрана из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV:
где:
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы, гидридогруппы, гидроксилгруппы и замещенной или незамещенной алкилоксигруппы; и,
L1, L2 и L3 представляют собой ковалентный линкер, отвечающий формуле V, соединяющий основную аминогруппу в остаток, ответственный за свойства спаривания нуклеиновых оснований:
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу (-СН2-), и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода (-O-), атома серы (-S-) и замещенной или незамещенной аминогруппы [-N(Н)-группы или -N(заместители-группы]; и
m - целое число, равное или большее 2, но меньшее или равное 15.
Представляющие особенный интерес олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 8, но меньшее или равное 25;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппу;
Х и Y независимо выбраны из гидридогруппы, замещенной или незамещенной алкилгруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, B2,…, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере две из B1, В2,…, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы и гидридогруппы;
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу, и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода и аминогруппы; и
m - целое число, равное или большее 2, но меньшее или равное 12.
Представляющие большой интерес олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 10, но меньшее или равное 25;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппу;
X и Y независимо выбраны из гидридогруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу, алкилоксигруппу или замещенную или незамещенную аминогруппу; и
B1, B2,…, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тамин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере три из B1, В2,…, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы и гидридогруппы;
Q1 и Qm представляют собой метиленгруппу, и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из метиленгруппы, атома кислорода и аминогруппы; и
m - целое число, равное или большее 2, но меньшее или равное 10.
Представляющие более повышенный интерес олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 10, но меньшее или равное 20;
S1, S2,…, Sn-1, Sn, T1, Т2,…, Tn-1 и Tn представляют гидридогруппу;
X и Y независимо выбраны из гидридогруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2,…, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере три из B1, B2,…, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R3, и R5 представляют собой гидридогуппу, и R2, R4 и R6 независимо обозначают гидридогруппу или замещенную или незамещенную амидинилгруппу;
Q1 и Qm представляют собой метиленгруппу, и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из метиленгруппы, атома кислорода и аминогруппы; и
m - целое число, равное или большее 2, но меньшее или равное 10.
Представляющие наибольший интерес олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 10, но меньшее или равное 20;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппу;
X и Y независимо выбраны из гидридогруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2,…, Bn-1 и Bn независим