Композиции инсулинов длительного действия
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтической композиции на водной основе, содержащей 300 Ед/мл [эквимолярно 300 МЕ инсулина человека] инсулина гларгина, для лечения диабета 1 и 2 типа. Использование данных изобретений позволяет обеспечить запас базального инсулина в течение 24 часов после подкожной инъекции однократной дозы. 9 ил., 12 табл.,18 пр.
Реферат
Заявка относится к водной фармацевтической композиции, включающей в себя 200-1000 Ед/мл [эквимолярно 200-1000 МЕ инсулина человека] инсулина гларгина, при условии, что концентрация инсулина гларгина в указанной композиции не равна 684 Ед/мл, и к ее применению.
Инсулин гларгин представляет собой 31B-32B-Di-Arg инсулина человека, аналог инсулина человека, с дополнительной заменой аспарагина в положении A21 на глицин.
Лантус® представляет собой продукт инсулина, содержащий инсулин гларгин, обеспечивающий запас базального инсулина в течение 24 часов после подкожной инъекции однократной дозы.
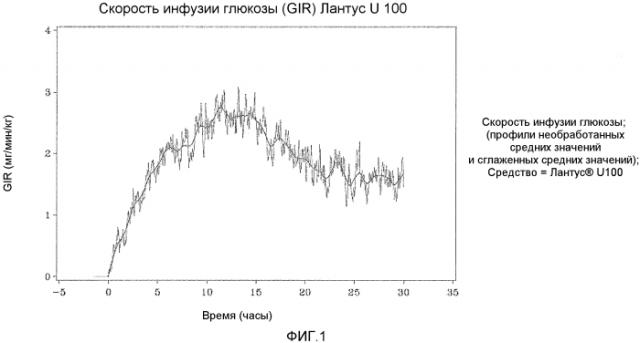
Глюкодинамический эффект Лантуса® отличается от других представленных на рынке продуктов инсулина благодаря отложенной и прогнозируемой абсорбции инсулина гларгина из области подкожной инъекции, что дает в результате сглаженную концентрацию в течение 24 часов и профиль действия без определенного пика. Лантус® был создан в соответствии с медицинской необходимостью в продукте инсулина длительного действия, который может быть введен в виде однократной дневной инъекции для предоставления нормального или близкого к нормальному контроля глюкозы крови с профилем базального инсулина, который является настолько плавным, насколько возможно, на протяжении 24-часового периода времени. Такое средство обеспечивает хороший контроль глюкозы крови на протяжении всего дня, и в то же время минимизирует склонность к возникновению гипогликемии, наблюдаемой в случае других средств инсулина с более определенным “пиковым” действием.
Значительное число пациентов, в частности пациентов с повышенной устойчивостью к инсулину вследствие ожирения, применяют большие дозы для контроля глюкозы крови. Например, доза 100 Ед требует инъекции 1 мл Лантуса® U100, которая может вызвать некоторый дискомфорт; каждый мл Лантуса® U100 содержит 100 Ед (3,6378 мг) инсулина гларгина. Для уменьшения объема инъекции была разработана композиция, содержащая 300 Ед инсулина гларгина в мл. Хотя изобретение не ограничивается композицией инсулина гларгина U300, клинические исследования, описанные здесь, осуществляли с композицией инсулина гларгина U300; каждый мл инсулина гларгина U300 содержит 300 Ед (10,9134 мг) инсулина гларгина. Указанное средство позволило бы пациентам вводить то же число единиц инсулина гларгина в одной третьей объема инъекции.
Ожидали, что оба средства инсулина гларгина, U100 и U300, обеспечат одинаковое воздействие инсулина и одинаковую эффективность, т.е. временные профили.
ПОДРОБНОЕ ОПИСАНИЕ
Воздействие и активность инсулина гларгина U300, исследуемого (T) лекарственного средства, проверяли на здоровых субъектах, не страдающих диабетом, в эугликемических клэмп-тестах на эквивалентность воздействия и активности с Лантусом U100, утвержденным эталонным (R) медицинским средствам. Для оценки долговременности действия инсулина гларгина после подкожного введения выбрали 30 часов. Воздействие оценивали исходя из профилей “концентрация инсулина гларгина - время после подкожного введения”, тогда как активность одновременно оценивали в виде утилизации глюкозы на единицу инсулина.
Дизайн эксперимента с репликами позволил ограничить число субъектов для оценки биоэквивалентности и вариабельности, как рекомендовано в руководстве FDA “Guidance for Industry, Statistical Approaches to Establishing Bioequivalence”.
Предполагали, что соответствующее клиническое исследование установит эквивалентность воздействия и активности.
Для данного исследования выбрали дозу 0,4 Ед/кг; она соответствует средней дозе базального инсулина у пациентов. У здоровых субъектов, не страдающих диабетом, указанная доза вызывает значительное увеличение концентрации инсулина в плазме крови и эффект длительного снижения уровня глюкозы, который может быть измерен количественно в условиях эугликемического клэмп-теста.
Дизайн эксперимента с репликами, одобренный в методических указаниях, требует двух повторных инъекций однократных доз каждого из двух IP (R: Лантус® U100, T: инсулин гларгин U300) в заранее заданных перекрестных последовательностях с четырьмя периодами (RTTR или TRRT), как распределено в плане рандомизации. Указанные инъекции осуществляли в Периоды (P) 1-4 в четыре разных дня. В результате каждый субъект получил две повторные однократные подкожные дозы 0,4 Ед/кг Лантуса® U100 (R) и инсулина гларгина U300 (T), которые вводили поочередно в две противоположные стороны околопупочной области.
Период вымывания от 4 до 18 дней отделял каждый день дозирования. Продолжительность периода вымывания изменялась индивидуально, что позволяло участнику исследования и исследователю согласовывать свои потребности. По опыту, 4 дня составляют минимальный период восстановления, обеспечивая проведение 1 клэмп-теста в неделю для участника, тогда как 18 дней представляют собой перерыв в 3 недели между днями проведения клэмп-теста, обеспечивая субъектам больше свободы для выполнения обязанностей, не связанных с исследованием.
Перед визитами проведения клэмп-теста, во время SCR (скрининговый визит), субъектов проверяли на соответствие требованиям исследования, и в EOS (окончание исследования) визит субъекты проходили заключительное обследование для подтверждения нормального состоянии здоровья. Скрининг и P1 разделяли не более чем 21 день, тогда как визиты EOS имели место не ранее чем в такой же день недели, как День 1 в P4, на следующей неделе, т.е. после дополнительных 4 дней, и не позднее, чем две недели после Дня 2 P4, т.е. после дополнительных 14 дней.
Данное исследование представляло собой однодозовое исследование всего с 4 повторными введениями. Эффект IP составлял по длительности приблизительно 24 часа, поэтому субъекты должны были оставаться в исследовательском центре в течение 2 дней. Субъекты получали лечение 4 раза.
Главная цель исследования заключалась в оценке средней биоэквивалентности (ABE) Лантуса® U100 (коммерческое средство) и инсулина гларгина U300 по биодоступности (воздействии) и биоэффективности (активности) с применением эугликемического клэмп-метода.
Дополнительная цель исследования заключалась в оценке безопасности и переносимости инсулина гларгина U300.
Как упоминалось выше, предполагали, что оба средства инсулина гларгина U100 и U300 обеспечивают одинаковое воздействие инсулина и одинаковую эффективность. Однако, как не удивительно, показали, что воздействие и эффективность инсулина не являются одинаковыми. Инсулин гларгин U100 и инсулин гларгин U300 не являются эквивалентными по биодоступности (воздействию) и биоэффективности (активности). Воздействие и активность после введения инсулина гларгина U300 были приблизительно на 40% меньше по сравнению с воздействием и активностью после введения такого же количества (0,4 Ед/кг) инсулина гларгина U100.
Однако инсулин гларгин U300 продемонстрировал еще более плавный профиль PK (воздействия) и PD (активности), чем инсулин гларгин U100, который был бы желателен для базального инсулина. Указанные удивительные и неожиданные различия в воздействии и активности между средствами инсулина гларгина U100 и инсулина гларгина U300 после одинаковой п/к дозы у здоровых субъектов показаны по существу на фигурах ниже. Следует отметить, что в то же время глюкоза крови оставалась постоянной.
Эффект снижения глюкозы крови инсулина гларгина дополнительно оценивали у здоровых нормогликемических собак породы бигль. При увеличении концентрации инсулина гларгина среднее время действия возрастало от 6,8 часа (U100) до 7,69 часа (U300), соответственно.
При увеличении концентрации гларгина от 100 до 300 Ед/мл у собаки профиль “время снижения глюкозы крови-действие” изменялся по направлению к более плавной и пролонгированной активности. Настоящие данные, полученные на собаках, соответствуют данным, полученным в экспериментах с участием людей, показывающим, что более высокие концентрации инсулина гларгина положительно коррелируют с профилем и с большей продолжительностью действия.
Кроме того, исследовали с помощью микроскопии осадки средств инсулина гларгина с концентрациями 100 Ед/мл, 300 Ед/мл, 500 Ед/мл 700 Ед/мл и 1000 Ед/мл. Указанные исследования выявили различия в свойствах осадков, приводящих к образованию заметно больших частиц при увеличении концентраций.
Кроме того, влияние средств с более высокими концентрациями инсулина гларгина с учетом свойств растворения исследуют с применением тестовой системы in-vitro. Для проведения указанного, исследования осадков осуществляют с применением фосфатного буфера со значением pH 7,4, воспроизводя условия in-vivo.
Супернатант осажденного инсулина исследуют с применением метода ВЭЖХ для определения содержания инсулина гларгина.
Международный патент WO2008/013938 A2 раскрывает лекарственное средство на водной основе, содержащее инсулин гларгин в концентрации 684 Ед/мл.
Хотя изобретение не ограничивается средством инсулина гларгина U300 и является эффективным с другими более концентрированными средствами инсулина гларгина, как уже указано подробно в описании, клинические исследования, описанные здесь, осуществляли со средством инсулина гларгина U300.
Средство инсулина гларгина U300, 1 мл, содержит 10,913 мг 21A-Gly-30Ba-L-Arg-30Bb-L-Arg инсулина человека [эквимолярно 300 МЕ инсулина человека], 90 мкг цинка, 2,7 мг m-крезола, 20 мг 85% глицерина, HCl и NaOH до значения pH 4,0; удельная плотность 1,006 г/мл
Однаковозможны вариации в отношении типа эксципиентов и их концентраций.
Лекарственное средство содержит 200-1000 Ед/мл инсулина гларгина [эквимолярно 200-1000 МЕ инсулина человека], где концентрация указанной композиции не равна 684 Ед/мл, предпочтительно составляет 250-500 Ед/мл инсулина гларгина [эквимолярно 250-500 МЕ инсулина человека], более предпочтительно 270-330 Ед/мл инсулина гларгина [эквимолярно 270-330 МЕ инсулина человека], и еще более предпочтительно 300 Ед/мл инсулина гларгина [эквимолярно 300 МЕ инсулина человека].
В лекарственное средство могут быть добавлены сурфактанты, например, в числе прочего, неионные сурфактанты. Особенно предпочтительны фармацевтически общепринятые сурфактанты, такие как, например:
частичные сложные эфиры и сложные эфиры жирных кислот, и простые эфиры многоатомных спиртов, таких как глицерин, сорбит и т.д. (Span®, Tween®, в частности Tween® 20 и Tween® 80, Myrj®, Brij®), Cremophor® или полоксамеры. Сурфактанты представлены в лекарственном средстве в концентрации 5-200 мкг/мл, предпочтительно 5-120 мкг/мл и особенно предпочтительно 20-75 мкг/мл.
Средство может дополнительно содержать консерванты (например, фенол, m-крезол, p-крезол, парабены), изотонические агенты (например, маннит, сорбит, лактоза, декстроза, трегалоза, хлорид натрия, глицерин), буферные вещества, соли, кислоты и щелочные металлы, а также другие эксципиенты. Указанные вещества могут быть представлены в каждом случае индивидуально или альтернативно в виде смесей.
Глицерин, декстроза, лактоза, сорбит и маннит могут быть представлены в лекарственном средстве в концентрации 100-250 мМ, NaCl в концентрации до 150 мМ, буферные вещества, такие как, например, фосфат, ацетат, цитрат, аргинин, глицилглицин или TRIS (т.е. 2-амино-2-гидроксиметил-1,3-пропандиол) буфер и соответствующие соли представлены в концентрации 5-250 мМ, предпочтительно 10-100 мМ. Дополнительные эксципиенты могут представлять собой, в числе прочего, соли или аргинин.
Концентрация цинка в средстве находится в диапазоне концентрации, который достигается присутствием 0-1000 мкг/мл, предпочтительно 20-400 мкг/мл цинка, наиболее предпочтительно 90 мкг/мл. Однако цинк может быть представлен в форме хлорида цинка, но соль не ограничивается хлоридом цинка.
В лекарственном средстве глицерин и/или маннит может быть представлен в концентрации 100-250 ммоль/л, и/или NaCl предпочтительно представлен в концентрации до 150 ммоль/л.
В лекарственном средстве буферное вещество может быть представлено в концентрации 5-250 ммоль/л.
Другим объектом изобретения является лекарственное средство инсулина, который содержит дополнительные добавки, такие как, например, соли, которые задерживают высвобождение инсулина. Смеси указанных инсулинов с отсроченным высвобождением и средств, описанных выше, включены в настоящее описание.
Другой объект изобретения относится к способу получения указанных лекарственных средств. Для получения средств ингредиенты растворяют в воде и регулируют значение pH с помощью HCl и/или NaOH. Аналогичным образом, другой объект изобретения относится к применению таких средств для лечения диабета.
Другой объект изобретения относится к применению или к добавлению сурфактантов в качестве стабилизатора во время процесса получения инсулина, аналогов инсулина или производных инсулина или их средств.
Изобретение дополнительно относится к средству, как описано выше, который дополнительно включает в себя также глюкагоноподобный пептид-1 (GLP1) или его аналог или их производные, или эксендин-3 или эксендин-4 или аналог или их производные, предпочтительно эксендин-4.
Изобретение дополнительно относится к средству, как описано выше, в котором аналог эксендина-4 выбран из группы, включающей в себя
H-desPro36-эксендин-4-Lys6-NH2,
H-des(Pro36,37)-эксендин-4-Lys4-NH2 и
H-des(Pro36,37)-эксендин-4-Lys5-NH2,
или их фармакологически переносимая соль.
Изобретение дополнительно относится к средству, как описано выше, в котором аналог эксендина-4 выбран из группы, включающей в себя
desPro36 [Asp28]эксендин-4 (1-39),
desPro36 [IsoAsp28]эксендин-4 (1-39),
desPro36 [Met(O)14, Asp28]эксендин-4 (1-39),
desPro36 [Met(O)14, IsoAsp28]эксендин-4 (1-39),
desPro36 [Trp(O2)25, Asp28]эксендин-2 (1-39),
desPro36 [Trp(O2)25, IsoAsp28]эксендин-2 (1-39),
desPro36 [Met(O)14Trp(O2)25, Asp28]эксендин-4 (1-39) и
desPro36 [Met(O)14Trp(O2)25, IsoAsp28]эксендин-4 (1-39),
или их фармакологически переносимую соль.
Изобретение дополнительно относится к средству, как описано в предыдущем параграфе, в котором пептид -Lys6-NH2 прикреплен к С-концам аналогов эксендина-4.
Изобретение дополнительно относится к средству, как описано выше, в котором аналог эксендина-4 выбран из группы, включающей в себя
H-(Lys)6- desPro36 [Asp28]эксендин-4(1-39)-Lys6-NH2
des Asp28Pro36, Pro37, Pro38 эксендин-4(1-39)-NH2,
H-(Lys)6- desPro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5 des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-NH2,
des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36 [Trp(O2)25, Asp28]эксендин-4(1-39)-Lys6-NH2,
H-des Asp28 Pro36, Pro37, Pro38 [Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
des Pro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6- des Pro36 [Met(O)14, Asp28]эксендин-4(1-39)-Lys6-NH2,
des Met(O)14Asp28 Pro 36, Pro37, Pro38 эксендин-4(1-39)-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Met(O)14, Asp28] эксендин-4(1-39)-NH2,
des Pro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-Lys6-NH2,
H-Asn-(Glu)5 des Pro36, Pro37, Pro38 [Met(O)14, Asp28] эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-Lys6-NH2,
des Asp28 Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Met(O)14, Asp28] эксендин-4(1-39)-NH2,
des Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5- des Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28] эксендин-4(1-39)-(Lys)6-NH2,
или их фармакологически переносимую соль.
Изобретение дополнительно относится к средству как описано выше, который дополнительно включает в себя Arg34, Lys26 (Nε(γ-глутамил(Nα-гексадеканоил))) GLP-1 (7-37) [лираглутид] или их фармакологически переносимую соль.
В одном воплощении настоящее изобретение относится к лекарственному средству на водной основе, содержащей инсулин гларгин в диапазоне 200-1000 Ед/мл [эквимолярно 200-1000 МЕ инсулина человека], предпочтительно 200 Ед/мл - 650 Ед/мл, еще предпочтительнее 700 Ед/мл - 1000 Ед/мл, более предпочтительно 270-330 Ед/мл и наиболее предпочтительно в концентрации 300 Ед/мл, при условии, что концентрация инсулина гларгина в указанной композиции не равна 684 Ед/мл.
Кроме того, средство также может включать в себя аналог эксендина-4, как, например, ликсисенатид, эксенатид и лираглутид. Указанные аналоги эксендина-4 представлены в средстве в диапазоне от 0,1 мкг до 10 мкг на Ед. инсулина гларгина, предпочтительно от 0,2 до 1мкг на Ед. инсулина гларгина и еще более предпочтительно от 0,25 мкг до 0,7 мкг на Ед. инсулина гларгина. Предпочтительным является ликсисенатид.
Кроме того, лекарственное средство на водной основе может содержать один или более эксципиентов, выбранных из группы, включающей в себя цинк, m-крезол, глицерин, полисорбат 20 и натрий. В частности лекарственное средство на водной основе может содержать 90 мкг/мл цинка, 2,7 мг/мл m-крезола и 20 мг/мл глицерина 85%. Дополнительно лекарственное средство на водной основе может содержать 20 мкг/мл полисорбата 20.
Значение pH лекарственного средства на водной основе составляет от 3,4 до 4,6, предпочтительно от 4 до 4,5.
Настоящее изобретение относится к способу лечения диабета I типа и II типа, включающему в себя введение водной фармацевтической композиции настоящего изобретения пациенту с диабетом. Из числа различных раскрытых диапазонов концентраций предпочтительной является концентрация 300 Ед/мл, и предпочтительным аналогом инсулина является инсулин гларгин. Дополнительно лекарственное средство на водной основе также может содержать цинк, m-крезол, глицерин, полисорбат 20 и натрий и их смеси в диапазонах, раскрытых в описании в отношении лекарственного средства на водной основе настоящего изобретения. В предпочтительном воплощении лекарственное средство на водной основе также включает в себя от 0,1 мкг до 10 мкг ликсисенатида на Ед. инсулина гларгина.
Инсулин вводят предпочтительно один раз в день, но также он может быть введен два раза в день при необходимости. Необходимые дозы являются функцией потребностей конкретного пациента, определяемых достижением нормальных или приемлемых уровней глюкозы крови.
Настоящее изобретение также относится к способу увеличения продолжительности действия инсулина гларгина в лечении диабета I типа и диабета II типа у пациента, включающему в себя введение указанному пациенту лекарственного средства на водной основе настоящего изобретения. Из числа различных раскрытых диапазонов концентраций предпочтительной является концентрация 300 Ед/мл. Дополнительно лекарственное средство на водной основе также может содержать цинк, m-крезол, глицерин, полисорбат 20 и натрий и их смеси в диапазонах, раскрытых в описании в отношении лекарственного средства на водной основе настоящего изобретения. В предпочтительном воплощении лекарственное средство на водной основе также включает в себя от 0,1 мкг до 10 мкг ликсисенатида на Ед. инсулина гларгина.
Настоящее изобретение также относится к способу уменьшения частоты возникновения гипогликемии в лечении диабета I типа и диабета II типа у пациента инсулином гларгином, включающему в себя введение указанному пациенту лекарственного средства настоящего на водной основе изобретения. Из числа различных диапазонов концентраций является концентрация 300 Ед/мл. Дополнительно лекарственное средство на водной основе также может содержать цинк, m-крезол, глицерин, полисорбат 20 и натрий и их смеси в диапазонах, раскрытых здесь в отношении лекарственного средства на водной основе настоящего изобретения. В предпочтительном воплощении лекарственное средство на водной основе также содержит от 0,1 мкг до 10 мкг ликсисенатида на Ед. инсулина гларгина.
Настоящее изобретение также относится к способу предоставления базального инсулина безпикового пролонгированного действия в лечении диабета I типа и диабета II типа у пациента инсулином гларгином, включающему в себя введение указанному пациенту лекарственного средства на водной основе настоящего изобретения. Из числа различных раскрытых диапазонов концентраций предпочтительной является концентрация 300 Ед/мл. Дополнительно лекарственное средство на водной основе также может содержать цинк, m-крезол, глицерин, полисорбат 20 и натрий и их смеси в диапазонах, раскрытых здесь в отношении лекарственного средства на водной основе настоящего изобретения. В предпочтительном воплощении лекарственное средство на водной основе также включает в себя от 0,1 мкг до 10 мкг ликсисенатида на Ед. инсулина гларгина.
Применение средства на водной основе в соответствии с любым из указанных выше пунктов в лечении диабета 1 типа и диабета 2 типа.
Дополнительно заявка описывается с помощью нескольких примеров, которые не являются ограничивающими.
Пример 1. Описание протокола
Данное исследование являлось одноцентровым рандомизированным контролируемым слепым с четырьмя периодами, с 2-мя видами лечения, с 2-мя последовательностями перекрестным исследованием на здоровых субъектах с шестью визитами:
| Визит 1: | Скрининг (SCR) |
| Визиты со 2 по 5, Период (P) 1-4: | лечение, период проведения эугликемического клэмп-теста |
| Визит 6: | Окончание исследования (EOS) |
Субъекты получали однократные подкожные дозы 0,4 Ед/кг инсулина гларгина U100 и инсулина гларгина U300, попеременно инъецируемые в две противоположные стороны околопупочной области (слева, справа, слева, справа) в четыре разных дня. Исследуемое средство вводили с повтором лечения R и T в 2 последовательностях, RTTR или TRRT в P1-P4. Период вымывания от 4 до 18 дней отделял каждый день введения доз.
| R: | инсулин гларгин U100 0,4 Ед/кг веса тела (коммерческое средство; эталонное средство) |
| T: | инсулин гларгин U300 0,4 Ед/кг веса тела (тестируемое средство) |
P1 должен иметь место не позднее чем 3-21 день после SCR. Визит EOS должен происходить между 4 и 14 днями после P4.
Во время P1-P4, субъектов подсоединяли к Биостатору для измерения глюкозы крови и регулирования скорости инфузии глюкозы. Осуществляли мониторинг уровней глюкозы крови и скорости инфузии глюкозы (GIR) в течение 90 минут (исходный период) до подкожной инъекции исследуемого средства и в течение 30 часов после введения исследуемого средства. Инициировали инфузию 20% раствора глюкозы для поддержания уровней глюкозы крови на 5% ниже индивидуального уровня глюкозы натощак, определяемого как среднее значение 3 показателей глюкозы крови натощак, измеренных за 60, 30 и 5 минут до введения исследуемого средства. Получали профили GIR. Образцы крови получали в заранее установленные моменты времени во время периода эугликемического клэмп-теста для определения сывороточных концентраций инсулина гларгина. За исключением водопроводной воды, субъекты находились в состоянии натощак во время периода поддержания фиксированной концентрации глюкозы в условиях клэмп-теста.
Предполагалось, что продолжительность настоящего исследования для субъекта составит 13 недель между SCR и визитом EOS.
Протокол исследования был предоставлен для рассмотрения и письменного утверждения независимым комитетам по этике и/или институтским наблюдательным советам. Протокол соответствовал рекомендациям 18-й Всемирной медицинской ассамблеи (Хельсинки,1964) и всех действующих изменений и дополнений. Протокол также соответствовал законам и положениям, а также существующим методическим рекомендациям Германии, где проводилось исследование. Информированное согласие получали до проведения каких-либо процедур, связанных с исследованием.
Пример 2: Отбор субъектов
Двадцать четыре (24) здоровых субъекта были запланированы для проведения лечения, чтобы получить 20 субъектов, завершивших исследование.
Субъекты, отвечавшие всем нижеследующим критериям, рассматривались для включения в исследование:
Демография
• Субъекты любого пола в возрасте от 18 до 50 лет;
• Вес тела от 50 кг до 110 кг и индекс массы тела от 18 до 28 кг/мІ;
Состояние здоровья
• Признанные здоровыми после тщательной клинической оценки (подробный анамнез и полное физическое обследование);
• Не курящие в течение по меньшей мере 3 месяцев;
• Электрокардиограмма в 12 отведениях и основные показатели жизнедеятельности, если только Исследователь рассматривает отклонение как клинически несущественное
Нормальные основные показатели жизнедеятельности после 5 минут отдыха в положении лежа на спине:
95 мм рт.ст. ≤систолическое давление крови ≤140 мм рт.ст.;
45 мм рт.ст. ≤диастолическое артериальное давление ≤90 мм рт.ст.;
40 уд/мин ≤пульс≤100 уд/мин;
Нормальная ЭКГ в 12 отведениях; 120 мс <PR<220 мс, QRS<120 мс, QTc≤430 мс
(для женщин: QTc≤450 мс);
• Лабораторные параметры в пределах диапазона нормальных значений, если только Исследователь рассматривает отклонение как клинически несущественное для здоровых субъектов; однако сывороточный креатинин и ферменты печени (AST, ALT) должны быть строго ниже верхнего предела нормальных лабораторных значений;
• Нормальный метаболический контроль, определяемый как глюкоза сыворотки крови натощак (≤100 мг/дл) и гликозилированный гемоглобин (HbA1c≤6,1%);
• Субъекты не должны принимать лекарство, отпускаемое по рецепту, на регулярной основе, в течение по меньшей мере четырех (4) недель до участия в исследовании;
Ограничения для женщин-субъектов
• Женщины-субъекты детородного возраста (определяемые как женщины в пременопаузе и не стерилизованные хирургически или в постменопаузе менее чем 2 года) и сексуально активные должны использовать адекватные методы контроля рождаемости. Адекватные методы контроля рождаемости определяют как высокоэффективный метод контрацепции (индекс Перла <1%) такой как импланты, инъекции, комбинированные противозачаточные таблетки или гормональные MED (внутриматочные средства). Женщины в постменопаузе для целей настоящего клинического испытания включают в себя: женщин с аменореей в течение 2 или более лет или хирургически стерилизованных женщин;
• Женщины-субъекты должны иметь отрицательный результат теста по моче на хорионический бета-гонадотропин (beta-HCG) во время скрининга перед исследованием и до первого клэмп-теста;
Административные положения
• Должны дать письменное информированное согласие до проведения какой-либо процедуры исследования;
• Должны покрываться системой медицинского страхования и/или в соответствии с рекомендациями действующего федерального закона применительно к биомедицинским исследованиям;
• Не должны находиться под административным или судебным надзором.
Субъекты, соответствующие любому из перечисленного ниже, не включались в исследование:
Анамнез и клинический статус
• Присутствие в анамнезе или наличие клинически значимого сердечно-сосудистого, легочного, желудочно-кишечного, печеночного, почечного, метаболического, гематологического, неврологического, психического, системного, глазного или инфекционного заболевания; любое острое инфекционное заболевание или признаки острого заболевания;
• Наличие или присутствие в анамнезе лекарственной аллергии, или аллергического заболевания, которое диагносцировал и лечил врач;
• Чрезмерное потребление напитков, содержащих ксантиновые основания (>4 чашки или стакана/день);
• Противопоказания на основании (в соответствии с диапазонами нормальных значений - если значение находится вне диапазона нормальных значений, субъект может быть включен в исследование, если исследователь расценивает данное аномальное значение как клинически несущественное):
- медицинского/хирургического анамнеза и физического обследования
- лабораторных тестов (гематологический анализ, биохимический анализ крови, и анализа мочи с помощью тестовой полоски)
- стандартной электрокардиограммы в 12 отведениях
- кровяного давления и частоты сердечных сокращений
• Текущее лечение прописанными по рецепту лекарствами или любое регулярно проводимое лечение прописанными по рецепту лекарствами в течение 4 недель до участия в исследовании.
• Симптомы клинически значимого заболевания в течение 3 месяцев до исследования, или любое заболевание главных внутренних органов в течение 4 недель до исследования, которые, по мнению Исследователя, могут препятствовать целям исследования.
• Наличие или осложнение заболеваний или других состояний, которые, как известно, могут препятствовать абсорбции, распределению, метаболизму или выведению лекарств.
• Лекарственная или алкогольная зависимость в анамнезе
• Гиперчувствительность к исследуемому средству или к лекарствам со сходной химической структурой в анамнезе
• Прогрессирующее смертельное заболевание
• Заранее запланированное хирургическое вмешательство во время исследования
• Сдача крови более чем 500 мл в течение предыдущих 3 месяцев
Не допускалось участие субъекта в исследовании более одного раза.
Общие условия
• Субъект, который, по мнению Исследователя, вероятно не будет соблюдать требования терапии во время исследования, или неконтактен ввиду языковой проблемы или слабого умственного развития или вследствие психического состояния, которое не позволяет субъекту понимать сущность, объем и возможные последствия исследования
• Субъект в период исключения предыдущего исследования, согласно применяемым положениям;
• Субъект является исследователем или младшим исследователем, научным сотрудником, фармацевтом, координатором исследования, другим сотрудником, непосредственно участвующим в осуществлении протокола;
• Получение исследуемого лекарства в течение предыдущих 30 дней до SCR.
Биологический статус
• Положительная реакция в любом из следующих тестов: HBs-антиген, анти-HCV антитела, анти-HIV1 антитела, anti-HIV2 антитела;
• Положительные результаты анализа мочи с целью выявления запрещенных средств при SCR (амфетамины/метамфетамины, барбитураты, бензодиазепины, каннабиноиды, кокаин, опиаты);
• Положительный результат пробы на алкоголь в выдыхаемом воздухе проба на алкоголь в выдыхаемом воздухе
Пример 3: Лечение
Сведения о средствах исследования
| Код лекарства: HOE901(Лантус® U100 коммерческое средство) HOE901 | (средство инсулин гларгин U300) |
| INN: | |
| Инсулин гларгин (рекомбинантый аналог инсулина человека) | Инсулин гларгин (рекомбинантый аналог инсулина человека) |
| Средство:Картриджи для 3 мл раствора | Картриджи для 3 мл раствора U300 (1 мл содержит 10,913 мг |
| U100 (1 мл содержит 3,637 мг 21A-Gly-30Ba-L-Arg-30Bb-L-Arg инсулина человека [эквимолярно 100 МЕ инсулина человека], 30 мкг цинка, 2,7 мг m-крезола, 20 мг 85% глицерина, HCl и NaOH до pH 4,0; удельная плотность 1,004 г/мл) | 21A-Gly-30Ba-L-Arg-30Bb-L-Arg инсулина человека [эквимолярно 300 МЕ инсулина человека], 90 мкг цинка, 2,7 мг m-крезола, 20 мг глицерина 85%, HCl и NaOH до pH 4,0; удельная плотность 1,006 г/мл) |
| Доза/путь введения | |
| 0,4 Ед/кг веса тела; разовая п/к инъекция в околопупочную область натощак с вечера | 0,4 Ед/кг веса тела; разовая п/к инъекция в околопупочную область натощак с вечера |
| Производитель:Sanofi-Aventis Германия GmbH | Производитель:Sanofi-Aventis Германия GmbH |
Расчет дозы для средства Лантус®/инсулин гларгин
Чтобы рассчитать количество инсулина гларгина, данное каждому субъекту (0,4 Ед/кг), вес тела (в кг) определяли до одного десятичного знака после запятой и рассчитанное количество инсулина округляли с увеличением или с уменьшением до целых чисел, как показано в следующих примерах: субъект с весом тела 75,3 кг получал 30 Ед инсулина (75,3·0,4=30,12 которые округляют с понижением до 30); субъект с весом тела 74,4 кг получал 30 Ед инсулина (74,4·0,4=29,76, которые округляют с повышением до 30). Вес тела, записанный в День 1 Периода 1, использовали для расчета дозы исследуемого средства во время Периодов 2, 3 и 4, если вес тела изменялся не более чем на 2 кг, по сравнению с Периодом 1.
Количество в единицах было одинаковым для инсулина гларгина U100 и инсулина гларгина U300. Указанная удельная плотность является одинаковой для обоих лекарственных продуктов. Однако, учитывая, что концентрация инсулина гларгина в три раза выше в инсулине гларгине U300 по сравнению с инсулином гларгином U100, объем, который нужно ввести, и, следовательно, вес составлял 1/3 для инсулина гларгина U300. Шприцы, в которых предоставляли индивидуальную дозу, готовили по весу. Вес нетто регистрировался только в исходной документации Исследователя.
Расчет и приготовление дозы инсулинов
| Таблица 1Приготовление инфузии | ||||
| Код лекарства | INN | Средство | Производитель | Доза/путь введения |
| Глюкоза | Глюкоза | 20% раствор для инфузии | Сертифици-рованный, выбранный PROFIL | в/в инфузия |
| Интрамед Гепарин натрия | Гепарин | Пузырек, содержащий 5 мл раствора (5000 МЕ/мл) | Сертифици-рованный, выбранный PROFIL | в/в инфузия |
| 0,9% Хлорид натрия | Хлорид натрия | Раствор | Сертифици-рованный, выбранный PROFIL | в/в инфузия |
Раствор глюкозы: проводили инфузию 20% раствора глюкозы с помощью Биостатора, чтобы сохранить индивидуальный уровень глюкозы у субъектов на определенном заранее заданном уровне. Через вторую инфузионную помпу (часть Биостатора) вводили 0,9% раствор хлорида натрия, чтобы иметь в распоряжении проходимый катетер. Если количество необходимого 20% раствора глюкозы превышало инфузионную пропускную способность Биостатора, вторую помпу включали для инфузии глюкозы.
Гепарин: проводили инфузию 10000 МЕ гепарина в 100 мл 0,9% раствора хлорида натрия в катетер с двойным просветом со скоростью приблизительно 2 мл/час, чтобы сохранить его в доступном состоянии для измерения глюкозы крови Биостатором.
Описание методов маскирования:
Исследование являлось простым слепым исследованием. Различные объемы инъекции препятствовали маскированию лечения. Инъекцию выполнял медицинский работник, не участвовавший иным образом в исследовании. Исследователь имел доступ к рандомизационному коду.
Способ распределения субъектов в группу лечения
Исследуемое средство вводили только субъектам, включенным в данное исследование после процедур, изложенных в протоколе клинического исследования.
Создавали схему рандомизации, которая связывала рандомизационные номера, статифицированные по полу, с последовательностями лечения двух средств Лантус®, которые вводили в виде инъекций в P1-P4.
Утром в День 1 Периода 1, как только Исследователь подтверждал, что субъекты удовлетворяют критериям, указанным в протоколе, подходящие субъекты были рандомиз