Индуктор il-12 и il-1a
Иллюстрации
Показать всеГруппа изобретений относится к области фармакологии, биологии и медицины и может быть использована для лечения заболеваний и состояний, при которых повышение уровня интерлейкина-12 и/или интерлейкина-1а в организме оказывает терапевтическое действие. Предложено применение оксиэтиламмония метилфеноксиацетата в качестве индуктора интерлейкина-12 и/или интерлейкина-1а и соответствующий способ лечения заболеваний и состояний, заключающийся в повышении уровня интерлейкина-12 и/или интерлейкина-1а. Предварительно может быть определено наличие мутаций в гене, кодирующем интерлейкин-12 и/или интерлейкин-1а. Оксиэтиламмония метилфеноксиацетат может быть применен системно или местно. Технический результат состоит в увеличении количества индукторов IL-1a и/или IL-12, в снижении побочных эффектов, усилении содействию лечению заболеваний и состояний, увеличении специфичности воздействия на причину заболевания или состояния, уменьшении вероятности получения неожиданных негативных эффектов лечения. 2 н. и 3 з.п.ф-лы, 2 ил.
Реферат
Изобретение относится к области фармакологии и биологии, медицины и может быть использовано для лечения заболеваний и состояний, при которых повышение уровня интерлейкина-12 и/или интерлейкина-1а в организме оказывает терапевтическое действие.
Соединение оксиэтиламмония метилфеноксиацетат (трис-(2-оксиэтил)аммония о-крезоксиацетат), являющееся действующим веществом препарата трекрезан (крезацин, иркутин), зарегистрированного как адаптоген широкого спектра действия [1, 2, 3, 4, 5, 6, 7, 8], а также оказывает ряд иных действий на организм [9].
Показано, что трекрезан оказывает противоинфекционное действие за счет увеличения CD 19 [10]. Известно использование препарата для лечения острого вирусного гепатита В [11], а также гепатита А и В с отягощенным профессиональным анамнезом [12], экспериментальной бронхопневмонии у крыс [13] и экспериментальной пневмонии у крыс [14], для подавления развитие герпеса [15, 16]. В составе комплексного препарата используется для лечения парвовирусного энтерита собак [17]. Является эффективным адъювантом при комплексном лечении больных туберкулезом [18]. Показано, что введение трекрезана способствует усилению на 80% фагоцитоза стафилококков, а также усиливает «окислительный взрыв» макрофагов и их поглотительную способность. Имеются данные, что применение трекрезана позволяет снизить заболеваемость ОРЗ [19].
Известно применение трекрезана как противовоспалительного агента - для лечения пародонтита [20], в составе композиций - как ранозаживляющего средства [21, 22, 23, 24], репаративного средства [25].
Трекрезан также используют в качестве иммунотропного средства [26, 27] в составе композиции - иммуностимулирующего средства [28, 29, 30, 31]. Также трекрезан известен в качестве средства, активирующего альфа- и гамма-интерфероногенез [32, 33, 34].
Известно применение трекрезана в качестве антиоксиданта [35, 36, 37, 38, 39], а также в составе препарата, повышающего репродуктивную способность [40, 41, 42].
Известно, что производные крезацина - хлоркрезацин и его аналог 2-бром-феноксиацетат трис-(2-гидрокеиэтил)аммония - бромфенацин обладают выраженной противоопухолевой активностью [43]. Известен препарат, содержащий крезацин-орто-крезоксиацетат(2-оксиэтил) аммониевую соль ортокрезоксиуксусной кислоты 16,0-16,5, антисептик-стимулятор Дорогова (фракция 2) 11,5-12,0, воду дистиллированную, который усиливает проницаемость клеточных мембран быстроразвивающихся (меристемных, раковых) клеток, что приводит к нарушению их метаболизма [44]. Крезацин может быть применен при лечении некоторых видов злокачественных новообразований [45].
Показано, что трекрезан снижает как спонтанную, так и ЛДС-индуцированную продукцию IL-1 у больных мышей [46, 47]. Было отмечено, что уменьшение секреции IL-1 под влиянием трекрезана является одной из причин устранения анемии у исследуемых животных [48]. Однако понятие «интерлейкин-1» широкое, это группа цитокинов, свойства которых различаются. В связи с этим неясно, какой именно интерлейкин-1 исследовали в вышеприведенных источниках.
Применение оксиэтиламмония метилфеноксиацетата по новому назначению стало возможным благодаря выявленным нами новым свойствам, а именно нами показано, что введение трекрезана способствует увеличению концентрации IL-12 и/или IL-1a в сыворотке, что говорит о специфичности взаимодействия с иммунной системой.
IL-1 - это гормон, секретируемый макрофагами при иммунном ответе. Как элемент защитного механизма организма против инфекций и иных форм повреждений, данный полипептид стимулирует пролиферацию и/или дифференцировку широкого спектра типов клеток, включая Т- и В-лимфоциты, клетки печени, клетки красного костного мозга, соединительной ткани, скелетных мышц, мозга и др. Данный белковый фактор регулирует множество иммунологических и неиммунологических ответов. Так, считается, что данный белок - эндогенный Или лейкоцитарный пироген, активатор В-клеток, фактор, активирующий тимоциты и эпидермальные клетки, эндогенный медиатор лейкоцитов [49], модулятор функции клеток печени - способствует увеличенному синтезу и секреции белков острой фазы, увеличенному поглощению аминокислот, железа и цинка, созреванию и высвобождению нейтрофилов из красного костного мозга и прочее [50].
В семейство IL-1, как правило, включают IL-1a, IL-1b, рецепторы IL-1 (IL-1Re) и рецепторный антагонист этого цитокина (IL-Ra). IL-1, в зависимости от формы, по-разному влияет на опухолевый рост. IL-1a усиливает сниженный противоопухолевый иммунитет, замедляет рост опухоли и снижает ее метастатический потенциал, повышает сопротивляемость бактериальной инфекции. На регенерацию тканей IL-1a не влияет. IL-1a быстро инактивируется при повышенной температуре тела. Простагландин Е2 (ПГЕ2) снижает противоопухолевый потенциал IL-1a. IL-1b, наоборот, усиливает регенерацию тканей и стимулирует у онкологических больных развитие метастазов. Это происходит потому, что IL-1b усиливает продукцию ПГЕ2, увеличивает экспрессию рецепторов маннозы на эндотелиальных клетках и продукцию фактора роста опухоли. Через 1 месяц после применения IL-1b у пациентов без метастазов отмечался рост опухолевых маркеров в 2-10 раз, а у пациентов с метастазами происходил рост опухолевых маркеров в 20-40 раз.
Показано, что эпидермис кожи и особенно роговой слой являются главным источником эндогенного интерлейкина-1а в организме человека: 1 г рогового слоя кожи содержит около 6*105 международных единиц активности интерлейкина-1а, что соответствует величине 6000 нг/г IL-1a стандарта ВОЗ, сыворотка плазмы здорового человека по данным клинических исследований содержит не более 2 пг/мл IL-1a [51], что почти в 3 миллиона раз меньше, чем количество IL-1a, постоянно производимое в эпидермисе человека. Интерлейкин 1а синтезируется в кератиноцитах постоянно, в существенных количествах, его биологическая активность не выходит за пределы кожи. При этом данная молекула регулируется аутокринно. Показано, что IL-1a воздействует на фибробласты дермы, опосредуя индукцию роста эпидермиса.
В низких концентрациях IL-1a, в основном, стимулирует продукцию нового коллагена, белка дермы, обеспечивающего механическую прочность кожи: в концентрации 1 пм стимулирует общую продукцию коллагена в 1,7 раз, а общая скорость деградации коллагена не изменяется. В высоких концентрациях IL-1a, в основном, стимулирует деградацию коллагена.
IL-1a стимулирует синтез фибробластами водорастворимого предшественника эластина, белка дермы, ответственного за упругие свойства кожи, тропоэластина [52], а также глюкозаминагликанов, в том числе гиалуроновой кислоты [53, 54].
Известно, что при повреждении кожи продукция в эпидермисе IL-1a увеличивается. Данное свойство важно для поддержания в норме барьерной функции кожи, особенно стареющей кожи. Показано, что дефицит IL-1a может приводить к возрастным нарушениям барьерной функции кожи, в частности к уменьшению ее толщины, упругости и прочности. IL-1a является ключевым конституционным фактором, инициирующим процессы обновления кожи.
Известен синтетический эквивалент человеческого IL-1a (Dermatopoietin), который используют для создания косметических и дерматологических продуктов, для уменьшения признаков старения кожи, улучшения сохранения влаги кожей, восполнения возрастной потери коллагена, эластина и гиалуроновой кислоты в дерме, а также улучшения регулярности дермы [55].
IL-1a обратимо ингибирует пролиферацию меланоцитов и активность тирозиназы, которая играет ключевую роль в образовании меланина в коже [56], при этом индуцирует экспрессию неактивного предшественника нескольких прямых активаторов меланогенеза [57], в том числе альфа-меланоцитстимулирующего гормона, который образуется под воздействием ультрафиолета и является ингибитором биологического действия IL-1a.
Известна роль IL-1a в регуляции работы волосяных фолликул. Показано, что IL-1a может ингибировать пролиферацию клеток волосяного фолликула в концентрации 10 нг/мл в течение 2-4 дней. Еще через 3 дня после остановки пролиферации клеток волосяного фолликула наблюдали ингибирование роста самого волоса. Концентрация полумаксимального ингибирования роста фолликула - 30 пг/мл [58]. Однако также показано, что в тех же концентрациях IL-1a опосредует пролиферацию и дифференциацию клеток эпителиального матрикса, рост волос и создание сети сосудов вокруг волосяных фолликул в фазе анагена (роста) цикла жизни волос [59]. IL-1a выступает отрицательным регулятором эффектов дигидротестостерона в клетках волосяного фолликула. Показано, что IL-1a защищает животных от потери волос, индуцированной химиотерапией, данный эффект также показан в нескольких моделях аллопеции [60, 61, 62, 63, 64]. В данных патологических моделях рост волос коррелировал с уровнем экспрессии IL-1a.
Известно применение синтетического аналога фитогормонов трис(2-оксиэтил) аммония О-крезоксиацетата в качестве средства для ускорения созревания зимнего волосяного покрова молодняка норок [65]. При этом препарат вводили при кормлении с кормом.
Поскольку нами показано, что трекрезан селективно индуцирует синтез интерлейкина-1а, целесообразно использовать данный препарат для достижения концентраций интерлейкина-1а, необходимых для опосредования эффектов, при местном применении (на коже) - для омоложения кожи, в сочетании с воздействием ультрафиолета - для интенсификации загара, для уменьшения роста нежелательных волос, в том числе в сочетании с их частичным Или полным удалением, преимущественно после удаления, для увеличения роста волос на определенных участках (например волосистая часть головы, линия роста ресниц, брови, для мужчин - формирование оволосения по мужскому типу), для интенсификации защитных свойств кожи, причем важно, что действие при этом будет исключительно локальным, что позволит получить эффект точно в месте применения. Использование трекрезана позволяет добиться естественного локального синтеза интерлейкина-1а, что позволяет преодолеть недостатки применения полученного иным способом непосредственно интерлейкина-1а. При системном введении достигается увеличение концентрации интерлейкина-1а в сыворотке, что можно использовать для лечения заболеваний и состояний, при которых селективное увеличение содержания данного цитокина оказывает терапевтическое действие, например для усиления ослабленного противоопухолевого иммунитета, замедления роста опухоли и снижения ее метастатического потенциала, для повышения сопротивляемости бактериальным инфекциям. Так, повышенная продукция IL-1 описана при бактериальных инфекциях, пневмокониозе, саркоидозе, туберкулезе, респираторном дистресс-синдроме. Пониженную продукцию IL-1 наблюдали у больных с респираторными вирусными инфекциями, атопиями, раком легкого [85, 86].
Данное изобретение позволит расширить спектр безопасных индукторов IL-1a и обеспечить его селективное действие.
Известно применение интерлейкина-1а, в том числе совместно с интерлейкином-12, в качестве адъюванта в композиции с антигеном, на слизистых, что позволяет вызвать иммунный ответ [66].
Интерлейкин-12 (IL-12, CLMF (cytotoxic lymphocyte maturation factor), NKSF (natural killer cell stimulatory factor), TcMF (CTL maturation factor, CLMF), TSF (T-cell stimulating factor)) представляет собой гетеродимерный цитокин, продуцируемый, в основном, активированными фагоцитирующими клетками (моноцитами, макрофагами и нейтрофилами), а также дендритными клетками [67, 68] и различными другими типами клеток (В-лимфоцитами). Наиболее мощные индукторы IL-12 - бактерии, бактериальные продукты и внутриклеточные паразиты (например лейшмании [86]). Вирус иммунодефицита человека (HIV) ингибирует синтез IL-I2, с чем связаны многие дефекты клеточной защиты при СПИДе. Селективная ингибиция синтеза IL-12, даже при сохранении продукции других провоспалительных цитокинов (IL-1, TNF-a), позволяет возбудителям длительно персистировать в организме хозяина [86]. IL-12 продуцируется после стимуляции форболовыми эфирами или кальциевыми ионофорами B-лимфобластоидных клеток человека. В литературе описан семейный генетический дефект синтеза IL-12 моноцитами крови и связанный с ним дефект синтеза IFN-γ мононуклеарами крови в ответ на индукцию ФГА. Дефект проявлялся высокой частотой развития диссеминированных инфекций, вызванных Mycobacterium avium [86].
IL-12 индуцирует продукцию цитокинов, в первую очередь IFN-гамма, NK- и Т-клетками, действует как фактор роста для активированных NK- и Т-клеток, усиливает цитотоксическую активность NK-клеток и способствует генерации цитотоксических Т-лимфоцитов. В естественных условиях IL-12 действует, прежде всего, в три этапа при инфекции: 1. В начале инфекции синтезируется IL-12 и индуцирует продукцию NK- и Т-клетками IFN-гамма, что способствует фагоцитарной активация клеток и воспалению; 2. IL-12 и IL-12-индуцированный ИФН-гамма опосредует Th1 дифференцировку праймированием CD4+ Т-клеток для высокой ИФН-гамма продукции; и 3. IL-12 способствует оптимальной продукции IFN-гамма и пролиферации дифференцированных клеток Th1 в ответ на антиген. Раннее предпочтение, выраженное в иммунном ответе, зависит от баланса между IL-12, опосредующим Th1-ответ и IL-4, опосредующим Th2-ответ. Таким образом, IL-12 представляет собой функциональный мост между ранней неспецифической врожденной резистентностью и последующим антиген-специфическим адаптивным иммунитетом [69].
Рецептор IL-12 (CD212) - белок около 110 кДа. До 1000-9000 IL-12 рецепторов на клетку с высоким сродством экспрессируются на мононуклеарных клетках периферической крови, активированных различными митогенами для Т-клеток Или IL-2.
Рецепторы IL-12 присутствуют на активированных Т-клетках, экспрессирующих CD4 и CD8 и на активированных CD56 (+) натуральных киллерах (NK). Покоящиеся мононуклеарные клетки периферической крови, В-клетки миндалин или В-клетки миндалин, активирующиеся anti-IgM/Dx, anti-IgM/Dx + IL-2 Или SAC + IL-2, не экспрессируют рецептор. Рецепторы, имеющие высокое сродство к IL-12, экспрессируются на клеточной линии NK-подобных клеток трансформированной мартышки, HVS.SILVA 40.
IL-12 стимулирует пролиферацию человеческих лимфобластов, что следует за активацией клеток фитогемагглютинином. IL-12 активирует CD56 (+) NK-клетки, и эта деятельность блокируется антителами, специфичными к TNF-alpha. IL-12 опосредует специфичные аллогенные CTL-реакции. Эффект IL-12 усиливается при использовании анти-CD3 антител и при аллогенной стимуляции в смешанных культурах лимфоцитов при индукции пролиферации Т-клеток.
В периферических лимфоцитах - Т-хелперах типа Th1 IL-12 индуцирует синтез IFN-гамма, IL-2 и TNF. TNF-альфа также, по-видимому, участвует в опосредовании эффектов IL-12 на NK-клетки, так как эффекты IL-12 блокируются антителами, специфичными к TNF-аль. IL-12 и TNF-альфа являются ко-стимуляторами продукции ИФН-гамма, причем IL-12 максимизирует ответ ИФН-гамма; синтез IL-12, TNF и IFN-гамма ингибируется IL-10. В Т-хелперах типа Th2 IL-12 снижает синтез IL-4, IL-5 и IL-10.
При взаимодействии с субоптимальными количествами IL-2 IL-12 опосредует стимулирование пролиферации мононуклеарных клеток в периферической крови и опосредует формирование лимфокинактивированных клеток-киллеров. Пикомолярные концентрации IL-12 также эффективны, как наномолярные концентрации IL-2 в увеличении цитолитической активности естественных клеток-киллеров, популяция которых растет in vivo под действием IL-2. IL-12 также выступает в качестве ко-митогена и усиливает пролиферацию покоящихся периферийных клеток, индуцированных IL-2.
IL-12, возможно, вовлечен в выбор изотипов иммуноглобулинов. В пикомолярных концентрациях IL-12 заметно ингибирует синтез IgE на мононуклеарных клетках периферической крови, стимулированных IL-4 также в присутствии антител против IFN-гамма.
IL-12 усиливает миелопоэз примитивных клеток-предшественников костного мозга, индуцированных SCF (фактором стволовых клеток) и проявляет синергизм с колониестимулирующими факторами (CSF) для индукции пролиферации. IL-12 также имеет синергетический эффект на более детерминированные клетки-предшественники костного мозга, проявляя синергизм с IL-3, IL-11 Или IL-3 плюс SCF.
Интерлейкин-12 является активатором клеточного иммунитета с противоопухолевой и антиметастатической активностью. Он усиливает активность Т-киллеров, NK-клеток. Дефицит продукции интерлейкина-12 макрофагами может значительно снижать противоопухолевую активность. Оказывает противоопухолевый эффект при раке легкого.
Известно применение интерлейкина-12 для пролиферации гемопоэтических репопулирующих клеток, гематопоэтичеких клеток-предшественников и гематопоэтичеких стволовых клеток, а также для сохранения Или восстановления красного костного мозга [70]. Известно применение интерлейкина-12 для увеличения эндогенной продукции эритропоэтина [71]. Известно применение IL-12 для уменьшения образования избыточных швов и спаек [72].
Имеются литературные данные о роли интерлейкина-12 как стимулятора репарации ДНК после различных видов повреждения, в том числе ультрафиолетовым излучением [73, 74]. Показано, что дефицит IL-12 способствует фотокарциногенезу [75]. Также известно применение интерлейкина-12 в составе композиций для лечения повреждений в организме, вызванных радиацией [76].
Известно применение фрагментов IL-12, точнее, аденовирусной конструкции, содержащей ген, кодирующий фрагмент данного цитокина, для лечения солидных опухолей [77]. Аналогичное применение описано и в международной заявке на изобретение WO 2004035799 (A3), дата приоритета 2002-10-11. Известны генетические конструкции, содержащие субъединицы данного белка, для доставки генов, кодирующих данные субъединицы, и их экспрессии в клетках млекопитающих in vivo [78]. Известен модифицированный вирус оспы Анкара, который применяют для индукции интерлейкина-12 для защиты животного от опухолевого или чужеродного антигена [79].
Известно применение IL-12 в качестве адъюванта, увеличивающего эффективность вакцины при совместном введении, в особенности, если она нацелена на индукцию клеточного иммунного ответа [80]. Адъювантное действие IL-12 также применяют при создании энергетического пищевого продукта и напитка [81]. Известно и применение IL-12 совместно с антигеном патогена у новорожденных, для привлечения Th1-подобного ответа, а также для преодоления подавления интерферона-гамма [82].
Таким образом, спектр терапевтических эффектов, наблюдаемых при увеличении количества IL-12 в организме, при заболеваниях и состояниях, широк. Благодаря способности IL-12 в небольших концентрациях заметно ингибировать синтез IgE использование селективного индуктора данного цитокина может способствовать лечению, например аллергических болезней, обусловленных IgE-антителами, атопических и анафилактических болезней, гипер-IgE-синдрома (синдрома Джоба), ослаблению реакции "трансплантат против хозяина". Благодаря противоопухолевой и антиметастатической активности IL-12 селективный индуктор данного цитокина может быть использован для лечения опухолевых заболеваний. Предлагаемый селективный индуктор IL-12 также может быть использован для усиления гемопоэза, для стимуляции репарации ДНК после различных видов повреждения, для усиления иммунного ответа на вводимый антиген. Количество индукторов данного цитокина, в особенности безопасных, немного. Селективные индукторы IL-12 неизвестны. Данное изобретение позволит расширить спектр безопасных индукторов IL-12 и обеспечить его селективное действие.
Важно учитывать, что при наличии мутаций в генах, кодирующих индуцируемые оксиэтиламмония метилфеноксиацетатом цитокины [83, 84], целесообразность использования любых индукторов данных цитокинов должна быть проанализирована для недопущения развития непредсказуемых реакций. В связи с этим перед применением оксиэтиламмония метилфеноксиацетата может быть произведено определение наличия мутаций в генах, кодирующих индуцируемые цитокины, IL-1a и/или IL-12.
Технический результат от использования оксиэтиламмония метилфеноксиацетата по новому назначению выражается, в первую очередь, в увеличении количества индукторов IL-1a и/или IL-12, что немаловажно при выявлении противопоказаний, либо побочных эффектов-аналогов у пациента. Технический результат также выражается в снижении побочных эффектов за счет того, что данный индуктор действует селективно и хорошо изучен. Технический результат также выражается в усилении содействию лечению заболеваний и состояний ввиду наличия положительного эффекта данного соединения на эмоциональный настрой.
Технический результат от использования способа лечения заболеваний и состояний, заключающегося в повышении уровня интерлейкина-12 и/или IL-1a, отличающегося тем, что в качестве индуктора используют оксиэтиламмония метилфеноксиацетат, выражается в увеличении специфичности воздействия на причину заболевания или состояния, что позволяет добиться этиотропного терапевтического действия. Технический результат от использования данного способа также выражается в уменьшении вероятности получения неожиданных негативных эффектов лечения за счет выявления аномалий в структуре гена, кодирующего индуцируемый цитокин, либо таких генов, до назначения лечения препаратом на основе данного вещества.
Технический результат применения препарата местно выражается в увеличении специфичности индукции синтеза интерлейкина-1а, что позволяет опосредовать тот Или иной эффект оксиэтиламмония метилфеноксиацетата в месте, где это требуется. Применение препарата системно позволяет увеличить содержание интерлейкина-1а и/или интерлейкина-12 в сыворотке крови, благодаря чему терапевтическое действие оказывается по иным механизмам.
Сущность изобретения
Предложено новое применение соединения оксиэтиламмония метилфеноксиацетат (oxyethylammonium methylphenoxiacetate, трис-(2-оксиэтил)аммония o-крезоксиацетат, препарат трекрезан, крезацин, иркутин) - в качестве индуктора интерлейкина-12 и/или интерлейкина-1а. Также предложен способ лечения заболеваний и состояний, заключающийся в повышении уровня интерлейкина-12 и/или интерлейкина-1а, отличающийся тем, что в качестве индуктора используют препарат оксиэтиламмония метилфеноксиацетат. Предварительно может быть определено наличие мутаций в гене, кодирующем интерлейкин-1а и/или интерлейкин-12. Для индукции интерлейкина-12 и/или интерлейкина-1а препарат оксиэтиламмония метилфеноксиацетата может быть применен системно, альтернативной формой введения для индукции исключительно интерлейкина-1а может быть местное введение.
Краткое описание чертежей
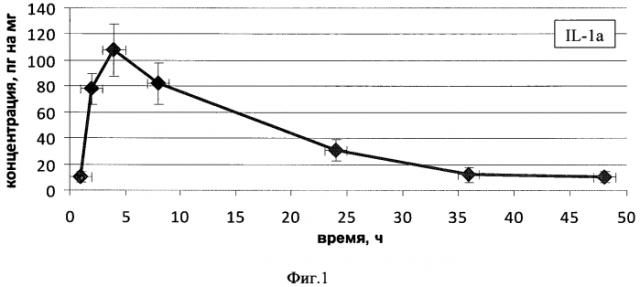
На Фиг. 1 приведен график изменения концентрации интерлейкина-1а в сыворотке крови исследуемых животных после введения препарата трекрезан.
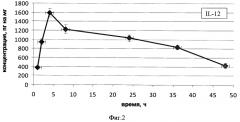
На Фиг. 2 изображен график изменения концентрации интерлейкина-12 в сыворотке крови исследуемых животных после введения препарата трекрезан.
Возможность осуществления изобретения может быть проиллюстрирована следующими примерами. Полученные результаты исследований проиллюстрированы Фиг. 1, Фиг. 2.
Пример 1. Исследование индукции цитокинов при введении оксиэтиламмония метилфеноксиацетата
Спектр индуцированных цитокинов (IL1a, IL1b, IL-2, IL-4, IL-6, IL-10, IL-12, IL-18, TNFa) изучали после введения оксиэтиламмония метилфеноксиацетата в форме препарата трекрезан в количестве 10 мг на одно животное с помощью гастрозоида раствора препарата однократно. Для эксперимента использовали мышей линии BALB/C, самок, массой 16-22 г, возраста 18 недель. В опыте было сформировано 2 группы животных, включая контрольную группу. Количество цитокинов в сыворотке определяли на 1, 2, 4, 8, 24, 36 и 48 ч после введения препарата. Параллельно изучали «фоновое» количество цитокинов, присутствующее в сыворотке исследуемых животных. Для этой цели использовали 8 мышей в качестве контрольной группы, которые получали перорально физиологический раствор. Результаты исследования представлены в таблицах 1 и 2.
Для цитокинов интерлейкин-4, интерлейкин-2 были зафиксированы значения, близкие к 0 пг/мл в течение всего исследования. Цитокины ILlb, IL-6, IL-10, IL-18 и TNFa присутствовали в количестве, достоверно не отличающемся от значений контрольной группы. Графики, описывающие динамику концентраций изучаемых цитокинов в сыворотке, представлены на Фиг. 1.
Среди исследованного спектра цитокинов, индуцированных препаратом трекрезан, зафиксирована выраженная индукция интерлейкина-1а в течение 24 ч после введения препарата и выраженная индукция интерлейкина-12 в течение 36 часов после введения препарата.
Учитывая данные по индукции IL-12 и IL-1a, отсутствие стимуляции трекрезаном синтеза таких провоспалительных цитокинов, как IL-1-b и TNF-a, указывает на специфичное взаимодействие с иммунной системой, а не формирование неспецифичных реакций на препарат.
Пример 2. Демонстрация эффекта при локальном применении оксиэтиламмония метилфеноксиацетата через индукцию IL-1a
Женщина, 25 лет, обратилась к врачу-дерматокосметологу с жалобой на тонкие ресницы и тонкие волосы на бровях. Назначено нанесение раствора оксиэтиламмония метилфеноксиацетата в концентрации 10 мг/мл на кожу локально, по линии роста волос, дважды в день в течение двух недель. По окончании курса зафиксировано улучшение состояния волос в обрабатываемых областях, их утолщение и удлинение. Побочные эффекты не обнаружены.
Пример 3. Демонстрация эффекта при системном введении оксиэтиламмония метилфеноксиацетата через индукцию IL-1a
Мужчина, 24 года, грузчик в продуктовом магазине. Заболел остро в январе, в период эпидемии гриппа. Заболевание протекало с высокой лихорадкой, кашлем, слабостью. Лечился домашними средствами, принимал парацетамол 0,5 г 3 раза в день в составе растворимых порошков, результата не было. По обращении к участковому терапевту был поставлен диагноз: грипп, среднетяжелое течение. Госпитализирован в клинику Института гриппа РАМН. При поступлении в клинику обнаружена пониженная концентрация IL-1-альфа в крови. Также были взят анализ на мутацию С(-889)Т, который показал отсутствие таковой. Назначено противовирусное лечение (ремантадин, рибавирин), а также трекрезан 0,5 г 3 раза в день, курс 7 дней. В середине курса лечения был взят анализ на IL-1-альфа повторно, который показал увеличение концентрации данного цитокина в крови. На фоне лечения больной сразу же пошел на поправку, выписан на 8-й день с диагнозом: практически здоров. По выписке в иммунологических анализах отмечено восстановление уровня IL-1-альфа в крови.
Пример 4. Демонстрация эффекта при системном введении оксиэтиламмония метилфеноксиацетата, через индукцию IL-12
Женщина, 34 года, рабочая прядильного производства. При профилактическом обследовании выявлен инфильтрат в легких. Госпитализирована с подозрением на туберкулез легких. В специализированной клинике туберкулеза выявлены положительные результаты тестов на наличие микобактерий туберкулеза. При иммунологическом обследовании выявлены пониженная концентрация IL-12 и повышенная концентрация IL-1a в крови. Больная прошла лечение фтивазидом и стрептомицином в течение месяца. Дополнительно ей назначали трекрезан по схеме: 0,5 г 2 раза в день, 1 раз в 3 дня, курс 21 день. В середине курса лечения был взят анализ на IL-12 повторно, который показал увеличение концентрации данного цитокина в крови. Выписана под наблюдение тубдиспансера с улучшением.
Пример 4. Демонстрация эффекта при системном введении оксиэтиламмония метилфеноксиацетата, через индукцию IL-1-альфа и IL-12
Мужчина, 58 лет, сварщик. Поступил в терапевтическую клинику с жалобами на сильный кашель с мокротой, повышение температуры, боли в груди. Курит с 20 лет, до 15-20 папирос в день. Поставлен диагноз: хронический бронхит в стадии обострения, признаки ХОБЛ. При обследовании в мокроте микоплазм, микобактерий не выявлено. Чувствителен к антибиотикам группы пенициллина. В крови - нормальный уровень IL-1-альфа и IL-12. Произведен забор генетического материала с последующим выявлением точечных мутаций в генах, кодирующих вышеуказанные цитокины, в лаборатории, с использованием праймеров, специфичных к фрагментам, которые могут содержать мутации. Информация о возможных мутациях взята из базы данных мутаций генов человека http://www.hgmd.cf.ac.uk/ac/index.php. Мутации не выявлены. Проведено лечение амоксиклавом, отхаркивающими (бромгексин) и трекрезаном по 1,0 г 2 раза через день в течение 10 дней. В середине курса лечения был взят анализ на IL-1-альфа и IL-12 повторно, который показал увеличение концентрации данных цитокинов в крови.
Выписан в удовлетворительном состоянии на 12-й день. При выписке в крови тенденция к снижению уровней IL-12 и IL-1-альфа.
Список литературы
1. ПРИКАЗ МИНЗДРАВМЕДПРОМА РФ ОТ 26.07.94 N 151 О РАЗРЕШЕНИИ К МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ
2. М.Г. Воронков, М.М. Расулов «Трекрезан - родоначальник нового класса адаптогенов и иммуномодуляторов (обзор)» // Химико-фармацевтический журнал, 2007. - №1. - С. 3-7. - Библиогр.: с. 6-7 (56 назв.)
3. RU 2098088 (C1), дата приоритета 10.12.1997
4. RU 2063749 (C1), дата приоритета 20.07.1996
5. RU 94006580 A1, дата публикации заявки - 20.03.1997
6. RU 2394018 C2, дата приоритета 25.07.2008
7. RU 2074171 C1, дата публикации заявки - 27.02.1997
8. RU 2268879 C1, дата приоритета 12.05.2004
9. М.Г. Воронков, А.П. Дыбан, В.М. Дьяков. Н.Л. Симбирцев. Применение трекрезана для повышения репродуктивной способности млекопитающих и жизнеспособности их потомства» // Доклады академии наук, 1999, Том 364, №5, с. 703-707
10. RU 2156088 (C1), дата приоритета 20.09.2000
11. RU 2099051 (C1), дата приоритета 20.12.1997
12. Колесникова О.П., Воронков М.Г., Расулов М.М., Мирскова А.Н. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА И КЛИНИЧЕСКИЕ ЭФФЕКТЫ ТРЕКРЕЗАНА. Химико-фармацевтический журнал, 2007. - N 5. - С. 13-17. Библ. 21 назв.
13. Zarubina IV1, Bolekhan AV, Shabanov PD, Efficiency of trekrezan in experimental bronchopneumonia in rats. Eksp Klin Farmakol. 2006 Sep-Oct; 69 (5): 50-4
14. Зарубина И.В., Болехан А.В., Шабанов П.Д. Патогенетические механизмы и пути фармакологической коррекции пневмоний // ПФБН. 2006. №1-2
15. RU 2353354 C1, дата приоритета 31.08.2007
16. «КЛИНИЧЕСКИЕ ИСПЫТАНИЯ ТРЕКРЕЗАНА» (из брошюры Ю. Ефремова)
17. RU 2220717 C2, дата приоритета 04.10.2001
18. Колесникова О.П., Воронков М.Г., Расулов М.М., Мирскова А.Н. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА И КЛИНИЧЕСКИЕ ЭФФЕКТЫ
ТРЕКРЕЗАНА. Химико-фармацевтический журнал, 2007. - N 5. - С. 13-17. Библ. 21 назв.
19. В.В. Буланова. Коррекция препаратом трекрезан иммунного и соматического статусов девушек. Автореферат и диссертация по медицине (14.03.06), Москва, 2010 г.
20. RU 2306131 (C1), дата приоритета 20.09.2007
21. RU 2367455 C2, дата приоритета 23.05.2007
22. RU 2367456 C2, дата приоритета 23.05.2007
23. RU 2367469 C2, дата приоритета 23.05.2007
24. RU 2367457 C2, дата приоритета 23.05.2007
25. RU 2401104 C2, дата приоритета 04.12.2008
26. RU 2099051 (C1), дата приоритета 20.12.1997
27. RU 2098088 (C1), дата приоритета 10.12.1997
28. RU 2228190 (C1), дата приоритета 10.05.2004
29. RU 2401104 C2, дата приоритета 04.12.2008
30. RU 2414221 (C2), дата приоритета 04.12.2008
31. RU 2404773 C2, дата приоритета 04.12.2008
32. [EAA] 200900805, дата приоритета 2009 06 08
33. RU 2353354 C1, дата приоритета 31.08.2007
34. Шабанов П.Д., Зарубина И.В., Болехан А.В., Рылеев А.Ю., Жумашева А.Б., Цыган В.Н. Иммуномодулятор Трекрезан: профиль общей и иммунотропной активности. // Русский медицинский журнал, 2005. т. №20. - С. 1361
5. RU 2352330 C1, дата приоритета 31.08.2007
36. RU 2348400 (C1), дата приоритета 31.08.2007
37. RU 2353354 C1, дата приоритета 31.08.2007
38. RU 2352330 C1, дата приоритета 31.08.2007
39. RU 2351322 C1, дата приоритета 31.08.2007
40. SU 704618 A1, Опубликовано: 25.12.1979
41. RU 2381693 C1, дата приоритета 21.05.2007
42. RU 2374900 C2, дата приоритета 21.05.2007
43. RU 2427568 C2, дата приоритета 17.11.2009
44. RU 2282973 C2, дата приоритета 14.10.2004
45. RU 2074171 C1, опубликовано: 27.02.1997
46. Kolesnikova OP1, Kudaeva ОТ, Sukhenko TG, Limonov VL, Kozlov VA, Mirskova AN, Voronkov MG. Trekrezan as a modulator of hemato- and immunopoieses. Dokl Biol Sci. 2003 Jul-Aug; 391: 306-8
47. Т.Г. Сухенко, О.П. Колесникова, В.А. Козлов. ИММУНОПОЭЗМОДУЛИРУЮЩИЕ И ЭРИТРОПОЭЗМОДУЛИРУЮЩИЕ СВОЙСТВА ТРЕКРЕЗАНА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ИММУНОДЕФИЦИТЕ. №4 (2001) НЕЙРОФАРМАКОЛОГИЯ
48. Voronkov MG1, Nurbekov МК, Bobkova SN, Karaulova LK, Susova MI, Rasulov MM. Antisclerotic effect of Trekrezan and its possible mechanisms. Dokl Biochem Biophys. 2010 Mar-Apr; 431: 73-5
49. NZ 212173 (A), дата приоритета 1985-01-17
50. US 6268180 (B1), дата приоритета 19850425
51. Barahmani N, Lopez A, Babu D, Hernandez M, Donley SE, Duvic M. Serum T helper 1 cytokine levels are greater in patients with alopecia areata regardless of severity or atopy. Clin Exp Dermatol. 2010 Jun; 35(4): 409-16. doi: 10.1111/j.1365-2230.2009.03523.x. Epub 2009 Oct 23
52. Wood LC, Jackson SM, Elias PM, Grunfeld C, Feingold KR. Cutaneous barrier perturbation stimulates cytokine production in the epidermis of mice. J Clin Invest. 1992 Aug; 90 (2): 482-7.
53. Duncan MR, Berman B. Differential regulation of collagen, glycosaminoglycan, fibronectin, and collagenase activity production in cultured human adult dermal fibroblasts by interleukin 1-alpha and beta and tumor necrosis factor-alpha and beta. J Invest Dermatol. 1989 May; 92(5): 699-706
54. Postlethwaite AE1, Smith GN Jr, Lachman LB, Endres RO, Poppleton HM, Hasty KA, Seyer JM, Kang AH. Stimulation of glycosaminoglycan synthesis in cultured human dermal fibroblasts by interleukin 1. Induction of hyaluronic acid synthesis by natural and recombinant interleukin 1a and synthetic interleukin 1 beta peptide 163-171. J Clin Invest. 1989 Feb; 83(2): 629-36
55. Шох П., Помыткин И..Интерлейкин-1а, эпидермальный цитокин, регулятор процессов формирования и функционирования кожи. Миниобзор.
56. Swope VB, Abdel-Malek Z, Kassem LM, Nordlund JJ. Interleukins 1 alpha and 6 and tumor necrosis factor-alpha are paracrine inhibitors of human melanocyte proliferation and melanogenesis. J Invest Dermatol. 1991 Feb; 96(2): 180-5.
57. Wintzen M1, Yaar M, Burbach JP, Gilchrest BA. Proopiomelanocortin gene product regulation in keratinocytes. J Invest Dermatol. 1996 Apr; 106(4): 673-8
58. Harmon CS1, Nevins TD. IL-1 alpha inhibits human hair follicle growth and hair fiber production in whole-organ cultures. Lymphokine Cytokine Res. 1993 Aug; 12(4): 197-203.
59. Boivin WA1, Jiang H, Utting OB, Hunt DW. Influence of interleukin-1 alpha on androgen receptor expression and cytokine secretion by cultured human dermal papilla cells. Exp Dermatol. 2006 Oct; 15(10): 784-93.
60. Hussein AM. Interleukin 1 protects against 1-beta-D-arabinofuranosylcytosine-induced alopecia in the newborn rat animal model. Cancer Res. 1991 Jun 15; 51(12): 3329-30.
61. Hussein AM1, Jimenez JJ, McCall CA, Yunis AA. Protection from chemotherapy-induced alopecia in a rat model. Science. 1990 Sep 28; 249(4976): 1564-6.
62. Jimenez JJ1, Wong GH, Yunis AA. Interleukin 1 protects from cytosine arabinoside-induced alopecia in the rat model. FASEB J. 1991 Jul; 5(10): 2456-8.
63. Tang L1, Cao L, Pelech S, Lui H, Shapiro J. Cytokines and signal transduction pathways mediated by anthralin in alopecia areata-affected Dundee experimental balding rats. J Investig Dermatol Symp Proc. 2003 Jun; 8(1): 87-90.
64. Sredni B, Xu RH, Albeck M, Gafter U, Gal R, Shani A, Tichler T, Shapira J, Bruderman I, Catane R, Kaufman B, Whisnant JK, Mettinger KL, Kalechman Y. The protective role of the immunomodulator AS 101 against chemotherapy-induced alopecia studies on human and animal models. Int J Cancer. 1996 Jan 3; 65(1): 97-103.
65. SU 1212405, дата приоритета 05.07.1983
66. US 7041294 (B2), дата приоритета 19981008
67. Hsieh CS, Macatonia SE, O′Garra A, Murphy KM. Pathogen-induced Th1 phenotype development in CD4+ alpha beta-TCR transgenic T cells is macrophage dependent. Int Immunol. 1993 Apr; 5(4): 371-82, 1993
68. Chan CW, Crafton E, Fan HN, Flook J, Yoshimura K, Skarica M, Brockstedt D, Dubensky TW, Stins MF, Lanier LL, Pardoll DM, Housseau F.. Interferon-producing killer dendritic cells provide a link between innate and adaptive immunity. Nat Med. 2006 Feb; 12 (2): 207-13. Epub 2006 Jan 29
69. Trinchieri G. Interleukin-12: a proinflammatory cytokine with immunoregulatory functions that bridge innate resistance and antigen-specific adaptive immunity. Annu Rev Immunol. 1995; 13: 251-76
70. JP 2012025765, дата приоритета 20030703
71. CA 2843014 (A1), дата приоритета 20110727
72. US 6638949 (B1), дата приоритета 19970825
73. Beissert S, Ruhlemann D, Mohammad T, Grabbe S, El-Ghorr A, Norval M, Morrison H, Granstein RD, Schwarz T. IL-12 prevents the inhibitory effects of cis-urocanic acid on tumor antigen presentation by Langerhans cells: implications for photocarcinogenesis. J Immunol. 2001 Dec 1; 167(11): 6232-8;
74. Schwarz T, Schwarz A. DNA repair and cytokine responses. J Investig Dermatol Symp Proc. 2009 Aug; 14(1): 63-6. doi: 10.1038/jidsymp.2009.3. Review.
75. Maeda A, Schneider SW, Kojima M, Beissert S, Schwarz T, Schwarz A. Enhanced photocarcinogenesis in interleukin-12-deficient mice. Cancer Res. 2006 Mar 15; 66(6): 2962-9.
76. WO 2013154647 (A2), дата приоритета 20120118
77. WO 2012116636 (A1), дата приоритета 20130902
78. EP 0963207 (A1), дата приоритета 19960605
79. EP 2204179 (A2), дата приоритета 20020419
80. WO 2008070647 (A1), дата приоритета 20061207
81. JP 2007131568 (A), дата приоритета 2005-11-09
82. CA 2322336 (A1), дата приоритета 19980305
83. Lu D, Chen L, Shi X, Zhang X, Ling X, Chen X, Xie L, Jiang L, Ding L, He Y, Zhang X. A functional polymorphism in interleukin-1α (ILIA) gene is associated with risk of alopecia areata in Chinese populations. Gene. 2013 Jun 1; 521(2): 282-6. doi: 10.1016/j.gene.2013.02.048. Epub 2013 Mar 28.
84. Saxena Rl, Chawla YK, Verma I, Kaur J. Effect of IL-12B, IL-2, TGF-β1, and IL-4 polymorphism and expression on hepatitis В progression. J Interferon Cytokine Res. 2014 Feb; 34(2): 117-28. doi: 10.1089/jir.2013.0043. Epub 2013 Oct 26.
85. Dinarello C, Wolff S. The role of interleukin-1 in disease // N. Engl. J. Med., 1993, v. 328, P. 106-115
86. Фрейдлин И.С.Иммунная система и ее дефекты: Руководство для врачей. СПб., 1998. - 113 с. - ISBN 5-230-08852-4.
1. Применение оксиэтиламмония метилфеноксиацетата в качестве индуктора интерлейкина-12 и/или интерлейкина-1-альфа.
2. Способ лечения заболеваний и состояний, заключающийся в повышении уровня интерлейкина-12 и/или интерлейкина-1-альфа, отличающийся тем, что в качестве индуктора используют препарат оксиэтиламмония метилфеноксиацетата.
3. Способ по п. 2, характеризующийся тем, что предварительно определяют наличие мутаций в гене, кодирующем интерлейкин-12 и/или интерлейкин-1 альфа.
4. Способ по п. 2 или 3, характеризующийся тем, что оксиэтиламмония метилфеноксиацетат применяют системно.
5. Способ по п. 2 или 3, характеризующийся тем, что оксиэтиламмония метилфеноксиацетат применяют местно для индукции исключительно интерлейкина-1-альфа.