Мутеины липокалина 2 человека (lcn2, hngal) с аффинностью для определенной мишени
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения мутеинов липокалина 2 (Lcn2, hNGAL) человека. Способ основан на мутагенезе молекулы нуклеиновой кислоты, кодирующей белок Lcn2 человека. При этом мутагенезу подвергают по меньшей мере нуклеотидный триплет, кодирующий положение 96 в линейной полипептидной последовательности Lcn2 человека. Также заявлены мутеины, полученные указанным способом, которые связываются с заранее определенной мишенью с обнаруживаемой аффинностью, где указанная мишень не связывается с природным hGAL при физиологических условиях. Изобретение также относится к молекулам нуклеиновой кислоты, кодирующим такие мутеины, клетке-хозяину, а также к диагностическому и аналитическому наборам, включающим мутеины по изобретению. 7 н. и 13 з. п. ф-лы, 28 ил., 3 табл., 24 пр.
Реферат
Сущность изобретения
Настоящее изобретение относится к новой библиотеке для получения мутеинов и к новым мутеинам, полученным из липокалина 2 человека (Lcn2, hNGAL), и близким белкам, которые связываются с определенной мишенью с обнаруживаемой аффинностью. Изобретение также относится к соответствующим молекулам нуклеиновой кислоты, кодирующим такой мутеин и способу их получения. Изобретение также относится к способу получения такого мутеина. Кроме того, изобретение относится к фармацевтической композиции, содержащей такой мутеин липокалина, а также к различным применениям мутеина.
Мутеины Lcn2 по настоящему изобретению демонстрируют возможность использования в качестве лекарственных и/или диагностических средств для некоторых заболеваний. Например, они могут использоваться для связывания и истощения патологических форм природных биологических молекул, таких как бета-амилоидный пептид при болезни Альцгеймера. В другом примере их можно использовать для специфической направленной доставки различных меток или токсинов к связанным с заболеванием клеточным поверхностным маркерам, таким как экстрадомен В фибронектина, который связан с неоваскуляризацией опухоли. За счет определенных положительных эффектов мутеинов Lcn2, которые можно получить по настоящему изобретению, возможны различные другие применения или примеры.
Уровень техники
Болезнь Альцгеймера (AD) является наиболее частой формой деменции у пожилых людей. Нарушенный процессинг предшественника амилоидного белка связан с AD, приводя к образованию потенциально нейротоксического белка, содержащего остатки 40-42 бета-амилоидного пептида (Aβ). Последующая агрегация Aβ в олигомеры и длинные фибриллы играет ключевую роль в развитии болезни, завершаясь образованием старческих бляшек (Haass and Selkoe, Nat. Rev. Mol. Cell Biol. (2007) 8, 101-112). Несмотря на возрастающее значение AD, по-прежнему имеется нерешенная потребность в эффективных лекарственных средствах для профилактики, лечения или замедления данной деменции.
Существующие в настоящее время подходы, направленные против амилоида, нацелены на: (i) профилактику образования Aβ; (ii) блокирование его агрегации; (iii) снижение уровня растворимого Aβ в мозге и (iv) разрушение имеющихся амилоидных бляшек. До настоящего времени иммунотерапия, включающая активную и пассивную иммунизацию пациентов с AD, была наиболее перспективной в данной области (Dodel et al. (2003) Lancet Neurology, 2, 215-220; Lichtlen and Mohajeri (2007) J. Neurochem., 104, 859-874; Brody and Holtzmann (2008) Annu. Rev. Neurosci., 31, 175-193). Однако недавние клинические испытания активной иммунизации пациентов с AD были приостановлены в результате повышенной частоты возникновения менингоэнцефалита у 6% пациентов. За счет этих возможных побочных эффектов Fc-опосредованных иммунологических функций, не связывающиеся с Ig соединения, такие как антикалины, обеспечивают альтернативу. Обнаружение молекулы аффитела со специфичностью к бета-амилоиду является одним примером потенциальных свойств инженерных белков, не связывающихся с Ig (Gronwall et al. (2007) J. Biotechnol., 128, 162-183; Hoyer et al. (2008) Proc. Natl. Acad. Sci. USA, 105, 5099-5104).
Однако бактериальная природа аффител может быть нежелательна в связи с иммуногенностью у пациента-человека.
Фибронектин (FN) играет важную роль в адгезии, миграции, пролиферации и дифференцировке клеток. FN представляет собой крупный, модульный, димерный гликопротеин, содержащий многочисленные домены типа I, II и III. Альтернативные сплайсированные варианты FN, такие как его экстрадомен В (ED-B), который находится между доменами FNIII7 и FNIII8, экспрессируются со специфичным для ткани и стадии развития характером (Zardi et al. (1987) EMBO J., 6, 2337-2342).
ED-B отсутствует в тканях здоровых взрослых людей, за исключением заживления ран и неопластической васкуляризации. Следовательно, ED-B-содержащий фибронектин экспрессируется на высоком уровне во многих типах опухолей, в которых происходит неоваскуляризация и проходит аномальный ангиогенез. Несмотря на то, что фактическая биологическая роль ED-B в ангиогенезе остается неясной, его присутствие в FN служит превосходным маркером опухолегенеза. В целом, отличие между злокачественными тканями и здоровыми органами является преимущественной терапевтической стратегией избирательной направленной доставки лекарственных препаратов непосредственно в опухолевую ткань, что приводит к повышенной местной концентрации препарата.
Для специфического обнаружения и направленной доставки к ED-B были получены рекомбинантные фрагменты антител с использованием технологии фагового дисплея антител. Одни фрагменты выделенных антител представляют одноцепочечные Fv L19 (Carnemolla et al. (1996) Int. J. Cancer, 68, 397-405; Ebbinghaus et al. (2004) Curr. Pharm. Des., 10, 1537-1549). В настоящее время направление L19 к ED-B в комбинации с эффективным цитотоксическим препаратом является перспективной возможностью для лечения и диагностики рака (Schliemann and Neri (2007) Biochim. Biophys. Acta, 1776, 175-192; Kaspar et al. (2006) Int. J. Cancer, 118, 1331-1339).
Однако фрагмент scFv L19 склонен к олигомеризации.
В результате вышеуказанных существующих проблем для лечения болезни Альцгеймера и диагностики или терапии опухолей целью настоящего изобретения является обеспечение способов и соединений, которые можно использовать для лечения болезни Альцгеймера, а также в диагностике и терапии опухолей.
Подробное описание изобретения
Заявители обнаружили, что специфические мутеины белков, полученные из липокалина 2, являются привлекающими внимание соединениями за счет их более высокой стабильности и меньшего размера. Заявители идентифицировали определенную группу мутеинов липокалина 2 с мутациями в определенных положениях, которые обладают высокой аффинностью и специфичностью, например, к ED-B. Такие мутеины Lcn2 специфически распознают фибронектин, содержащий ED-B, на клетках человека с высокой чувствительностью и, таким образом, являются перспективными для применения в качестве лекарственных средств для диагностики и лечения опухолевых заболеваний.
Заявители также смогли идентифицировать определенные мутеины Lcn2c с высокой аффинностью и специфичностью для Aβ пептида. Такие мутеины Lcn2 могут даже ингибировать агрегацию Aβ и, таким образом, являются перспективными, возможно после дальнейшего усовершенствования и модификации, в качестве лекарственных средств для лечения AD.
Кроме того, настоящее изобретение также относится к новым рандомизированным библиотекам, основанным на скэффолде Lcn2 человека, которые позволят эффективно получать мутеины, такие как мутеины по настоящему изобретению, с высокой аффинностью и специфичностью для определенной мишени в общем. Примеры таких библиотек или их разделов показаны на фигурах 1 и 2.
В одном из аспектов, по меньшей мере в 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 нуклеотидных триплетах, кодирующих любое из положений последовательности 36, 40, 41, 49, 52, 68, 70, 72, 73, 77, 79, 81, 96, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности hLcn2, проводили случайный мутагенез заменой в данных положениях группой нуклеотидных триплетов. Группа нуклеотидных триплетов может относиться, не ограничиваясь этим, (a) к менее чем 64 возможным триплетам, кодированных нуклеотидами NNN (если N=A, T, G, C, что означает 4×4×4=64 возможных триплетов), (b) к менее чем 32 возможным триплетам, кодированных нуклеотидами NNK или NNS, (с) к менее чем необходимым триплетам для кодирования всех 20 природных протеиногенных аминокислот. В еще одном варианте осуществления нуклеотидные триплеты, кодирующие цистеин, не используются для замены во время мутагенеза. Это означает, что мутагенез не приводит к образованию мутеинов, содержащих новые цистеины, помимо тех цистеинов, которые уже входили в исходную, не мутагенизированную последовательность. Таким образом, в данном аспекте определяется, каким образом нуклеотидные триплеты выглядят, когда не введены в положения, которые подвергаются мутагенезу, как определено в данном разделе (см. пример 1 и фигуру 2).
Таким образом, в первом аспекте настоящее изобретение относится к способу получения мутеина, полученного из липокалина 2 человека (Lcn2; также известного как липокалин, связанный с желатиназой нейтрофилов, hNGAL, или как сидерокалин). Мутеины, полученные с использованием этого способа, могут связываться с неприродной мишенью с обнаруживаемой аффинностью. Способ включает проведение мутагенеза молекулы нуклеиновой кислоты, кодирующей липокалин 2 (Lcn2, hNGAL) человека, в нуклеотидном триплете, кодирующем по меньшей мере одно из положений в последовательности, соответствующих положениям 96, 100 и 106 линейной последовательности полипептида липокалина 2 человека, с получением одной или более молекул нуклеиновой кислоты мутеинов.
Согласно вышеуказанному термин «липокалин 2 человека» или «липокалин, связанный с желатиназой нейтрофилов (hNGAL)» включает структурные гомологи, уже идентифицированные или которые будут выделены, от других видов, которые обладают гомологией аминокислотных последовательностей или идентичностью последовательностей более чем примерно на 60%. Предпочтительно, чтобы данные липокалины человека, описанные выше, содержали 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16 или 17 мутированных аминокислотных остатков в любом из положений последовательности, соответствующих положениям последовательности 33, 36, 40, 41, 42, 43, 44, 46, 47, 48, 49, 50, 51, 52, 54, 55, 59, 65, 68, 70, 72, 73, 75, 77, 78, 79, 80, 81, 86, 87, 98, 96, 99, 100, 103, 106, 107, 110, 111, 125, 127, 132, 134, 136 и 138 линейной полипептидной последовательности hNGAL. В том смысле, в котором в настоящем документе используется термин «гомология» в его обычном понимании, то он включает идентичные аминокислоты, а также аминокислоты, которые относятся к консервативным заменам (например, замене остатка глютамина на остаток аспартата) в эквивалентных положениях в линейной аминокислотной последовательности двух белков, которые сравниваются друг с другом. В том смысле, в котором в настоящем изобретении используется термин «идентичность последовательностей» или «идентичность», он означает процент парных идентичных остатков - после выравнивания по гомологии последовательности полипептида по настоящему изобретению с интересующей последовательностью - по числу остатков в более длинной из данных двух последовательностей.
Процент гомологии последовательностей или идентичность последовательностей определяется в настоящем документе с использованием программы BLASTP, версия blastp 2.2.5 (16 ноября, 2002; см. Altschul S.F. et al. (1997) Nucl. Acids Res., 25, 3389-3402). Процент гомологии основан на выравнивании полных полипептидных последовательностей (матрица: BLOSUM 62; цены гэпов: 11,1; значение порога установлено на 10-3), включая пропептидные последовательности с использованием липокалина 2 человека в качестве стандарта при парном сравнении. Ее рассчитывают в виде процента числа «позитивов» (гомологичных аминокислот), указанных результатом программы BLASTP, деленное на общее число аминокислот, выбранных программой при выравнивании. В данной связи следует отметить, что общее число выбранных аминокислот может отличаться от длины липокалина 2 человека.
В случае иного белка, чем липокалин 2 человека, используемого в настоящем изобретении, определение мутированных положений последовательности, данное для липокалина 2 человека, можно отнести к другому липокалину с помощью опубликованных выравниваний последовательностей или способов выравнивания, известных специалистам в данной области. Выравнивание последовательностей можно проводить, например, как описано в международной заявке WO 99/16873 (см. фигуру 3 в настоящем документе) с использованием опубликованного выравнивания, такого как приведено на фигуре 1 у Redl. B. (2000) Biochim. Biophys. Acta, 1482, 241-248. Если имеется трехмерная структура липокалинов, то можно использовать структурное наложение для определения положений последовательности, которые должны подвергнуться мутагенезу в настоящем изобретении. Также для данной цели можно использовать другие способы структурного анализа, такие как мультимерная магнитно-резонансная спектроскопия.
Гомолог липокалина 2 человека может также представлять собой белок-мутеин самого липокалина 2 человека, в котором аминокислотные замены вводят в положения, иные чем положения, выбранные в настоящем изобретении. Например, такой мутеин может представлять белок, в котором мутированы положения в подвергаемых воздействию растворителя β-складках, по сравнению с последовательностью дикого типа липокалина 2 человека для повышения растворимости или стабильности белка.
В общем, термин «липокалин 2 человека» включает все белки, обладающие гомологией последовательностей или идентичностью последовательностей более чем на 60, 70, 80, 85, 90 или 95% по отношению к липокалину 2 человека. Предпочтительно, чтобы данные липокалины человека, описанные выше, содержали 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16 или 17 мутированных аминокислотных остатков в любом из положений последовательности, соответствующих положениям последовательности 33, 36, 40, 41, 42, 43, 44, 46, 47, 48, 49, 50, 51, 52, 54, 55, 59, 65, 68, 70, 72, 73, 75, 77, 78, 79, 80, 81, 86, 87, 98, 96, 99, 100, 103, 106, 107, 110, 111, 125, 127, 132, 134, 136 и 138 линейной полипептидной последовательности hNGAL.
Таким образом, в дополнительном аспекте настоящее изобретение относится к мутеину, полученному из липокалина 2 человека (т.е. мутеину липокалина человека или мутированному липокалину человека, предпочтительно, мутированному зрелому hNGAL, где указанный зрелый hNGAL имеет инвентарный номер P80188 в SWISS-PROT Data Bank, более предпочтительно, указанный зрелый hNGAL имеет аминокислотную последовательность SEQ ID NO:44). Этот мутеин включает по меньшей мере один или два мутированных аминокислотных остатка в любом из положений последовательности, соответствующих положениям последовательности 96, 100 и 106 линейной полипептидной последовательности Lcn2 человека, и где мутеин связывается с определенной неприродной мишенью с обнаруживаемой аффинностью.
В том смысле, в котором в настоящем документе используются термины «мутеин», «мутированная» молекула (белка или нуклеиновой кислоты) или «мутант», они относятся к замене, делеции или инсерции соответственно одного или более нуклеотидов или аминокислот по сравнению с встречающимся в природе (дикого типа) нуклеиновокислотным или белковым «стандартным» скэффолдам. Предпочтительно, число соответственно нуклеотидов или аминокислот, которое подвергает замене, делеции или инсерции, составляет 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более, например, 25, 30, 35, 40, 45 или 50.
В том смысле, в котором в настоящем документе используются термины «липокалин человека, связанный с желатиназой нейтрофилов» или «hNGAL», или «липокалин 2» или «Lcn2», все они относятся к зрелому hNGAL с инвентарным номером P80188 в SWISS-PROT Data Bank (приведенная в настоящем документе в качестве примера последовательность SEQ ID NO:44).
В данном контексте отмечается, что изобретение основано на удивительном открытии того, что мутагенез липокалина 2 человека, крысиного белка, связанного с α2-микроглобулином (A2m), и 24р3/утерокалина мыши (24р3) в одном или более вышеуказанных 3 положений последовательности обеспечивает мутеины, которые обладают достаточным аффинным связыванием с заранее определенной мишенью, которая может включать, не ограничиваясь этим, пептид, белок, фрагмент или домен белка, и небольшую органическую молекулу.
Данная мишень может представлять любую желаемую, неприродную мишень/лиганд. В одном варианте осуществления термин «неприродный лиганд» относится к соединению, которое не связывается с природным зрелым hNGAL в физиологических условиях.
В том смысле, в котором в настоящем документе используются термины «органическая молекула» или «небольшая органическая молекула» для неприродной мишени, они означают органическую молекулу, содержащую по меньшей мере 2 атома углерода, но предпочтительно, не более чем 7 или 12 атомов, вращающихся вокруг углеродных связей, имеющую молекулярную массу в пределах между 100 и 2000 дальтон, предпочтительно, между 100 и 1000 дальтон и, необязательно, молекула включает один или более атомов металла.
В том смысле, в котором в настоящем документе используется термин «пептид» для неприродной мишени, он относится к дипептиду или олигопептиду с 2-45 аминокислотами. В одном из вариантов осуществления пептид содержит 2-40, 2-35, 2-30, 2-25, 2-20, 2-15 или 2-10 аминокислотных остатков. Пептид может представлять собой природный или синтетический пептид, и может содержать - помимо 20 природных L-аминокислот - D-аминокислоты, не встречающиеся в природе аминокислоты и аналоги аминокислот. В одном варианте осуществления пептид представляет собой бета-амилоидный пептид (Абета или Аβ). В еще одном варианте осуществления бета-амилоидный пептид представляет Аβ40 пептид или Аβ42 пептид.
В одном из вариантов осуществления небольшая органическая молекула представляет соединение, проявляющее свойства иммунологического гаптена.
В одном из вариантов осуществления неприродная мишень представляет белок фибронектин или его домен, такой как EB-домен или фрагмент EB-домена.
Мутеин липокалина 2 человека по изобретению может содержать аминокислотную последовательность дикого типа (природную) помимо положений мутированной аминокислотной последовательности. С другой стороны, мутеины липокалина, раскрытые в настоящем документе, также могут содержать аминокислотные мутации помимо положений последовательности, подвергнутых мутагенезу, при условии, что данные мутации не оказывают отрицательного влияния на связывающую активность и укладку мутеина. Такие мутации можно легко провести на уровне ДНК с использованием общепринятых стандартных методов (Sambrook J. et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989). Возможные изменения аминокислотной последовательности представляют собой инсерции или делеции, а также аминокислотные замены. Такие замены могут быть консервативными, т.е. аминокислотный остаток замещается аналогичным в химическом отношении аминокислотным остатком. Примерами консервативных замен являются замены среди членов следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изолейцин, лейцин, метионин и валин и 6) фенилаланин, тирозин и триптофан. С другой стороны, возможно ввести неконсервативные изменения в аминокислотную последовательность. Кроме того, также вместо замены единичных аминокислотных остатков, также возможно вставить или делецировать одну или более следующих друг за другом аминокислот первичной структуры липокалина 2 человека, при условии, что данные делеции и инсерции проводят к получению стабильно уложенного/функционального мутеина.
Как уже отмечалось, такие модификации аминокислотной последовательности включают направленный мутагенез единичных аминокислотных положений для упрощения субклонирования мутированного гена липокалина или его фрагментов включением сайтов расщепления для некоторых рестриктаз. Кроме того, данные мутации также можно включить для дополнительного повышения аффинности мутеина липокалина для определенной мишени. Кроме того, можно ввести мутации для модуляции некоторых свойств мутеина, например, для повышения стабильности укладки, стабильности в сыворотке, резистентности белка или растворимости в воде, или снижения тенденции к агрегации, если это необходимо. Например, природные остатки цистеина можно мутировать в другие аминокислоты для предупреждения образования дисульфидных мостиков. Однако также возможно преднамеренно мутировать другое положение аминокислотной последовательности в цистеин для введения новых реакционноспособных групп, например, для конъюгации с другими соединениями, такими как полиэтиленгликоль (ПЭГ), гидроксиэтилкрахмал (HES), биотин, пептиды или белки, или для образования не встречающихся в природе дисульфидных связей. Примерные возможности такой мутации для введения остатков цистеина в аминокислотную последовательность мутеина липокалина 2 человека включают введение остатка цистеина (Cys) по меньшей мере в одно из положений последовательности, которое соответствует положениям 14, 21, 60, 84, 88, 116, 141, 145, 143, 146 или 158 последовательности hNGAL дикого типа. Полученные тиоловые группы на стороне любого из аминокислотных положений 14, 21, 60, 84, 88, 116, 141, 145, 143, 146 и/или 158 можно использовать для ПЭГилирования или HESилирования мутеина, например, для повышения периода полураспада соответствующего мутеина липокалина 2 человека.
В одном из вариантов осуществления мутеин по настоящему изобретению содержит мутированные аминокислотные остатки по меньшей мере в любых 2 или всех 3 положениях в последовательности, соответствующих положениям последовательности 96, 100 и 106 линейной полипептидной последовательности липокалина 2 человека.
В дополнительном варианте осуществления мутеин содержит по меньшей мере 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16 и 17 мутированных аминокислотных остатков в любом из положений последовательности, соответствующих положениям последовательности 33, 36, 40, 41, 42, 43, 44, 46, 47, 48, 49, 50, 51, 52, 54, 55, 59, 65, 68, 70, 72, 73, 75, 77, 78, 79, 80, 81, 86, 87, 98, 96, 99, 100, 103, 106, 107, 110, 111, 125, 127, 132, 134, 136 и 138 линейной полипептидной последовательности hNGAL. В дополнительном варианте осуществления мутеин содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 мутированных аминокислотных остатков в любом из положений последовательности 33, 36, 40, 41, 42, 43, 44, 46, 47, 48, 49, 50, 51, 52, 54, 55, 59, 65, 68, 70, 72, 73, 75, 77, 78, 79, 80, 81, 86, 87, 98, 96, 99, 100, 103, 106, 107, 110, 111, 125, 127, 132, 134, 136 и 138 линейной полипептидной последовательности hNGAL. В еще одном варианте осуществления мутеин содержит 18, 19 или 20 мутированных аминокислотных остатков в любом из положений последовательности 33, 36, 40, 41, 42, 43, 44, 46, 47, 48, 49, 50, 51, 52, 54, 55, 59, 65, 68, 70, 72, 73, 75, 77, 78, 79, 80, 81, 86, 87, 98, 96, 99, 100, 103, 106, 107, 110, 111, 125, 127, 132, 134, 136 и 138 линейной полипептидной последовательности липокалина 2 человека.
В еще одном варианте осуществления настоящего изобретения мутеин содержит мутированные аминокислотные остатки по меньшей мере в любых 10, 14, 15, 20, 22, 24, 26, 28, 29, 30, 31, 32, 33, 35 или всех 45 вышеперечисленных положений последовательности.
Мутеин по изобретению, который связывается с бета-амилоидным пептидом, таким как Aβ40 пептид и Aβ42 пептид, может содержать по сравнению с аминокислотной последовательностью зрелого липокалина 2 человека дикого типа, показанного на фигуре 17 (Lcn2), по меньшей мере 2, 3, 4, 5, 6, 8, 7, 9, 10, 11 или 12 аминокислотных замен, которые включают, не ограничиваясь этим, Leu36→Val или Cys; Ala40→Tyr или Lys, или Val; Ile41→Thr или Ser, или Leu; Gln49→Leu или Trp; Leu70→Gly; Arg72→Gly или Asp; Lys73→Leu или Trp, или Asp; Asp77→Asn или His, или Leu; Trp79→Lys; Asn96→Ile или Arg; Tyr100→Gln или Arg, или Glu; Leu103→Met или Arg, или Gly; Tyr106→Tyr или Ala, или Trp; Lys125→Thr или Val, или Glu; Ser127→Gly или Gln, или Ala; Tyr132→Met или Ser, или Thr и Lys134→Asn. Было установлено, что такие мутеины могут ингибировать агрегацию Aβ в условиях in vitro и in vivo. Предпочтительно, что такой мутеин, описанный в настоящем документе, связывался с и ингибировал агрегацию Aβ, предпочтительно, Aβ40, более предпочтительно, в условиях теста, описанного в примере 11 (предпочтительно, включая соотношение мутеин:Aβ40, равное 1:10). Настоящее изобретение также относится к мутеинам, описанным выше, обладающим сравнимой биологической функцией по сравнению с мутеином US7. Выражение «сравнимая биологическая функция» означает, что такие мутеины способны связываться с и ингибировать агрегацию Aβ, предпочтительно, Aβ40, с отклонением в ингибирующей агрегацию активности по сравнению с US7 не более чем на 40, 30, 20, 15, 10, 5, 2,5, 2 или 1%, например, в условиях, которые тождественны или идентичны описанным в примере 11 (предпочтительно включая соотношение мутеин:Aβ40, равное 1:10). Настоящее изобретение также относится к мутеинам, описанным в настоящем документе, для применения для лечения или профилактики нейродегенеративных заболеваний, таких как болезнь Альцгеймера.
В одном из вариантов осуществления мутеин по изобретению, который связывается с бета-амилоидным пептидом, таким как Aβ40 пептид и Aβ42 пептид, может содержать следующие аминокислотные замены Leu36→Val; Ala40→Tyr; Ile41→Thr; Gln49→Leu; Leu70→Gly; Lys73→Leu; Asp77→Asn; Trp79→Lys; Asn96→Ile; Tyr100→Gln; Leu103→Met; Lys125→Thr; Ser127→Gly; Tyr132→Met и Lys134→Asn. Примером мутеина, содержащего такие аминокислотные замены, является S1-A4, показанный на фигуре 17 (SEQ ID NO:39).
В дополнительном варианте осуществления мутеин по изобретению, который связывается с бета-амилоидным пептидом, таким как Aβ40 пептид и Aβ42 пептид, может содержать следующие аминокислотные замены Leu36→Val; Ala40→Lys; Ile41→Ser; Gln49→Trp; Leu70→Gly; Arg72→Gly; Lys73→Thr; Asp77→His; Trp79→Lys; Asn96→Arg; Tyr100→Arg; Leu103→Arg; Tyr106→Ala; Lys125→Val; Ser127→Gln; Tyr132→Ser и Lys134→Asn. Примером мутеина, содержащего такие аминокислотные замены, является US-7, показанный на фигуре 17 (SEQ ID NO:41).
Изобретение также относится к мутированному зрелому липокалину hNGAL (депозированному под инвентарным номером P80188 в SWISS-PROT Data Bank, предпочтительно, имеющему аминокислотную последовательность, представленную в SEQ ID NO:40), содержащему одну или более мутированных аминокислот, описанных в настоящем документе, в положении, соответствующем положению 36, 40, 41, 49, 70, 72, 73, 77, 79, 96, 100, 103, 106, 125, 127, 132, 134 линейной полипептидной последовательности hNGAL дикого типа.
В еще одном варианте осуществления мутеин по изобретению, который связывается с бета-амилоидным пептидом, таким как Aβ40 пептид и Aβ42 пептид, может содержать следующие аминокислотные замены Leu36→Cys; Ala40→Val; Ile41→Leu; Gln49→Leu; Leu70→Gly; Arg72→Asp; Lys73→Asp; Asp77→Leu; Trp79→Lys; Asn96→Arg; Tyr100→Glu; Leu103→Gly; Tyr106→Trp; Lys125→Glu; Ser127→Ala; Tyr132→Thr и Lys134→Asn. Примером мутеина, содержащего такие аминокислотные замены, является H1-G1, показанный на фигуре 17 (SEQ ID NO:43).
В еще одном варианте осуществления мутеин по изобретению, который связывается с бета-амилоидным пептидом, таким как Aβ40 пептид и Aβ42 пептид, может содержать следующие аминокислотные замены Leu36→Ala; Ala40→Val; Ile41→Leu; Gln49→Leu; Leu70→Gly; Arg72→Asp; Lys73→Asp; Asp77→Leu; Trp79→Lys; Asn96→Arg; Tyr100→Glu; Leu103→Gly; Tyr106→Trp; Lys125→Glu; Ser127→Ala; Tyr132→Thr и Lys134→Asn. Примером мутеина, содержащего такие аминокислотные замены, является H1GA показанный в SEQ ID NO:50.
Предпочтительно, чтобы мутеин, описанный в настоящем документе, связывался с и ингибировал агрегацию Aβ, предпочтительно, Aβ40, более предпочтительно, в условиях теста, описанного в примере 23 (предпочтительно, в соотношении Aβ40:H1GA, равным 10:2). Настоящее изобретение также относится к мутеинам, описанным выше, обладающим сравнимой биологической функцией при сравнении с мутеином H1GA. Выражение «сравнимая биологическая функция» означает, что такие мутеины способны связываться с и ингибировать агрегацию Aβ, предпочтительно, Aβ40, с отклонением в ингибирующей агрегацию активности по сравнению с H1GA не более чем на 40, 30, 20, 15, 10, 5, 2,5, 2 или 1%, например, в условиях, которые тождественны или идентичны описанным в примере 23 (предпочтительно, в соотношении Aβ40:H1GA, равным 10:2). Настоящее изобретение также относится к мутеинам, описанным в настоящем документе, для применения для лечения или профилактики нейродегенеративных заболеваний, таких как болезнь Альцгеймера.
В еще одном варианте осуществления мутеин по изобретению, который связывается с бета-амилоидным пептидом, таким как Aβ40 пептид и Aβ42 пептид, может содержать следующие аминокислотные замены Leu36→Val; Ala40→Val; Ile41→Leu; Gln49→Leu; Leu70→Gly; Arg72→Asp; Lys73→Asp; Asp77→Leu; Trp79→Lys; Asn96→Arg; Tyr100→Glu; Leu103→Gly; Tyr106→Trp; Lys125→Glu; Ser127→Ala; Tyr132→Thr и Lys134→Asn. Примером мутеина, содержащего такие аминокислотные замены, является H1GV, показанный в SEQ ID NO:52.
Предпочтительно, что мутеин, описанный в настоящем документе, связывается с Aβ40 в условиях теста, описанных в примере 21 Настоящее изобретение также относится к мутеинам, описанным выше, обладающим сравнимой биологической функцией по сравнению с мутеином H1GV. Выражение «сравнимая биологическая функция» означает, что такие мутеины способны связываться с Aβ, предпочтительно, с Aβ40, с отклонением в ингибирующей агрегацию активности по сравнению с H1GV не более чем 40, 30, 20, 15, 10, 5, 2,5, 2 или 1%, например, в условиях, которые тождественны или идентичны описанным в примере 21. Настоящее изобретение также относится к мутеинам, описанным в настоящем документе, для применения для лечения или профилактики нейродегенеративных заболеваний, таких как болезнь Альцгеймера.
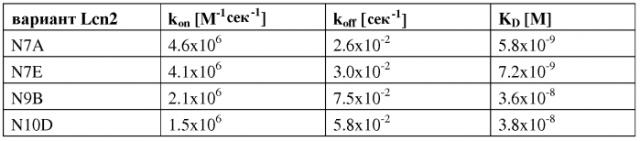
В еще одном варианте осуществления мутеин по изобретению, который связывается с экстрадоменом В или его фрагментом, содержит следующие аминокислотные замены Leu36→Lys; Ala40→His; Ile41→Asp; Gln49→Arg; Tyr52→Gln; Ser68→Asn; Leu70→Arg; Arg72→Val; Lys73→His; Asp77→Asn; Trp79→Arg; Arg81→Trp; Tyr100→Trp; Tyr106→Trp; Lys125→Arg; Ser127→Tyr; Tyr132→Leu; Lys134→Glu и Ser146→Asn. Примером мутеина, содержащего такие аминокислотные замены, является N7A, показанный на фигуре 17 (SEQ ID NO:20).
В еще одном варианте осуществления мутеин по изобретению, который связывается с экстрадоменом В или его фрагментом, содержит следующие аминокислотные замены Leu36→Arg; Ala40→Met; Ile41→Arg; Gln49→Ala; Tyr52→Val; Ser68→Lys; Leu70→Met; Arg72→Gln; Lys73→Arg; Asp77→Lys; Trp79→Met; Arg81→Asn; Asn96→Ala; Tyr100→Pro; Leu103→Pro, Tyr106→Thr; Lys125→His; Ser127→Phe и Lys134→His. Примером мутеина, содержащего такие аминокислотные замены, является N9B, показанный на фигуре 17 (SEQ ID NO:24).
В еще одном варианте осуществления мутеин по изобретению, который связывается с экстрадоменом В или его фрагментом, содержит следующие аминокислотные замены Leu36→Ala; Ala40→Thr; Ile41→Trp; Gln49→Tyr; Tyr52→Gln; Ser68→Asn; Arg72→Met; Lys73→Ser; Asp77→Arg; Trp79→Met; Arg81→His; Asn96→Ser; Tyr100→Trp; Tyr106→Trp; Lys125→Arg; Ser127→Tyr; Tyr132→Phe и Lys134→Gly. Примером мутеина, содержащего такие аминокислотные замены, является N10D, показанный на фигуре 17 (SEQ ID NO:26).
В еще одном варианте осуществления мутеин по изобретению, который связывается с экстрадоменом В или его фрагментом, содержит следующие аминокислотные замены Leu36→Glu; Ala40→Ser; Ile41→Leu; Gln49→Arg; Leu70→Arg; Lys73→Ser; Asp77→His; Trp79→Leu; Asn96→Leu; Tyr100→Lys; Leu103→His; Tyr106→Phe; Lys125→Thr; Ser127→Ala и Lys134→Phe. Примером мутеина, содержащего такие аминокислотные замены, является N7E, показанный на фигуре 17 (SEQ ID NO:22).
Вышеприведенные мутеины, описанные при обращении к фигуре 17, могут содержать дополнительные аминокислотные замены. Мутеины могут дополнительно содержать аминокислотные замены, которые могут включать, не ограничиваясь этим, Gln28→His или Cys87→Ser. Другие возможные аминокислотные замены включают, не ограничиваясь этим, Tyr52→Gln или Val; Ser68→Lys или Asn или Arg81→Trp или Asn, или His.
Мутеины липокалина по изобретению способны связываться с желаемой неприродной мишенью с обнаруживаемой аффинностью, т.е. константой диссоциации (KD), составляющей по меньшей мере 200 нМ. В еще одном варианте осуществления мутеин связывается с определенной неприродной мишенью с KD по меньшей мере 1 мкМ или ниже, или 100 мкМ или ниже, или 1 мкМ или ниже, или 500 нМ, или 200 нМ или ниже, или 100 нМ или ниже, или 50 нМ или ниже, или 10 нМ или ниже, или 1 нМ или ниже. В еще одном варианте осуществления мутеины липокалина связываются с желаемой мишенью с константой диссоциации для определенной мишени, равной по меньшей мере 100, 20, 1 нМ или даже ниже. Аффинность связывания мутеина с желаемой мишенью можно определить с использованием большого числа методов, таких как титрование с использованием флуоресцентных индикаторов, конкурентный ELISA или поверхностный плазмонный резонанс (Biacore).
Специалистам в данной области, очевидно, понятно, что образование комплекса с мишенью зависит от многих факторов, таких как концентрация партнеров по связыванию, присутствие конкурентов, ионная сила буферной системы и т.д. Отбор и обогащение обычно проводят в условиях, обеспечивающих выделение мутеинов липокалина, обладающих в комплексе с желаемой мишенью, константой диссоциации на уровне, указанном выше. Однако можно провести стадии промывания и элюирования в условиях различной жесткости. Также возможен отбор на основе кинетических характеристик. Например, отбор можно провести в условиях, способствующих образованию комплекса мишени с мутеинами, который показывает медленную диссоциацию от мишени, или другими словами, с низким значением koff. Альтернативно отбор можно осуществить в условиях, способствующих быстрому образованию комплекса между мутеином и мишенью, или другими словами, высоким значением kon.
Мутеин по изобретению, как правило, находится в виде мономерного белка. Однако также возможно, чтобы мутеин липокалина по изобретению был способен к спонтанной димеризации или олигомеризации. Несмотря на то, что применение мутеинов липокалина, которые образуют стабильные мономеры, может быть предпочтительным для некоторых применений, например, за счет более быстрой диффузии и лучшего проникновения в ткани, в других случаях может быть преимущественным применение мутеинов липокалина, которые образуют стабильные гомодимеры или мультимеры, поскольку такие мультимеры могут обеспечить (дополнительное) повышенную аффинность и/или авидность для определенной мишени. Кроме того, олигомерные формы мутеина липокалина могут иметь замедленные скорости диссоциации или более длительный период полураспада.
Также следует отметить, что на образование комплекса между соответствующим мутеином и его лигандом оказывает влияние много различных факторов, таких как концентрации соответствующих партнеров по связыванию, присутствие конкурентов, рН и ионная сила используемой буферной системы, и экспериментальный метод, используемый для определения константы диссоциации KD (например, титрование с использованием флуоресцентных индикаторов, конкурентный ELISA или поверхностный плазмонный резонанс, и это только, назвав некоторые из них) или даже математический алгоритм, который используют для обработки экспериментальных данных.
Следовательно, специалистам в данной области также понятно, что значения KD (константы диссоциации комплекса, образованного между соответствующим мутеином и его мишенью/лигандом) могут варьировать в определенных экспериментальных пределах в зависимости от метода и экспериментальной системы, которые используются для определения аффинности конкретного мутеина липокалина для определенного лиганда. Это означает, что может быть незначительное отклонение в установленных значениях KD или пределах толерантности, в зависимости, например, от того определяли значение KD с использованием поверхностного плазмонного резонанса (Biacore) или конкурентного ELISA.
В одном из вариантов осуществления мутеины, раскрытые в настоящем документе, можно связать через N- или С-конец с аффинной меткой, такой как пентагистидиновая метка, гексагистидиновая метка или Strep-метка®. Таким образом, настоящая заявка также включает все подробно и в общих чертах описанные мутеины, содержащие такие метки.
В том смысле, в котором в настоящем изобретении используется термин «фрагмент» по отношению к мутеину липокалина, он относится к белкам или пептидам, полученным из полноразмерного зрелого Lcn2, которые укорочены по N- и/или С-концу, т.е. с отсутствием по меньшей мере одной из N- и/или С-концевых аминокислот. Такие фрагменты содержат, предпочтительно, по меньшей мере 10, более предпочтительно, 20, наиболее предпочтительно, 30 или более следующих друг за другом аминокислот первичной последовательности зрелого Lcn2, и которые обычно детектируются в иммуноанализе зрелого Lcn2.
Также в объем настоящего изобретения включаются вышеуказанные мутеины, которые изменены в отношении их иммуногенности.
Цитотоксические Т-клетки распознают пептидные антигены на клеточной поверхности антигенпрезентирующих клеток вместе с молекулами главного комплекса гистосовместимости класса I (MHC). Способность пептидов связываться с молекулами MHC является аллель-специфической и коррелирует с их иммуногенностью. Для снижения иммуногенности определенного белка возможность прогнозировать то, какие пептиды в белке обладают потенциальной активностью связываться с определенной молекулой MHC, имеет большое значение. Ранее были описаны подходы, которые использовались для расчетного подхода для идентификации потенциальных эпитопов Т-клеток, для прогноза связывания определенной пептидной последовательности с молекулами MHC класса I (Altuvia et al. (1995) J. Mol. Biol. 249:244-250).
Такой подход также можно использовать для идентификации потенциальных эпитопов для Т-клеток в мутеинах по изобретению и сделать выбор в зависимости от предполагаемого применения конкретного мутеина на основе его предполагаемой иммуногенности. Также возможно подвергнуть области пептидов, которые были прогнозированы, как содержащие эпитопы для Т-клеток, дополнительному мутагенезу для снижения или элиминации таких эпитопов