Варианты плазминогена и плазмина
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению вариантов плазминогена и плазмина, содержащих одну или несколько точковых мутаций в каталитическом домене, которые снижают или предотвращают аутокаталитическую потерю протеазной активности плазмина, и может быть использовано в медицине. Изобретение позволяет получить аутопротеолитически стабильный плазмин. 26 н. и 25 з.п. ф-лы, 10 ил., 3 табл., 5 пр.
Реферат
Область изобретения
Данное изобретение относится к вариантам плазминогена и плазмина, содержащим одну или несколько точковых мутаций в каталитическом домене, которые снижают или предотвращают аутокаталитическую потерю протеазной активности плазмина. Также раскрываются композиции, применения и способы применения указанных вариантов плазминогена и плазмина.
ПРЕДПОСЫЛКИ ДАННОГО ИЗОБРЕТЕНИЯ
Активация зимогена плазминогена приводит к образованию фибринолитически/тромболитически активной сериновой протеиназы - плазмина. Активация эндогенного плазминогена может быть запущена или усилена введением активатора плазминогена, такого как урокиназа, стрептокиназа, стафилокиназа или tPA, или любого их варианта. При активации белок плазминоген протеолитически расщепляется до тяжелой цепи, содержащей 5 доменов «двойная петля», и легкой цепи, содержащей каталитический домен. Обе цепи скрепляются вместе посредством 2 дисульфидных связей. После активации аутолитическое расщепление удаляет N-концевой сегмент из тяжелой цепи (78 аминокислот плазмина человека; 77 аминокислот бычьего плазмина) и тяжелая цепь бычьего плазмина может быть дополнительно аутокаталитически расщеплена между доменами типа «двойная петля» 3 и 4, таким образом давая в результате бычий мидиплазмин (Christensen et al. 1995, Biochem J 305, 97-102). Активация плазминогена до плазмина, запущенная с помощью расщепления R561-V562 пептидной связи в плазминогене человека, вызывает большое конформационное изменение в легкой цепи, где указанное изменение приводит к примированию, или активации, каталитической триады внутри указанной легкой цепи. Бактериальные активаторы плазминогена, такие как стрептокиназа и стафилокиназа, формируют комплекс с плазминогеном, и без расщепления пептидной связи R561-V562 плазминогена каталитический сайт плазминогена активируется посредством конформационных изменений при образовании комплекса активатор-плазминоген (механизмы активации плазминогена подытожены в, например, разделе Введение Terzyan et al. 2004; Proteins 56: 277-284).
Поскольку активаторы плазминогена действуют как непрямые тромболитические средства, то альтернативно было предложено применение плазмина самого по себе в качестве прямого фибринолитического/тромболитического средства. Такое прямое применение, однако, затрудняется из-за того факта, что плазмин, подобно многим протеазам, подвергается аутокаталитическому протеолитическому распаду, кинетикой уравнения реакции второго порядка при условии игибирования (Jespersen et al. 1986, Thrombosis Research 41, 395-404).
В начале 1960-х было установлено, что плазмин может быть стабилизирован в кислом pH, или, альтернативно, в нейтральном pH, при условии присутствия аминокислоты, такой как лизин. Тем не менее, сообщалось, что имело место аутолитическое расщепление после Lys104, Arg189 и Lys622 (нумерация относительно Lys-плазмина) даже если плазмин хранили при pH 3,8 (WO01/36608). При хранении плазмина при еще более низком pH, равном 2,2, не-аутолитическое кислотное расщепление происходит между Asp-Pro (D-P) в положениях Asp62, Asp154 и Asp346 (WO01/36608). Это иллюстрирует, что pH может быть понижено до точки, где больше не возникает очевидный аутокаталитический распад, но при которой кислотный гидролиз становится фактором дестабилизации. Отсутствует информация в WO01/36608 в отношении того, что пептидные связи в плазмине являются чувствительными к (аутокаталитическому) гидролизу при нейтральном pH. Известные стабилизаторы плазмина включают глицерин, достаточно высокую ионную силу, фибриноген и ε-аминокапроновую кислоту (EACA), как раскрывается Jespersen et al. (1986, Thromb Res 41, 395-404). Лизин и лизиновые производные (такие как EACA и транексамовая кислота) и p-аминометилбензойная кислота (PAMBA) являются некоторыми дополнительными известными стабилизаторами (Uehsima et al. 1996, Clin Chim Acta 245, 7-18; Verstraete 1985, Drugs 29, 236-261). Патент США №4462980 сообщал об образовании плазминовых агрегатов, которые вносили свой вклад в распад плазмина, несмотря на хранение в кислотных условиях. Решение этой проблемы было представлено в Патенте США №4462980 посредством добавления полигидроксидного соединения. Другие пути стабилизации плазмина включают добавление олигопептидных соединений (например, патент США №5879923). Альтернативно, каталитический сайт плазмина может быть обратимо блокирован посредством дериватизации, например, ацилирования (европейский патент №EP 0009879). Пегилирование плазмина также было предложено как средство стабилизации фермент (WO 93/15189).
Описан ряд вариантов плазмина, отличных от процессированных форм плазмина, и он включает химерный микроплазмин (WO 2004/045558) и варианты с точковой мутацией в сайте расщепления двух цепей (Патент США №5087572) или в аминокислоте каталитической триады (Mhashilkar et al. 1993, Proc Natl Acad Sci USA 90, 5374-5377; Wang et al., 2001, J Mol Biol 295, 903-914). Wang et al. (1995, Protein Science 4, 1758-1767 и 1768-1779) сообщали о широком ряде мутантов микроплазминогена по аминокислотным положениям 545, 548, 550, 555, 556, 558, 560-564, 585, 740 и 788. Двойной мутант, где цистеины в аминокислотных положениях 558 и 566 были замещены на серины, описывался в Linde et al. (1998, Eur J Biochem 251, 472-479). Takeda-Shitaka et al. (1999, Chem Pharm Bull 47, 322-328) приводят вариант плазмина с уменьшенной активностью, где изменение включает замещение аланина в аминокислотном положении 601 на треонин. Все аминокислотные положения, приведенные выше, считаются относительно Glu-плазминогена, начиная с Glu в аминокислотном положении 1. Нерасщепляемый вариант плазминогена (расщепление между тяжелой и легкой цепью нарушено) описан в WO 91/08297. Dawson et al. (1994, Biochemistry 33, 12042-12047) описывают уменьшенную аффинность для стрептокиназы варианта Glu-плазминогена с Glu вместо Arg в положении 719 (R719E). Jespers et al. (1998, Biochemistry 37, 6380-6386) получили при сканировании по Ala ряд полученных с помощью фагового дисплея моносайтовых мутантов микроплазминогена H569A, R610A, K615A, D660A, Y672A, R712A, R719A, T782A, R789A, и обнаружили, что аргинин в положении 719 является ключевым для взаимодействия со стафилокиназой; мутант D660A не был дополнительно охарактеризован из-за очень низкой экспрессии; только мутант R719A был дополнительно получен в растворимой форме. Ни один из мутантов не показал существенного изменения в протеолитической активности (субстрат S-2403). Jespers et al. (1998) также включили в их анализ мутанта с активным сайтом S741A; кристаллическая структура этого мутанта раскрыта в Wang et al. (2000, J Mol Biol 295, 903-914). В дальнейших попытках обнаружить сайты взаимодействия стрептокиназа/плазминоген, Terzyan et al. (2004, Proteins 56, 277-284) сообщали о ряде мутантов микроплазминогена (K698M, D740N, S741A) в уже мутированном окружении (R561A), последнее подавляло протеолитическую активацию плазминогена и, таким образом, подавляло образование активного микроплазмина (который будет затруднять изучение механизма контакт-активации комплекса стрептокиназа-микроплазминоген). Terzyan et al. (2004) дополнительно упоминают “произвольный” тройной мутант R561A/H569Y/K698M очевидно функционально не отличающийся от двойного мутанта R561A/K698M. Wang et al. (2000, Eur J Biochem 267, 3994-4001) при изучении взаимодействия стрептокиназа/плазмина(плазминогена) получили набор мутантов микроплазминогена (аминокислоты 530-791 Glu-плазминогена) в Cys536Ala и Cys541Ser окружении. Эти мутанты включают мутацию R561A, как описано выше (Terzyan et al. (2004)), а также двойные мутанты R561A/K698G, R561A/K698A и R561A/K698Q. В такое же C536A/C541S окружении были введены также отдельные мутации K698G и K698A, из которых K698G не была в дальнейшем охарактеризована из-за трудностей с очисткой. Описанные выше исследования были направлены на достижение лучшего понимания характеристик молекулы плазминогена/плазмина и не сообщают о какой-либо клинической пользе или преимуществе или предполагаемых клинических преимуществах мутантов плазминогена/плазмина. Peisach et al. (1999, Biochemistry 38, 11180-11188) добились успеха в определении кристаллической структуры микроплазминогена, содержащего мутации M585Q, V673M и M788L.
Nguyen и Chrambach (1981, Preparative Biochem 11, 159-172) сообщили о присутствии “минорного и неидентифицированного белкового компонента” 10,0 кДа на основе SDS-PAGE в восстанавливающих условиях сырого коммерческого препарата урокиназа-активированного плазмина (Homolysin). Отличия в аутолизе плазмина человека в зависимости от pH были описаны детально Shi и Wu (1988, Thrombosis Research 51, 355-364). Ohyama et al. (2004, Eur J Biochem 271, 809-820) предложили применение нелизиновых аналоговых модуляторов плазминогена при лечении рака благодаря усилению аутопротеолиза плазмина такими соединениями, которые приводят к усиленному образованию ангиостатинов (в присутствии урокиназного активатора плазминогена). Таблица 3 в Ohyama et al. (2004) приводит по меньшей мере 15 сайтов расщепления в плазмине, подвергнутом действию усиливающих аутопротеолиз соединений. При обсуждении их наблюдений в свете ранее проведенных исследований считается вероятным, что усиливающие аутопротеолиз соединения являются более или менее селективно усиливающими протеолиз B/легкой цепи, поскольку минимальный распад как A/тяжелой-, так и B-цепи обнаружен при отсутствии усиливающих аутопротеолиз соединений.
Ясно, что ни один из описанных выше способов/вариантов не решал проблему получения плазмина, стабилизированного на молекулярном уровне. Обеспечение варианта плазмина (или соответствующего варианта плазминогена, из которого может быть получен плазмин) с каталитическим доменом, по сути являющимся устойчивым к аутокаталитическому распаду, будет значительным шагом вперед по направлению к эффективному и безопасному длительному хранению, а также по направлению к эффективному и безопасному терапевтическому применению плазмина, например при тромболитической терапии или при индукции заднего отслоения стекловидного тела или разжижения стекловидного тела глаза.
Краткое описание данного изобретения
Данное изобретение относится к выделенным вариантам плазминогена или плазминам, полученным из них, или к выделенным вариантам плазмина, или к протеолитически активным или обратимым неактивным производным любого из указанных плазминов, характеризующихся тем, что указанные варианты плазминогена или плазмина или указанные производные содержат в их каталитическом домене мутацию по меньшей мере одной внутренней аминокислоты в положении P, пептидная связь которой с внутренней аминокислотой в положении P+1 склонна к аутопротеолизу, в аминокислоту, пептидная связь которой с внутренней аминокислотой в положении P+1 является менее склонной или не склонна к аутопротеолизу.
Альтернативно, вариант плазминогена, вариант плазмина или производное плазмина по данному изобретению содержит в его каталитическом домене мутацию по меньшей мере двух внутренних аминокислот в положениях P и P', пептидная связь которых с внутренними аминокислотами в положениях P+1 и P'+1 склонна к аутопротеолизу в аминокислоты, пептидная связь которых с внутренними аминокислотами в положениях P+1 и P'+1 является менее склонной или не склонна к аутопротеолизу.
В частности, указанные внутренние аминокислоты в положениях P или P и P' представляют собой лизины или аргинины.
Более конкретно, указанная по меньшей мере одна или две внутренние аминокислоты в положении P или в положениях P и P' могут быть по меньшей мере одной или по меньшей мере двумя из следующего:
(i) лизин в положении 137 каталитического домена плазмина человека или соответствующий лизин или аргинин каталитического домена плазмина, не принадлежащего человеку;
(ii) лизин в положении 147 каталитического домена плазмина человека или соответствующий лизин или аргинин каталитического домена плазмина, не принадлежащего человеку; или
(iii) аргинин в положении 158 каталитического домена плазмина человека или соответствующий аргинин или лизин каталитического домена плазмина, не принадлежащего человеку;
где указанный каталитический домен плазмина человека начинается с аминокислоты валин в положении 1, которая является той же аминокислотой валин, что встречается в положении 562 Glu-плазминогена человека.
Альтернативно, указанная по меньшей мере одна внутренняя аминокислота в положении P представляет собой лизин в положении 147 каталитического домена плазмина человека или представляет собой соответствующий лизин или аргинин каталитического домена плазмина, не принадлежащего человеку, где указанный каталитический домен плазмина человека начинается с аминокислоты валин в положении 1, которая является той же аминокислотой валин, что встречается в положении 562 Glu-плазминогена человека. Необязательно, варианты плазминогена, варианты плазмина или производные плазмина с мутацией лизина в положении 147 каталитического домена плазмина человека (или соответствующего лизина или аргинина каталитического домена плазмина, не принадлежащего человеку) могут дополнительно содержать мутацию внутренних аминокислот в положениях 137 и/или 158 каталитического домена человека или соответствующих лизинов и/или аргининов каталитического домена плазмина, не принадлежащего человеку, где указанный каталитический домен плазмина человека начинается с аминокислоты валин в положении 1, которая является той же аминокислотой валин, что встречается в положении 562 Glu-плазминогена человека.
В дополнительной альтернативе варианты плазминогена, варианты плазмина или производные плазмина по данному изобретению являются такими, что:
(i) если мутация указанной по меньшей мере одной внутренней аминокислоты в положении P представляет собой мутацию лизина в положении 137 каталитического домена плазмина человека (которое является аминокислотным положением 698 относительно Glu-плазминогена человека) в аминокислоту, делая пептидную связь между аминокислотами 137 и 138 более устойчивой к аутопротеолизу, то указанный вариант плазминогена, вариант плазмина или производное плазмина содержит интактный сайт активации в аминокислотных положениях 561 и 562 (относительно Glu-плазминогена человека), и если аминокислоты в положении 536 и 541 (относительно Glu-плазминогена человека) присутствуют снаружи каталитического домена, то указанные аминокислоты представляют собой цистеины дикого типа, или
(ii) если мутация указанной по меньшей мере одной внутренней аминокислоты в положении P представляет собой мутацию аргинина в положении 158 каталитического домена плазмина человека (которое является аминокислотным положением 719 относительно Glu-плазминогена человека) в аланин или глутамат, то по меньшей мере одна другая внутренняя аминокислота каталитического домена плазмина человека в положении P', пептидная связь которой с внутренней аминокислотой в положении P'+1, склонна к аутопротеолизу, мутирована в аминокислоту, пептидная связь которой с внутренней аминокислотой в положении P'+1 является менее склонной или не склонна к аутопротеолизу.
Вариант плазминогена, вариант плазмина или производное плазмина согласно (i) или (ii), приведенных выше, может дополнительно содержать мутацию внутренней аминокислоты в положении 147 каталитического домена человека или соответствующего лизина или аргинина каталитического домена плазмина, не принадлежащего человеку, где указанный каталитический домен плазмина человека начинается с аминокислоты валин в положении 1, которая является той же аминокислотой валин, что встречается в положении 562 Glu-плазминогена человека.
Любой из вариантов плазминогена, вариантов плазмина или производных плазмина по данному изобретению может дополнительно характеризоваться тем, что его константа аутолиза составляет не более чем 95% от константы аутолиза плазмина дикого типа.
Любой из вариантов плазминогена, вариантов плазмина или производных плазмина по данному изобретению может дополнительно характеризоваться тем, что каталитическая константа kкат находится в диапазоне 10% - 200% от kкат плазмина дикого типа.
Любой из вариантов плазминогена, вариантов плазмина или производных плазмина по данному изобретению может дополнительно характеризоваться тем, что его константа аутолиза составляет не более чем 95% от константы аутолиза плазмина дикого типа, и его каталитическая константа kкат находится в диапазоне 10% - 200% от kкат плазмина дикого типа.
Без какого-либо ограничения, любой из выше перечисленных вариантов плазминогена, вариантов плазмина или производных плазмина по данному изобретению может быть одним из следующего: Glu-плазминоген или Glu-плазмин, Lys-плазминоген или Lys-плазмин, мидиплазминоген или мидиплазмин, миниплазминоген или миниплазмин, микроплазминоген или микроплазмин, дельтаплазминоген или дельтаплазмин.
Данное изобретение дополнительно относится к выделенным вариантам плазминогена, вариантам плазмина или производным плазмина по данному изобретению или комбинации любых из них для применения в качестве лекарственного препарата.
Данное изобретение также относится к композициям, содержащим выделенный вариант плазминогена, вариант плазмина или производное плазмина по данному изобретению или комбинацию любого из них и по меньшей мере одно из следующего: фармацевтически приемлемый разбавитель, носитель или вспомогательное средство. Такая композиция может необязательно дополнительно содержать по меньшей мере одно из следующего: антикоагулянт, тромболитическое средство, противовоспалительное средство, противовирусное средство, антибактериальное средство, противогрибковое средство, антиангиогенное средство, антимитотическое средство, антигистаминное средство или анестетик.
Данное изобретение также включает любое полезное применение выделенного варианта плазминогена, варианта плазмина или производного плазмина по данному изобретению. Без какого-либо ограничения, они включают следующее: индуцирование или стимулирование лизиса патологического отложения фибрина у субъекта, индуцирование заднего отслоения стекловидного тела глаза и/или для индуцирования разжижения стекловидного тела глаза, облегчение хирургической витрэктомии глаза у субъекта, ферментное очищение раны поврежденной ткани субъекта, снижение циркулирующего фибриногена у субъекта, снижение уровней α2-антиплазмина у субъекта, снижение риска патологического отложения фибрина.
Данное изобретение дополнительно относится к способам скрининга в отношении аутопротеолитически стабильного варианта плазмина, где указанные способы включают этапы следующего:
(i) определение в каталитическом домене плазмина дикого типа по меньшей мере одной внутренней аминокислоты в положении P, пептидная связь которой с внутренней аминокислотой в положении P+1 склонна к аутопротеолизу,
(ii) мутирование аминокислоты в положении P, определенной в (i), в аминокислоту, пептидная связь которой с внутренней аминокислотой в положении P+1 является менее склонной или не склонна к аутопротеолизу,
(iii) определение аутопротеолитической стабильности мутанта, полученного в результате (ii), и
(iv) отбор из (iii) мутанта, который является аутопротеолитически стабильным, в качестве аутопротеолитически стабильного варианта.
Альтернативно, такие способы скрининга в отношении аутопротеолитически стабильного варианта плазмина могут включать этапы следующего:
(i) мутирование одной или нескольких аминокислот аргинина или лизина в положениях 137, 147 и 158 каталитического домена плазмина человека или соответствующих аргининов или лизинов плазмина, не принадлежащего человеку, в аминокислоту, отличающуюся от природной аминокислоты,
(ii) определение аутопротеолитической стабильности мутанта, полученного в результате (i) и
(iii) отбор из (ii) мутанта, который является аутопротеолитически стабильным, в качестве аутопротеолитически стабильного варианта плазмина;
где указанный каталитический домен плазмина человека начинается с аминокислоты валин в положении, которая является той же аминокислотой валин, что встречается в положении 562 Glu-плазминогена человека.
Любой из выше перечисленных способов скрининга может необязательно дополнительно включать этап, где определяют протеолитическую активность аутопротеолитически стабильного варианта плазмина.
Данное изобретение дополнительно включает способы улучшения стабильности при длительном хранении плазмин-содержащей композиции, где указанные способы включают этап определения аутопротеолитически стабильного варианта плазмина, способного храниться в течение длительного периода времени без существенной потери протеолитической активности.
Данное изобретение дополнительно включает способы получения варианта плазминогена по данному изобретению, где указанные способы включают этапы следующего:
(i) введение нуклеиновой кислоты, кодирующей плазминоген по данному изобретению, в подходящую клетку-хозяина, способную экспрессировать указанный плазминоген;
(ii) выращивание клетки-хозяина, полученной в (i), в условиях и за время, достаточное для экспрессии указанного плазминогена в указанной клетке-хозяине; и
(iii) сбор плазминогена, экспресированного в (ii).
Такие способы могут необязательно дополнительно включать этап (iv), где плазминоген, собранный в (iii), очищают.
Данное изобретение аналогично включает способы получения варианта плазмина по данному изобретению, где указанные способы включают этапы следующего:
(i) введение нуклеиновой кислоты, кодирующей плазминоген по данному изобретению, в подходящую клетку-хозяина, способную экспрессировать указанный плазминоген;
(ii) выращивание клетки-хозяина, полученной в (i), в условиях и за время, достаточное для экспрессии указанного плазминогена в указанной клетке-хозяине;
(iii) сбор плазминогена, экспресированного в (ii);
(iv) активация плазминогена (iii) до плазмина.
Такие способы могут дополнительно необязательно включать этап, где плазминоген, собранный в (iii), очищают до активации в (iv). Дополнительно, в любом способе получения варианта плазмина по данному изобретению активный плазмин, полученный в (iv), можно необязательно очистить. Также дополнительно активный вариант плазмина, полученный согласно способу данного изобретения, можно необязательно дериватизировать и/или обратимо инактивировать.
Данное изобретение дополнительно относится к выделенным последовательности нуклеиновых кислот, кодирующим вариант плазминогена или вариант плазмина по данному изобретению. Рекомбинантные векторы, содержащие такие нуклеиновые кислоты, являются также частью данного изобретения, также как и клетки-хозяева, трансформированные такой нуклеиновой кислотой или рекомбинантным вектором.
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ НА ФигураХ
ФИГУРА 1. Аминокислотная последовательность с двойной нумерацией аминокислотных положений Glu-плазминогена дикого типа человека (1-791) и каталитического домена плазмина (1-230, аминокислотная последовательность и нумерация полужирным шрифтом). Микроплазминоген, используемый для демонстрации данного изобретения, начинается в положении аминокислоты 543 (нумерация относительно Glu-плазминогена). Выделенные аминокислоты в аминокислотных положениях 137, 147 и 158 (нумерация относительно каталитического домена плазмина), как определили, являются аминокислотами, пептидная связь которых с аминокислотами в положениях 138, 148 и 159, соответственно, является чувствительной к аутокаталитическому расщеплению. Домены «двойная петля» (полученные из информации, включенной в GenBank по номером доступа AAA36451) заключены в рамки и их аминокислотные последовательности напечатаны с заменой букв нормального шрифта на курсив. Аминокислоты каталитической триады обведены кружком.
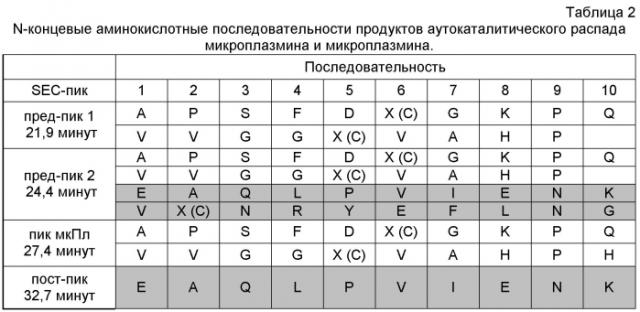
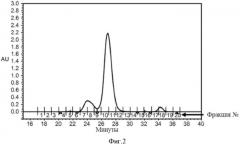
ФИГУРА 2. Профиль эксклюзионной хроматографии (SEC) микроплазмина, полученного в широкомасштабном производстве. Собирали элюаты, соответствующие номеру фракции 5 (пре-пик 1), номерам фракций 7 и 8 (пре-пик 2), номерам фракций 10-12 (пик микроплазмина), и номерам фракций 15 и 16 (пост-пик) и материал из них подвергли секвенированию по аминокислотам с N-конца (метод Эдмана). Пик, элюирующий около номеров фракций 17-18, соответствовал пику буфера. AU: единицы поглощения.
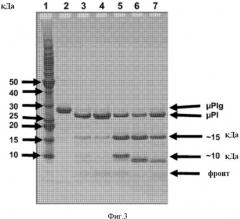
ФИГУРА 3. Анализ SDS-PAGE в восстанавливающих условиях микроплазмина, полученного в широкомасштабном производстве. Дорожка 1: шкала молекулярных масс, где молекулярные массы обозначены слева. Дорожка 2: микроплазминоген. Дорожка 3: микроплазмин при pH 3,1. Дорожка 4: микроплазмин при pH 4,0. Дорожка 5: микроплазмин при pH 5,0. Дорожка 6: микроплазмин при pH 6,0. Дорожка 7: микроплазмин при pH 7,0. Все образцы (конечная концентрация белка 0,6 мг/мл) оставляли на 4 часов при 20°C при указанном pH и затем замораживали при -70°C. Гель окрашивали Кумасси бриллиантовым голубым. μPlg=микроплазминоген, μPl=плазмин, фронт=основной фронт геля.
ФИГУРА 4. Микроплазмин инкубировали в буфере с нейтральным pH, и образцы собирали в указанные моменты времени и анализировали с помощью SDS-PAGE (A) или вестерн-блоттинга (B). Стрелка “a” указывает на интактный микроплазмин, тогда как стрелки “b” и “c” указывают на ~ 15 кДа и ~ 10 кДа фрагменты, соответственно, которые были получены аутокаталитически.
ФИГУРА 5. Кинетика аутолиза микроплазмина, оцениваемая с помощью вестерн-блоттинга (кружки), соответствует потере активности микроплазмина (квадраты).
ФИГУРА 6. (A) Микроплазмин разводили в PBS (квадраты) или в стекловидном теле глаза свиньи (кружки) до конечной концентрации 1,53 мкМ, и остаточную концентрацию активного микроплазмина измеряли в различные моменты времени. (B) Образцы стекловидного тела глаза свиньи собирали в указанные моменты времени и анализировали с помощью вестерн-блоттинга. Стрелка указывает на ~15 кДа фрагмент.
ФИГУРА 7. (A) Иммуноаффинная хроматограмма варианта микроплазмина Lys137Met (K137M) на иммобилизированном антителе к микроплазмину. Собранные фракции элюирования имеют нумерацию 1-11 выше по оси X (объем элюирования). (B) Анализ SDS-PAGE в восстанавливающих условиях фракций элюирования иммуноаффинности, проведенный в (A). Дорожка 1: шкала молекулярных масс. Дорожка 2: фракция элюата 2. Дорожка 3: фракция элюата 3; Дорожка 4: фракция элюата 4; Дорожка 5: фракция элюата 5; Дорожка 6: фракция элюата 6; Дорожка 7: сырой супернатант. Гель был окрашен Кумасси.
ФИГУРА 8. (A) Активация варианта K137M рекомбинантной стафилокиназой. Активность достигала максимума через 10 мин (указано стрелкой), затем снижалась по мере прохождения аутолитической инактивации. (B) SDS-PAGE в восстанавливающих условиях варианта K137M, показывающий, что активация стафилокиназой является почти полной в течение 10 мин, и что потеря активности является результатом аутолитического распада, что доказывается накоплением двух фрагментов ~ 17 и ~8 кДа. Полосы 1-7 представляют образцы, собранные через 0 мин, 10 мин, 1 час, 2 час, 3 час, 6 час и 24 час после добавления стафилокиназы. (▲) Микроплазминоген, (▼) микроплазмин, (∇) фрагменты аутолитического распада. (C) HPLC анализ образцов, собранных через 0 мин, 10 мин и 6 часов после добавления стафилокиназы. HPLC-профиль, полученный через 10 мин после добавления стафилокиназы, показывает, что ~ 85% неактивного микроплазминогена превратилось в активный вид микроплазмина, и HPLC профиль при t=6 часов показывает присутствие фрагментов аутолитического распада (∇), в соответствии с SDS-гелем, показанным в (B). Площадь пика микроплазмина при t=10 мин (стрелка) использовали, чтобы рассчитать концентрацию активного вида путем сравнения со стандартной кривой, полученной с высоко очищенным микроплазмином (не показано). Все данные HPLC были получены, используя UPLC-устройства Acquity (Waters). Образцы микроплазмина типично разводили в 5 раз в 0,1% трифторуксусной кислоте (TFA), 5% ацетонитриле, и впрыскивали на BEH300 C18 UPLC-колонку Acquity (Waters), которую предварительно уравновесили в 0,1% TFA, 34% ацетонитриле. Элюирование затем проводили 34 - 44% ацетонитрилом, 1,5-мл линейным градиентом в 0,1% TFA, а белки обнаруживали с помощью последующего поглощения при 214 нм. Температура колонки поддерживали при 75°C, и все эксперименты проводили со скоростью потока 100 мкл/мин. (D) Количественный анализ вида микроплазмина K137M при t=10 мин с помощью HPLC и последующее снижение остаточной активности объединили для расчета молярной концентрации интактного, активного микроплазмина, присутствующего в образце в каждой временной точке. Данные согласовывали с Уравнением 1 (смотри Пример 3) для расчета константы второго порядка для аутолиза (k). Незакрашенные кружки (○) представляют данные для варианта K137M. Для сравнительных целей также представлен (●) сходный набор данных, полученных с другим вариантом (K147A-R158A).
ФИГУРА 9. Определение кинетических параметров для варианта микроплазмина K137M. Определение kкат и Kм из измерения начальных скоростей гидролиза (vi) при различных концентрациях субстрата (S-2403). Данные сопоставили с Уравнением 2 (смотри Пример 4).
ФИГУРА 10. Выравнивание аминокислотной последовательности белков плазминогена млекопитающих, полученных из GenBank. Выравнивание последовательностей проводили с помощью программного обеспечения COBALT (Constraint-based Multiple Alignment Tool; Papadopolous and Aagarwala, Bioinformatics, 23:1073-79, 2007), доступным с сайта Национального центра биотехнологической информации (NCBI) с установками по умолчанию. ▼: обозначение начала Glu-плазминогена. Аминокислотная нумерация дана по отношению к плазминогену человека.
Детальное описание изобретения
Данное изобретение основано на результатах исследования механизмов, лежащих в основе естественной ауто-инактивации протеолитической активности плазмина при нейтральном pH, исследования, для которого изобретатель сфокусировался на микроплазмине, который состоит, главным образом, из каталитического домена плазмина. Пептидные связи, подверженные расщеплению плазмином, расположены на C-конце лизина или аргинина (Weinstein and Doolittle, 1972, Biochim Biophys Acta 258, 577-590). Около 10% (22 из 230) аминокислот каталитического домена плазмина (начиная с аминокислотного положения 562, валин, в Glu-плазминогене человека) представляют собой лизины или аргинины. Теоретически все пептидные связи, которые являются C-концевыми на этих лизинах и аргининах в одной молекуле плазмина, могут быть протеолитически расщеплены другой молекулой плазмина.
Один аспект данного изобретения, таким образом, относится к молекулам плазмина и к молекулам плазминогена, в частности, молекулам плазминогена, которые являются активируемыми/могут потенциально быть активированы до плазмина, содержащим в их каталитическом домене одну или несколько мутаций аминокислот, так чтобы пептидные связи, восприимчивые к аутопротеолитическому распаду в плазмине или плазминогене дикого типа, были менее восприимчивы или не восприимчивы к аутопротеолитическому распаду в молекулах плазмина и плазминогена - объектов данного изобретения.
Данное изобретение другими словами относится к выделенному варианту плазминогена или плазмину, полученному из него, или выделенному варианту плазмина, или протеолитически активному или обратимому неактивному производному любого из указанных плазминов, характеризующимся тем, что указанный вариант плазминогена или вариант плазмина или их производное содержит в своем каталитическом домене мутацию по меньшей мере одной внутренней аминокислоты в положении P, пептидная связь которой с внутренней аминокислотой в положении P+1 склонна к (или чувствительна к, подвержена, или восприимчива к) аутопротеолизу, в аминокислоту, пептидная связь которой с внутренней аминокислотой в положении P+1 является менее склонной или не склонна к (или менее чувствительной, подверженной или восприимчивой или не чувствительна, подвержена или восприимчива) к аутопротеолизу. В частности, указанная внутренняя аминокислота в положении P представляет собой лизин или аргинин. В качестве используемой в данном документе ссылки (если не указано иное) каталитический домен плазмина будет нумероваться по отношению к плазмину человека, который начинается с валина в положении P=1, который является таким же, как валин в положении 562 Glu-плазминогена человека (смотри Фигуру 1). В данном документе также может быть сделана ссылка на два различных аминокислотных положения в каталитическом домене плазмина, которые затем называют P и P', соответственно.
Альтернативно, вариант плазминогена, вариант плазмина или производное плазмина по данному изобретению могут содержать в своем каталитическом домене мутацию по меньшей мере двух внутренних аминокислот в положении P и P', пептидная связь которых с внутренними аминокислотами в положениях P+1 и P'+1 склонна к аутопротеолизу, в аминокислоты, пептидная связь которых с внутренними аминокислотами в положении P+1 и P'+1 является менее склонной или не склонна к аутопротеолизу.
После определения аминокислот в положениях P специалист в данной области техники будет способен легко решить, в какую другую аминокислоту дикого типа может быть мутирована аминокислота в положении P. Такое решение может, но не обязательно должно, следовать критериям, таким как размер аминокислоты, заряд аминокислоты, полярность аминокислоты и/или индекс гидрофобности аминокислоты (смотри Таблицу 1). В частности, для плазмина и плазминогена указанная внутренняя аминокислота в положении P, по всей вероятности, будет лизином или аргинином, подразумевая, что они должны мутировать в аминокислоту, отличную от аргинина или лизина, соответственно. Более того, наличие кристаллической структуры каталитического домена плазминогена и плазмина (MMDB ID:12717; PDB ID:1DDJ; Wang et al., 2001, J Mol Biol 295, 903-914) значительно помогает определению мутантных аминокислот так, чтобы полученная мутантная молекула плазмина или плазминогена сохраняла протеолитическую активность. Кроме того, можно ожидать, что мутация аминокислоты дикого типа в указанном положении P в любую из аминокислот данной группы будет давать на выходе сходные результаты. На основе Таблицы 1, указанные данные группы могут быть обозначены следующим образом:
- гидрофобные алифатические аминокислоты: Met, Ile, Leu и Val
- гидрофобные ароматические аминокислоты: Phe
- гидрофильные кислые аминокислоты: Asp, Glu, Asn и Gln
- гидрофильные основные аминокислоты: Arg, Lys и His
- умеренно гидрофобные алифатические аминокислоты: Gly, Ala, Ser, Thr, Cys, Pro
- умеренно гидрофобные ароматические аминокислоты: Tyr и Trp.
Из них, и с целью мутации, Cys и Pro могут быть менее предпочтительными аминокислотами-заменителями аминокислот дикого типа плазмина или плазминогена из-за создания возможной свободной тиольной группы с помощью Cys, или из-за более обширного нарушения белковой структуры с помощью Pro. Другие аминокислотные замены включают мутацию аминокислоты дикого типа в указанном положении P каталитического домена плазмина(плазминогена) в неприродную или неканоническую аминокислоту или в аналоги аминокислот, такие как норлейцин, норвалин, орнитин или цитруллин (для более обширного списка, смотри, например, Hendrickson et al. 2004, Annu Rev Biochem 73, 147-176).
Таблица 1. Характеристики аминокислот.
| Аминокислота | Полярность боковой цепи | Заряд боковой цепи(при pH 7) | Индекс гидрофобности | ||
| A | неполярная | нейтральный | 1,8 | ||
| Аланин | Ala | положительный | -4,5 | ||
| Аргинин | Arg | нейтральный | -3,5 | ||
| Аспарагин | Asn | отрицательный | -3,5 | ||
| Цистеин | Cys | Аспарагиновая кислота | Asp | нейтральный | 2,5 |
| Глутаминовая кислота | Glu | E | полярная | отрицательный | -3,5 |
| Глутамин | Gln | Q | полярная | нейтральный | -3,5 |
| Глицин | Gly | G | неполярная | нейтральный | -0,4 |
| Гистидин | His | H | полярная | положительный | -3,2 |
| Изолейцин | Ile | I | неполярная | нейтральный | 4,5 |
| Лейцин | Leu | L | неполярная | нейтральный | 3,8 |
| Лизин | Lys | K | полярная | положительный | -3,9 |
| Метионин | Met | M | неполярная | нейтральный | 1,9 |
| Фенилаланин | Phe | F | неполярная | нейтральный | 2,8 |
| Пролин | Pro | P | неполярная | нейтральный | -1,6 |
| Серин | Ser | S | полярная | нейтральный | -0,8 |
| Треонин | Thr | T | полярная | нейтральный | -0,7 |
| Триптофан | Trp | W | неполярная | нейтральный | -0,9 |
| Тирозин | Tyr | Y | полярная | нейтральный | -1,3 |
| Валин | Val | V | неполярная | нейтральный | 4,2 |
Изобретатель наблюдал, что в тестовых условиях внутри каталитического домена плазмина происходит лишь о