Новый алициклический спирт
Иллюстрации
Показать всеНастоящее изобретение относится к новому алициклическому спиртовому соединению, представленному химической формулой (1), которое может быть использовано в качестве исходного материала для парфюмерного состава и которое обладает превосходным цветочно-травянистым ароматом с бодрящими свежими нотами. Также изобретение относится к парфюмерной композиции, содержащей предлагаемое алициклическое спиртовое соединение, и к способу его получения. Способ получения заключается во взаимодействии 1-изопропил-4-метилциклогексена с монооксидом углерода в присутствии фторида водорода, взаимодействии получаемого фторида 4-изопропил-1-метилциклогексанкарбоновой кислоты со спиртом с получением карбонильного соединения циклогексана, с последующим восстановлением карбонильного соединения циклогексана. 3 н.п. ф-лы, 1 табл., 3 пр.
Реферат
Область техники
Настоящее изобретение относится к алициклическому спиртовому соединению, которое может быть использовано в качестве исходного материала для парфюмерного состава, способу его получения и парфюмерной композиции, содержащей указанное алициклическое спиртовое соединение.
Предшествующий уровень техники
Известно, что некоторые алициклические спиртовые соединения полезны в качестве исходного материала для парфюмерного состава. Например, непатентный документ 1 раскрывает то, что Mayol, обладающий ароматом зелени и ландышеподобным ароматом, Mugetanol, обладающий легким цветочным ландышеподобным ароматом, Patchone, обладающий пачулиподобным древесным ароматом, и тому подобные, используют в качестве исходного материала для парфюмерного состава.
Документы предшествующего уровня техники
[Непатентный документ]
Непатентный документ 1: «Fundamentals of parfume and fragrance preparation» под редакцией Mototaka Nakajima, 1995, страницы 141-144, Sangyo-Tosho Publishing Co., Ltd.
Раскрытие настоящего изобретения
Задачи, которые решаются настоящим изобретением
Задачей настоящего изобретения является предоставление нового алициклического спиртового соединения, обладающего цветочно-травянистым ароматом, предназначенного в качестве исходного материала для парфюмерного состава, способ его получения и парфюмерную композицию, содержащую указанное алициклическое спиртовое соединение.
Средства для решения этих задач
В результате синтеза различных соединений и изучения их ароматов авторы настоящего изобретения обнаружили, что алициклическое спиртовое соединение, представленное следующей химической формулой (1), которое является новым соединением, обладает превосходным цветочно-травянистым ароматом с бодрящими свежими нотами.
Таким образом, настоящее изобретение относится к новому алициклическому спиртовому соединению, способу его получения и парфюмерным композициям, содержащим указанное алициклическое спиртовое соединение, а именно:
[1] Алициклическое спиртовое соединение, представленное химической формулой (1).
[2] Парфюмерная композиция, содержащая алициклическое спиртовое соединение, представленное химической формулой (1).
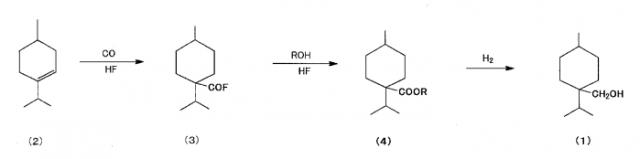
[3] Способ получения алициклического спиртового соединения, представленного химической формулой (1), путем
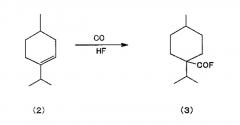
взаимодействия 1-изопропил-4-метилциклогексена, представленного химической формулой (2), с монооксидом углерода в присутствии фторида водорода,
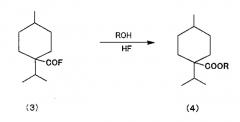
взаимодействия полученного фторангидрида 4-изопропил-1-метилциклогексанкарбоновой кислоты, представленного химической формулой (3), со спиртом с получением карбонильного соединения циклогексана, представленного общей формулой (4), и
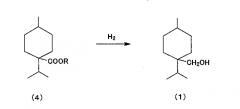
восстановления карбонильного соединения циклогексана, представленного общей формулой (4), с получением указанного алициклического спиртового соединения, представленного химической формулой (1),
где R представляет собой алкильную группу, содержащую 1-4 углеродных атома.
[Эффект настоящего изобретения]
Новое алициклическое спиртовое соединение по настоящему изобретению является новым с точки зрения обладания превосходным цветочно-травянистым ароматом с бодрящими свежими нотами. Благодаря его превосходным свойствам поддерживать устойчивый аромат, оно является полезным в качестве ароматизирующего ингредиента для широкого ассортимента продуктов, таких как гигиено-косметические продукты, мыла и детергент для одежды.
Кроме того, промышленный способ получения алициклического спиртового соединения по настоящему изобретению позволяет получать указанное алициклическое спиртовое соединение выгодным с точки зрения промышленности способом.
Способы осуществления настоящего изобретения
Новый алициклический спирт, представленный химической формулой (1)
Новое алициклическое спиртовое соединение по настоящему изобретению представлено химической формулой (1). Согласно структуре, представленной химической формулой (1), цис-изомер и транс-изомер могут присутствовать в зависимости от замещения положения 1 и положения 4 в кольце циклогексана. Что касается структуры нового алициклического спиртового соединения по настоящему изобретению, цис-изомер или транс-изомер могут быть использованы независимо или может быть использована их смесь.
Новое алициклическое спиртовое соединение, представленное вышеуказанной химической формулой (1), обладает превосходным цветочно-травянистым ароматом с бодрящими свежими нотами, и может быть использовано независимо или в комбинации с другими компонентами в качестве ароматизирующего ингредиента для мыла, шампуня, ополаскивателя, детергента, косметических препаратов, разбрызгиваемых продуктов, душистых веществ, парфюмерии, добавок для ванны и тому подобных.
Парфюмерная композиция
Парфюмерная композиция по настоящему изобретению может быть получена путем объединения нового алициклического спиртового соединения, представленного химической формулой (1), с другими традиционно применяемыми парфюмерными компонентами и/или парфюмерными составами, содержащими желаемую композицию. Соотношение в комбинации зависит от типов парфюмерных составов, типов и силы предполагаемого аромата и тому подобного. Предпочтительно включать новое алициклическое спиртовое соединение в количестве от 0,01 до 90% масс., более предпочтительно, в количестве от 0,1 до 50% масс.
Примеры ароматизирующих материалов, которые могут быть объединены с новым алициклическим спиртовым соединением по настоящему изобретению, включают натуральные эфирные масла, натуральные экстракты и синтетическую парфюмерию из углеводородов, спиртов, фенолов, сложных эфиров, карбонатов, альдегидов, кетонов, ацеталей, эфиров, нитрилов, карбоновых кислот, лактонов и тому подобных.
Способ промышленного получения нового алициклического спирта
Способ промышленного получения нового алициклического спиртового соединения по настоящему изобретению включает
(a) взаимодействие моноенового соединения, представленного химической формулой (2), с монооксидом углерода в присутствии фторида водорода (далее HF) с получением фторангидрида, представленного химической формулой (3) (далее «карбонилирование»),
(b) взаимодействие полученного фторангидрида со спиртом с получением карбонильного соединения циклогексана, представленного общей формулой (4) (далее «этерификация»), и
(c) восстановление полученного карбонильного соединения циклогексана с получением алициклического спиртового соединения, представленного химической формулой (1) (далее «восстановление карбонильной группы»).
<(a) Карбонилирование>
Реакция карбонилирования моноенового соединения осуществляется в присутствии HF под давлением монооксида углерода. Таким образом, алициклическое карбонильное соединение, представленное химической формулой (3), получают совместно с различными побочными продуктами, включая другие изомеры.
[Моноеновое соединение]
Моноеновое соединение, представленное химической формулой (2), может быть синтезировано частичным гидрированием соответствующего диенового соединения в присутствии гидрирующего катализатора.
Моноеновое соединение, синтезируемое таким образом, может быть использовано после удаления катализатора фильтрацией и подобным способом и/или путем очистки дистилляцией или подобным образом.
[Синтез моноенового соединения]
В качестве диеновых соединений, которые могут быть использованы в синтезе моноенового соединения (далее «диеновое соединение»), предпочтительно может быть использовано углеводородное соединение, имеющее 6-членную кольцевую структуру, содержащую только метильную группу и изопропильную группу в положении 1 и положении 4, соответственно, шестичленного кольца, содержащего две двойные связи в молекуле.
Примеры диеновых соединений включают алициклические углеводороды и терпеновые углеводороды. Их предпочтительные примеры включают лимонен, α-терпинен, β-терпинен, γ-терпинен, изолимонен, α-фелландрен, β-фелландрен, Menogenes, терпинолен и дипентен. Их более предпочтительные примеры включают лимонен, α-терпинен, γ-терпинен, α-фелландрен, терпинолен и дипентен. Их наиболее предпочтительные примеры включает терпинолен.
Катализаторы гидрирования для диенового соединения, в частности, не ограничены, если они традиционно применяются для гидрирования ненасыщенных связей. Предпочтительно использование катализатора, содержащего по меньшей мере один металл, выбранный из металлов 8-11 групп периодической таблицы.
Более конкретно, предпочтительно использование катализатора, содержащего по меньшей мере один металл, выбранный из группы, состоящей из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота.
Катализатор гидрирования может быть твердым катализатором или гомогенным катализатором. Предпочтительно использование твердого катализатора с точки зрения отделяемости от реагента.
Примеры твердых катализаторов включают металлический катализатор без носителя и металлический катализатор на носителе. Предпочтительные примеры металлических катализаторов без носителя включают (1) катализатор Ренея, такой как никелевый катализатор Ренея, кобальтовый катализатор Ренея и медный катализатор Ренея и (2) оксиды платины, палладия, родия и рутения и их коллоидные катализаторы.
Примеры металлических катализаторов на носителе включают катализатор, где по меньшей мере один металл, выбранный из группы, состоящей из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота, находится(находятся) на или смешан(ы) с носителем, таким как оксид магния, диоксид циркония, диоксид церия, диатомит, активированный уголь, оксид алюминия, диоксид кремния, цеолит и диоксид титана.
Их предпочтительные примеры включают медный катализатор на носителе, где медный катализатор находится на носителе, таком как Cu-Cr катализатор (катализатор Адкинса), Cu-Zn катализатор и Cu-Fe катализатор, платиновый катализатор на носителе, такой как Pt/C катализатор и Pt/оксид алюминия катализатор, палладиевый катализатор на носителе, такой как Pd/C катализатор и Pd/оксид алюминия катализатор, рутениевый катализатор на носителе, такой как Ru/C катализатор и Ru/оксид алюминия катализатор, и родиевый катализатор на носителе, такой как Rh/C катализатор и Rh/оксид алюминия катализатор. Среди них предпочтительно использование катализатора, содержащего медь, исходя из реакционной способности и селективности.
При использовании медного катализатора его реакционная способность и селективность могут быть улучшены путем активирования катализатора в растворителе, таком как гептан при 140-200°C под давлением водорода 1-3 МПа, перед тем, как подвергнуть реакции с диеновыми соединениями.
Применяемое количество катализатора гидрирования зависит от типа катализатора. Уместно применять катализатор в количестве 0,001-100% масс., предпочтительно 0,01-30% масс., более предпочтительно 0,1-20% масс. в зависимости от количества диенового соединения, которое является исходным материалом.
Давление водорода может быть нормальным давлением или повышенным давлением. Давление обычно находится в диапазоне 0,1-4,0 МПа, предпочтительно 0,1-3,0 МПа, более предпочтительно 0,1-2,0 МПа.
Реакция гидрирования может быть проведена в условии отсутствия растворителя или с использованием растворителя. Примеры растворителей включают воду, органические кислоты, такие как муравьиная кислота и уксусная кислота; ароматические соединения, такие как бензол, o-дихлорбензол, толуол и ксилол; углеводороды, такие как гексан, гептан и циклогексан; спирты, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, этиленгликоль и диэтиленгликоль; простые эфиры, такие как диоксан, тетрагидрофуран, диметоксиэтан и простой диметиловый эфир диэтиленгликоля (диглим); и их смеси.
Количество растворителей, применяемых для реакции гидрирования, обычно находится в диапазоне 0,1-30 раз по массе, предпочтительно 0,2-20 раз по массе в зависимости от количества диенового соединения, которое является исходным материалом.
Температура реакции гидрирования обычно составляет от -90°C до 200°C, предпочтительно от 20°C до 150°C, более предпочтительно от 20°C до 100°C.
Форма реакции гидрирования, в частности, не ограничена, если реакция каталитического гидрирования может быть осуществлена. Могут быть применены известные способы, применяемые традиционно. Их примеры включают реактор с суспендированным катализатором на подложке, где реакция каталитического гидрирования осуществляется путем псевдоожижения катализатора в жидкости и реакторе с неподвижным слоем катализатора, где реакция каталитического гидрирования осуществляется путем подачи жидкости, тогда как катализатор загружается заранее и фиксируется.
[Монооксид углерода]
Монооксид углерода, применяемый при карбонилировании по настоящему изобретению, может содержать инертные газы, такие как азот и метан. Реакцию карбонилирования проводят предпочтительно под парциальным давлением монооксида углерода 0,5-5 МПа, более предпочтительно 1-3 МПа. Когда парциальное давление монооксида углерода составляет 0,5 МПа или выше, реакция карбонилирования может протекать достаточным образом с получением алициклического карбонильного соединения, которое является целевым соединением, с высоким выходом без сопутствующих побочных реакций, таких как реакция диспропорционирования и полимеризации. Парциальное давление монооксида углерода составляет предпочтительно 5 МПа или менее, исходя из допустимой нагрузки на оборудование.
[Фторид водорода]
HF, применяемый для карбонилирования, применяют в существенно безводном состоянии, поскольку он применяется и в качестве растворителя в реакции, и в качестве катализатора, и в качестве вспомогательного материала. HF обычно применяют в молях в количестве 4-15-, предпочтительно 6-10-кратном по отношению к количеству моноенового соединения, которое является исходным материалом. Когда молярное отношение HF в молях является 4-кратным или более, реакция карбонилирования может протекать эффективно, побочные реакции, такие как реакция диспропорционирования и полимеризация, могут быть ингибированы и алициклическое карбонильное соединение, которое является целевым соединением, может быть получено с высоким выходом. Применяемое количество HF составляет, предпочтительно, в молях 15-кратное количество или менее, исходя из стоимости исходных материалов и продуктивности.
[Условия реакции]
Форма реакции карбонилирования, в частности, не ограничена, и могут быть применены любые способы, такие как периодическая реакция, полунепрерывная реакция и непрерывная реакция.
Температура реакции карбонилирования составляет предпочтительно от -50°C до 30°C, более предпочтительно от -40°C до 0°C, наиболее предпочтительно от -30°C до -25°C. Когда температура реакции карбонилирования составляет 30°C или ниже, или, в частности, -25°C или ниже, может быть достигнута высокая селективность. Предпочтительно проведение реакции при температуре -50°C или выше, исходя из скорости реакции.
<(b) Этерификация>
Реакционную смесь фторангидрида, полученную реакцией карбонилирования, затем подвергают взаимодействию со спиртом, содержащим 1-4 углеродных атома, с получением алициклического сложноэфирного соединения. В этом случае предпочтительно применение способа, где предварительно определенное количество спирта добавляют в реакционную смесь фторангидрида, исходя из коррозионной устойчивости прибора, где протекает реакция.
Реакционная смесь фторангидрида, полученная реакцией карбонилирования (I), может быть использована в качестве исходного материала для следующей стадии, которая представляет собой стадию восстановления карбонильной группы в форме фторангидрида после отгонки избытка HF и очистки обычным способом, таким как дистилляция, или (II) может быть подвергнута гидролизу с получением соответствующего соединения карбоновой кислоты после отгонки избытка HF, и затем указанное соединение карбоновой кислоты может быть использовано в качестве исходного материала для следующей стадии, которая является стадией восстановления карбонильной группы после очистки обычным способом, таким как дистилляция
В вышеуказанной химической формуле R представляет собой алкильную группу, содержащую 1-4 углеродных атома.
Примеры спиртов, используемых на вышеуказанной стадии этерификации, включают метанол, этанол, н-пропанол, изопропанол, н-бутиловый спирт, изобутиловый спирт и трет-бутиловый спирт. Среди них предпочтительно использование метанола или этанола, исходя из реакционной способности.
Спирт может быть использован в количестве предпочтительно 0,5-2,0 молей, более предпочтительно 0,8-1,5-кратном количестве по отношению к количеству моноенового соединения, которое является исходным материалом на стадии карбонилирования. Молярное соотношение спирта 0,5 или более является предпочтительным, поскольку в таком случае остается небольшое количество непрореагировавшего фторида и коррозия оборудования на следующих стадиях может быть ингибирована. 2,0-кратное или меньшее молярное соотношение спирта является предпочтительным, поскольку может быть подавлена реакция дегидратации между молекулами спирта и может быть ингибирована коррозия оборудования.
Температура реакции между фторангидридом и спиртом составляет от -40°C до 20°C, исходя из ингибирования разложения карбонильного соединения циклогексана, представленного общей формулой (4). Когда температура реакции составляет менее -40°C, скорость реакции этерификации может стать низкой, и выход может быть снижен. Когда температура реакции составляет более 20°C, может быть увеличен риск получения воды в качестве побочного продукта в реакционной системе из-за разложения сложного эфира, реакции дегидратации добавленного спирта или тому подобного.
Карбонильное соединение циклогексана, представленное общей формулой (4), полученное таким образом, очищают обычными способами, такими как дистилляция, после отгонки HF.
<(c) Восстановление карбонильной группы>
Восстановления карбонильного соединения циклогексана, представленного общей формулой (4), полученное в вышеуказанной стадии этерификации, может быть выполнено любыми традиционными способами восстановления карбонильного соединения до спиртового соединения, которое, в частности, не ограничено. Например, могут быть использованы любые способы, показанные в Fifth Series of Experimental Chemistry, том 14 (Maruzen Publishing Co., Ltd.), страницы 11-27, такие как восстановление гидрида, восстановление металлом и солями металла и каталитическое гидрирование. С точки зрения экономической эффективности восстановление каталитическим гидрированием является предпочтительным.
Катализаторы, используемые для каталитического гидрирования карбонильных соединений циклогексана, в частности, не ограничены, если они являются обычными катализаторами, используемыми для гидрирования карбонильного соединения. Предпочтительно использование катализатора, содержащего по меньшей мере один металл, выбранный из группы, состоящей из металлов 8-11 групп периодической таблицы.
Их конкретные примеры включают катализатор каталитического гидрирования, содержащий по меньшей мере один металл, выбранный из группы, состоящей из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота.
Катализатор каталитического гидрирования может быть твердым катализатором или гомогенным катализатором. С точки зрения отделяемости от реагента предпочтительно использование твердого катализатора.
Примеры твердых катализаторов включают металлический катализатор без носителя и металлический катализатор на носителе.
Предпочтительные примеры металлических катализаторов без носителя включают (1) катализатор Ренея, такой как никелевый катализатор Ренея, кобальтовый катализатор Ренея и медный катализатор Ренея, и (2) оксиды платины, палладия, родия и рутения и их коллоидные катализаторы.
Примеры металлических катализаторов на носителе включают катализатор, где по меньшей мере один металл, выбранный из группы, состоящей из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота, находится(находятся) на или смешан(ы) с носителем, таким как оксид магния, диоксид циркония, диоксид церия, диатомит, активированный уголь, оксид алюминия, диоксид кремния, цеолит и диоксид титана.
Их предпочтительные примеры включают медный катализатор на носителе, где медный катализатор находится на носителе, таком как Cu-Cr катализатор (катализатор Адкинса), Cu-Zn катализатор и Cu-Fe катализатор, платиновый катализатор на носителе, такой как Pt/C катализатор и Pt/оксид алюминия катализатор, палладиевый катализатор на носителе, такой как Pd/C катализатор и Pd/оксид алюминия катализатор, рутениевый катализатор на носителе, такой как Ru/C катализатор и Ru/оксид алюминия катализатор, и родиевый катализатор на носителе, такой как Rh/C катализатор и Rh/оксид алюминия катализатор. Среди них предпочтительно использование катализатора, содержащего по меньшей мере один металл, выбранный из группы, состоящей из никеля и меди, исходя из реакционной способности.
Применяемое количество катализатора каталитического гидрирования зависит от типа катализатора. Уместно применять катализатор в количестве 1-100% масс., предпочтительно 3-30% масс. в зависимости от количества карбонильного соединения циклогексана, которое является исходным материалом.
[Растворитель]
Стадия восстановления карбонильной группы в настоящем изобретении может быть выполнена в условии отсутствия растворителя или с использованием растворителя.
Примеры растворителей на стадии восстановления карбонильной группы в настоящем изобретении включают воду, органические кислоты, такие как муравьиная кислота и уксусная кислота; ароматические соединения, такие как бензол, o-дихлорбензол, толуол и ксилол; углеводороды, такие как гексан, гептан и циклогексан; спирты, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, этиленгликоль и диэтиленгликоль; простые эфиры, такие как диоксан, тетрагидрофуран, диметоксиэтан и простой диметиловый эфир диэтиленгликоля; и их смеси.
Среди них предпочтительно проведение стадии в условии отсутствия растворителя или при использовании растворителя, выбранного из ароматических соединений, таких как бензол, o-дихлорбензол, толуол и ксилол; углеводородов, таких как гексан, гептан и циклогексан; спиртов, таких как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, этиленгликоль и диэтиленгликоль; простых эфиров, таких как диоксан, тетрагидрофуран, диметоксиэтан и простой диметиловый эфир диэтиленгликоля; и их смесей.
Количество растворителей в случае использования растворителей на стадии восстановления карбонильной группы в настоящем изобретении обычно находится в диапазоне 0-30 раз по массе, предпочтительно 0-20 раз по массе в зависимости от количества карбонильной группы циклогексана, представленного общей формулой (4), полученного на стадии этерификации.
[Условия реакции]
Что касается давления водорода на стадии восстановления карбонильной группы в настоящем изобретении, с точки зрения смещения равновесия реакции в сторону образования спирта, предпочтительно проведение реакции под высоким давлением. С учетом стоимости технического обеспечения, давление гидрирования составляет предпочтительно 1-30 МПа, более предпочтительно 2-20 МПа, наиболее предпочтительно 5-10 МПа.
Температура реакции на стадии восстановления карбонильной группы в настоящем изобретении составляет предпочтительно 100°C или выше, более предпочтительно 150°C или выше, исходя из достижения достаточной скорости реакции.
Температура реакции на этой стадии составляет предпочтительно 300°C или ниже, более предпочтительно 280°C или ниже, наиболее предпочтительно 250°C или ниже, исходя из ингибирования реакции переэтерификации между получаемым алициклическим спиртом и карбонильным соединением циклогексана, представленным общей формулой (4).
Форма стадии восстановления карбонильной группы в настоящем изобретении, в частности, не ограничена. Также в случае проведения восстановления каталитическим гидрированием форма стадии, в частности, не ограничена, если реакция каталитического гидрирования может быть осуществлена. Могут быть применены известные способы, применяемые традиционно.
Их примеры включают реактор с суспендированным катализатором на подложке, где реакция каталитического гидрирования осуществляется путем псевдоожижения катализатора в жидкости и реакторе с неподвижным слоем катализатора, где реакция каталитического гидрирования осуществляется путем подачи жидкости, тогда как катализатор загружается заранее и фиксируется.
Во время этой реакции в качестве побочных продуктов получают спирты, содержащие 1-4 углеродных атома. Реакция может быть осуществлена в присутствии этих побочных продуктов, спиртов или может быть осуществлена с их непрерывным или периодическим удалением во время реакции.
После удаления катализатора гидрирования из алициклического спиртового соединения, полученного таким образом, очистку проводят общепринятыми способами, такими как дистилляция, посредством чего может быть получено новое алициклическое спиртовое соединение, представленное формулой (1), в высокой степени очистки.
Примеры
Настоящее изобретение будет описано ниже более подробно со ссылками на примеры и сравнительные примеры, которые не предназначены для ограничения объема настоящего изобретения.
В примерах и сравнительных примерах, описанных ниже, если не указано иначе, % обозначает % масс.
<Газово-хроматографический анализ>
Исследования моноенового соединения и алициклического спиртового соединения проводили при помощи газовой хроматографии с использованием прибора торговой марки «GC-17A» производства Shimadzu Corporation и прибора торговой марки «HR-1» производства Shinwa Chemical Industries Ltd.; капиллярная колонка 0,32 ммΦ × 25 м. Температуру повышали со 100°C до 250°C со скоростью 2°C/мин.
Анализ карбонильного соединения циклогексана проводили газовой хроматографией с использованием прибора торговой марки «GC-17A» производства Shimadzu Corporation и прибора торговой марки «DBWAX» производства J & W; капиллярная колонка 0,32 ммΦ × 30 м × 0,25 мкм. Температуру повышали со 100°C до 250°C со скоростью 5°C/мин.
<Пример получения 1>: Получение 1-изопропил-4-метилциклогексена
50,0 г Cu-Cr катализатора торговой марки «N-203S» производства JGC Catalysts and Chemicals Ltd. и 500,0 г гептана, специального реагента производства Wako Pure Chemical Industries, Ltd., загружали в автоклав из нержавеющей стали объемом 5 л, оборудованный мешалкой с приводом типа NAC, тремя входными форсунками сверху и выпускной форсункой у основания, с возможностью регулирования внутренней температуры посредством внешней оболочки. Активацию осуществляли в течение 1 часа при 170°C под давлением водорода 2 МПа.
После охлаждения в него загружали 500,0 г терпинолена, специального реагента производства Wako Pure Chemical Industries, Ltd. и проводили реакцию гидрирования с перемешиванием в течение 8 часов при 110°C под давлением водорода 2 МПа.
Затем реакционную смесь, полученную таким образом, фильтровали для удаления катализатора с получением 980,0 г реакционной смеси с концентрацией 1-изопропил-4-метилциклогексена 22,5%, концентрацией 4-изопропил-1-метилциклогексана 10,2% и концентрацией гептана 46,5%, в которой выход составлял 44,2% на основе терпинолена.
После удаления низкокипящих компонентов путем выпаривания из полученной таким образом реакционной смеси, проводили разгонку при помощи ректификатора с числом теоретических тарелок 20 при температуре дистилляции 118°C под вакуумном в 200 торр, в результате чего получали 282,0 г смеси, содержащей 1-изопропил-4-метилциклогексен в концентрации 61,6%, 4-изопропил-1-метилциклогексан в концентрации 31,0% с выходом на основе терпинолена 34,8%.
<Пример 1>
Карбонилирование и этерификацию 1-изопропил-4-метилциклогексена с получением метил 1-изопропил-4-метилциклогексанкарбоксилата
<Карбонилирование>
Эксперимент проводили с использованием автоклава из нержавеющей стали объемом 500 мл, оборудованного мешалкой с приводом типа NAC, тремя входными форсунками сверху и выпускной форсункой у основания, с возможностью регулирования внутренней температуры посредством внешней оболочки.
Сначала атмосферу в автоклаве замещали монооксидом углерода и затем в него помещали 90 г (4,5 моля) безводного фторида водорода. После установки температуры жидкости на -30°C давление увеличивали до 2 МПа при помощи монооксида углерода.
Поддерживая реакцию при температуре -30°C и и давлении в 2 МПа, в автоклав через верх подавали 277,5 г раствора гептана, содержащего 1-изопропил-4-метилциклогексен в концентрации 32,0%, 4-изопропил-1-метилциклогексан в концентрации 16,1% и гептан в концентрации 51,9%, который представлял собой реакционную смесь, полученную в примере получения 1 и содержащую 0,64 моля 1-изопропил-4-метилциклогексена, и проводили реакцию карбонилирования. После завершения подачи раствора перемешивание продолжали в течение приблизительно 10 минут, пока наблюдалось поглощение монооксида углерода.
<Этерификация>
Затем, поддерживая реакцию при температуре -30°C, в автоклав через верх подавали 30,9 г (0,96 моля) метанола и реакцию этерификации проводили в течение 1 часа с перемешиванием.
Реакционную смесь через основание автоклава выливали в воду со льдом, и смесь разделялась на масляную фазу и водную фазу. Масляную фазу промывали дважды 100 мл 2%-го раствора гидроксида натрия и дважды 100 мл дистиллированной воды и дегидратировали при помощи 10 г безводного сульфата натрия.
Жидкость, полученную таким образом, анализировали при помощи газовой хроматографии и в результате обнаружили получение смеси с содержанием 62,8% изомера метил 1-изопропил-4-метилциклогексанкарбоксилата и 37,2% других изомеров.
После удаления низкокипящих компонентов путем выпаривания из полученной таким образом жидкости проводили разгонку при помощи ректификатора с числом теоретических тарелок 20 при температуре дистилляции 139°C под вакуумом в 60 торр, в результате чего получали 102,9 г смеси сложных эфиров, содержащих 74,0% метил 1-изопропил-4-метилциклогексанкарбоксилата и 26,0% других изомеров, в качестве основной фракция дистиллята, где выход составлял 59,7% мольных в зависимости от количества 1-изопропил-4-метилциклогексена.
<Восстановление карбонильной группы; получение (1-изопропил-4-метилциклогексил)метанола путем восстановления метил 1-изопропил-4-метилциклогексанкарбоксилата>
2,5 г Cu-Zn катализатора на носителе из оксида алюминия производства JGC Catalysts and Chemicals Ltd., 50,0 г смеси сложных эфиров, полученных в вышеуказанной главной фракции дистиллята, содержащей 74,0% метил 1-изопропил-4-метилциклогексанкарбоксилата и 26,0% других изомеров, загружали в автоклав из нержавеющей стали и реакцию восстановления проводили с перемешиванием в течение 20 часов при 260°C под давлением водорода в 10 МПа в потоке водородного газа без использования растворителей.
После фильтрования реакционной смеси для удаления катализатора получали 34 г продукта, представлявшего собой смесь, содержащую 73,5% (1-изопропил-4-метилциклогексил)метанола и 26,5% других изомеров, с выходом (1-изопропил-4-метилциклогексил)метанола 79,2% мольных в зависимости от количества метил 1-изопропил-4-метилциклогексанкарбоксилата.
После удаления низкокипящих компонентов путем выпаривания из полученной таким образом смеси проводили разгонку при помощи ректификатора с числом теоретических тарелок 20 для выделения целевого продукта. Полученная таким образом фракция дистиллята имела чистоту 92,0% и обладала превосходным цветочно-травянистым ароматом с бодрящими свежими нотами.
В результате ГХ-МС анализа обнаружили, что ее молекулярная масса составляла 170, что совпадало с молекулярной массой предполагаемого соединения.
По спектру 1H ЯМР, измеренному в тяжелом растворителе, хлороформе, обнаружили химические сдвиги (δ м.д., стандарт TMS) при 3,65 (ушир., 1H), 3,45 (с, 2H), 1,81 (м, 1H), 1,61 (м, 1H), 1,56 (м, 2H), 1,52 (м, 2H), 1,31 (м, 2H), 1,27 (м, 2H), 0,96 (д, 3H) и 0,83 (д, 6H), посредством чего соединение было идентифицировано как (1-изопропил-4-метилциклогексил)метанол, представленный формулой (1).
<Пример 2> Парфюмерная композиция фруктового типа
5 частей по массе соединения, представленного химической формулой (1), полученного в примере 1, смешивали с 95 частями по массе парфюмерной композиции, содержащей композицию, показанную в таблице 1, посредством чего парфюмерная композиция фруктового типа характеризовалась свежим сладким ароматом, напоминающим ананас.
| Таблица 1 | |
| Компонент | Части по массе |
| диметилбензилкарбинилбутират | 60 |
| диметилбензилкарбинилацетат | 10 |
| бензилбутират | 5 |
| «FRUITATE» Kao Corporation | 5 |
| «FLORAMAT» Kao Corporation | 5 |
| бензиловый спирт | 3 |
| этилмальтол | 3 |
| γ-ундекалактон | 1 |
| Ванилин | 1 |
| Ванитроп | 1 |
| Розовый тип | 1 |
| Общее количество | 95 |
Промышленная применимость
Новое алициклическое спиртовое соединение по настоящему изобретению является новым с точки зрения обладания превосходным цветочно-травянистым ароматом с бодрящими свежими нотами. Благодаря его превосходным свойствам поддерживать устойчивый аромат, оно является полезным в качестве ароматизирующего ингредиента для широкого ассортимента продуктов, таких как гигиено-косметические продукты, мыла и детергент для одежды.
Кроме того, промышленный способ получения алициклического спиртового соединения по настоящему изобретению позволяет получать указанное алициклическое спиртовое соединение выгодным с точки зрения промышленности способом.
1. Алициклическое спиртовое соединение, представленное химической формулой (1)
2. Парфюмерная композиция, содержащая алициклическое спиртовое соединение, представленное химической формулой (1)
3. Способ получения алициклического спиртового соединения, представленного химической формулой (1), путемвзаимодействия 1-изопропил-4-метилциклогексена, представленного химической формулой (2), с монооксидом углерода в присутствии фторида водорода,взаимодействия полученного фторангидрида 4-изопропил-1-метилциклогексанкарбоновой кислоты, представленного химической формулой (3), со спиртом с получением карбонильного соединения циклогексана, представленного общей формулой (4), ивосстановления указанного карбонильного соединения циклогексана, представленного общей формулой (4), с получением указанного алициклического спиртового соединения, представленного химической формулой (1), где R представляет собой алкильную группу, содержащую 1-4 углеродных атома.