Способ повышения устойчивости растений к абиотическим стрессам
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано при получении микробиологических средств регуляции роста и развития растений. Способ повышения устойчивости растений к абиотическим стрессам предусматривает обработку растений ассоциативными метилотрофными бактериями, оказывающими протекторное действие на рост и развитие растений, подверженных абиотическим стрессам. В качестве бактерий с протекторным действием используют природные изоляты метилобактерий, обладающих способностью к синтезу фитогормонов, гиббереллинов, цитокинов и ауксинов. Инокуляции могут быть подвергнуты семена и микроразмножаемые растения. Изобретение позволяет повысить продуктивность и устойчивость растений к неблагоприятным воздействиям внешней среды: дефициту влаги, повышенной кислотности, ионной токсичности. 6 табл., 6 пр.
Реферат
Изобретение относится к биотехнологии и сельскому хозяйству, а именно к микробиологическим средствам регуляции роста и развития растений.
Основной причиной снижения продуктивности сельскохозяйственных культур во всем мире являются различные неблагоприятные факторы абиотической среды.
В современном сельском хозяйстве повышение устойчивости растений к неблагоприятным условиям среды достигается сочетанием различных подходов. Так, методами традиционной селекции создаются пластичные сорта, обладающие повышенной устойчивостью к какому-либо стрессовому фактору, однако продолжительность периода выведения сорта, как правило, составляет длительный период времени - не менее 10 лет.
Существуют способы повышения толерантности к абиотическим стрессам за счет генно-инженерной трансформации клетки растений экзогенным полинуклеотидом, экспрессия которого придает клетке повышенную толерантность к абиотическому стрессу, а затем из клетки регенерируют фертильное растение [Ронен Д., Голан Е., Карчи X., Мейсснер Р. Способы повышения толерантности к абиотическому стрессу и/или биомассы у растений и получаемые таким образом растения // Патент РФ №2350653, публикация заявки 27.07.2006, БИ №9, 2009, дата приоритета 20.05.2004].
К недостаткам способа относится то, что он не может обеспечить кардинальное решение проблемы, поскольку устойчивость к абиотическим стрессам имеет полигенную природу, а способ предусматривает стратегию переноса одного-двух генов. К тому же, несовершенство генно-инженерных технологий обусловливает значительные медико-биологические и экологические риски при использовании генно-модифицированных растений.
Известны способы повышения устойчивости растений к метеорологическим и фитопатогенным стрессам за счет обработки семян и вегетирующих растений химическими средствами, обладающими одновременно ауксиновой и слабой ретардантной активностью [Гафуров Р.Г. Стресспротекторы-фиторегуляторы для растениеводства / Патент РФ №2394427, публикация заявки 20.07.2010, БИ №20, дата приоритета 05.02.2009].
Недостатки использования химических стресспротекторов-фиторегуляторов заключаются в их способности вызывать изменения в геноме растений вследствие специфики их химической природы; наличия в коммерческих препаратах примесей и образования мутагенов при их метаболизме в растениях [Хрусталева Л.И. Фиторегуляторы и их влияние на геном растений // Сельскохозяйственная биотехнология. Избранные работы / Под ред. B.C. Шевелухи. М.: «Евразия+». 2000. С. 158-169]. Существенным недостатком синтетических фиторегуляторов является их высокая стоимость, поскольку химический синтез аналогов фитогормонов сопряжен со слишком высокими затратами.
Ближайшим аналогом средства повышения устойчивости растений к неблагоприятным факторам абиотической среды является использование ризосферной ростстимулирующей бактерии Pseudomonas aureofaciens ВКМ В-2391Д для защиты и улучшения роста растений, растущих на почвах, загрязненных полициклическими ароматическими углеводородами (ПАУ) [Анохина Т.О. Кочетков В.В., Воронин A.M. Штамм бактерий Pseudomonas aureofaciens для защиты и улучшения роста растений, растущих на почвах, загрязненных полициклическими ароматическими углеводородами // Патент РФ №2352629. Публикация заявки 20.10.2007, БИ №11, дата приоритета 12.04.2006]. Техническим эффектом, который может быть получен при использовании данного штамма, является его способность улучшать рост растений, загрязненных ПАУ. Недостатком использования ризосферного штамма является зависимость эффективности его взаимодействия с растением от генетически обусловленного состава его корневых выделений. Например, активность колонизации ризосферы псевдомонадами зависит от соотношения сахаров и органических кислот в корневых выделениях, а основным условием синтеза индолил-уксусной кислоты (ИУК) ризосферными бактериями является наличие в корневых экссудатах триптофана - предшественника ИУК [Кравченко Л.В., Леонова Е.И. Использование триптофана корневых экзометаболитов при биосинтезе индолил-3-уксусной кислоты ассоциативными бактериями. // Микробиология. - 1993. - Т. 62. - №3. - С. 453-459.], содержание которого варьирует у различных видов и сортов растений. Ризосферные бактерии, как правило, не способны установить прочную ассоциативную связь с растениями из-за конкуренции с другими почвенными микроорганизмами, поэтому биопрепараты на их основе приводят к кратковременным положительным эффектам и требуют нескольких обработок в течение вегетационного периода. Недостаточная эффективность таких биопрепаратов может быть связана с потерей жизнеспособности клетками бактерий в почве или с низкой степенью приживаемости микроорганизмов на растениях.
В качестве прототипа изобретения выбрано использование ассоциативных метилобактерий для стимуляции роста и морфогенеза растений in vitro [Каляева М.А., Захарченко Н.С., Доронина Н.В., Рукавцова Е.Б., Иванова Е.Г., Алексеева В.В., Троценко Ю.А., Бурьянов Я.И. Стимуляция роста и морфогенеза растений in vitro ассоциативными метилотрофными бактериями // Физиология растений. 2001. Т. 48. №4. С. 596-599.]. Инокуляция метилотрофными бактериями изолированной растительной ткани приводила к формированию стойких микробно-растительных ассоциаций. При последующих пассажах, метилобактерий сохранялись в межклетниках и участвовали в метаболизме растений, оказывая положительное влияние на их рост и морфогенез. В этой работе рассматривали влияние на рост и развитие растений облигатных аэробных метилобактерий, а роль розовоокрашенных факультативных метилотрофных (РОФМ) бактерий в ней не показана. Кроме того, во всех перечисленных аналогах и прототипе нет сведений о возможности влияния колонизации бактериями на повышение устойчивости растений к стрессовым абиотическим факторам: дефицита влаги, токсичности ионов алюминия и кислой реакции среды.
Задачей предлагаемого изобретения является разработка способа повышения устойчивости растений к неблагоприятным факторам абиотической среды на основе фиторегуляторного и протекторного действия метилобактерий.
Поставленная задача решается тем, что семена и/или культивируемую in vitro растительную ткань инокулируют метилобактериями, используя природные немодифицированные микроорганизмы.
Сущность изобретения
Тесный ассоциативный симбиоз метилотрофных бактерий с растением, в отличие от PGPR-бактерий, не видоспецифичен. Он основан на функционировании природного «метанольного цикла», который заключается в использовании метилобактериями в качестве источника углерода и энергии метанола - естественного продукта метаболизма растений, снабжая их взамен биоактивными соединениями, вне зависимости от почвенно-климатических условий и генотипических особенностей растений. Благодаря уникальности метаболизма, метилобактерий не имеют конкурентов среди почвенных микроорганизмов. Кроме того, они способны колонизировать не только ризосферу, но и филоплану растений. Среди метилотрофных бактерий нет фитопатогенных видов, они не опасны для теплокровных животных и человека. Ассоциативные розовоокрашенные факультативные метилотрофные (РОФМ) бактерии отличаются высокой выживаемостью при высушивании и замораживании, устойчивостью к УФ радиации, низкой влажности и высокой температуре [Романовская В.А., Соколов И.Г., Малашенко Ю.П., Рокитко П.В. Мутабельность эпифитных и почвенных бактерий рода Methylobacterium и их резистентность к ультрафиолетовому и ионизирующему излучению // Микробиология. 1998. т. 67, №1. С. 106-115.]. Высокая жизнеспособность клеток РОФМ бактерий во внешней среде и хорошая приживаемость метилобактерий на растениях в сочетании со способностью к синтезу цитокининов, ауксинов, витаминов и других биологически активных веществ в строго сбалансированных количествах, благоприятствуют росту и развитию растений, повышают их устойчивость к стрессам.
Дополнительным преимуществом РОФМ бактерий является возможность инокуляции ими не только семян и посадочного материала, но и клонально микроразмножаемых растений, которые лишены естественной ассоциативной микрофлоры и особенно уязвимы к воздействию неблагоприятных факторов среды.
Условиями достижения технического результата являются использование штаммов метилотрофных бактерий, ассоциированных с растениями в местных природно-климатических условиях, использование суспензий ассоциативных бактерий для инокуляции семян с титром 106-109, а для инокуляции микроразмножаемых растений - суспензий с титром 106. Важно использовать штаммы, биосинтетическая активность которых подтверждена положительными результатами тестирования. Основным отличительным признаком используемых штаммов является их протекторное действие в отношении стрессированных растений за счет сбалансированного синтеза метаболитов с фиторегуляторной активностью.
Технический эффект, достигаемый при использовании предлагаемого изобретения, заключается в повышении устойчивости растений к неблагоприятным воздействиям внешней среды: дефициту влаги, повышенной кислотности, ионной токсичности.
Описание изобретения
С целью повышения устойчивости растений к неблагоприятным факторам абиотической среды проводят инокуляцию семян и микроразмножаемых растений культурами метилобактерий с фиторегуляторным и протекторным действием.
Для инокуляции растений используют штаммы метилотрофных бактерий, получая элективную культуру на минеральной среде Канеда с метанолом, содержащей (г/л): KH2PO4 - 2, (NH4)SO4 - 2, MgSO4·7H2O - 0.125, NaCl - 0.5, FeSO4·7H2O - 0.002, дрожжевой автолизат - 0.1. Метанол в количестве 1% (об.:об.) добавляют после стерилизации и остывания среды до 30°C, разливают среду по 50 мл в колбы, объемом 250 мл. Засев среды производят, помещая сегменты основания листа и листовые влагалища зерновых злаков или напочвенные водорослевые пленки (наиболее благоприятные места для обитания метилотрофных бактерий) из расчета 10 кв. см на 50 мл среды. Культивирование проводят при 27°C на качалке (180 об/мин) в течение 7 сут. Из колб, содержимое которых приобрело розовый оттенок, отбирают по 1 мл накопительной культуры и высевают методом серийных разведений на агар Канеда с добавлением 2% метанола. Культивируют посевы при 27°C в течение 5-7 сут. Появившиеся мелкие (0,5-2,0 мм) колонии розового цвета изолируют под контролем стереоскопического микроскопа (×6-8 раз) и выделяют в чистую культуру.
Полученные таким образом культуры метилобактерий выращивают методом жидкофазного культивирования на минеральной среде того же состава при 27°C на качалке (180 об/мин) в течение 2 суток. Для определения способности бактерий синтезировать фитогормоны используют культуральную жидкость, которую предварительно освобождают от клеток микроорганизмов центрифугированием при 6000 об/мин в течение 10 мин.
Определение способности бактерий к синтезу ауксинов. Для определения способности бактерий синтезировать ауксины используют колориметрический метод анализа с реактивом Сальковского (1 мл 0,5М FeCl3 в 50 мл 35% хлорной кислоте). При смешении реактива Сальковского с надосадочной жидкостью в соотношении 1:2 через 30-40 мин появляется розовое окрашивание, по которому судят о наличии в культуральной жидкости ауксинов. Количественное определение ауксинов в надосадочной жидкости проводят на ФЭК 56М при длине волны 540 нм. Для построения калибровочного графика используют разведения стандартного раствора ИУК ("Fluca", Швейцария). Контролем служит питательная среда, на которой выращивают бактериальные культуры.
Определение способности бактерий к синтезу цитокининов. Определение цитокинина в культуральной жидкости бактерий проводят согласно методике, основанной на способности цитокининов задерживать старение листьев, в частности замедлять их пожелтение, что возможно зарегистрировать фотометрически. Ячмень выращивают в емкостях с почвой в условиях климакамеры. В возрасте 10-15 суток у растений отбирают сходные по размеру и цвету листья первого яруса. Их разрезают, отступив 2 см от нижнего края листа, на сегменты длиной 2 см. Сегменты раскладывают на фильтровальную бумагу, смоченную 3 мл КЖ испытуемой бактерии, и помещенные в стерильные чашки Петри диаметром 10 см. В каждую чашку помещают до 9 листовых сегментов. В контроле для смачивания фильтровальной бумаги используют неинокулированную среду. Чашки инкубируют при 20-25°C в кювете под стеклом при освещении лампами дневного света. Сохранение хлорофилла в сегментах ячменя оценивают через 7-10 суток инкубации. Для этого из трех сегментов вырезают пробочным сверлом по два диска диаметром 5 мм. Диски объединяют и растирают с 80%-м этанолом в фарфоровой чашке для упаривания, добавляя на кончике ланцета кварцевый песок и CaCO3. Полученный раствор количественно переносят в центрифужную пробирку и отделяют осадок центрифугированием в течение 5 мин при 2 тыс.об/мин. Осадок отбрасывают, а объем надосадочной жидкости доводят 80% этанолом до 5 мл. Оптическую плотность раствора определяют при 665 нм против контроля, которым является раствор, полученный путем объединения экстрактов хлорофилла из отрезков листьев, экспонированных на неинокулированной среде. Результаты выражают в оптических единицах. Для построения калибровочной кривой используют отрезки листьев ячменя, которые экспонируют на фильтровальной бумаге, смоченной растворами кинетина разных концентраций - от 1 до 50 мг/л. Контролем служат отрезки листьев, экспонированные на дистиллированной воде.
Определение способности бактерий к синтезу гиббереллинов проводят методом биотестирования на гипокотилях (подсемядольное колено) проросших семян салата {Lactuca sativa L.). Семена проращивают в течение двух дней на влажной фильтровальной бумаге в чашках Петри, помещенных в термостат при 25°C в темноте. Затем отбирают проростки с одинаковыми по длине корешками 6-8 мм и гипокотелем не более 5 мм, помещают их в стерильные чашки Петри на диск фильтровальной бумаги, смоченный 3 мл КЖ испытуемых штаммов микроорганизмов. В качестве контроля используют стерильную неинокулированную среду. Для каждой пробы берут по 10 проростков. Инкубацию проводят, размещая кюветы с чашками на 15 см ниже постоянного источника света. Длину гипокотилей измеряют через 3 суток. Принимая, что величина прироста гипокотелей прямо пропорционально зависит от концентрации гормона, для определения концентрации гиббереллина в КЖ микроорганизмов строят калибровочную кривую на основе данных, полученных в результате измерения длины гипокотилей в аналогичном варианте с использованием растворов гиббереллина в концентрациях от 1 до 100 мг/л.
Основным отличительным признаком штаммов метилотрофных бактерий, пригодных для инокуляции растений в целях повышения их стрессоустойчивости, является продукция ауксинов в пределах от 3 до 15 мкг/мл, цитокининов - не менее 0,5 мкг/мл, гиббереллина - не менее 0,15 мкг/мл.
Технический эффект, который достигается при использовании предлагаемого изобретения, заключается в повышении продуктивности и устойчивости растений к неблагоприятным воздействиям внешней среды: дефициту влаги, повышенной кислотности, ионной токсичности. Условиями достижения технического результата являются использование штаммов метилотрофных бактерий, ассоциированных с растениями в местных природно-климатических условиях, использование суспензий ассоциативных бактерий для инокуляции семян с титром 106-109, а для инокуляции микроразмножаемых растений - суспензий с титром 106. Важно использовать штаммы, биосинтетическая активность которых подтверждена положительными результатами тестирования. Основным отличительным признаком используемых штаммов является их протекторное действие в отношении стрессированных растений за счет сбалансированного синтеза метаболитов с фиторегуляторной активностью.
Далее приводятся примеры, показывающие эффективность применения природных изолятов метилотрофных бактерий для стимуляции ростовых процессов у растений, подвергнутых различным видам абиотических стрессов.
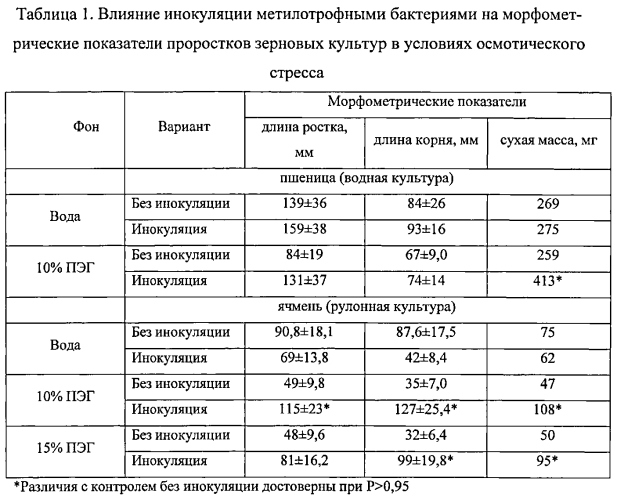
Пример 1, демонстрирующий стимуляцию роста пшеницы (Triticum aestivum L.) и ячменя {Hordeum vulgare L.) метилобактериями в условиях осмотического стресса. Семена растений стерилизовали в 2%-ном растворе препарата Виркон C в течение 15 мин, замачивали для инокуляции в жидких культурах метилобактерий (106 КОЕ/мл) на 24 ч (пшеница) и (109 КОЕ/мл) 4 ч (ячмень). Контролем служили семена, замоченные в среде Канеда, на которой выращивали культуры метилобактерий. После замачивания семена пшеницы проращивали в водной, а ячмень - в водно-бумажной культуре в сосудах, заполненных раствором Кнопа в половинной концентрации. Для создания осмотического стресса в раствор добавляли 10 и 15% полиэтиленгликоля (ПЭГ) с относительной молекулярной массой 6000. Растения выращивали при освещенности 10 Клк, фотопериоде 16 часов и температуре 23/18°C день/ночь. Линейные размеры и сухую массу проростков пшеницы определяли через 14 суток, у проростков ячменя - через 7 суток после инокуляции.
В результате инокуляции метилотрофными бактериями сухая масса проростков пшеницы в условиях дефицита влаги, обусловленного добавлением 10% ПЭГ, была на 59% выше, чем в контроле без инокуляции (табл. 1). Линейные размеры и сухая биомасса проростков ячменя, выращенных на фоне 10% ПЭГ, достоверно превысили высоту ростка, длину корня и сухую массу неинокулированных проростков в 2,3; 3,6 и в 2,3 раза соответственно. На фоне осмотического стресса, обусловленного 15% ПЭГ, длина корня и сухая масса инокулированных метилобактериями проростков ячменя превышали в 3,1 и 1,9 раза соответствующие показатели растений без инокуляции. Таким образом, в условиях осмотического стресса метилотрофные бактерии оказали на проростки пшеницы и ячменя протекторное и фиторегуляторное действие.
Пример 2, демонстрирующий изменение в результате инокуляции метилобактериями направленности морфогенеза в каллусной ткани ячменя, подвергнутой токсическому действию ионов алюминия. Для получения растений-регенерантов, устойчивых к ионам алюминия, используется каллусная ткань с продуктивным типом морфогенеза. Каллусную ткань ячменя получали и культивировали общепринятым методом на питательной среде Мурасиге и Скуга с введением 40 мг/л Al3+ при pH 3,8. Для инокуляции каллусной ткани использовали природные изоляты метилобактерий. Инокулировали 10-14 дневные каллусы, нанося культуру бактерий (107 КОЕ/мл) стерильной кисточкой на всю поверхность каллуса. Тип морфогенеза в каллусных культурах трех генотипов ячменя оценивали по наличию побегов и корней, сформированных одним каллусом на 20-й день после инокуляции (табл. 2).
Под воздействием инокуляции метилобактериями доля каллусных линий, реализующих продуктивный тип морфогенеза в стрессовых условиях, повысилась на 7,1-21,1% по сравнению с контролем без инокуляции, в зависимости от генотипа ячменя. Увеличению регенерационной способности каллусной ткани ячменя в присутствии ионов алюминия способствовало стресспротекторное и фиторегуляторное действие метилобактерий.
Пример 3, демонстрирующий повышение частоты регенерации растений в каллусной культуре ячменя в условиях стресса, обусловленного сочетанием токсичности ионов алюминия и дефицита влаги. Каллусные культуры ячменя трех различных генотипов получали и культивировали согласно общепринятому методу. На этапе пролиферации каллус пассировали на стандартную питательную среду Мурасиге и Скуга с добавлением 20 мг/л Al3+ при pH 3,8, а на этапе морфогенеза - с добавлением 10% ПЭГ. Инокулировали природными изолятами метилотрофных бактерий 10-14-дневные каллусы ячменя, нанося культуру бактерий (107 КОЕ/мл) стерильной кисточкой на всю поверхность каллуса. Оценивали частоту регенерации растений через 35 дней после инокуляции (табл. 3).
Количество растений-регенерантов, индуцированных различными генотипами ячменя в стрессовых условиях при инокуляции каллусов культурами метилобактерий, существенно превышало число растений регенерантов, полученных в контроле без инокуляции.
Пример 4, демонстрирующий стимуляцию роста растений картофеля (Solatium tuberosum L.) в меристемной культуре.
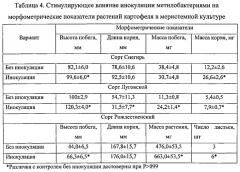
Культивирование меристемных растений картофеля проводили по стандартной методике на питательной среде Мурасиге и Скуга с добавлением 0,5 мг/л гибберелловой кислоты и 0,1 индолил-3-уксусной кислоты. Инокулировали метилобактериями микрочеренки картофеля, нанося культуру метилобактерий стерильной кисточкой на всю поверхность черенка. Эффективность инокуляции метилобактериями оценивали по морфометрическим показателям растений через 35 суток после инокуляции (табл. 4).
При микроклональном размножении картофеля метилобактериями инокуляция черенков приводила к более интенсивному росту побега и корня, формированию большего числа листьев, чем у неинокулированных растений в контроле.
Пример 5, демонстрирующий повышение в результате инокуляции метилобактериями адаптивности полученных при клональном микроразмножении растений земляники (Fragaria ananassa Duch.) к почвенным условиям.
Перевод клонально микроразмноженных in vitro меристемных растений в нестерильные условия часто бывает осложнен их низкой приживаемостью и слабым ростом. Для повышения адаптивности к почвенным условиям корни меристемных растений земляники инокулировали погружением на 24 ч в жидкую культуру метилобактерий (109 КОЕ/г), после чего растения высаживали в стаканчики с промытым и прокаленным речным песком. Спустя 1 месяц учитывали массу и линейные размеры растений. Контролем служили одновозрастные растения без инокуляции (табл. 5).
В результате инокуляции метилобактериями корней перед высадкой земляники в песчаную культуру увеличилась на 15% биомасса и на 32% - высота надземной части по сравнению с контрольными растениями. Это указывает на возможность использования метилобактерий для повышения адаптивности клонально микроразмножаемых in vitro растений земляники.
Пример 6, демонстрирующий повышение в результате инокуляции метилобактериями продуктивности клонально микроразмноженных растений картофеля при перенесении их в почвенные условия.
Меристемные растения картофеля, подвергнутые in vitro инокуляции метилобактериями, через 35 суток после инокуляции высаживали в почву и выращивали в вегетационных сосудах в контролируемых условиях климакамеры и при естественном освещении и влажности на вегетационной площадке. Учитывали количество и массу клубней с одного растения (табл. 5).
Положительный эффект колонизации метилобактериями меристемного картофеля продолжался таким образом, и при переводе растений из условий in vitro в почву. Масса клубневого потомства растенй, инокулированных метилобактериями, были достоверно выше, чем в контрольных вариантах без инокуляции.
Таким образом, заявленное изобретение обеспечивает технический эффект, заключающийся в повышении продуктивности и устойчивости растений к неблагоприятным воздействиям внешней среды: дефициту влаги, повышенной кислотности, ионной токсичности.
Способ повышения устойчивости растений к абиотическим стрессам, включающий обработку микроорганизмами со стресспротективным и фиторегуляторным действием, отличающийся тем, что колонизируют семена и/или микроразмножаемые in vitro растения выделенными из природных растительных субстратов в накопительной культуре с метанолом и отобранными тестированием на фиторегуляторную активность ассоциативными метилобактериями, выращенными в суспензионной культуре до концентрации 106-109 КОЕ/мл.