Ферментация и очистка гепаросана к5
Иллюстрации
Показать всеСпособ получения по существу чистого гепаросана из E.coli K5 предусматривает культивирование клеток E.coli K5 в среде, содержащей глюкозу в качестве основного источника углерода, осуществление связывания гепаросана с твердофазным носителем с последующим элюированием и осаждение гепаросана из элюата. При этом указанное культивирование включает фазу периодического культивирования и фазу периодического культивирования с подпиткой. Среда, применяемая на стадии периодического культивирования, содержит (на литр) примерно 20 г глюкозы, 10-300 мг тиамина, примерно 13,5 г KH2PO4, примерно 4,0 г (NH4)2HPO4, примерно 1,4 г MgSO4·7H2O, примерно 1,7 г лимонной кислоты, и примерно 10,0 мл раствора микроэлементов, раствор микроэлементов по существу состоит из (на 1 л 5М HCl) 10,0 г FeSO4·7H2O, 2,0 г CaCl2, 2,2 г ZnSO4·7H2O, 0,5 г MnSO4·4H2O, 1,0 г CuSO4·5H2O, 0,1 г (NH4)6Mo7O24·4H2O и 0,02 г Na2B4O7·10H2O. Среда для подпитки, применяемая на стадии периодического культивирования с подпиткой, содержит (на литр): 250-1000 г глюкозы, 20 г MgSO4, 0,15-0,5 г тиамина и, возможно, 47 г KH2PO4. Снабжение кислородом осуществляют барботированием воздуха с дополнительной подачей или без дополнительной подачи кислорода. Способ позволяет получить по меньшей мере на 90% чистый гепаросан. 13 з.п. ф-лы, 12 ил., 1 табл., 3 пр.
Реферат
Настоящая заявка испрашивает приоритет по предварительной заявке на патент США №61/275, 675, поданной 1 сентября 2009 года, которая включена в настоящую заявку посредством ссылки в полном объеме.
ЛИЦЕНЗИОННЫЕ ПРАВА ГОСУДАРСТВА
Настоящее изобретение было осуществлено при поддержке Федерального правительства США по грантам GM38060 и HL096972, присужденным Национальным институтом здоровья. Федеральное правительство США имеет определенные права на настоящее изобретение.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Гепарин и гепарансульфат представляют собой биологически важные молекулы, вовлеченные в процесс антикоагуляции крови, вирусные и бактериальные инфекции, ангиогепез, воспаление, рак и в процессы развития. Linhardt (2003) "Heparin: structure and activity," J Med Chem, 46: 2551-2554. Linhardt RJ, Toida T. (2004) "Role of glycosaminoglycans in cellular communication," Ace Chem Res, 37: 431-438. Гепарин находит широкий спектр применения, в том числе в хирургии, в процессе оксигенации в аппарате искусственного кровообращения и при почечном диализе, при лечении тромбоза глубоких вен и острого коронарного синдрома. Linhardt "Heparin: an important drug enters its seventh decade." Chem. Ind. 2, 45-50 (1991); Agnelli et al. "Enoxaparin plus compression stockings compared with compression stockings alone in the prevention of venous thromboembolism after elective neurosurgery" N Engl J Med 339 (2), 80-5 (1998). Гепарином также покрывают поверхности емкостей для крови и медицинского оборудования, в том числе пробирок и гемодиализного аппарата, для формирования антикоагулянтной поверхности. Гепарин в настоящее время получают из тканей животных в количестве примерно 100 тонн/год, но такой гепарин может быть загрязнен другими биологическими продуктами. Linhardt Chem. Ind. 2, 45-50 (1991). Гепарин, загрязненный сверхсульфатированным хондроитинсульфатом, стал причиной гибели примерно 100 американцев в 2008 году. Guerrini, et al. "Oversulfated chondroitin sulfate is a contaminant in heparin associated with adverse clinical events." Nature Biotechnology 26, 669-675 (2008).
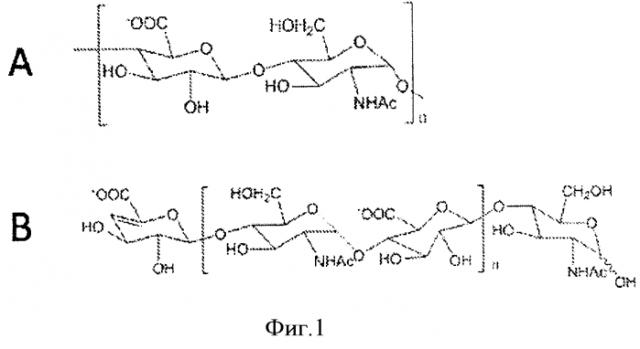
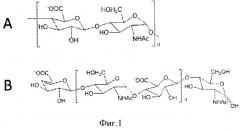
Природный предшественник биосинтеза эукариотического гепарина, гепаросан, представляет собой полисахарид с повторяющимся дисахаридным блоком [→ 4) β-D-глюкуроновая кислота (GlcA) (1→4) N-ацетил-α-D-глюкозамин (GlcNAc) (1→]n, показанным на Фиг.1.
Гепаросан также синтезируются в виде полисахаридиой капсулы у бактерий, в том числе у Escherichia coli K5 и Pasteurella multicida. Lindahl U et al. (1998) "Regulated diversity of heparan sulfate" J Biol Chem 273(39):24979-24982. Синтез гепаросана K5 по имеющимся данным начинается с 2-кето-3-дезоксиоктулозоновой кислоты. Finke A et al. 5 (1991) "Biosynthesis of the Escherichia coli K5 polysaccharide, a representative of group II capsular polysaccharides: polymerization in vitro and characterization of the product" J Bacterial 173(13):4088-94. Затем гепаросан K5 удлиняется за счет альтернативного действия гликотрансфераз KfiA и KfiC, которые присоединяют GlcNAc и GlcA к невосстанавливающему концу растущей полисахаридной цепи. Hodson N et al. (2000) "Identification that KfiA, a protein essential for the biosynthesis of the Escherichia coli K5 capsular polysaccharide, is an alpha -UDP-GlcNAc glycosyltransferase. The formation of a membrane-associated K5 biosynthetic complex requires KfiA, KfiB, and KfiC." J Biol Chem 275(35):27311-5. После синтеза цепь гепаросана транспортируется на поверхность клетки посредством пути, в который вовлечены шесть белков: KpsC, KpsD, KpsE, KpsM, KpsS и KpsT. McNulty С et al. (2006) "The cell surface expression of group 2 capsular polysaccharides in Escherichia coli: the role of KpsD, RhsA and a multi-protein complex at the pole of the cell" Mol Microbiol 59(3):907-22. Считается, что цепь гепаросана K5 заякорена на поверхности клетки через замещение липидной группы на молекулу фосфатидной кислоты на редуцирующем конце полисахарида в наружной мембране Е. coli. Jann В, Jann K. (1990) "Structure and biosynthesis of the capsular antigens of Escherichia coli" Curr Top Microbiol Immunol 150:19-42. Фрагменты полисахарида гепаросана могут высвобождаться из клеток Е. coli K5 за счет действия гепаросаплиазы К5, фермента бактериофагального происхождения, который расщепляет гепаросановую цепь посредством механизма β-элиминирования. Manzoni М et al. (1996) "Production of K5 polysaccharides of different molecular weight by Escherichia coli" Journal of Bioactive and Compatible Polymers 11 (4):301 -311. Manzoni М, et al. (2000) "Influence of the culture conditions on extracellular lyase activity related to K5 polysaccharide." Biotechnology Letters 22(1):81-85. Активность лиазы K5 может оказывать влияние на количество гепаросана, выделяемого в культуральную среду, а также на структуру и характеристику молекулярного веса гепаросана, как находящегося в клетках, так и высвобождаемого в среду (Фиг.16). Гепаросан К5, но оценкам, имеет молекулярный вес (Mw) 20000 и состоит из двух основных субкомпонентов с молекулярным весом (Mw) 16000 и 1500. Соотношение двух субкомпонентов соответствует общему молекулярному весу и зависит от активности лиазы K5. Vann WF et al./ (1981) "The structure of the capsular Polysaccharide (K5 Antigen) of Urinary-Tract-Infective Escherichia-Coli 010-K5-H4 - a Polymer Similar to Desulfo-Heparin" European Journal of Biochemistry 116(2):359-364; Manzoni (2000) Biotechnology Letters 22(1):81-85.
Как показали лабораторные исследования, гепаросап со средним молекулярным весом (Mw)>10000, полученный из штамма Е. coli K5, может быть ферментативно превращен в полисахарид-антикоагулянт, схожий с гепарином. Lindahl et al. (2005) "Generation of "Neoheparin" from E coli K5 capsular polysaccharide"./ Med Chem 48(2):349-352; Zhang et al. (2008) "Solution structures of chemoenzymatically synthesized heparin and its precursors" Journal of the American Chemical Society 130(39): 12998-13007. Гепаросан также можно применять для различных целей (WO 2009/014559).
Настоящее изобретение описывает способ ферментации Е. coli K5 с высоким выходом гепаросана и эффективного выделения гепаросана высокой степени чистоты, применимый для промышленного производства гепаросана.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к усовершенствованному способу производства гепаросана с помощью ферментации Е. coli K5, выделения полисахарида K5, и очистки.
В одном из вариантов реализации указанный способ включает (а) культивирование E.coli K5 в среде заданного состава с глюкозой в качестве основного источника углерода (б) осуществление связывания гепаросана с твердофазным носителем с последующим элюированием, и (в) осаждение гепаросана из элюата. Способ пригоден для продукции по существу чистого гепаросана, степень чистоты которого составляет не менее 90%.
В соответствующих вариантах реализации указанный способ включает в себя две стадии культивирования, а именно периодическое культивирование и периодическое культивирование с подпиткой, причем (а) среда, применяемая на стадии периодического культивирования, включает (на 1 литр) примерно 20 г глюкозы, 10-300 мг тиамина, примерно 13,5 г KН2РО4, примерно 4,0 г (NH4)2HPO4, примерно 1,4 г MgSO4·7H2O, 1,7 г лимонной кислоты, и примерно 10,0 мл раствора микроэлементов (на литр), при этом раствор микроэлементов включает (на 1 л 5 М НСl) 10,0 г FeSO4·7H2O, 2,0 г CaCl2, 2,2 г ZnSO4·7H2O, 0,5 г MnSO4·4H2O, 1,0 г CuSO4 ·5H2O, 0,1 г (NH4)6МO7O24·4Н2O и 0,02 г Na2B4O7·10H2O и где (б) раствор для подпитки, используемый на стадии культивирования с подпиткой, включает (на 1 литр): 250-1000 г глюкозы, примерно 20 г MgSO4·7H2O и 0,15-0,5 г тиамина, и может содержать примерно 47 г KН2РO4.
В соответствующих вариантах реализации поступление кислорода обеспечивают путем барботирования воздухом. Воздух может быть дополнен кислородом. Предпочтительно концентрацию растворенного кислорода поддерживают на уровне примерно 20%. В некоторых вариантах реализации применяют чистый кислород. В других соответствующих вариантах реализации условия культивирования включают температуру, поддерживаемую па уровне 37°С, и рН, поддерживаемый па уровне примерно 7. рН можно поддерживать путем добавления раствора аммиака или газообразного аммиака. В некоторых вариантах, раствор аммиака составляет примерно 25-35%, в частности, примерно 30%, например, 29%.
В конкретных вариантах реализации среду для подпитки, применяемую на стадии культивирования с подпиткой, подают со скоростью, определяемой по формуле:
M s ( t ) = F ( t ) S F ( t ) = ( μ Y X S + m ) X ( t 0 ) V ( t 0 ) exp [ μ ( t − t 0 ) ] ,
где MS представляет собой скорость потока источника углерода (г/ч), F - скорость подачи раствора для подпитки (л/ч); SF представляет собой концентрацию источника углерода в подпитке (г/л); Х - концентрация клеток (г/л с.м.к.), m - удельный коэффициент поддержания (г/г DCW/ч), V - объем культуры (л); t0 - время начала подпитки; t - время процесса; µ - удельная скорость роста (ч-1) и YX/s - выход клеток на количество источника углерода (г/г).
Указанный способ также включает осуществление связывания и элюирования гепаросана из культуральной среды. В одном варианте реализации гепаросан получают из бесклеточного супернатанта. В другом варианте реализации гепаросан получают из клеток путем их обработки детергентом, таким как ДСН (например, 1% ДСН), при перемешивании.
После удаления клеток связывание и элюирование может включать смешивание анионообменных смол с супернатантом культуры с последующим удалением супернатанта, промыванием смолы с 50 мМ раствором хлорида натрия в натрий-ацетатном буфере при рН 4, элюированием раствором 1 М хлорида натрия в натрий-ацетатном буфере при рН 4.
Кроме того, реакцию связывания и элюирования можно проводить с помощью хитозана. В одном из вариантов реализации супернатант культуры смешивают с раствором хитозана для осаждения. Затем отделяют осадок, промывают его, например, водой или каким-либо разбавленным буфером и элюируют с помощью сильного основания, такого как 1М NaOH. Связывание и элюирование с применением хитозана можно проводить в дополнение с анионным обменом. После осуществления связывания и элюирования гепаросан осаждают из элюата, например, с помощью этанола или метанола. В одном из вариантов реализации используют 3 объема этанола. Полученный осадок обычно промывают и высушивают.
Этот способ также включает дополнительную стадию депирогенизации, например, путем окисления, в том числе с помощью перекиси водорода.
Способ настоящего изобретения позволяет получить высокий выход гепаросана с высокой степенью чистоты из небольшого объема культуры за короткий период времени и с низким содержанием загрязняющих веществ. Таким образом, настоящее изобретение можно применять для промышленного производства гепаросана. Выход продукта гепаросана может быть получен при ферментации менее чем за 60 часов, менее чем за 48 часов и менее чем 40 часов без учета роста стартовой культуры. В других вариантах реализации первоначальный объем культуры составляет 3 л на этапе периодического культивирования до 7 литров на стадии подпитки, и подобные соотношения. В соответствующих вариантах реализации, таким образом, из культуры получают по меньшей мере 10 г/л, по меньшей мере 11 г/л, по меньшей мере 12 г/л, по меньшей мере 13 г/л, по меньшей мере 14 г/л, а по меньшей мере 15 г/л гепаросана. Степень чистоты по существу чистого гепаросана составляет по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, или по меньшей мере 99% чисты. В соответствующих вариантах реализации гепаросан содержит менее 1% ДНК и менее 2% белка. Гепаросан можно применять для переработки в гепарин. В одном варианте реализации гепаросан имеет среднечисленный молекулярный вес по меньшей мере 10, 20, 30, 40, 50 или 60 кДа, например примерно 58 кДа, средневесовой молекулярный вес по меньшей мере 20, 30, 40, 50, 60, 70, 80 или 90 кДа, например примерно 84 кДа, и индекс полидисперсности (ИПД) менее 2,0, например, меньше 1,9, 1,8, 1,7, 1,6, 1,5, 1,4 или 1,3, в том числе примерно 1,4.
В других вариантах реализации настоящее изобретение включает применение гепаросана, полученного описанным выше способом, при приготовлении фармацевтических препаратов, например для нанесения покрытия на медицинские изделия. В схожих вариантах реализации гепаросан применяют для производства гепарина. Соответственно, изобретение представляет собой способ применения гепаросана или гепарина, полученного вышеизложенным способом, для изготовления лекарственных средств.
В других вариантах реализации изобретение относится к гепаросану, полученному вышеизложенным способом, в том числе гепаросану со степенью чистоты по меньшей 5 мере 90%. по меньшей мере 95% и более. В схожих вариантах реализации изобретение относится к гепарину, полученному из указанного гепаросана.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1. Структура гепаросана. А. Повторяющийся дисахаридный блок гепаросана В. Структура цепи гепаросана в результате действия K5 гепаросанлиазы.
Фигура 2. Спектр 1Н-ЯМР (600 МГц) гепаросана, полученного из культуры, выращенной во встряхиваемой колбе. А. Стек-диаграмма, показывающая количество гепаросана, полученного из: 1. среды LB, 2. среды LB с МWсредн>3000, 3. среды LB с МWсредн<3000; на вставке представлен анализ в образцов 1, 2 и 3 с помощью электрофореза в ПААГ. В. Гепаросан, полученный из среды М9. С. Гепаросан, полученный из среды с заданным содержанием глицерина. D. Гепаросан, полученный из среды заданного состава с глюкозой.
Фигура 3. Продукция гепаросана в ферментере объемом 7 л. На Панели А показана кривая подачи глюкозы (черный цвет), кривая изменения рН (синяя) и кривая содержания 20 растворенного кислорода (% DO) (красная) в зависимости от времени ферментации (часы). На Панели В показана кривая роста клеток (общ. с.м.к. г,▲) и выработки гепаросана (г,▪) в зависимости от времени ферментации (часы).
Фигура 4. Характеристика гепаросана, очищенного из супернатанта 7 л культуральной среды. А. 1Н-ЯМР (600 МГц) (600 МГц) гепаросана. В. 13С-ЯМР 25 гепаросана, полученного из среды М9, содержащей 13C-глюкозу и 15N-сульфат аммония. С. Анализ с помощью Фурье-МС цепи гепаросана со средней молекулярной массой 4551,81 (степень полимеризации=24), очищенного с помощью препаративного электрофореза в ПААГ (Ly et al., 2010).
Фигура 5. Анализ молекулярной массы гепаросана с помощью электрофореза в 30 ПААГ, окрашенном красителем альциановый синий. А. Молекулярные стандарты, охватывающие диапазон градиентного геля. На дорожках представлены: 1. Молекулярные маркеры ГК (30 кДа-310 кДа), 2. Молекулярные маркеры гепаросана (6,4 кДа-14.1 кДа). В. Гепаросан, полученный при культивировании во встряхиваемой колбе в различных средах. На дорожках представлены: 1. Гепаросан из среды М9, 2. Гепаросан из синтетической среды с глицерином, 3. Гепаросан из синтетической среды с глюкозой, и 4. Гепаросан из среды LB. С. Пробы гепаросана, производимого в 7 л ферментере, взятые на разных сроках. На дорожках представлены: 1-6. Пробы гепаросана из ферментера взятые через 4,5 ч, 12,6 ч, 14,5 ч, 20 ч, 32,9 ч и 37,6 ч после начала культивирования.
Фигура 6. Временная динамика характеристики молекулярного веса гепаросана, производимого в 7 л ферментере. Показаны изменения среднечисленного молекулярного веса MN(■), средневесового молекулярного веса MW (●) и индекса полидисперсности PDIС(▲).
Фигура 7. Изменение содержания рН (■) и растворенного кислорода (% DO) (♦) в зависимости от времени ферментации (часы) в 20 л ферментере.
Фигура 8. Временная динамика роста клеток (с.м.к. г/л, (■)) и концентрации гепаросана в супернатанте культуральной среды (г/л, (♦)) в 20 л ферментере.
Фигура 9. 1Н-ЯМР-спектр образцов очищенного гепаросана.
Фигура 10. Концентрация гепаросана в супернатанте после осаждения с 15 использованием различного количества хитозана из 10 мл раствора чистого гепаросана 1 мг/мл.
Фигура 11. Процент выхода с использованием различного количества хитозана из 10 мл раствора чистого гепаросана 1 мг/мл.
Фигура 12. Процент выхода с использованием различного количества хитозана из 20 10 мл проб разбавленной в 5 раз культуральной среды.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Гепаросан представляет собой полисахарид с повторяющимся дисахаридным блоком [GlcAα-(1-4)GlcNAcR(1-4)]n. Поскольку экзополисахарид K5 образуется из гепаросана, который выделяют и очищают в соответствии с настоящим изобретением, «гепаросан» в определенном контексте может относиться к гепаросану, связанному с бактериями, присутствующему в культуральной среде, и к гепаросану на стадии выделения и очистки. Значение термина «гепаросан» в соответствующем контексте будет 30 понятно специалисту в данной области.
Escherichia coli K5 относится к вариантам Е. coli, которые продуцируют экзополисахарид К5. Подходящие для применения в настоящем изобретении штаммы Е. coli K5 могут быть получены из государственных коллекций, таких как АТСС (Американская коллекция типовых культур, США), например штамм Е. coli ATCC23506.
Штаммы Escherichia coli K5 могут быть выделены из клинических источников и/или могут быть генетически модифицированными.
При использовании в настоящей заявке термин «ферментация» относится к размножению бактерий и продукции экзополисахарида, в частности экзополисахарида K5. При использовании в настоящей заявке термин «изолированный/выделенный» означает, что гепаросан отделен от питательной среды и бактериальных клеток и присутствует в количестве, достаточном для его идентификации или применения.
При использовании в настоящей заявке термин «по существу чистый» означает, что гепаросан по существу не содержит других веществ до такой степени, что он подходит для практического применения по назначению. По существу чистый гепаросан является по меньшей мере на 90% чистым. Предпочтительно, вещество свободно от примесей более чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или даже более чем 99%. Степень чистоты можно оценить с помощью способов, известных в данной области.
При использовании в настоящей заявке объекта в единственном числе, подразумевается «один или более», если особым образом не оговаривается, что подразумевается «только один».
Термин «примерно/примерно» используется в соответствии с пониманием специалиста в данной области в том контексте, к которому относится указанный термин. Для численных значений предполагается, что термин «примерно/примерно» охватывает изменения указанного значения в пределах 10%.
ФЕРМЕНТАЦИЯ Е. coli K5 ДЛЯ ПРОИЗВОДСТВА ГЕПАРОСАНА
Для определения надлежащих условий ферментации необходимо учитывать многие факторы. Е. coli, в целом, может расти на самых разных средах и при различных значениях рН, температуры, О2 и других условиях. Однако в отличие от лабораторных штаммов, штамм Е. coli K5 не подвергался обширному генетическому исследованию, изучению его роста и функций.
Изменения условий роста могут оказывать влияние на (а) скорость роста бактерий, (б) максимальную плотность клеток (в) производство экзополисахаридных капсул K5, (г) степени модификации капсулы Е. coli K5, на состояние резидентного бактериофага в Е. coli K5, и другие факторы, (д) высвобождение экзополисахаридной капсулы K5 в среду, (е) соответствие диапазона размеров образующегося полисахарида гепаросана возможности его переработки в гепарин, и (г) количество и тип примесей. Например, условия, которые способствуют лизису клеток, могут увеличить выход экзополисахарида K5 в супернатант культуры, но также могут увеличить деградацию экзополисахаридной капсулы К5, а также количество и объем примесей в супернатанте.
Важным моментом является то, насколько легко какая-либо из примесей может быть удалена на последующих стадиях очистки и обработки, влияет ли эта примесь на последующую переработку гепаросана в гепарин, и представляет ли примесь опасность для людей и животных. Е. coli K5 является известным патогеном, и, следовательно, токсины и другие факторы, связанные с вирулентностью, должны быть удалены. Липополисахариды (ЛПС) являются широко распространенными загрязнителями экстрактов грамотрицательных бактерий, и они известны как мощные иммуностимулирующие агенты и токсины. Нуклеиновые кислоты также могут обладать иммуностимулирующим эффектом, как ЛПС, так и нуклеиновые кислоты имеют полисахаридное ядро, и поэтому могут выделяться совместно с гепаросаном. Другие примеси могут включать в себя полисахариды, отличные от гепаросана, или производные гепаросана.
Для производства фармацевтической и медицинской продукции источник и характеристики питательной среды могут иметь большое значение. Например, комплексная среда, полученная путем гидролиза животных или растительных белков, отлично подходит для роста и продукции К5, но для такой среды характерны различия между партиями и она может содержать аитигенные и другие загрязняющие примеси.
Для производства гепаросана в промышленных масштабах необходимо учитывать дополнительные факторы, в том числе объем культуры, время и температуру ферментации. Таким образом, являются предпочтительными меньшие объемы питательной среды, и условия, способствующие более быстрому росту. Также актуальным является выявление питательной среды, в которой применяются широкодоступные, стандартизированные и недорогие исходные вещества.
Кроме того, условия культивирования должны быть масштабируемыми. Так, выявленные оптимальные условия для культуры 5 мл должны также подтверждаться при культивировании в более крупных масштабах, например, 5 л, 20 л, 100 л и более.
Соответственно, процесс культивирования должен быть надежными и воспроизводимым, и, таким образом, не должен быть чувствительным к небольшим изменениям условий.
В связи с вышеизложенным, выявление условий, подходящих для промышленного производства гепаросана, не является тривиальной задачей. Авторы настоящего изобретения определили подходящие условия для роста и культивирования Е. coli K5 для облегчения производства, выделения и очистки гепаросана, которые могут быть адаптированы для промышленного производства.
Среда для культивирования согласно настоящему изобретению представляет собой среду с заданным составом с глюкозой в качестве источника углерода, варьирующую в зависимости от фазы роста. Состав среды для периодического культивирования является следующим на литр: примерно 20 г глюкозы, 10-300 мг тиамина, примерно 13,5 г KH2PO4, примерно 4,0 г (NH4)2HPO4, примерно 1,4 г MgSO4·7H2O, примерно 1,7 г лимонной кислоты и примерно 10,0 мл раствора микроэлементов. Раствор микроэлементов включал (на 1 л 5М НСl) 10,0 г FeSO4·7H2O, 2,0 г СаСl2, 2,2 г ZnSO4·7H2O, 0,5 г MnSO4·4H2O, 1,0 г 10 CuSO4·5H2O, 0,1 г (N4)6МO7O24·4Н2O и 0,02 г Na2B4O7·10H2O. Раствор для подпитки, используемый на стадии культивирования с подпиткой, включал (на 1 л): 250-1000 г глюкозы, примерно 20 г MgSO4·7H2O и 0,15-0,5 г тиамина, и мог содержать примерно 47 г KН2РO4. В некоторых вариантах реализации раствор для подпитки содержал 700 г глюкозы, 20 г MgSO4·7H2O и 0,2 г тиамина. В другом варианте реализации раствор для подпитки содержал 700 г глюкозы, 20 г MgSO4·7H2O 47 г KН2РO4 и 0,4 г тиамина.
Культуру для инокуляции получали, выращивая штамм Е. coli K5 в течение ночи при 37°С в конической колбе. Затем культурой для инокуляции инокулировали ферментер. Процесс ферментации в ферментере включает две фазы: фазу периодического роста, и фазу, на которой осуществляют подпитку согласно комбинации стратегий экспоненциальной подпитки (exponential feeding) и подпитки с учетом содержания растворенного кислорода (DO-stat feeding). Фаза периодического роста начинается после посева культуры для инокуляции в ферментер. Температура поддерживается при 37°С, а уровень рН поддерживается между 6 и 8, путем добавления NH4OH при снижении рН.
Второй этап ферментации начинается после того, как концентрация растворенного кислорода резко увеличивается, а содержание глюкозы в среде истощается. Скорость подачи глюкозы рассчитывается в целом по формуле, но с возможными отклонениями:
M S ( t ) = F ( t ) S F ( t ) = ( μ Y X / S + m ) X ( t ) V ( t ) = ( μ Y X / S + m ) X ( t 0 ) V ( t 0 ) exp [ μ ( t − t 0 ) ] ,
где MS представляет собой скорость потока источника углерода (г/ч), F - скорость подачи раствора для подпитки (л/ч); Sp представляет собой концентрацию источника углерода в подпитке (г/л); Х - концентрация клеток (г/л с.м.к.), m - удельный коэффициент поддержания (г/г DCW/ч), V - объем культуры (л); t0 - время начала подпитки; t - время процесса; µ - удельная скорость роста (ч-1) и YX/S - выход клеток на количество источника углерода (г/г).
В течение всего процесса подпитки р. находится между 0,1 и 0,4. В некоторых вариантах реализации в процессе подпитки возможны паузы, используемые как контрольные точки для проверки того, не превышен ли уровень глюкозы, и для проверки того, что уровень токсичных веществ, таких как ацетат, в культуральной среде является низким. В таких контрольных точках подпитку возобновляют после резкого повышения концентрации растворенного кислорода, что указывает па истощение глюкозы в питательной среде. При крупномасштабном культивировании такие наблюдения проводят непрерывно с помощью датчиков или путем автоматического отбора проб и анализа в процессе ферментации.
Как правило, ферментацию продолжают до тех пор, пока плотность клеток не перестанет увеличиваться. Ферментацию затем останавливают, и мешалку ферментера оставляют еще на 30-60 минут для того, чтобы с поверхности клеток и в среду могло бы высвободиться большее количество полисахаридных капсул К5.
ОЧИСТКА ГЕПАРОСАНА ИЗ КУЛЬТУРЫ ПОСЛЕ ФЕРМЕНТАЦИИ
В одном из примеров вариантов реализации настоящего изобретения очистка гепаросана может включать (а) этап получения супернатанта культуры или фильтрата, (б) осуществление связывания гепаросана с твердофазным носителем, таким как смола, и элюирование с него гепаросана; (с) осаждение с помощью спирта и (г) депирогенизацию. Могут быть добавлены дополнительные этапы связывания, преципитации и депирогенизации.
На этапе (а) культуру центрифугируют или фильтруют для отделения супернатанта от осадка клеток. Для инактивации бактериальных клеток к культуре могут быть добавлены формалин или другие агенты. Как правило, гепаросан выделяют из супернатанта, но также его можно выделять, промывая клетки, в том числе с помощью детергентов, таких как додецилсульфат натрия, и механического перемешивания с последующим центрифугированием с получением осадка и экстрагирования гепаросана из супернатанта.
На этапе (б) гепаросан связывают с твердофазным носителем, который преимущественно связывает гепаросан. Например, к супернатанту после стадии (а) добавляют смолы, например, анионообменную смолу. Смесь перемешивают, чтобы связать гепаросан в супернатанте со смолой. Затем смесь фильтруют для отделения смолы от раствора. Твердофазный носитель затем промывают, чтобы смыть не связавшиеся примеси, и элюируют.
В случае анионообменных смол промывку осуществляют с помощью раствора с низкой концентрацией соли для смыва не связавшихся примесей и элюируют с помощью 1-2 М раствора хлорида натрия. Для связывания гепаросана также можно применять хитозан. Поскольку хитозан можно добавлять в виде раствора, и таким образом, не в «твердой фазе», он преципитирует и таким образом «выводит» гепаросан из супернатанта. Кроме того, гепаросан можно пропускать через соответствующую колонку, содержащую твердофазный носитель, промывать и элюировать.
На этапе (в) элюат с гепаросаном, образовавшийся на этапе (б), преципитируют, например, путем добавления 1-5 частей по объему этанола или метанола. Этот этап не только позволяет сконцентрировать гепаросан, но и избирательно удалить примеси. Осадок отделяют центрифугированием и промывают 50-80% спиртом.
В стадии (г) преципитат растворяют в воде и подвергают депирогенизации для 15 инактивации оставшегося липополисахарида и других загрязнений. Обычно, для этого применяют окисляющий агент, такой как перекись водорода, но также известны другие пероксиды или обесцвечивающие агенты. Образующийся в результате гепаросан вновь преципитируют, как указано выше, и высушивают.
АНАЛИЗ
Полученный на предыдущем этапе гепаросан анализируют для определения его выхода, степени чистоты и пригодности для дальнейшей обработки. Можно применять несколько аналитических инструментальных подходов.
Дисахаридный состав можно проанализировать с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с масс-спектрометрией (MS) с ионизацией электрораспылением (ESI, electrospray ionization), после частичного гидролиза гепаросана. Bhattacharyya S et al. (2010) '-Cell-bound IL-8 increases in bronchial epithelial cells after arylsulfatase В silencing due to sequestration with chondroitin-4-sulfate," Am J Respir Cell and Molec Biol 42, 51-61. Также можно применять 1Н-ЯМР и 13C-ЯМР для анализа негидролизованного гепаросана, кроме того, этот метод позволяет определить концентрацию и чистоты гепаросана. Wang Z, Zhang Z, McCallum SA, Linhardt RJ. 2009. Nuclear magnetic resonance quantification for monitoring heparosan K5 capsular polysaccharide production. Anal Biochem. 398(2):275-7. Гепаросан также можно проанализировать с помощью анализа с карбазолом, как описано в работе Bitter Т, Muir HM. (1962) “А Modified Uronic Acid Carbazole Reaction." Analytical Biochemistry 4(4):330.
Содержание ДИК можно определить по УФ-поглощению. Содержание белка можно определить с помощью хорошо известных наборов, таких как набор Micro BCA Protein Assay Kit согласно инструкциям производителя.
Профиль молекулярного веса очищенного гепаросана определяют путем сравнения с лестницей гепаросана или гиалуроновой кислоты с известным молекулярным весом, и на основании его рассчитывают средний молекулярный вес, количество и распределение гепаросана.
Содержание пирогена можно определить с помощью анализа с применением лизата амебоцитов Limulus (LAL).
Изобретение можно лучше понять со ссылкой на следующие примеры, которые приведены для иллюстрации некоторых вариантов реализации изобретения, которые не являются ограничивающими. Как понятно специалисту в данной области, возможны 15 изменения без отступления от сущности изобретения.
ПРИМЕРЫ
ПРИМЕР 1. Материалы
В качестве ферментера применяли автоклавируемый стеклянный биореактор объемом 7 л от Applikon (Schiedam, Netherlands). Для управления ферментеров и сбора данных использовали программу BioXpert VI.5. Среда Difco™ LB в сухом виде приобретена у компании BD (Franklin Lakes, NJ). Большинство химических веществ, используемых для приготовления синтетической среды приобретены у Sigma-Aldrich (St Louis, МО). Antifoam 204 приобретен у Sigma-Aldrich (St Louis, МО). Встряхиваемые колбы с перегородками приобретены у Coming (Corning, NY). Для очистки гепаросана использовали быстропроточную ДЭАЭ-сефарозу DEAE от GE Healthcare (Piscataway, NJ). Колонки Vivapure D Mini H приобретены у Sartorius Stedim Biotech (Aubagne, France). Набор Micro BCA Protein Assay Kit - от Thermo Scientific (Rockford, IL). Ферменты, используемые для гидролитического расщепления гепаросана для дисахаридного анализа, нарабатывали и очищали в нашей лаборатории, как описано Man et al.(2009) "Structural snapshots of heparin depolymerization by heparin lyase I"./ Biol Chem 284(49):34019-27. ВЭЖХ-МС проводили с помощью прибора Agilent 1100 (Santa Clara, California). Планшеты для ТСХ с силикагелем получали от EMD (Gibbstown, NJ). Вещества для подготовки лестницы молекулярных весов гепаросана и определения молекулярного веса гепаросана были подробно описаны в работе Ly М, et al. (2010) "Analysis of E.coli K5 capsular polysaccharide heparosan" Anal Bioanal Chem (DOI: 10.1007/s00216-010-3679-7). Набор маркера молекулярных весов гиалуропана Select_HA™ LoLadder приобретен у Hyalose (Oklahoma City, OK).
Рост E.coli K5 во встряхиваемой колбе объемом 2,8 л
Штамм E.coli K5 из Американской коллекции типовых культур (АТСС U 23506) хранили замороженными в 1 мл среды М9, LB, среды с глицерином или среды с глюкозой, содержащей с 25% глицерин. Во встряхиваемую колбу объемом 250 мл, содержащую 25 мл соответствующей среды, вносили 0,5 мл размороженной культуры E.coli. Культуру собирали в конце экспоненциальной стадии роста при плотности клеток 1,1 г сухой массы клеток (с.м.к.) на л для культуры в среде М9, 5,4 г с.м.к./л для синтетической среды с глицерином, 5,6 г с.м.к./л в случае синтетической среды с глюкозой, и 1,9 г с.м.к./л для среды LB. Культуру E.coli K5 (300 мл) затем выращивали во встряхиваемой колбе объемом 2,8 л, инокулированной 5% по объему клетками, взятыми в конце стадии экспоненциального роста. Культуры выращивали при скорости покачивания 220 оборотов в минуту и при 37°С до 1-4 ч после того, как рост достигал стационарной фазы, а затем культуру собирали для выделения гепаросана. Среда, используемая для ферментации в колбе 2,8 л, включала следующие среды. 1. Среду LB: Difco™ LB broth, Lennox, 20 г/л 2. среда М9: 2 г/л глюкозы, 0,12 г/л MgSO4, 0,011 г/л CaCl2, 0,337 г/л тиамина-HCl, 6 г/л Na2HPO4, KH2PO4 3 г/л, 0,5 г/л NaCl, 1 г/л NH4Cl. 3. Среда с заданным содержанием глицерина: 20 г/л глицерина, 20 мг/л тиамина, 13,5 г КН2РO4, 4,0 г (NH4)2HPO4, 1,4 г MgSO4·7H2O, 1,7 г лимонной кислоты и 10,0 мл раствора микроэлементов. Раствор микроэлементов включал (на 1 л 5М НСl) 10,0 г FeSO4·7H2O, 2,0 г CaCl2, 2,2 г ZnSO4·7H2O, 0,5 г MnSO4·4H2O, 1,0 г CuSO4, 0,1 г (NН4)6МO7O24·4Н2O и 0,02 г Nа2 В4O7·10Н2O Wang FL, Lee SY (1998). См. "High cell density culture of metabolically engineered Escherichia coli for the production of poly(3-hydroxybutyrate) in a defined medium" Biotechnology and Bioengineering 58(2-3):325-328. 4. Среда заданного состава с глюкозой содержала: на литр 20 г глюкозы, 20 мг тиамина, 13,5 г KН2РO4, 4,0 г (NH4)2HPO4, 1,4 г MgSO4·7H2O, 1,7 г лимонной кислоты и 10,0 мл раствора микроэлементов. Раствор микроэлементов включал (на 1 л 5М НСl) 10,0 г FeSO4·7H2O, 2,0 г СаСl2, 2,2 г ZnSO4·7H2O, 0,5 г MnSO4·4H2O, 1,0 г CuSO4·5H2O, 0,1 г (Na4)6МO7O24·4Н2О и 0,02 г Na2B4O7·10H2O (см. Wang FL, Lee SY (1998), выше).
Рост Е. coli K5 в ферментере объемом 7 л
Такая ферментация включает стадию периодического культивирования и стадию периодического культивирования с подпиткой. Среда для периодического культивирования включала: (на 1 литр) 20 г глюкозы, 20 мг тиамина, 13,5 г KН2РO4, 4,0 г (NH4)2HPO4, 1,4 г MgSO4·7H2O, 1,7 г лимонной кислоты, и 10,0 мл раствора микроэлементов. Раствор микроэлементов включал (на 1 л 5М НСl) 10,0 г FeSO4·7H2O, 2,0 г СаСl2, 2,2 г ZnSO4·7H2O, 0,5 г MnSO4·4H2O, 1,0 г CuSO4H2O, 0,1 г (NH2)6МO7O24·4Н2O и 0,02 г Na2B4O7·10H2O. Раствор для подпитки, используемый на стадии культивирования с подпиткой, включал (на 1 л): 700 г глюкозы, 20 г MgSO4·7H2O и 0,2 г тиамина (см. Wang FL, Lee SY (1998), выше).
Стадия периодического культивирования начиналась с посева культуры для инокуляции (300 мл на 5,6 г/л с.м.к.), выращенной во встряхиваемой колбе и взятой в конце фазы экспоненциального роста. Температура поддерживали при ~ 37°С, а рН поддерживали примерно 7 (путем добавления 29% раствора аммиака). Для подачи кислорода барботировали воздух в ферментер, а скорость перемешивания составляла до 520 об/мин.
Второй этап ферментации начинали после того, как уровень глюкозы в питательной среде периодической культуры истощался, а содержание растворенного кислорода резко увеличивалось. После этого в культуру подавали раствор для подпитки экспоненциально согласно формуле 1:
(1)
M s ( t ) = F ( t ) S F ( t ) = ( μ Y X S + m ) X ( t 0 ) V ( t 0 ) exp [ μ ( t − t 0 ) ] ,
где Ms представляет собой скорость потока источника углерода (г/ч), F - скорость подачи раствора для подпитки (л/ч); SF представляет собой концентрацию источника углерода в подпитке (г/л); Х - концентрация клеток (г/л с.м.к.), m - удельный коэффициент поддержания (г/г DCW/ч), V - объем культуры (л); to -