Способ получения микротрубок из хитозана (варианты)
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой способ получения микротрубок из хитозана, заключающийся в том, что готовят раствор хитозана в органической кислоте, опускают стержень в раствор хитозана в органической кислоте, отличающийся тем, что в качестве кислоты выбран 1.5% водный раствор гликолевой кислоты, причем раствор содержит хитозан в количестве 2.5-4 мас.%; стержень с нанесенным на него слоем раствора хитозана погружают в 0.1 М водный раствор додецилбензосульфата натрия и оставляют на 12 часов. Изобретение обеспечивает упрощение технологии изготовления полой цилиндрической структуры из раствора полимера и сокращение времени его реализации, повышение экологичности процесса, повышение биосовместимости готового продукта. 2 н.п. ф-лы, 34 пр., 1 табл., 5 ил.
Реферат
Изобретение относится к области химической и биохимической технологии, медицине, а именно к способам получения полимерных материалов в форме полых цилиндрических структур из растворов природных и искусственных полимеров, в частности, микротрубок хитозана. Полые полимерные структуры на основе хитозана предположительно могут использоваться в качестве протезов и заплат кровеносных сосудов, контейнеров для хранения лекарств и их доставки в зону запланированной локализации, компонентов медицинских мембран различного назначения и т.п.
Наряду с широко используемыми в настоящее время имплантируемыми протезами кровеносных сосудов из бионедеградируемых полимеров, все большее значение приобретают протезы, биодеградируемые в организме естественным метаболическим путем с последующим восстановлением клеточного состава сосудистой стенки. Применение таких протезов позволяет избежать повторного ремоделирования сосуда и особенно актуально в случаях физиологического взросления организма. Одним из перспективных полимеров для создания таких протезов является аминополисахарид хитозан.
Хитозан - продукт частичного или полного деацетилирования биополимера хитина. Благодаря таким свойствам как биосовместимость, близость по физиологической активности к компонентам живых тканей, биоразлагаемость, нетоксичность находит широкое применение в различных областях медицины, фармакологии, косметологии, биотехнологии. Например, хитозан широко используют для получения пленок медицинского назначения [Патент РФ №2108114, МПК A61L15/28;Патент РФ №2219954, МПК A61L15/28; Патент РФ №2254145, МПК A61L15/28, A61L15/32, A61L26/00; Патент РФ №2270646, МПК A61F13/02(2006.01), A61L15/22(2006.01), A61L15/44(2006.01), A61L15/60 (2006.01); Патент РФ №2314834, МПК A61L15/18 (2006.01), A61L15/44 (2006.01), A61P17/02 (2006.01), A61F13/00 (2006.01); Патент РФ №2429022, МПК А61L15/16 (2006.01), А61L15/28 (2006.01); Патент РФ №2461575, МПК C08B37/08 (2006/01), C08J5/18 (2006/01)], пористых мембран [Патент РФ №2270209, МПК C08L5/08 (2006.01), C08L89/00 (2006.01), A61K38/39 (2006.01), A61K47/36 (2006.01), C08J9/00 (2006.01)], макропористых гранул [Патент РФ №2234514, МПК C08B37/08, C08J9/28, C08L5/08, C12N5/00], губок [Свидетельство на полезную модель РФ №8606, МПК A61L15/44; Свидетельство на полезную модель РФ №8607, МПК A61L15/44], волокон [Патент WO 2009/049565 A2, МПК D01D5/00; D01D5/06; D01F4/00; D01F9/00; Патент РФ №2468129, МПК D01F4/00 (2006.01), A61L15/22 (2006.01), A61L15/28 (2006.01)]. Поскольку температура плавления хитозана значительно выше температуры его термического разложения, все эти материалы получают из растворов этого аминополисахарида. Способы получения микротрубок на основе хитозана в научной литературе встречаются крайне редко, а в патентной литературе - отсутствуют.
Известен способ формирования микротрубок из нановолокон хитозана, получаемых методом электроформования и используемых для регенерации вегетативных нервов [Matsumoto I., Kaneko M., Oda M., Watanabe G. Repair of intra-thoracic autonomic nerves using chitosan tubes //Interact. Cardiovasc. Thorac. Surg. 2010. V.10. №4. Р.498-501]. Готовят раствор хитозана (степень деацетилирования 93 мольн.%) в трифторуксусной кислоте с добавкой метиленхлорида. Полученный раствор фильтруют и используют для электроформования волокна. Электроформование осуществляют на вращающийся стержень из нержавеющей стали диаметром 2 мм. После удаления стержня остается трубка, стенки которой представляют собой пористую структуру из хаотически уложенных (переплетенных) нановолокон хитозана. Согласно данному способу получают трубки из хитозана в солевой форме длиной 1.8 см и внутренним диаметром 2 мм.
Недостатком способа является использование агрессивных растворителей: трифторуксусной кислоты (8 класс опасности) и метиленхлорида (4 класс опасности). Хитозан в полученных трубках находится в солевой форме, скорость биодеградации которой значительно выше скорости эпителизации биоткани. Кроме этого, трубки из нетканых материалов обладают высокой механической порозностью. Все сказанное делает невозможность применения таких трубок как в качестве протезов и заплат кровеносных сосудов, так и в других медико-биологических приложениях.
Известен способ получения методом многостадийного электроформования композитных трубок длиной 40 мм и внутренним диаметром 4.5 мм с наружным слоем изнановолоконполилактида и внутренним слоем из бикомпонентных волокон фиброина шелка и желатины [Wang S., Zhang Y., Wang H., Yin G., Dong Z. Fabrication and properties of the electrospun polylactide/silk fibroin-gelatin composite tubular scaffold //Biomacromolecules. 2009. V.10. №8. P.2240-2244]. Электроформование осуществляют на вращающийся стержень путем последовательного нанесения слоев: сначала из бикомпонентных нановолокон желатины и фиброина шелка, затем из однокомпонентных нановолокон полилактида. Для увеличения стабильности и прочности, полученные композитные трубки дополнительно погружают в этанол на 15 минут и сушат в течение 24 часов при комнатной температуре. Прочность на разрыв таких композитных трубок составляет 2.21±0.18 МПа.
Недостатком способа является его многостадийность получения трубок, их многокомпонентность. Задача формирования композитных трубок с использования хитозана в способе не ставилась.
Известно получение хитин-хитозановых микротрубок различного диаметра [Freier T., Montenegro R., Koh H.S., Shoichet M.S. Chitin based tubes for tissue engineering in the nervous system //Biomaterials. 2005. V.26. Р.4624-4632]. Способ осуществляют следующим образом. Готовят 3%-ый раствор хитозана в смеси 2% уксусной кислоты с этанолом (1:1 по объему). Раствор охлаждают до 10ºC и смешивают с двукратным молярным избытком уксусного ангидрида. Реакционную смесь обрабатывают ультразвуком для удаления пузырьков воздуха. Для получения микротрубок используют герметически закрываемую форму, состоящую из стеклянного цилиндра диаметром 4 мм и вставленного в него стеклянного стержня диаметром 1.7 мм. Реакционную смесь вводят в полую часть формы, расположенную между цилиндром и стержнем, и оставляют на 24 часа для протекания реакции ацетилирования хитозан→хитин. Полученные хитиновые гидрогелевые микротрубки вынимают из формы, промывают и хранят в дистиллированной воде. Для увеличения прочности хитиновых микротрубок снижают степень ацетилирования хитина, проводя его модификацию щелочным гидролизом, т.е. осуществляют химическую реакцию полимераналогичного превращения хитин→хитозан. Для этого хитиновую микротрубку одевают на стеклянный стержень и выдерживают в 40% водном растворе NaOH при 110ºC в течение 2 часов. Затем микротрубки промывают дистиллированной водой, сушат на воздухе в течение 3 часов при комнатной температуре и нормальном давлении, снимают со стеклянного стержня и хранят в воде. Такую процедуру повторяют от 1 до 3 раз, снижая степень ацетилирования хитина с 94 мольн.% до 1 мольн.%.
Недостатком способа является многостадийность, сложность, длительность и низкая производительность процесса получения микротрубок, необходимость использования специальной формовочной конструкции. Для получения хитиновых трубок, т.е. проведения реакции полимераналогичного превращения хитозан→хитин, используют агрессивный растворитель уксусный ангидрид (3 класс опасности).
Известен способ получения пористых микротрубок из хитозана диаметром ~ 0.5-8 мм, толщиной стенок ~ 0.2-1 мм, средним размером пор ~0.02-0.1 мм и пористостью 20-90% [Zhang X.F., Cao W.L., Gong Y.D., Gao Y., Li J.M. A method for the preparation of porous chitosan tube. China Patent №ZL 02 149086.4.2005]. Для осуществления способа хитозан растворяют в уксусной кислоте, полученный раствор фильтруют и удаляют пузырьки воздуха под вакуумом (давление не менее 100 Па). Затем раствор хитозана под давлением вносят в цилиндрическую форму из нержавеющей стали, вставляют стержень и выдерживают при температуре -5 - -196ºС в течение 8-15 часов до полного замораживания. Далее снимают цилиндрическую часть формы, трубку из хитозана на стержне промывают водой и сушат в сублимационной камере для удаления влаги. Сухую трубку на стержне помещают в раствор NaOH на 8-15 минут для удаления остаточной уксусной кислоты, промывают деионизированной водой до нейтральной реакции, затем опускают в фосфатный буфер (рН = 7,4) на 10-30 минут, сушат фильтровальной бумагой и удаляют стержень.
Недостатком способа является большое количество физико-химических и технологических операций, используемых для получения микротрубок хитозана; использование высоких давлений и низких температур; сложность введения раствора хитозана в форму, требующая применения избыточного давления; необходимость использования сублимационной сушки. Все это приводит к удорожанию готового продукта.
Известен способ получения биополимерных микротрубок из кровеносного сосуда животного [Патент РФ 2385689, МПК A61F2/06(2006.01), A61L27/38(2006.01), A61L33/10(2006.01)]. Способ включает следующие этапы. Кровеносные сосуды животных фиксируются путем сшивания фиксирующим агентом и обрабатываются с целью удаления антигенов. На внутреннюю поверхность обработанного сосуда наносят активное покрытие, содержащее антикоагуляционные компоненты. Полученныемикротрубки используют в качестве искусственного биологического кровеносного сосуда.
Недостатком способа является многостадийность получения микротрубок, применение большого количества химических реагентов. Кроме того, использование микротрубок из биотканей животного происхождения в качестве искусственного кровеносного сосуда может приводить к проявлению аллергических и аутоиммунных реакций. Задача получения микротрубок из хитозана в способе не ставилась.
Известен способ получения двухслойных хитозановых микротрубок, используемых для регенерации нервов [Wang W., Itoh S., Matsuda A., Ichinose S., Shinomiya K., Hata Y., Tanaka J. Influences of mechanical propertiesand permeability on chitosan nano/microfiber mesh tubes as a scaffold for nerve regeneration //J. Biomed. Mater. Res.A. 2008. V.84. №3. Р.557-566]. Микротрубки состоят из двух слоев: внутреннего и внешнего. Каждый слой имеет форму полого цилиндра, но отличается морфологическим рельефом. Первый (внутренний) слой диаметром 1.2 мм и толщиной стенок 0.3-0.5 мм получают методом электроформования. Хитозан (степень деацетилирования 78 мольн.%) растворяют в трифторуксусной кислоте при 50ºС в течение 12 часов, затем добавляют метиленхлорид в соотношении трифторуксусная кислота:метиленхлорид = 4:1. Полученный раствор фильтруют и используют для электроформования нановолокна, которое осуществляют на вращающийся стержень из нержавеющей стали диаметром 1.2 мм. Затем стержень с нановолокнистым слоем хитозана опускают в этиловый спирт, оставляют на 3 минуты, вынимают, снимают со стержня, помещают в 28%-ный водный раствор аммиака и оставляют при комнатнойтемпературе на 12 часов для нейтрализации трифторуксусной кислоты и метиленхлорида. Далее промывают дистиллированной водой при комнатной температуре в течение 2 часов, погружают в 99.5% этанол, вынимают и сушат на воздухе при комнатной температуре в течение 2 часов. Для получения второго (внешнего) слоя микротрубки с внешним диаметром 2.1 мм и внутренним диаметром 2.0 мм готовят 5%-ный раствор хитозана (степень деацетилирования 93 мольн.%) в 6%-ой уксусной кислоте и погружают в него проволоку из нержавеющей стали диаметром 2 мм в вертикальном положении. Проволоку с нанесенным слоем раствора хитозана в уксусной кислоте вынимают и сушат на воздухе при температуре 50ºС в течение 20 минут. Данную процедуру повторяют 4 раза. Затем полученный внешний слой микротрубки погружают в 5% раствор каустической соды на 10 минут при комнатной температуре, вынимают и промывают водой в течение 2 часов. Для формирования двухслойной микротрубки внутреннюю и внешнюю части механически совмещают, погружают в дистиллированную воду при комнатной температуре на 30 минут и хранят в 70% этаноле. Разрывное напряжение двухслойных хитозановых трубок составляет σ = 4.82±0.42 МПа, относительное удлинение при разрыве ε = 11.23±1.97%).
Недостатком данного способа является сложность, многостадийность, длительность и высокая трудоемкость процесса получения микротрубок, требующие значительных энергетических и сырьевых затрат, высокой квалификации оператора. В способе используется агрессивная трифторуксусная кислота и метиленхлорид.
Известен способ получения микротрубок из фиброина шелка [Lovett M., Cannizzaro C., Daheron L., Messmer B., Vunjak-Novakovic G., Kaplan D. Silk fibroin microtubes for blood vessel engineering //Biomaterials. 2007. V.28. №35. P.5271-5279]. Готовят 6-8%-ный водный раствор фиброина шелка из коконов тутового шелкопряда. Для этого коконы обрабатывают 0.02 М раствором карбоната натрия, промывают дистиллированной водой, растворяют в 9.3 М растворе бромида лития при нагревании и подвергают диализу против дистиллированной воды в течение 48 часов. Затем полученный 6-8%-ный раствор фиброина шелка концентрируют путем диализа против 10 мас.% полиэтиленгликоля до получения концентрированного 20-30%-ного водного раствора фиброина шелка и хранят при 4ºС до использования. Получение микротрубок осуществляют путем погружения стальной проволоки (диаметр 0.12-6 мм) в 20-30 %-ный раствор фиброина шелка. После равномерного покрытия проволоки концентрированным раствором фиброина шелка (формирование жидкого слоя) ее извлекают и погружают в метанол (формирование твердого слоя). При этом фиброин шелка из аморфной жидкой фазы (жидкий слой) переходит в кристаллическую фазу (твердый слой) -β-форму, характеризующуюся антипараллельными β-слоями. Процессы погружения проволоки в раствор фиброина шелка с последующим ее переносом в раствор метанола, т.е. формирования жидкого и твердого слоев, проводят 2-4 раза. Нанесенное на проволоку покрытие из фиброина шелка высушивают в течение 12 часов, затем помещают в раствор ПАВ для снятия микротрубки со стальной проволоки. Микротрубки рекомендуют использовать в качестве микрососудистых трансплантатов. Способ также предусматривает введение 1-20 мас.% полиэтиленоксида в состав формовочного раствора фиброина шелка для повышения пористости микротрубок.
Недостатком способа является большое количество (2-4 раза) процедур перехода жидкого слоя в твердый слой, используемых для формирования стенок микротрубки; сложность приготовления концентрированного раствора фиброина шелка, требующего проведения большого количества различных химических и физико-химических реакций. Материалом микротрубки является фиброин шелка, т.е. белок, который может вызывать аллергию и даже реакции отторжения. Кроме того, в способе используетсяэкологически опасная жидкость - метанол-сильный яд, действующий преимущественно на нервную и сосудистую систему. В организм человека может проникнуть через дыхательные пути и даже через неповрежденную кожу [ГОСТ 2222-95: Метанол технический. Технические условия]. Задача получения микротрубки из аминополисахарида хитозана в способе не ставилась.
Наиболее близким решением к предлагаемому способу является способ получения композитных трубок на основе хитозана (степень деацетилирования 83.7 мольн.%, молекулярная масса 1800 кДа), желатины и хитозановой пряжи с диаметром волокон 12 мкм производства QingdaoJifaCo (China) [ZhangL., AoQ., WangA., LuG., KongL., GongY., ZhaoN., ZhangX.A sandwich tubular scaffold derived from chitosan for blood vessel tissue engineering //J. Biomed. Mater.Res. 2006. V.77A. Р.277-284]. Готовят 2%-ый раствор хитозана в 1%-ой уксусной кислоте, а также его смесь с 10%-ым водным раствором желатины в объемном соотношении 4:1 при 50°C в течение 2 ч. Из хитозановой пряжи ткут трикотажную хитозановую трубку, которую используют в качестве основы для получения композитных трубок. Тканую хитозановую трубку надевают на цилиндрический стержень из нержавеющей стали с тефлоновым покрытием, опускают в вертикальном положении в 2% раствор хитозана, выдерживают 1 минуту, вынимают и сушат на воздухе при 50°C. Данную процедуру повторяют три раза, пока толщина стенок образца не достигнет ~ 0.5 мм. Высушенный образец, состоящий из тканой хитозановой трубки с пленочным покрытием из хитозана, снимают со стержня, надевают на стержень меньшего диаметра (на 1 мм), опускают в горизонтальном положении в раствор смеси хитозана и желатины на несколько секунд и вынимают. Полученную композицию помещают в предварительно охлажденный до -8°C толуол для быстрого замораживания, обезвоживают в предварительно охлажденном этаноле с перенасыщенной гидроокисью натрия, отмывают три раза деионизованной водой и сушат на воздухе.
Недостатком способа является многостадийность процесса получения композитных хитозансодержащих трубок и их высокая себестоимость, необходимость использования агрессивного растворителя толуола (3-ий класс опасности, при высоких концентрациях пары толуола действуют наркотически, горюч и пожароопасен) и низких температур для формирования конечной структуры композитных трубок. Кроме того, в состав трубки входит желатина, получаемая из тканей животных, которая может вызывать аллергические реакции и даже анафилактический шок, что ограничивает применение готового продукта в медицинской практике, фармакологии и др.
Задача предлагаемого решения заключается в получении микротрубок на основе хитозана с заданными морфологией, физико-химическими и биохимическими свойствами.
Технический результат заключается в упрощении технологии изготовления полой цилиндрической структуры из раствора полимера и сокращении времени его реализации, повышении экологичности процесса, а также в повышении биосовместимости готового продукта.
Поставленная задача решается тем, что, согласно мокрому способу получения микротрубок из хитозана, готовят раствор хитозана в органической кислоте, опускают стержень в раствор хитозана в органической кислоте, в качестве кислоты выбран 1.5% водный раствор молочной или гликолевой кислоты, причем раствор содержит хитозан в количестве 2.5-4 мас.%; стержень с нанесенным на него слоем раствора хитозана погружают в 5% водный раствор NaOH или в 0.1 М водный раствор додецилбензосульфата натрия (ДДБСН) и оставляют на 12 часов. Согласно сухому способу получения микротрубок из хитозана, готовят раствор хитозана в органической кислоте, опускают стержень в раствор хитозана в органической кислоте, сушат в сушильном шкафу при 45-50°С до полного испарения растворителя, в качестве кислоты выбран 1.5% водный раствор молочной или гликолевой кислоты, причем раствор содержит хитозан в количестве 2.5-4 мас.%; перед сушкой стержень с нанесенным на него слоем раствора хитозана погружают в 50%-ный водный раствор триэтаноламина или в 0.1 М водный раствор додецилбензосульфата натрия (ДДБСН) на 1 мин, а после сушки стержень с нанесенным на него слоем хитозана погружают в 5% водный раствор NaOH или в 0.1 М водный раствор додецилбензосульфата натрия (ДДБСН) на 10-20 минут.
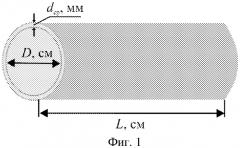
Изобретение поясняется примерами и чертежами, где на фиг. 1 приведено схематическое изображение микротрубки хитозана. На фиг. 2 представлена культура эпителиоцитов почки эмбриона макаки (МА-104) через 7 сут культивирования на поверхности микротрубки, полученной из раствора хитозана концентрации 4.0 мас.% в 1.5%-ном водном растворе гликолевой кислоты по мокрому способу. На фиг. 3 представлена культура эпителиоцитов почки эмбриона макаки (МА-104) через 7 сут культивирования на поверхности микротрубки, полученной из раствора хитозана концентрации 4.0 мас.% в 1.5%-ном водном растворе гликолевой кислоты по сухому способу. На фиг. 4 представлена культура фибробластов человека через 7 сут культивирования на поверхности микротрубки, полученной из раствора хитозана концентрации 4.0 мас.% в 1.5%-ном водном растворе гликолевой кислоты по мокрому способу. На фиг. 5 представлена культура фибробластов человека через 7 сут культивирования на поверхности микротрубки, полученной из раствора хитозана концентрации 4.0 мас.% в 1.5%-ном водном растворе гликолевой кислоты по сухому способу.
Способ получения микротрубок хитозана включает приготовление формовочного раствора из воздушно-сухой навески хитозана и раствора органической кислоты без и с добавкой пентаэритрита, нанесение полученного раствора на стержень с последующим формированием стенок микротрубки мокрым или сухим способом формования, снятие полученных образцов со стержня, отмывку микротрубок дистиллированной водой до нейтральной реакции и их хранение в набухшем состоянии в дистиллированной воде. Заявляемый способ позволяет получить бесшовные микротрубки на основе хитозана длиной L см, внутренним диаметром D см, и толщиной стенок dср мм (фиг. 1).
Способ осуществляется следующим образом.
1. Приготовление формовочного раствора. Воздушно-сухую навеску хитозана в количестве 2.5-4 мас.% растворяют в 1.5% водном растворе молочной или гликолевой кислотыв течение 1 сут, периодически встряхивая. Для гомогенизации раствора на последнем этапе используют перемешивание на магнитной мешалке.
2. Нанесение формовочного раствора на стержень. Используют стержень с круглым или овальным сечением. Стержень может быть выполнен из стекла, нержавеющей стали или эластичного материала, например, силикона. Стержень может быть одноосным или бифуркационным (т.е. иметь два разветвления). Стержень погружают вертикально в формовочный раствор хитозана и выдерживают в течение 1 мин для покрытия поверхности стержня равномерным слоем раствора хитозана.
3. Формирование стенок микротрубки.
3.1. Мокрый способ формования. Стержень с нанесенным слоем раствора хитозана концентрации 2.5-4 мас.% погружают в 5%-ный водный раствор NaOH или в 0.1 М водный раствор ДДБСН и оставляют на 12 часов для формирования стенок микротрубки в форме полого цилиндра посредством протекания реакции полимераналогичного превращения полисоль→полиоснование и фазового разделения сначала на границе двух жидких фаз, затем на границе твердая фаза-жидкая фаза.
3.2. Сухой способ формования. Стержень с нанесенным слоем раствора хитозана концентрации 2.5-4 мас.% погружают в 50%-ный водный раствор триэтаноламинана или в 0.1 М водный раствор ДДБСН 1 мин для формирования внешней поверхности стенки микротрубки, вынимают и сушат в сушильном шкафу при45-50°С в течение 2.5-4-х часов до полного испарения растворителя. Затем погружают в 5%-ный водныйраствор NaOH или в 0.1 М водный раствор ДДБСН на 10-20 минут для формирования стенок микротрубки в форме полого цилиндра посредством проведения химической реакции полисоль→полиоснование.
4. Снятие микротрубок со стержня, отмывка и хранение. Полученные по сухому и мокрому способам микротрубки снимают со стержня и промывают большим количеством дистиллированной воды до нейтральной реакции. Образцы микротрубок хранят в набухшем состоянии в дистиллированной воде.
Использовали хитозан с молекулярной массой 700 кДа, степенью деацетилирования 80 мольн.% производства ЗАО «Биопрогресс».
Толщину стенок микротрубок (d, мм) хитозана измеряли микрометром с ценой деления 10 мкм. Измерения проводили несколько раз на различных участках трубки, затем рассчитывали среднее значение толщины.
Морфологию образцов микротрубок оценивали визуально по следующим параметрам: цвет, прозрачность, однородность внутренней и внешней поверхности.
Упругопластические свойства микротрубок определяли согласно ГОСТ №14236-81 [Пленки полимерные. Метод испытания на растяжение] на разрывной машине одноосного растяжения TiraTest 28005 с ячейкой нагружения50 Н. Разрывную нагрузку и удлинение определяли при разрыве. Разрывное напряжение (σ, МПа) определяли с учетом площади поперечного сечения образца, взятого для испытания. Относительное удлинение при разрыве (ε, %) рассчитывали с учетом первоначальной длины образца микротрубки, взятого на испытание.
Применимость заявляемого решения иллюстрируется примерами, таблицей и рисунками.
Группа примеров №1-12: получение микротрубок хитозана мокрым способом формования, используя в качестве реагента перевода протонированной полисоли в полиоснование - водный раствор NaOH.
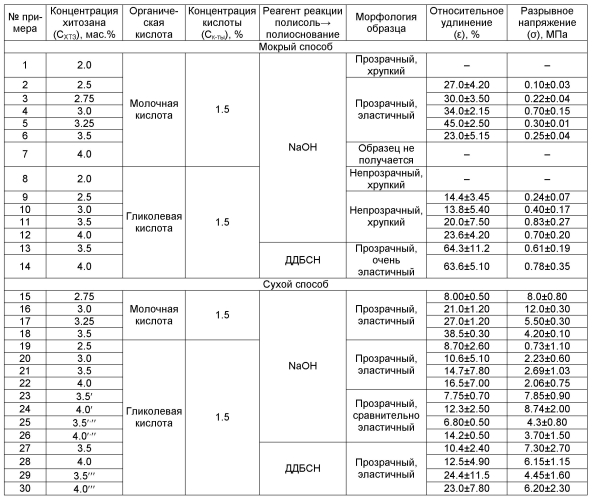
Пример 1. Готовят раствор хитозана концентрации 2.0 мас.% в 1.5%-ном водном растворе молочной кислоты. Полученный раствор наносят на стеклянный стержень с круглым сечением диаметром 5 мм, затем выдерживают в растворе NaOH в течение 12 час. Полученную микротрубку снимают со стеклянного стержня, отмывают до нейтрального рН дистиллированной водой и хранят в набухшем состоянии в воде. Образец микротрубки визуально выглядит прозрачным, но хрупким, в связи с чем, физико-механические свойства не анализируют (таблица).
Пример 2 выполнен аналогично примеру 1. Отличие состоит в том, что используют раствор хитозана концентрации 2.5 мас.%. Визуально образец микротрубки выглядит прозрачным и эластичным, имеет гладкие внешнюю и внутреннюю поверхности без видимых дефектов. Сформированный образец подвергают одноосному растяжению на разрывной машине. Величина относительного удлинения при разрыве составляет ε = 27% при разрывном напряжении σ = 0.10 МПа (таблица); усредненная толщина стенок микротрубки dср = 0.5 мм.
Пример 3 выполнен аналогично примеру 2. Отличие состоит в том, что используют раствор хитозана концентрации 2.75 мас.%. Физико-механические характеристики образца микротрубки: ε = 30%, σ = 0.22 МПа (таблица); dср = 0.41 мм.
Пример 4 выполнен аналогично примеру 2. Отличие состоит в том, что используют раствор хитозана концентрации 3.0 мас.%. Физико-механические характеристики образца микротрубки: ε = 34%, σ = 0.70 МПа (таблица); dср = 0.52 мм.
Пример 5 выполнен аналогично примеру 2. Отличие состоит в том, что используют раствор хитозана концентрации 3.25 мас.%. Физико-механические характеристики образца микротрубки: ε = 45%, σ = 0.30 МПа (таблица); dср = 0.40 мм.
Пример 6 выполнен аналогично примеру 2. Отличие состоит в том, что используют раствор хитозана концентрации 3.5 мас.%. Физико-механические характеристики образца микротрубки: ε = 23%, σ = 0.25 МПа (таблица); dср = 0.54 мм.
Пример 7 выполнен аналогично примеру 2. Отличие состоит в том, что используют раствор хитозана концентрации 4.0 мас.%. Хитозан растворяется частично, вязкость получаемого раствора чрезмерно высока, микротрубка не получается (таблица).
Пример 8 выполнен аналогично примеру 1. Отличие состоит в том, что вместо молочной кислоты используют гликолевую кислоту той же концентрации. Образец микротрубки визуально выглядит непрозрачным и хрупким, в связи с чем, физико-механические свойства не анализируют (таблица).
Пример 9 выполнен аналогично примеру 8. Отличие состоит в том, что используют раствор хитозана концентрации 2.5 мас.%. Визуально образец микротрубки выглядит непрозрачным и эластичным, имеет гладкие внешнюю и внутреннюю поверхности без видимых дефектов. Сформированный образец подвергают одноосному растяжению на разрывной машине. Величина относительного удлинения при разрыве составляет ε = 14.4% при разрывном напряжении σ = 0.24 МПа (таблица); усредненная толщина стенок микротрубки = 0.42 мм.
Пример 10 выполнен аналогично примеру 9. Отличие состоит в том, что используют раствор хитозана концентрации 3.0 мас.%. Физико-механические характеристики образца микротрубки: ε = 13.8%, σ = 0.40 МПа (таблица); dср = 0.4 мм.
Пример 11 выполнен аналогично примеру 9. Отличие состоит в том, что используют раствор хитозана концентрации 3.5 мас.%. Физико-механические характеристики образца микротрубки: ε = 20%, σ = 0.83 МПа (таблица); dср = 0.4 мм.
Пример 12 выполнен аналогично примеру 9. Отличие состоит в том, что используют раствор хитозана концентрации 4.0 мас.%. Физико-механические характеристики образца микротрубки: ε = 23.6%, σ = 0.7 МПа (таблица); = 0.7 мм.
Увеличивать концентрацию раствора хитозана в гликолевой кислоте выше 4 мас.% нецелесообразно в силу сложности его приготовления и высокой вязкости.
Примеры №13, 14: получение микротрубок хитозана мокрым способом формования, используя в качестве реагента перевода протонированной полисоли в полиоснование - водный раствор ДДБСН.
Пример 13 выполнен аналогично примеру 11. Отличие состоит в том, что для формирования стенок микротрубки в качестве реагента перевода протонированной полисоли в полиоснование используют ДДБСН. Величина относительного удлинения при разрыве составляет ε = 64.3% при разрывном напряжении σ = 0.61 МПа (таблица); усредненная толщина стенок микротрубки = 0.48 мм.
Пример 14 выполнен аналогично примеру 13. Отличие состоит в том, что используют раствор хитозана концентрации 4.0 мас.%..Величина относительного удлинения при разрыве составляет ε = 63.6% при разрывном напряжении σ = 0.78 МПа (таблица); усредненная толщина стенок микротрубки = 0.35 мм.
Группа примеров №15-22: получение микротрубок хитозана сухим способом формования, используя в качестве реагента перевода протонированной полисоли в полиоснование - водный раствор NaOH.
Пример 15. Готовят раствор хитозана концентрации 2.75 мас.% в 1.5%-ном водном растворе молочной кислоты. Полученный раствор наносят на стеклянный стержень с круглым сечением диаметром 5 мм, погружают в 50%-ный водный раствор триэтаноламина на 1 мин для формирования внешней поверхности стенки, вынимают и сушат в сушильном шкафу при 45-50°С в течение 2.5-3 часов до полного испарения растворителя. Затем погружают в 5%-ный водный раствор NaOH на 10-20 минут. Полученную микротрубку снимают со стеклянного стержня, отмывают до нейтрального рН дистиллированной водой и хранят в воде в набухшем состоянии. Образец микротрубки визуально выглядит прозрачным и эластичным, имеет гладкие внешнюю и внутреннюю поверхности без видимых деффектов. Сформированный образец подвергают одноосному растяжению на разрывной машине. Величина относительного удлинения при разрыве составляет ε = 8.0% при разрывном напряжении σ = 8.0 МПа (таблица); усредненная толщина стенок микротрубки dср = 0.29 мм.
Пример 16 выполнен аналогично примеру 15. Отличие состоит в том, что используют раствор хитозана концентрации 3.0 мас.%. Физико-механические характеристики образца микротрубки: ε = 21%, σ = 12 МПа (таблица); dср = 0.2 мм.
Пример 17 выполнен аналогично примеру 15. Отличие состоит в том, что используют раствор хитозана концентрации 3.25 мас.%. Физико-механические характеристики образца микротрубки: ε = 27%, σ = 5.5 МПа (таблица); dср = 0.35 мм.
Пример 18 выполнен аналогично примеру 15. Отличие состоит в том, что используют раствор хитозана концентрации 3.5 мас.%. Физико-механические характеристики образца микротрубки: ε = 38.5%, σ = 4.2 МПа (таблица); dср = 0.24 мм.
Пример 19 выполнен аналогично примеру 15. Отличие состоит в том, что вместо молочной кислоты используют гликолевую кислоту той же концентрации и раствор хитозана концентрации 2.5 мас.%. Образец микротрубки визуально выглядит прозрачным и эластичным, имеет гладкие внешнюю и внутреннюю поверхности без видимых дефектов. Сформированный образец подвергают одноосному растяжению на разрывной машине. Величина относительного удлинения при разрыве составляет ε = 8.70% при разрывном напряжении σ = 0.73 МПа (таблица); усредненная толщина стенок микротрубки dср = 0.15 мм.
Пример 20 выполнен аналогично примеру 19. Отличие состоит в том, что используют раствор хитозана концентрации 3.0 мас.%. Физико-механические характеристики образца микротрубки: ε = 10.6%, σ = 2.23 МПа (таблица); dср = 0.18 мм.
Пример 21 выполнен аналогично примеру 19. Отличие состоит в том, что используют раствор хитозана концентрации 3.5 мас.%. Физико-механические характеристики образца микротрубки: ε = 14.7%, σ = 2.69 МПа (таблица); dср = 0.12 мм.
Пример 22 выполнен аналогично примеру 19. Отличие состоит в том, что используют раствор хитозана концентрации 4.0 мас.%. Физико-механические характеристики образца микротрубки: ε = 16.5%, σ = 2.06 МПа (таблица); толщина стенки dср = 0.15 мм.
Примеры №23, 24: получение микротрубок сухим способом формования из растворов хитозана с добавкой пентаэритрита, используя в качестве реагента реакции полисоль→полиоснование водный раствор NaOH.
Пример 23 выполнен аналогично примеру 21. Отличие состоит в том, что в формовочный раствор добавляют 5 об.% пентаэритрита. Пентаэритрит (2,2-бис(гидроксиметил)пропан-1,3-диол) - четырехатомный спирт, применяется в качестве пластификаторапри получении полимерных материалов, в том числе и медико-биологического назначения [Cervera M.F., Karjalainen M, Airaksinen S., Rantanen J., Krogars K., Heinämäki J.,Colarte A.I., Yliruusi J. Physical stability and moisture sorption of aqueous chitosan-amylose starch films plasticized with polyols //Eur. J. Pharm. Biopharm. 2004. V.58. №1. Р.69-76].
Образец микротрубки визуально выглядит прозрачным и сравнительно эластичным, имеет гладкие внешнюю и внутреннюю поверхности без видимых дефектов. Физико-механические характеристики образца микротрубки: ε = 7.75%, σ = 7.85 МПа (таблица); dср = 0.3 мм.
Пример 24 выполнен аналогично примеру 22. Отличие состоит в том, что в формовочный раствор добавляют 5 об.% пентаэритрита. Физико-механические характеристики образца микротрубки: ε = 12.3%, σ = 8.74 МПа (таблица); dср = 0.1 мм.
Из сравнения примеров 23, 24 и 21, 22 видно, что добавка пентаэритрита значительно повышает прочность (σ) образцов микротрубок. Эластичность (ε) микротрубок при этом несколько снижается, но не существенно.
Примеры №25, 26: получение микротрубок сухим способом формования из растворов хитозана с добавкой пентаэритрита, используя в качестве реагента реакции полисоль→полиоснование водный раствор NaOH, путем двукратного нанесения формовочного раствора на стержень и двукратного формирования стенок микротрубки.
Пример 25 выполнен аналогично примеру 23. Отличие состоит в том, что процедуры нанесения формовочного раствора на стержень и формирования стенок микротрубки согласно сухому способу формования повторяют двукратно. Физико-механические характеристики образца микротрубки: ε = 6.8%, σ = 4.3 МПа (таблица); dср = 0.25 мм.
Пример 26 выполнен аналогично примеру 24. Отличие состоит в том, что процедуры нанесения формовочного раствора на стержень и формирования стенок микротрубки согласно сухому способу формования повторяют двукратно. Физико-механические характеристики образца микротрубки: ε = 14.2%, σ = 3.7 МПа (таблица); dср = 0.65 мм.
Из анализа примеров 25, 26 и 23, 24 следует, что двукратное нанесение формовочного раствора хитозана с добавкой пластификатора пентаэритрита с последующим формированием стенок микротрубки понижает прочность (σ) и незначительно влияет на эластичность (ε) по сравнению с однократным выполнением данных процедур.
Группа римеров №27-30: получение микротрубок сухим способом формования, используя в качестве реагента перевода протонированной полисоли в полиоснование - водный раствор ДДБСН.
Пример 27 выполнен аналогично примеру 21. Отличие состоит в том, что в качестве реагента перевода протонированной полисоли (в воздушно-сухом слое микротрубки) в полиоснование используют ДДБСН. Величина относительного удлинения при разрыве составляет ε = 10.4% при разрывном напряжении σ = 7.3 МПа (таблица); усредненная толщина стенок микротрубки = 0.17 мм.
Пример 28 выполнен аналогично примеру 27. Отличие состоит в том, что используют раствор хитозана концентрации 4.0 мас.%. Величина относительного удлинения при разрыве составляет ε = 12.5% при разрывном напряжении σ = 6.15 МПа (таблица); усредненная толщина стенок микротрубки = 0.25 мм.
Пример 29 выполнен аналогично примеру 27. Отличие состоит в том, что для формирования внешней поверхности стенки микротрубки используют ДДБСН. Величина относительного удлинения при разрыве составляет ε = 24.4% при разрывном напряжении σ = 4.45 МПа (таблица); усредненная толщина стенок микротрубки = 0.18 мм.
Пример 30 выполнен аналогично примеру 29. Отличие состоит в том, что используют раствор хитозана концентрации 4.0 мас.%. Величина относительного удлинения при разрыве составляет ε = 23% при разрывном напряжении σ = 6.20 МПа (таблица); усредненная толщина стенок микротрубки = 0.3 мм.
Группа примеров 31-34: оценка биосовместимости образцов микротрубок in vitro.
Примеры №31, 32: культивирование эпителиоподобных клеток МА-104 (макака резус, эмбриональная почка) на микротрубках хитозана.
Пример 31. Используют образец микротрубки, полученный по примеру 14, и эпителиоподобные клетки МА-104 (макака резус, эмбриональная почка). Работа с культурами клеток in vitro проводится в стерильных условиях: в лаборатории, специально оборудованной комплексом «чистых» ламинаров (2-ой класс защиты (Nuaire, USA)). Образец микротрубки стерилизуют в 70%-ном растворе этилового спирта в течение 20 минут, помещают в стерильные чашки Петри (FalconBD), заливают питательной средой ДМЕМ (Биолот, Россия) с добавлением 10% фетальной бычьей сыворотки (FetalBovineSerum, HyCloneUK) и смеси антибиотика антимикотика и вносят суспензию клеточной культуры в концентрации 1·104 кл./см3. Культивирование осуществляют в СО2-инкубаторе SanyoMCO-18 M (Sanyo, Япония) в атмосфере 5% СО2 при Т = 37°С. Смену питательной среды проводят при изменении цвета индикатора среды. Культивирование клеток осуществляют в течение 7 суток, оценку проводят ежедневно на инвертируемом микроскопе МИБ-Р (Россия). Показатели адгезии и пролиферации кл