3d биопластический материал на основе гидроколлоида гиалуроновой кислоты
Иллюстрации
Показать всеИзобретение относится к трехмерному биопластическому материалу, включающему основу в виде матрицы, в качестве материала которой используют гидроколлоид гиалуроновой кислоты. Каркас данной биоконструкции получают в результате совмещения методик гель-электрофореза и низкотемпературной лиофильной сушки с получением слоистой трехмерной структуры, наружной - плотной, однородной, внутренней - рыхлой со множеством гетерогенных лакун размером 252,16 ± 98,73 мкм, причем данная структура сохраняется в условиях клеточного культивирования in vitro и эксперимента in vivo. Изобретение обеспечивает повышение эффективности заживления ран и является основой для разработки новых тканеинженерных конструкций и искусственных органов. 16 ил., 1 табл.
Реферат
Область техники
Изобретение относится к медицине, медицинской биотехнологии, а именно к хирургии, комбустиологии, пластической хирургии, косметологии, биоинженерии, и может найти применение в качестве пластического материала для замещения объемных дефектов покровных тканей, стимуляции регенерации, клеточного культивирования in vitro, создания тканеинженерных конструкций и искусственных органов.
Уровень техники
Благодаря современным достижениям медицинского материаловедения и биоинженерии в мире создаются новые 3D (трехмерные) материалы для регенеративной медицины. Биопластические материалы получают в результате применения сложных синтетических технологий: стереолитографическое копирование тканей [22], технологии создания трехмерных имплантатов [5], жидкостно-распределительное моделирование [37] и фазово-изменяющее создание имплантатов [34]. На основе ключевых морфофункциональных критериев они классифицируются на 2 базовые группы [1-43]: матрично-пластические и матрично-целлюлярные (Таблица 1).
| Таблица 1 | |
| Обзор 3D биопластических материалов | |
| Матрично-пластические | Матрично-целлюлярные |
| Сферо®ГЕЛЬ | Epicel |
| Dermagraft | Apligraf (graftskin) |
| Graftjacket Tissue Matrix | TransCyte |
| PriMatrix Acellular Dermal Tissue Matrix | Orcel |
| Oasis wound dressing | |
| BioBrane | |
| AlloDerm | |
| Cymetra | |
| E-Z Derm | |
| Integra (сополимеры коллаген-гликозаминогликана) | |
| TissueMend® | |
| NeuroMatrix | |
| GammaGraft Skin Substitute | |
| Permacol Biological Implant | |
| TheraSkin | |
| Hyalomatrix | |
| HYAFF | |
| EpiFix Amniotic Membrane Allograft | |
| BioDfactor Human Amnion Allograft | |
| hMatrix | |
| Mediskin | |
| Alloskin | |
| Talymed | |
| DermaMatrix | |
| Grafix |
К первой группе относятся биопластические материалы, полученные на основе технологий обработки донорских материалов и тканей животных. Главным достоинством данных материалов является способность стимулировать регенеративные процессы. Ограничением для их широкого применения являются нерешенные вопросы иммунологической толерантности, вирусологической безопасности исходных донорских тканей, а также ряд юридических ограничений.
Вторая группа представлена биопластическими материалами, разработанными с помощью синтетических и клеточных методик. Подобные клеточно-матричные конструкции приобретают новые функциональные свойства и отличаются расширенными показаниями с высокой клинической эффективностью. Однако эти материалы имеют технологические ограничения по объему выпуска и высокую себестоимость, что в совокупности приводит к их малой доступности для клинической практики.
Вариантом решения данной проблемы стала бы разработка новых биопластических материалов, сочетающих в себе достоинства матрично-пластической группы материалов и способных выполнять роль клеточного матрикса in vivo.
Прототипом настоящего изобретения является 3D (трехмерный) биопластический материал Integra Dermal Regeneration Template and Integra Bilayer Wound Matrix [Stern R, McPherson M, Longaker MT., 1990; Dantzer E, Braye FM. 2001, Ryan CM, Schoenfeld DA, Malloy M, et al. 2002, Heimbach DM, Warden GD, Luterman A, et al. 2003, Heitland A, Piatkowski A, Noah EM, Pallua N. 2004, Fette A. 2005, U.S. Food and Drug Adminstration (FDA). 2008, Lee LF, Porch JV, Spenler W, Garner WL 2009].
Препарат Integra (сополимеры коллаген-гликозаминогликана) - это двухслойный 3D биопластический материал, состоящий из пористого слоя химически сшитого бычьего сухожильного коллагена и гликозаминогликана, покрытого полисилоксановым слоем. Integra Dermal Regeneration Template, Integra Bilayer Matrix Wound Dressing и Untegra Meshed Bilayer Wound Matrix (Integra LifeSciences Corporation, Плейнсборо, Нью-Джерси) являются идентичными продуктами, полученными из бесклеточного, биоразлагаемого коллаген-гликозаминогликана (К-ГАГ) - сополимерного матрикса, покрытого тонким силиконовым эластомером. Степень сшивания К-ГАГ обуславливает определенный период биодеградации матрикса, который в условиях раневого процесса в среднем составляет 2-3 недели. По данным разработчиков, силиконовый слой предназначен для сохранения гидробаланса раны и защиты от проникновения инфекции. Коллаген-гликозаминогликановый биоразлагаемый матрикс в процессе гисторегенерации выполняет каркасную функцию для формирования неодермы с разветвленной сосудистой сетью.
В 2001-2002 годах Управление по контролю за продуктами и лекарствами США (FDA) утвердило следующие показания для применения препарата Integra:
- для лечения ожогов, в том числе обширных;
- для ведения скальпированных ран, трофических язв на фоне сосудистой недостаточности и сахарного диабета, пролежней;
- пластика донорских участков при аутопластике (хирургия Мооса, лазерная хирургия).
Препарат Integra также может быть использован в лечении ран с отрицательным давлением.
Integra выпускается в стерильной двойной упаковке с фосфатным буфером, в виде лоскутов следующих размеров: листы 8″×10″ - 500 см2, 4″×10″ - 250 см2, 4″×5″ - 125 см2 и 2″×2″ - 25 см2.
Однако наличие в структуре Integra бычьего сухожильного коллагена приводит к появлению иммунологических реакций (аллергий) вплоть до отторжения материала с неполным заживлением раны. Кроме того, силиконовый слой препятствует первичной адгезии клеток, что в итоге затрудняет применение клеточных технологий совместно с Integra для лечения глубоких и обширных ожогов.
Вторым прототипом предлагаемого изобретения является биопластический материал (Патент РФ №2458709 от 28.12.2010 г.), получаемый путем послойной лиофилизации биополимера гиалуроновой кислоты с формированием объемного биоматериала толщиной в диапазоне от 0,5 до 10 см. Каждый слой имеет микроячеистое строение по типу каркасного построения множества микролабиринтов.
Применяя данную технологию, авторы получают объемный биоматериал, представленный на Фиг.4. Однако аморфная структура данного биоматериала не позволяет формировать губчатые или трубчатые варианты биопластических материалов. Известно, что губчатые или трубчатые варианты 3D (трехмерных) биопластических материалов являются наиболее перспективными в плане создания новых тканеинженерных конструкций или искусственных органов.
Раскрытие изобретения
Техническим результатом предлагаемого 3D (трехмерного) биопластического материала на основе гиалуроновой кислоты является повышение эффективности заживления ран, особенно глубоких и обширных, возможность создания новых тканеинженерных конструкций и искусственных органов при использовании с материалом клеточных технологий.
Задача решается тем, что структуру 3D (трехмерного) биопластического материала получают путем электрофореза геля гиалуроновой кислоты в условиях лиофильной камеры (электрофоретическая гель-сублимация) с формированием биоинженерной конструкции объемной формы, имеющей следующие морфологические характеристики:
- толщиной от 3 мм до 100 мм;
- степень пористости от 70% до 90%;
- гетерогенное распределение пор со средним размером 252,16±98,73 мкм;
- длина глобулярных образований на поверхности материала при исследовании методами туннельной микроскопии 101,5±11,2 нм, ширина 110,3±10,7 нм, высота 23,4±3,4 нм.
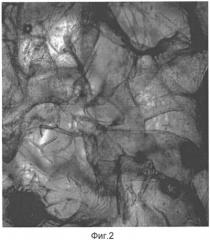
В качестве матрицы образующего вещества используется гидроколлоид гиалуроновой кислоты. Технология электрофоретической гель-сублимации позволяет формировать объемный (3D, трехмерный) биопластический материал с губчато-ячеистой структурой, образующей каркасное построение. Данная биоинженерная модель содержит микроячейки (Фиг.2 и 7), предназначенные для заполнения клетками в процессе регенерации тканей и пластики объемного дефекта раневой поверхности.
Предлагаемый 3D (трехмерный) биопластический материал на основе гиалуроновой кислоты не содержит белковых макромолекул животного происхождения (например, бычьего коллагена или эластина), что обуславливает его иммунологическую совместимость с тканями реципиента и биологическую безопасность.
Технология электрофоретической гель-сублимации осуществляется на оригинальном оборудовании (Фиг.16).
В горизонтальную кювету аппарата для электрофореза (Фиг.3) заполняется гидроколлоид гиалуроновой кислоты, затем кювета с электродами помещается в камеру низкотемпературной лиофильной сушки. В течение 6 часов лиофильной сушки на электроды подается электрический ток с напряжением 500 мВ, силой тока 25 мА.
Научно-техническая новизна разработанной технологии электрофоретической гель-сублимации заключается в сочетании режима низкотемпературной лиофильной сушки и метода электрофореза геля гиалуроновой кислоты. Если использовать только лиофильную сушку гидроколлоида гиалуроновой кислоты, то образуется аморфная ячеистая масса, а при отдельном применении электрофореза геля гиалуроновой кислоты видимых изменений вещества не отмечается.
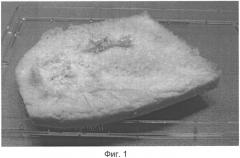
Только сочетанное использование режима низкотемпературной лиофильной сушки и метода электрофореза геля гиалуроновой кислоты приводит к формированию упорядоченной структуры 3D (трехмерного) биопластического материала на основе гиалуроновой кислоты (Фиг.1). На основе данного матрикса 3D биопластического материала возможно формировать новые объемные конструкции, например, трубчатое образование с толстыми стенками (Фиг.5).
В итоге применения данной технологии получается новый 3D (трехмерный) биопластический материал на основе гиалуроновой кислоты, имеющий комплексное слоистое построение - наружная однородная пластинка и внутренний губчато-ячеистый слой (схема строения указана на Фиг.8).
Осуществление изобретения
Пример получения 3D (трехмерного) биопластического материала на основе гиалуроновой кислоты.
Исходный гидроколлоид гиалуроновой кислоты (0,5-3% раствор гиалуроновой кислоты в виде вязкого геля) разливают по 5 мл в горизонтальные кюветы аппарата для электрофореза. Данные кюветы с электродами помещают в камеру лиофильной сушки. Замораживание проводят при -40°C в течение 6-8 ч. После чего осуществляют вакуумное обезвоживание при температуре полки -40°C. Общее время вакуумного обезвоживания составляет 9-10 ч. Готовый 3D (трехмерный) биопластический материал извлекают из камеры вместе с кюветой в биксы, выдерживают в них 1 ч, а затем перекладывают объемные конструкции в блистерную упаковку, хранят при обычных комнатных условиях.
Технология электрофоретической гель-сублимации позволяет получать устойчивые 3D (трехмерные) биопластические материалы на основе гиалуроновой кислоты с различной формой (от кубической до цилиндрической). При гистологическом исследовании материала установлено губчато-ячеистое построение (Фиг.5 и 6), которое сохраняется в условиях влажной среды в отличие от структуры обычного лиофилизата гиалуроновой кислоты, теряющей свое строение при увлажнении.
Новизной разработанного 3D (трехмерного) биопластического материала на основе гиалуроновой кислоты является то, что впервые устойчивая губчато-ячеистая структура гидроколлоида гиалуроновой кислоты получена в результате применения совмещенной технологии электрофореза геля гиалуроновой кислоты и метода низкотемпературной сушки (лиофилизации). При этом данной структуре можно придавать любую форму от губчатой до трубчатой (Фиг.1 и 4-5).
В случае получения губчатых 3D (трехмерных) биопластических материалов на основе гиалуроновой кислоты отмечено формирование плотной пластинки (схема на Фиг.8) у основания 3D материала, своего рода скрепляющей «платформой» для всей конструкции.
При гистологическом исследовании 3D (трехмерного) биопластического материала на основе гиалуроновой кислоты установлена уникальная слоисто-ячеистая структура (Фиг.2, 6 и 7). Гистологическое строение подтверждает наличие скрепляющей более плотной пластинки, таким образом, формируется 2 слоя: наружный с гомогенной и уплотненной структурой и внутренний - разрыхленный, с полостями.
Внутренние слои имеют ячеисто-буллезную структуру с наличием полостей различной формы и размеров. Ближе к наружной пластинке, ячейки, как правило, меньше по размерам, чем в более глубоких, внутренних слоях, где ячейки в несколько раз крупнее. В отличие от наружной (матричной) пластинки их строение неодинаково. Ближе к поверхности перегородки широкие.
Результаты исследований физических свойств разработанного 3D (трехмерного) биопластического материала на основе гиалуроновой кислоты.
Исследование макроструктуры 3D (трехмерного) биоматериала на основе гиалуроновой кислоты показало, что пористость (коэффициент открытой пористости) данного материала составляет 89±5%. Исследование адгезионных свойств материала выявило величину Wa - 110 мН/м2.
Использование оптической микроскопии позволило оценить средний диаметр пор, оказавшийся равный 252,16±98,73 мкм (Фиг.2, 6 и 7). При этом распределение пор по размерам оказалось достаточно гетерогенным.
Исследование тонкой структуры самого биоматериала на атомно-силовом микроскопе (АСМ) выявило волокнистое строение материала. Проведенная морфометрия позволила рассчитать средний диаметр фибриллярных образований, который оказался равен 105,6±9,25 нм (Фиг.9 и 10).
Определенные посредством атомно-силовой микроскопии (АСМ) средние значения шероховатости поверхности биоматериала составили величину 57,8±10,3 нм (Фиг.11).
Результаты исследования физических свойств разработанного 3D (трехмерного) биопластического материала на основе гидроколлоида гиалуроновой кислоты доказывают его оригинальное структурное пространственное построение.
Для оценки биосовместимости 3D (трехмерного) биопластического материала на основе гидроколлоида гиалуроновой кислоты было проведено его тестирование в культуре мезенхимальных стромальных стволовых клеток in vitro. Установлено, что разработанный 3D (трехмерный) материал не обладает свойствами цитотоксичности, в его присутствии клетки продолжали свой жизненный цикл. Изучаемые клетки располагались на поверхности материала и в его структуре, как показано на Фиг.12.
Для оценки влияния 3D (трехмерного) биопластического материала на основе гидроколлоида гиалуроновой кислоты на регенерацию биологических тканей был проведен эксперимент in vivo на лабораторных животных - линия крыс Wistar. В опытной группе выполнялась операция по удалению части печени (частичная гепатэктомия) и размещение в экспериментальную рану 3D биопластического материала с целью ускорения восстановления печени. В контрольной группе животных 3D материал не использовался.
Установлено, что у животных опытной группы ткани печени восстанавливались на 40% быстрее без рубцовых изменений и с наличием тонкостенных сосудистых элементов (Фиг.13), необходимых для сохранения функции печени. В контрольной группе на месте операционной травмы формировался выраженный рубец (Фиг.14).
При оценке расположения клеток в структуре материала и формирования полостей-лакун (Фиг.15) установлено, что структура 3D (трехмерного) материала на основе гидроколлоида гиалуроновой кислоты сохраняется в условиях эксперимента, в ней происходит пролиферация клеточных элементов.
Таким образом, разработанный 3D (трехмерный) биопластический материал на основе гидроколлоида гиалуроновой кислоты может являться основой для разработки новых тканеинженерных конструкций и искусственных органов, например печени и поджелудочной железы.
Краткое описание чертежей
Фиг.1 - внешний вид 3D (трехмерного) биопластического материала на основе гидроколлоида гиалуроновой кислоты.
Фиг.2 - микроячейки 3D (трехмерного) биопластического материала на основе гидроколлоида гиалуроновой кислоты.
Фиг.3 - горизонтальная кювета с электродами для электрофореза;
Фиг.4 - лиофилизат гидроколлоида гиалуроновой кислоты.
Фиг.5 - трубчатая конструкция на основе матрикса 3D биопластического материала на основе гидроколлоида гиалуроновой кислоты.
Фиг.6 и 7 - гистологическая структура 3D (трехмерного) биопластического материала на основе гидроколлоида гиалуроновой кислоты.
Фиг.8 - схема строения 3D (трехмерного) биопластического материала на основе гидроколлоида гиалуроновой кислоты, где 1 - губчато-ячеистый слой, 2 - наружная нижняя уплотненная пластинка.
Фиг.9 - АСМ-изображение поверхности биоматериала, шкала - 1 мкм.
Фиг.10 - АСМ-изображение поверхности биоматериала, шкала - 1 мкм.
Фиг.11 - трехмерная АСМ-реконструкция поверхности биоматериала для оценки его поверхности.
Фиг.12 - АСМ-изображение результатов клеточного культивирования - расположение мезенхимальной стволовой клетки в структуре биополимерного материала (А) шкала - 5 мкм, (Б) шкала - 2 мкм.
Фиг.13 - гистологический препарат опытной группы, окраска альциановым синим, отмечается выраженная васкуляризация (наличие множества тонкостенных сосудов с расширенным просветом).
Фиг.14 - гистологический препарат с окраской пикрофуксином по Ван Гизон, также отмечается закрытие экспериментальной раны печени, которое сопровождается формированием воспалительного инфильтрата с очагами деструкции и выраженной рубцовой тканью.
Фиг.15 - гистологический препарат с окраской гематоксилином и эозином, где показано расположение большого количества клеточных элементов в пластинке и перегородках полостей 3D биопластического материала.
Фиг.16 - установка для электрофоретической гель-сублимации: 1 - полка, 2 -сушильная камера, 3 - низкотемпературная камера, 4 - охлаждаемая ловушка, 5 - вакуумная система, 6 - система охлаждения и нагрева, 7 - кюветы с электродами.
Список литературы
1. Adams E. Bibliography: Collagen-based Dressings for Chronic Wound Management. Boston, MA: Veterans Health Administration Technology Assessment Program (VATAP): January 2003.
2. Agency for Healthcare Research and Quality (AHRQ). Overview of wound care technologies. Technology Assessment. Rockville, MD: AHRQ; 2003.
3. Barber С, Watt A, Pham C, et al. Bioengineered skin substitutes for the management of wounds: A systematic review. ASERNIP-S Report No. 52. Stepney, Australia: Australian Safety and Efficacy Register of New Interventional Procedures - Surgical (ASERNIP-S); August 2006.
4. Bradley M, Cullum N, Nelson EA, et al. Systematic reviews of wound care management: (2) dressings and topical agents used in the healing of chronic wounds. Health Tech Assess. 1999; (17 Pt 2): 1-35.
5. Bredt J.F., Sach E., Brancazio D. et al. Three dimensional printing system. 1998; US Patent: 5807437.
6. Canadian Agency for Drugs and Technologies in Health. Non-adherent versus traditional dressings for wound care: Comparative effectiveness, safety, and guidelines. Ottawa, ON: Canadian Agency for Drugs and Technologies in Health (CADTH); 2011.
7. Chaby G, Senet P, Vaneau M, et al. Dressings for acute and chronic wounds: A systematic review. Arch Dermatol. 2007; 143 (10): 1297-1304.
8. Cheng A, Saint-Cyr M. Comparison of different ADM materials in breast surgery. Clin Plast Surg. 2012; 39 (2): 167-175.
9. Cullum N, Petherick E. Pressure ulcers. In: BMJ Clinical Evidence. London, UK: BMJ Publishing Group; February 2006.
10. Dantzer E, Braye FM. Reconstructive surgery using an artificial dermis (Integra): Results with 39 grafts. Br J Plast Surg. 2001; 54 (8): 659-664.
11. Dumville JC, Deshpande S, O'Meara S, Speak K. Foam dressings for healing diabetic foot ulcers. Cochrane Database Syst Rev. 2011; (9): CD 009111.
12. Dumville JC, Deshpande S, O'Meara S, Speak K. Hydrocolloid dressings for healing diabetic foot ulcers. Cochrane Database Syst Rev. 2012; (2): CD 009099.
13. Dumville JC, O'Meara S, Deshpande S, Speak K. Alginate dressings for healing diabetic foot ulcers. Cochrane Database Syst Rev. 2012; (2): CD 009100.
14. Dumville JC, O'Meara S, Deshpande S, Speak K. Hydrogel dressings for healing diabetic foot ulcers. Cochrane Database Syst Rev. 2011; (9): CD 009101.
15. Dumville JC, Walter CJ, Sharp CA, Page T. Dressings for the prevention of surgical site infection. Cochrane Database Syst Rev. 2011; (7): CD 003091.
16. Ehrenreich M, Ruszczak Z. Update on tissue-engineered biological dressings. Tissue Eng. 2006; 12 (9): 2407-2424.
17. Fette A. Integra artificial skin in use for full-thickness burn surgery: Benefits or harms on patient outcome. Technol Health Care. 2005; 13 (6): 463-468.
18. Heimbach DM, Warden GD, Luterman A, et al. Multicenter postapproval clinical trial of Integra dermal regeneration template for burn treatment. J Burn Care Rehabil. 2003; 24 (1): 42-48.
19. Heitland A, Piatkowski A, Noah EM, Pallua N. Update on the use of collagen/glycosaminoglycate skin substitute-six years of experiences with artificial skin in 15 German burn centers. Burns. 2004; 30 (5): 471-475.
20. Но С, Tran K, Hux M, et al. Artificial skin grafts in chronic wound care: A meta-analysis of clinical efficacy and a review of cost-effectiveness. Technology Report No 52. Ottawa, ON: Canadian Coordinating Office for Health Technology Assessment (CCOHTA); 2005. Available at: http://www.cadth.ca/media/pdf/252_artificial_skin_grafts_tr_e.pdf.
21. http://www.surgeons.org/AM/Template.cfm?Section=ASERNIP_S_Publications&Template=/TaggedPage/
22. Hunt D. Foot ulcers and amputations in diabetes. In: BMJ Clinical Evidence. London, UK: BMJ Publishing Group; September 2006.
23. Jones JE, Nelson EA. Skin grafting for venous leg ulcers. Cochrane Database Syst Rev. 2007; (2): CD 001737.
24. Kranke P, Bennett MH, Martyn-St James M, et al. Hyperbaric oxygen therapy for chronic wounds. Cochrane Database Syst Rev. 2012; (4): CD 004123.
25. Landers R., Pfister A., Hubner U. et al. Fabrication of soft tissue engineering scaffords by means of rapid prototyping techniques. J. Mater. Sci. 2002; 37: 3107-3116.
26. Lee LF, Porch JV, Spenler W, Garner WL. Integra in lower extremity reconstruction after burn injury. Plast Reconstr Surg. 2009; 121 (4); 1256-1262.
27. National Institute for Clinical Excellence (NICE). Guidance on the use of debriding agents and specialist wound care clinics for difficult to heal surgical wounds. Technology Appraisal Guidance No. 24. London, UK: NICE; April 2001.
28. Nelson EA, Bradley MD. Dressings and topical agents for arterial leg ulcers. Cochrane Database Syst Rev. 2007; (1): CD 001836.
29. Nelson EA, Jones JI. Venous leg ulcers. In: BMJ Clinical Evidence. London, UK: BMJ Publishing Group; July 2006.
30. Nicolau I, Xie X, McGregor M, Dendukuri N. Evaluation of acellular dermal matrix for breast reconstruction: An update. Report No. 59. Montreal, QC: Technology Assessment Unit of the McGill University Health Centre (MUHC); 2012.
31. Palfreyman SJ, Nelson EA, Lochiel R, Michaels JA. Dressings for healing venous leg ulcers. Cochrane Database Syst Rev. 2006; (3): CD 001103.
32. Pham СТ. Bioengineered skin substitutes for the management of burns: A systematic review. ASERNIP-S Report No. 46. Stepney, Australia: Australian Safety and Efficacy Register of New Interventional Procedures - Surgical (ASERNIP-S); July 2006. Available at: http://www.surgeons.org/AM/Template.cfm?Section=ASERNIP_S_Publications&Template=/TaggedPage/.
33. Ryan CM, Schoenfeld DA, Malloy M, et al. Use of Integra artificial skin is associated with decreased length of stay for severely injured adult burn survivors. J Burn Care Rehabil. 2002; 23 (5): 311-317.
34. Sachlos E., Czernuszka J.T. Making tissue engineering scaffords work. Review on the application of solid freeform fabrication technology to the production of tissue engineering scaffords. Europ. Cells Materials. 2003; 5: 29-40.
35. Snyder DL, Sullivan N, Schoelles KM. Skin substitutes for treating chronic wounds. Technology Assessment Report. Prepared by the ECRI Institute Evidence-based Practice Center (EPC) under contract to the Agency for Healthcare Research and Quality (AHRQ), Contract No. HHSA 290-2007-10063. Project ID: HCPR0610. Rockville, MD: AHRQ; December 18, 2012.
36. Stern R, McPherson M, Longaker MT. Histologic study of artificial skin used in the treatment of full-thickness thermal injury. J Burn Care Rehabil. 1990; 11 (1): 7-13.
37. Taboas J.M., Maddox R.D., Krebsbach P.H., Hollister S.J. Indirect solid free form fabrication of local and global porous, biomimetic and composite 3D polimer-ceramic scaffords. Biomaterials 2003; 24: 181-194.
38. Tagged PageDisplay.cfm&TPLID=17&ContentlD=3297. Accessed March 9, 2007.
39. Technology Assessment Unit, Office of Patient Care Services, U.S. Department of Veterans Affairs (VATAP). Collagen-based wound care products: Summary of INAHTA reviews. Boston, MA: VATAP; 2003.
40. U.S. Food and Drug Administration (FDA). Collagen nerve cuff. 510 (k) Summary. K012814. Collagen Matrix, Inc., Franklin Lakes, NJ. Rockville, MD: FDA; September 21, 2001. Available at: http://www.fda.gov/cdrh/pdf/k012814.pdf.
41. Vermeulen H, Ubbink D, Goossens A, et al. Dressings and topical agents for surgical wounds healing by secondary intention. Cochrane Database Syst Rev. 2004; (1):CD 003554.
42. Wang C, Lau J. Hyperbaric oxygen therapy in treatment of hypoxic wounds - systematic review. Prepared by the New England Medical Center Evidence-based Practice Center (EPC) for the Agency for Healthcare Research and Quality (AHRQ) under contract no. 270-97-0019. Rockville, MD: Agency for Healthcare Research and Quality (AHRQ); November 2, 2001.
43. Wasiak J, Cleland H. Burns (minor thermal). In: BMJ Clinical Evidence. London, UK: BMJ Publishing Group; January 2006.
Трехмерный биопластический материал, включающий основу в виде матрицы, в качестве материала которой используют гидроколлоид гиалуроновой кислоты, отличающийся тем, что каркас данной биоконструкции получают в результате совмещения методик гель-электрофореза и низкотемпературной лиофильной сушки (технология электрофоретической гель-сублимации) с получением слоистой трехмерной структуры, наружной - плотной, однородной, внутренней - рыхлой со множеством гетерогенных лакун размером 252,16 ± 98,73 мкм, причем данная структура сохраняется в условиях клеточного культивирования in vitro и эксперимента in vivo.