Местная доставка комбинации агонистов аденозиновых рецепторов подтипа а2а/ингибитора фосфодиэстеразы в сосудах для уменьшения тяжести поражения миокарда
Иллюстрации
Показать всеИзобретение относится к медицине. Описано медицинское устройство для местной доставки селективного агониста аденозиновых рецепторов в сочетании с другими лекарственными средствами, используется для уменьшения поражения миокарда после острого инфаркта миокарда. В максимально короткие сроки после острого инфаркта миокарда стент или другое подходящее устройство, заключающее в себе или способное доставить селективный агонист аденозиновых рецепторов, размещают в кровеносном сосуде, в котором возникло закупоривание, вызвавшее инфаркт. После размещения стент или другое внутрипросветное устройство расправляется для устранения закупорки и восстановления кровотока в определенной области, участке или объеме ткани сердца. В течение заданного периода времени селективный агонист аденозиновых рецепторов по отдельности или в сочетании с другими лекарственными средствами элюирует из стента или другого устройства в нижележащий коронарный кровоток, направляющийся к ткани сердца, пораженной гипоксией в течение времени, достаточного для снижения уровня поражения миокарда. Стенты значительно снижают частоту рестеноза. 12 з.п. ф-лы, 19 ил.
Реферат
ОТСЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает преимущества предварительной заявки на патент США серийный № 61/415056, поданной 18 ноября 2010 г.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
1. Область применения изобретения
Настоящее изобретение относится к местному введению лекарственных средств и/или сочетаний лекарственных средств для уменьшения степени поражения миокарда после острого инфаркта миокарда и, более конкретно, к внутрипросветным медицинским устройствам для местной доставки лекарственных средств и/или сочетаний лекарственных средств для восстановления перфузии и снижения тяжести поражения миокарда после острого инфаркта миокарда.
2. Обсуждение существующего уровня техники
Многие люди страдают от болезней системы кровообращения или сосудистых заболеваний, вызываемых нарастающим закупориванием или сужением кровеносных сосудов, которые снабжают кровью сердце и другие жизненно-важные органы. У таких людей, закупоривание кровеносных сосудов более тяжелой степени часто приводит к артериальной гипертензии, ишемическому повреждению, инсульту или инфаркту миокарда. Атеросклеротические повреждения, которые ограничивают или затрудняют коронарный кровоток, являются основной причиной развития ишемической болезни сердца. С другой стороны, спонтанный разрыв воспаленного атеросклеротического очага или нестабильной бляшки может приводить к интермиттирующей или полной окклюзии артерии, вызывающей ишемическое повреждение, такое как инсульт и/или острый инфаркт миокарда. Чрескожная транслюминальная коронарная ангиопластика представляет собой медицинскую процедуру, цель которой заключается в увеличении кровотока через артерию. Чрескожная транслюминальная коронарная ангиопластика представляет собой основной способ лечения стеноза коронарной артерии. Возрастающая частота применения этой процедуры связана с относительно высокой результативностью и минимальной инвазивностью по сравнению с операцией коронарного шунтирования. Ограничением для чрескожной транслюминальной коронарной ангиопластики является внезапное закрытие сосуда, которое может возникнуть сразу после процедуры, и рестеноз, который развивается постепенно после процедуры. Кроме того, рестеноз является хронической проблемой у пациентов, прошедших шунтирование с помощью подкожной вены бедра. Представляется, что механизм острой тромботической окклюзии задействует несколько факторов, причина может заключаться в сосудистом возврате, вызывающим закрытие артерии и/или отложением тромбоцитов и фибрина вдоль длины пораженного участка вновь открытого кровеносного сосуда.
Рестеноз после чрескожной транслюминальной коронарной ангиопластики представляет собой более постепенный процесс, запускаемый повреждением сосуда. В развитии рестеноза участвуют различные процессы, включая тромбоз, воспаление, фактор роста и высвобождение цитокинов, пролиферацию клеток, миграцию клеток и процесс синтеза внеклеточного матрикса.
При расширении под давлением интракоронарного баллонного катетера во время ангиопластики, повреждаются гладкомышечные клетки и эндотелиальные клетки сосудистой стенки, что приводит к развитию тромботической и воспалительной реакции. Клеточные факторы роста, такие как тромбоцитарный фактор роста, основной фактор роста фибробластов, эпидермальный фактор роста, тромбин и т.д., высвобождаемые из тромбоцитов, мигрирующих макрофагов и/или лейкоцитов, или непосредственно из гладкомышечных клеток, провоцируют реакцию на миграцию и пролиферацию в гладкомышечных клетках медиального слоя. Происходит переход этих клеток из сократительного фенотипа в синтетический, для которого характерны лишь небольшое количество пучков сократительных волокон, обширный шероховатый эндоплазматический ретикулум, аппарат Гольджи и свободные рибосомы. Пролиферация/ миграция обычно начинаются в течение одного-двух дней после повреждения и достигают максимума через несколько дней (Campbell (Кэмпбелл) и Campbell (Кэмпбелл), 1987; Clowes (Клоуз) и Schwartz (Шварц), 1985).
Дочерние клетки мигрируют в слой интимы клеток гладких мышц артерии и продолжают пролиферировать и выделять значимые количества белков внеклеточного матрикса. Пролиферация, миграция и синтез внеклеточного матрикса продолжаются, пока не восстанавливается эндотелиальный слой, в это время замедляется пролиферация в интиме, обычно это происходит через семь - четырнадцать дней после повреждения. Вновь образовавшаяся ткань называется неоинтима. Дальнейшее сужение сосуда, которое происходит в течение периода от трех до шести месяцев, вызвано, в первую очередь, отрицательным или сократительным ремоделированием.
Одновременно с местной пролиферацией и миграцией происходит прилипание воспалительных клеток к участку сосудистого повреждения. В течение периода от трех до семи дней после повреждения, воспалительные клетки мигрируют в более глубокие слои сосудистой стенки. В моделях на животных, с применением повреждения от баллона или имплантации стента, воспалительные клетки могут персистировать на участке сосудистого повреждения по меньшей мере тридцать дней ((Tanaka (Танака) и соавт., 1993; Edelman (Эдельман) и соавт., 1998). В связи с этим, имеются воспалительные клетки, и они могут участвовать как в острой, так и в хронической фазах рестеноза.
В отличие от системной лекарственной терапии, подтверждено, что стенты значимо снижают частоту рестеноза. Обычно стенты представляют собой расширяемые с помощью баллона металлические трубки с множеством прорезей (обычно, кроме прочего, из нержавеющей стали или кобальтохромовых сплавов), которые расширяются внутри просвета коронарной артерии, прошедшей ангиопластику, обеспечивают структурную поддержку артериальной стенки с помощью жесткого каркаса. Такая поддержка помогает сохранить проходимость просвета сосуда. В двух рандомизированных клинических исследованиях, при оценке методом ангиографии, при применении стентов повышалась частота благоприятных исходов после чрескожной транслюминальной коронарной ангиопластики, благодаря увеличению минимального диаметра просвета и сокращения, но не исключения, частоты развития рестеноза через шесть месяцев (Serruys (Серруйс) и соавт., 1994; Fischman (Фишман) и соавт., 1994). Кроме того, стенты являются терапией выбора для реваскуляризации тромбированной коронарной артерии (острый инфаркт миокарда), в этом случае быстрое восстановление кровотока к ишемизированной ткани миокарда является определяющим фактором долгосрочной клинической эффективности. Установлено, что полное восстановление коронарного кровотока с помощью стента в течение 6 часов после проявления симптомов, а желательно менее чем через 3 часа, приводило к гораздо более благоприятным клиническим исходам в отношении устранения тромботической окклюзии по сравнению с введением тромболитических препаратов (тканевой активатор плазминогена, стрептокиназа и т.д.).
Стенты, применяемые для местной доставки рапамицинов, включая сиролимус, эверолимус и другие аналоги или производные рапамицина (ингибитор mTOR - мишень рапамицина у млекопитающих), подтвердили свою более высокую эффективность в значимом снижении частоты рестеноза и связанных с ним осложнений после чрескожной транслюминальной коронарной ангиопластики и других аналогичных процедур на артериях/венах по сравнению с непокрытыми металлическими стентами. Рапамицины могут наноситься на стент или внедряться в него различными способами. Например, рапамицины могут внедряться в полимерную матрицу, а затем присоединяться к поверхности стента с помощью любых приемлемых средств. Другим способом, рапамицины могут внедряться в полимерную матрицу, а затем загружаться в резервуар на стенте или в нем. Тем или иным способом, рапамицины элюируют из полимерной матрицы в окружающую ткань в течение заданного периода времени.
Кроме того, покрытие стентов гепарином, как представляется, дает дополнительные преимущества в уменьшении подострого тромбоза после имплантации тента. Таким образом, длительное механическое расширение суженной коронарной артерии стентом способствует предотвращению рестеноза, а покрытие стентов рапимицинами и гепарином является целесообразным и клинически ценным для местной доставки лекарственных препаратов на участок поврежденной ткани.
Принимая во внимание, что продемонстрирована целесообразность и желательность местной доставки лекарственных препаратов, стенты, как и другие имплантируемые медицинские устройства, могут использоваться для доставки других препаратов или лекарственных средств как в артерии, так и в органы, расположенные ниже по кровотоку от места размещения стента или другого медицинского устройства, для терапии других патологических состояний. Например, существует необходимость местной доставки лекарственных препаратов для уменьшения степени поражения миокарда после острого инфаркта миокарда. Более обобщенно, существует необходимость местного введения лекарственных препаратов для снижения степени ишемического поражения. Кроме того, возможна местная доставка сочетаний лекарственных средств для лечения других осложнений или состояний, потенциально связанных или не связанных с поражением.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Местная доставка через стент или любое другое подходящее устройство, селективного агониста аденозиновых рецепторов, в соответствии с настоящим изобретением, может использоваться для преодоления недостатков лечения, указанных выше.
В соответствии с одним из аспектов, настоящее изобретение направлено на создание медицинского устройства для местной доставки селективного агониста аденозиновых рецепторов в сочетании, по меньшей мере, с одним дополнительным лекарственным средством для лечения поражения миокарда после острого инфаркта миокарда. Медицинское устройство, содержащее расширяющееся внутрипросветное устройство, выполненное для открытия и восстановления кровотока в кровеносном сосуде, который, по меньшей мере, частично закупорен, селективный агонист аденозиновых рецепторов, прикрепляющийся с возможностью высвобождения, к расширяющемуся внутрипросветному устройству, селективный агонист аденозиновых рецепторов, предназначенный для элюирования в кровоток со скоростью по меньшей мере десять микрограмм в час в течение по меньшей мере четырех (4) часов после восстановления кровотока в кровеносном сосуде, и ингибитор фосфодиэстеразы, зафиксированный на расширяющемся внутрипросветном устройстве и предназначенный для элюирования, по меньшей мере, в одно из сосудистого русла и окружающей ткани.
В соответствии с другим аспектом, настоящее изобретение направлено на создание способа лечения поражения миокарда после острого инфаркта миокарда. Способ, включающий расширение внутрипросветного устройства для открытия и восстановления кровотока в кровеносном сосуде, который, по меньшей мере, частично закупорен, высвобождение селективного агониста аденозиновых рецепторов из расширяющегося внутрипросветного устройства в кровоток со скоростью по меньшей мере десять микрограмм в час в течение по меньшей мере четырех (4) часов после восстановления кровотока в кровеносном сосуде, и высвобождение ингибитора фосфодиэстеразы из расширяющегося внутрипросветного устройства, по меньшей мере, в одно из сосудистого русла и окружающей ткани.
Стент или другое имплантируемое медицинское устройство для местной доставки агониста аденозиновых рецепторов подтипа A2A может использоваться для уменьшения поражения миокарда после острого инфаркта миокарда. В максимально короткие сроки после острого инфаркта миокарда стент или другое подходящее устройство, содержащее или способное доставить агонист аденозиновых рецепторов подтипа A2A помещают в кровеносный сосуд, в котором возникло закупоривание, вызвавшее инфаркт. После размещения, стент или другое внутрипросветное устройство расправляется для устранения закупорки и восстановления кровотока в определенной области, участке или объеме ткани сердца. После определенного периода времени, описанного более подробно далее, агонист аденозиновых рецепторов подтипа A2A высвобождается из стента или другого устройства в нижележащий коронарный кровоток, направляющийся к ткани сердца, пораженной гипоксией, в течение времени, достаточного для снижения уровня поражения миокарда. Как описывается в этом документе, настоящее изобретение может также применяться для лечения других органов.
Раннее и постоянное высвобождение агониста аденозиновых рецепторов подтипа A2A может уменьшить поражение миокарда, сокращая размер или объем пораженной инфарктом ткани миокарда, снижая уровень гибели мышечных клеток, уменьшая степень реперфузионного повреждения, сохраняя лучшее функционирование капиллярного мышечного русла, и/или ослабляет так называемое состояние невосстановленного кровотока. Такие действия, в свою очередь, улучшают сердечный выброс, фракцию выброса и морфометрические показатели сердечной мышцы после инфаркта. Доставка агониста аденозиновых рецепторов подтипа A2A из стента или другого устройства к ткани, пораженной гипоксией, начинается немедленно после того, как закупоренный кровеносный сосуд становится проходимым после раскрытия устройства, или, более конкретно, доставка препарата из устройства не начинается до восстановления кровотока к участку лечения, поскольку лекарственный препарат переносится ниже с током крови. В случае со стентом с лекарственным покрытием или стентом, в котором лекарственный препарат содержится в резервуаре, доставка агониста аденозиновых рецепторов подтипа A2A будет начинаться немедленно после расширения стента и извлечения баллона, что делает возможным элюирование агониста. При применении саморасширяющего стента, доставка агониста будет начинаться после раскрытия стента и вхождение в контакт с кровью.
Кроме того, применение комбинации сиролимуса и цилостазола представляется более эффективным, чем использование одного лекарственного вещества для уменьшения пролиферации и миграции гладкомышечных клеток. Цилостазол может также применяться для достижения продолжительного действия против отложения тромбоцитов и предотвращения тромбоза на стенте или другом медицинском устройстве. Кроме того, цилостазол, являющийся ингибитором ФДЭ-III, также обладает действием, аналогичным действию селективных агонистов аденозиновых рецепторов подтипа A2A, описанных в этом документе. Действие ингибиторов фосфодиэстеразы обусловлено блокировкой или замедлением ферментативного превращения циклического аденозинмонофосфата (цАМФ) в 5'-аденозинмонофосфат (АМФ). Аденозиновые рецепторы подтипа A2A являются рецепторами, связанными с Gs белком, которые соединяются для активации аденилатциклазы. Агонист аденозиновых рецепторов подтипа A2A может, в связи с этим, повышать внутриклеточные уровни цАМФ в целевых клетках для осуществления их биологического действия. Поскольку уровни цАМФ в ткани непосредственно связаны со стимуляцией аденозиновых рецепторов, блокировка распада цАМФ с помощью ингибиторов ФДЭ приведет к еще более интенсивной стимуляции тех же аденозиновых рецепторов, что и рецепторы, на которые нацелено действие экзогенных агонистов аденозиновых рецепторов. В этом отношении, при совместной доставке ингибитора ФДЭ и селективного агониста аденозиновых рецепторов в комбинации обеспечивается более высокий уровень стимуляции аденозиновых рецепторов, чем при их доставке по-отдельности. Следовательно, сочетание препаратов можно применять для лечения рестеноза, тромбоза и уменьшения поражения миокарда после острого инфаркта миокарда, при доставке со стента или другого медицинского устройства.
Местная доставка может применяться в сочетании с системной доставкой того же лекарственного препарата и/или других лекарственных препаратов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеизложенные и прочие характеристики и преимущества настоящего изобретения станут понятны после следующего более подробного описания предпочтительных вариантов осуществления настоящего изобретения, проиллюстрированных с помощью прилагаемых изображений.
На фигуре 1 представлен продольный вид стента (концы не показаны) до расширения; показывающий наружную поверхность стента и характерную полосчатую структуру.
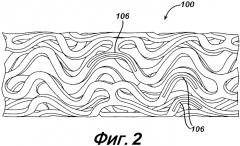
На фигуре 2 представлен вид в перспективе вдоль стента, изображенного на фиг. 1, имеющего резервуары в соответствии с настоящим изобретением.
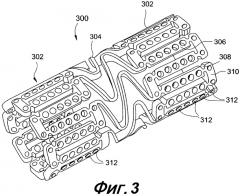
На фигуре 3 представлена изометрическая проекция расширяющегося медицинского устройства с лечебным средством, загруженным в отверстия в соответствии с настоящим изобретением.
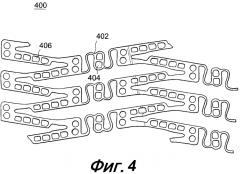
На фигуре 4 представлен увеличенный вид сбоку части расширяющегося медицинского устройства с отверстиями, заполненными лечебным средством, в перемычных элементах, в соответствии с настоящим изобретением.
На фигуре 5 представлен схематичный вид сбоку части стента, высвобождающего лекарственные препараты, в соответствии с настоящим изобретением.
На фигуре 6 представлено графическое изображение коронарного кровотока у свиней, находящихся под наркозом, со вскрытой грудной клеткой, которым имплантировали непокрытые металлические стенты и стенты, элюирующие ATL-359 в соответствии с настоящим изобретением.
На фигуре 7 представлено схематическое изображение первого примера осуществления изобретения в виде стента, покрытого комбинацией сиролимуса и цилостазола в соответствии с настоящим изобретением.
На фигуре 8 представлено графическое изображение кинетики высвобождения в условиях in vitro комбинации сиролимуса и цилостазола, покрывающей стент, из первого примера осуществления в соответствии с настоящим изобретением.
На фигуре 9 представлено схематическое изображение второго примера осуществления изобретения, включающего стент, покрытый комбинацией сиролимуса и цилостазола в соответствии с настоящим изобретением.
На фигуре 10 представлено графическое изображение кинетики высвобождения в условиях in vitro комбинации сиролимуса и цилостазола, покрывающей стент, из второго примера осуществления в соответствии с настоящим изобретением.
На фигуре 11 представлено схематическое изображение третьего примера осуществления изобретения, включающего стент, покрытый комбинацией сиролимуса и цилостазола в соответствии с настоящим изобретением.
На фигуре 12 представлено графическое изображение активности комбинации сиролимуса и цилостазола, элюирующихся со стента, в условиях in vitro, в экспериментальной модели кровеносной системы с использованием бычьей крови в соответствии с настоящим изобретением.
На фигуре 13 представлено графическое изображение кинетики высвобождения, в условиях in vivo, сиролимуса и цилостазола из стента, показанного на фигуре 15.
На фигуре 14 представлено графическое изображение кинетики высвобождения в условиях in vitro высвобождения сиролимуса и цилостазола из стента, показанного на фигуре 15.
На фигуре 15 представлено схематическое изображение четвертого примера осуществления изобретения, включающего стент, покрытый комбинацией сиролимуса и цилостазола, согласно настоящему изобретению.
На фигуре 16 представлено графическое изображение кинетики высвобождения, в условиях in vivo сиролимуса и цилостазола из стента, показанного на фигуре 7.
На фигуре 17 представлено графическое изображение кинетики высвобождения, в условиях in vitro, сиролимуса и цилостазола из стента, показанного на фигуре 7.
На фигуре 18 представлено графическое изображение кинетики высвобождения, в условиях in vivo, сиролимуса и цилостазола, из стента с двойным лекарственным покрытием в соответствии с настоящим изобретением.
На фигуре 19 представлено графическое изображение кинетики высвобождения ATL-359 в условиях in vitro в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Хотя примеры осуществления настоящего изобретения будут описываться применительно к лечению рестеноза или уменьшению поражения миокарда после острого инфаркта миокарда, важно отметить, что местная доставка препарата/сочетания препаратов может применяться для лечения широкого спектра состояний с использованием любого количества медицинских устройств, или для улучшения функционирования и/или увеличения срока службы устройства. Например, искусственные хрусталики, имплантируемые для восстановления зрения после удаления катаракты часто провоцируют развитие вторичной катаракты. Последняя, как правило, является результатом чрезмерного разрастания клеток на поверхности хрусталика, которое потенциально можно свести к минимуму при использовании устройства в сочетании с лекарственным препаратом или препаратами. Другие медицинские устройства, которые часто выходят из строя вследствие врастания ткани или отложения белкового материала внутри, на поверхности или вокруг устройства, такого как шунты при гидроцефалии, катетеры для диализа, устройства для прикрепления калоприемников, ушные дренажные трубки, электроды кардиостимуляторов и имплантируемых дефибрилляторов, могут также выиграть при сочетании устройства доставки и препарата. Устройства, которые служат для улучшения структуры и функции ткани или органа, в сочетании с подходящим лекарственным препаратом или препаратами также могут принести больше пользы. Например, возможно достичь более эффективной остеоинтеграции протезов для улучшения стабилизации имплантируемых устройств с помощью сочетания с такими препаратами, как костный морфогенетический белок. Аналогичным образом, другие хирургические устройства, шовный материал, скобки, устройства для анастомоза, позвоночные диски, костные стержни, фиксаторы шовного материала, гемостатические барьеры, зажимы, винты, пластинки, клипсы, сосудистые протезы, тканевой клей и герметики, тканевые каркасы, различные виды перевязочного материала, заменители кости, внутрипросветные устройства и сосудистые каркасы также могут обеспечивать для пациентов повышение результативности лечения при сочетании устройства доставки и препарата. Особенно эффективными могут являться периваскулярные обертывания, применяемые сами по себе или в сочетании с другими медицинскими устройствами. Периваскулярные обертывания могут обеспечивать доставку дополнительных лекарственных препаратов к месту лечения. В сущности, любое медицинское устройство может быть покрыто или загружено каким-либо способом лекарственным препаратом или сочетанием лекарственных препаратов, что улучшает результативность лечения по сравнению с применением устройства или фармацевтического препарата по отдельности.
Наряду с различными медицинскими приспособлениями, покрытие этих устройств может использоваться для доставки терапевтических и фармацевтических веществ, включая: антипролиферативные/ противоопухолевые средства, включая препараты природного происхождения, например, алкалоиды барвинка (т.е. винбластин, винкристин и винорелбин), паклитаксел, эпиподофиллотоксины (т.е. этопозид, тенипозид), антибиотики (дактиномицин (актиномицин D), даунорубицин, доксорубицин и идарубицин), антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин, ферменты (L-аспарагиназа, участвующая в системном метаболизме L-аспарагина и уменьшающая количество клеток, неспособных синтезировать собственный аспарагин); антитромботические средства, такие как, ингибиторы гликопротеина (ГП) llb/llla и антагонисты рецептора витронектина; антипролиферативные/антимитотические алкилирующие агенты, такие как азотистые иприты (мехлоретамин, циклофосфамид и его аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты - бусульфан, производные нитрозомочевины (кармустин (БИКНУ) и его аналоги, стрептозоцин), триазены - дакарбазин (DTIC); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат), аналоги пиримидина (фторурацил, флоксуридин и цитарабин), аналоги пурина и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлородеоксиаденозин {кладрибин}); координационные комплексы платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевина, митотан, аминоглутетимид; гормоны (т.е. эстроген); антикоагулянты (гепарин, синтетические соли гепарина и другие ингибиторы тромбина); фибринолитические средства (такие как тканевой активатор плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрел, абциксимаб; вещества, препятствующие миграции; антисекреторные препараты (брефельдин); противовоспалительные средства: такие как адренокортикальные стероиды (кортизол, кортизон, флудрокортизон, преднизон, преднизолон, 6α-метилпреднизолон, триамцинолон, бетаметазон и дексаметазон), нестероидные препараты (производные салициловой кислоты, т.е. аспирин); производные пара-аминофенола, т.е. ацетаминофен; индол- и инден-уксусные кислоты (индометацин, сулиндак и этодолак), гетероарил-уксусные кислоты (толметин, диклофенак и кеторолак), арилпропионовые кислоты (ибупрофен и его производные), антраниловые кислоты (мефенамовая кислота и меклофенамовая кислота), энолиевые кислоты (пироксикам, теноксикам, фенилбутазон и оксифентатразон), набуметон, соединения золота (ауранофин, ауротиоглюкоза, ауротиомалат натрия); иммунодепрессанты: (циклоспорин, такролимус (FK-506), азатиоприн, мофетила микофенолат); ангиогенные средства: фактор роста эндотелия сосудов (ФРЭС), фактор роста фибробластов (ФРФ); блокаторы рецептора ангиотензина; доноры оксида азота; антисмысловые олигонуклеотиды и их сочетания; ингибиторы клеточного цикла, ингибиторы mTOR, такие как сиролимус, эверолимус и другие аналоги рапамицина и ингибиторы киназы трансдукции сигналов рецепторов фактора роста; ретиноиды; ингибиторы циклина/циклин-зависимой киназы; ингибиторы кофермент-а редуктазы ЧМГ (статины); и ингибиторы протеазы.
Стент обычно представляет собой трубчатую конструкцию, которая вставляется в просвет канала для устранения закупорки. Обычно стент вставляют в просвет в сложенной форме, а затем расширяют автономно или при помощи другого устройства in situ. Типичным методом расширения является расширение при помощи баллона для ангиопластики, установленного на катетере; баллон надувается внутри стенозированного сосуда или канала тела для того, чтобы рассечь и разорвать обтурации, связанные с компонентами сосудистой стенки, и расширить просвет сосуда. Однако возможно использование саморасширяющихся стентов без баллона.
На фигуре 1 представлен пример стента 100, который может использоваться в соответствии с примером осуществления настоящего изобретения. Расширяемый цилиндрический стент 100 содержит структуру с многочисленными отверстиями, предназначенную для размещения в кровеносном сосуде, канале или просвете для удержания сосуда, канала или просвета в открытом состоянии, а более конкретно, для защиты сегмента артерии от рестеноза после ангиопластики. Стент 100 может расширяться по окружности и поддерживаться в расширенной конфигурации, которая остается жесткой по окружности или радиально. Стент 100 является гибким в осевом направлении, и при сгибании по полосе у стента 100 будут отсутствовать какие-либо выступающие наружу части.
Стент 100 обычно содержит первый и второй конец с промежуточным участком между ними. Стент 100 имеет продольную ось и содержит совокупность продольно расположенных полос 102, при этом, каждая полоса 102 очерчивает непрерывную волну вдоль сегмента, параллельного продольной оси. Совокупность звеньев 104, расположенных по окружности, удерживает полосы 102 в существенной степени трубчатой структуре 102. В сущности, каждая продольно расположенная полоса 102 соединяется в нескольких периодически расположенных местах со смежной полосой 102 при помощи коротких звеньев 104, расположенных по окружности. Волны, соотносимые с каждой из полос 102 обладают приблизительно одинаковой основной пространственной частотой на промежуточном участке, а полосы 102 расположены таким образом, чтобы волны, соотносимые с ними, в целом выравнивались таким образом, чтобы в общем совпадать по фазе друг с другом. Как изображено, каждая продольно расположенная полоса 102 проходит приблизительно два цикла волны до того, как соединяется с помощью звена со смежной полосой 102.
Стент 100 может изготавливаться с использованием любого количества способов. Например, стент 100 может изготавливаться из полой или формованной трубки из нержавеющей стали, которая может быть механически обработана при помощи лазера, электроразрядной фрезеровки, путем химического травления или другими способами. Стент 100 вводится в тело и помещается на желаемом месте в нерасширенном виде. В одном варианте осуществления, расширение в кровеносном сосуде происходит с помощью баллонного катетера, при этом окончательный диаметр стента 100 является функцией диаметра используемого баллонного катетера, а также конструкции (степень расширения) стента.
Следует учитывать, что стент 100, в соответствии с настоящим изобретением, может выполняться из материала с памятью формы, включая, например, подходящий сплав никеля и титана или нержавеющую сталь. Конструкции, выполненные из нержавеющей стали, могут быть саморасширяющимися, благодаря тому, что нержавеющей стали придается заранее определенная форма, например, ее скручивают в плетеную форму. В этом варианте осуществления, после формирования стента 100, его можно сжать так, чтобы он занимал в существенной степени малое пространство для обеспечения возможности его введения в кровеносный сосуд или другую ткань при помощи средств введения, которые включают подходящий катетер или гибкий стержень. При выходе из катетера стент 100, благодаря своей структуре, расширяется, принимая необходимую форму, при этом расширение происходит автоматически или инициируется с помощью изменения давления, температуры или путем электрической стимуляции.
На фигуре 2 представлен пример осуществления настоящего изобретения с использованием стента 100, представленного на фигуре 1, с внесением незначительных модификаций. Как изображено, после внесения модификаций стент 100 может заключать в себе один или несколько резервуаров 106. Каждый из резервуаров 106 может по желанию быть открытым или закрытым. Эти резервуары 106 могут специально выполняться для содержания в них препарата/комбинации препаратов, предназначенных для доставки. Независимо от конструкции стента 100, предпочтительно, чтобы дозировка вносимого препарата/комбинации препаратов обладала достаточной специфичностью и необходимой концентрацией для обеспечения эффективной дозировки для патологического состояния, по поводу которого проводится лечение. При этом, желательно, чтобы размер резервуаров, расположенных в полосах 102, был достаточным для внесения дозы препарата/комбинации препаратов в необходимом месте и в требуемом количестве. Однако важно отметить, что стент, представленный на фигуре 1, также может применяться для доставки препарата/комбинации препаратов. Например, поверхность стента может покрываться непосредственно препаратом/комбинацией препаратов, или они могут составлять часть полимерной матрицы, прикрепляемой к поверхности стента. Другими словами, покрытие поверхности стента является или действует как депо доставки препарата.
На фигуре 3 представлен альтернативный вариант расширяемого медицинского устройства, имеющего совокупность сквозных отверстий, содержащих лекарственное вещество для доставки в ткань или кровоток с помощью расширяющегося медицинского устройства. Расширяющееся медицинское устройство 300, представленное на фигуре 3, вырезано из материала цилиндрической формы, подходящего для изготовления цилиндрического расширяющегося медицинского устройства. Расширяющееся медицинское устройство 300 заключает в себе совокупность цилиндрических секций 302, связанных между собой совокупностью перемычечных элементов 304. Перемычечные элементы 304 позволяют устройству, поддерживающему ткань, сгибаться в осевом направлении, проходя по извилистому тракту сосудистого русла к месту развертывания, и позволяют устройству сгибаться в осевом направлении для соответствия изгибу просвета, требующего поддержки. Каждая цилиндрическая секция 302 образована сетью вытянутых стоек 306, которые соединены между собой пластическими шарнирами 308 и круговыми поперечинами 310. При расширении медицинского устройства 300 происходит деформация пластических шарниров 308, тогда как не происходит деформации вытянутых стоек 306.
Как показано на фигуре 3, в вытянутых стойках 306 и круговых поперечинах 310 выполнены отверстия 312, некоторые из которых, или они все, содержат лечебное средство для доставки в просвет, в котором имплантировано расширяющееся медицинское устройство. Кроме того, другие части устройства 300, такие как перемычечные элементы 304, могут заключать в себе отверстия, как показано на фигуре 4. В устройстве 400, представленном на фигуре 4, конструкция перемычечных элементов 402 может претерпеть модификацию по сравнению с той, что изображена на фигуре 3, с целью совмещения с дополнительными отверстиями или резервуарами 404. Желательно, чтобы отверстия или резервуары 404 в перемычечных элементах 402 и отверстия или резервуары 406 в оставшихся частях устройства 400 выполнялись в недеформируемых частях устройства 400 так, чтобы отверстия не подвергались деформации, а лечебное средство поставлялось без риска дробления, вытеснения или повреждения другого типа во время расширения устройства.
Примеры осуществления стента по настоящему изобретению, представленные на фигуре 3, могут далее конкретизироваться с помощью анализа методом конечных элементов и других методов для оптимизации внесения лечебных средств внутри отверстий 312. По существу, возможна модификация формы и расположения отверстий 312 для максимального увеличения объема пустот, при этом необходимо сохранять относительно высокий уровень прочности и жесткости поперечин относительно пластических шарниров 308. Обычно отверстия 312 заполнены менее чем на сто (100) процентов для любого применения.
В соответствии с примерами вариантов осуществления настоящего изобретения, единичные лечебные средства могут быть загружены в резервуары или отверстия, выполненные в стенте, или нанесены на его поверхность. Кроме того, множественные лечебные средства могут быть загружены в резервуары или отверстия, выполненные в стенте, или нанесены на его поверхность. Использование резервуаров или отверстий для высвобождения препарата или вещества, в соответствии с описанным выше в отношении фигуры 3, облегчает использование различных лечебных средств, а также обеспечивает ряд преимуществ, описанных далее в этом документе. Различные лечебные средства, содержащие различные лекарственные препараты, могут помещаться в различные отверстия в стенте. Это обеспечивает доставку двух или более лечебных средств одним стентом в соответствии с любой предпочтительной схемой доставки и с независимыми профилями скорости высвобождения препарата. В другом варианте, различные лечебные средства, содержащие один лекарственный препарат в различных концентрациях, могут помещаться в разные отверстия. Это позволяет равномерно распределять лекарственный препарат в ткани при неравномерной структуре самого устройства.
Два или более разных лечебных средств, используемых в устройствах, описываемых в настоящем документе, могут содержать (1) разные лекарственные препараты; (2) различные концентрации одного и того же препарата; (3) один и тот же препарат с разной кинетикой высвобождения, т.е. разной скоростью эрозии матрицы; или (4) разные формы одного и того же препарата. Примеры различных лечебных средств, содержащих в своем составе один и тот же лекарственный препарат с различной кинетикой высвобождения, могут использоваться с различными носителями для получения профилей элюирования разной формы. Некоторые примеры различных форм одного и того