Катионный пурпуринимид, обладающий антибактериальной активностью, и его применение для фотодинамической инактивации бактериальных биопленок
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтической химии, а именно к катионному пурпуринимиду и его применению в качестве фотосенсибилизатора (ФС) для фотодинамической инактивации бактериальных биопленок. Группа изобретений раскрывает катионный пурпуринимид, представляющий собой метиловый эфир 133-N-(N-метилникотинил)пурпуринимида, и его применение в виде кремофорной дисперсии для фотодинамической инактивации бактериальных биопленок.
Предлагаемый катионный пурпуринимид обладает высокой антибактериальной активностью и позволяет эффективно воздействовать и осуществлять лечение очагов инфекции с глубокой инфильтрацией в ткани. 2 н. и 2 з.п. ф-лы, 1 ил., 3 пр.
Реферат
Настоящее изобретение относится к фармацевтической химии, а именно к катионному пурпуринимиду и его применению в качестве фотосенсибилизатора (ФС) для фотодинамической инактивации бактерий.
Для фотодинамической инактивации бактерий на биологическую ткань с очагами бактериального поражения воздействуют фотосенсибилизатором, а через некоторое время облучают зону бактериального поражения светом, поглощаемым молекулами фотодинамически активной субстанции фотосенсибилизатора. Генерируемые при этом активные формы кислорода (синглетный кислород, свободно-радикальные частицы) воздействуют на биологические структуры, с которыми связаны молекулы фотосенсибилизатора, в частности патогенные микроорганизмы, и разрушают их.
Бактериальные биопленки и резистентность бактерий в них играют существенную роль в инфекционной патологии, формируя очаги хронической инфекции, в частности при легочных заболеваниях и инфекциях мочевыводящей системы. Множественная лекарственная устойчивость бактерий к антибиотикам, применяемым для лечения таких инфекций, обусловливает необходимость поиска новых терапевтических средств, мишенями которых были бы бактериальные биопленки.
Наиболее перспективными для фотодинамической инактивации бактерий являются катионные фотосенсибилизаторы, обладающие достаточно высокой фотодинамической эффективностью по отношению к грамположительным и грамотрицательным бактериям.
Ближайшим структурным аналогом заявляемого фотосенсибилизатора является метиловый эфир 133-N-(N-метилизоникотинил)бактериопурпуринимида, полученный нами ранее в ряду бактериохлорофилла [Mironov A.F., Grin М.А., Tsiprovskiy A.G., Titeev R.A., Nizhnik E.A., Lonin I.S. Synthesis of cationic bacteriochlorins // Mendeleev Commun. - 2004. - Vol. 14. - No. 5. - P. 204-207.]
Аналогом по применению является катионный фотосенсибилизатор Холосенс октакис[N-(2-гидроксиэтил)-N,N,-диметиламмониометил]фталоцианин цинка октахлорид [патент РФ №2282647, приоритет от 31.05.2005, опубл. 27.08.2006].
Недостатком известного фотосенсибилизатора является низкая эффективность фотодинамической инактивации бактерий в составе бактериальных биопленок, так как часть бактерий в них после ФДТ сохраняет жизнеспособность.
Технический результат заявляемого изобретения заключается в создании нового фотосенсибилизатора с высокой антибактериальной эффективностью фотодинамической инактивации бактерий в составе биопленок за счет уменьшения доли бактерий, сохранивших жизнеспособность после воздействия.
Указанный технический результат достигается тем, что в качестве фотосенсибилизатора для фотодинамической инактивации бактерий в составе биопленок используется катионный пурпуринимид, представляющий собой метиловый эфир 133-N-(N-метилникотинил)пурпуринимида со структурной формулой:
Указанный технический результат достигается также тем, что катионный фотосенсибилизатор для фотодинамической инактивации бактерий в составе биопленок представляет собой кремофорную дисперсию метилового эфира 133-N-(N-метилникотинил)пурпуринимида.
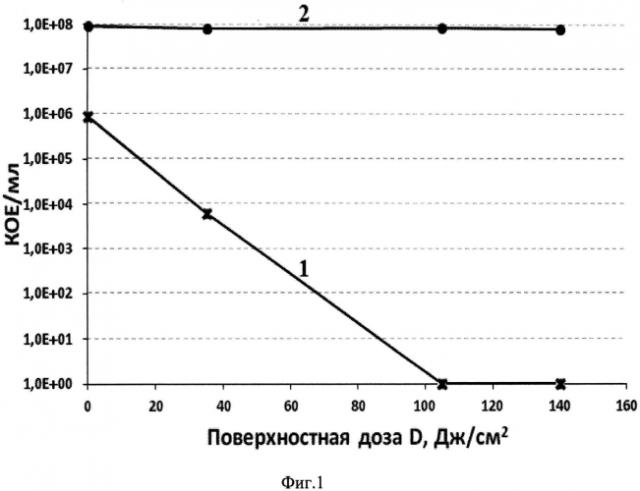
Сущность предлагаемого изобретения поясняется Фиг.1.
На Фиг. 1 приведены зависимость 1 значения титра бактерий Pseudomonas aeruginosa клинического изолята 32 от дозы облучения при фотодинамической инактивации бактерий в составе биопленок с использованием предлагаемого фотосенсибилизатора; для сравнения приведена зависимость 2 в интактном контроле (без использования предлагаемого фотосенсибилизатора и облучения).
Согласно Фиг. 1 при использовании заявляемого катионного пурпуринимида и при поверхностной дозе облучения 105 Дж/см2 достигается полная инактивация бактерий в составе биопленок.
Субстанцию предлагаемого катионного пурпуринимида получают в несколько стадий в соответствии с нижеприведенной схемой:
На первой стадии получают метиловый эфир N-аминопурпуринимида (3) за счет взаимодействия гидразингидрата с пурпурином 18 (1) и последующего метилирования продукта реакции (2) с помощью диазометана. На второй стадии метиловый эфир N-аминопурпуринимида (3) обрабатывают хлорангидридом никотиновой кислоты и кватернизуют пиридиновый атом азота в ацилированном пурпуринимиде (4) йодметаном, что приводит к заявляемому катионному пурпуринимиду (5) с основной полосой поглощения при 706 нм.
Нижеприведенные примеры раскрывают сущность заявляемого изобретения, а именно способ получения заявляемого катионного пурпуринимида (пример 1), его кремофорной дисперсии (пример 2) и применение его в качестве фотосенсибилизатора для фотодинамической инактивации бактериальных биопленок (пример 3).
Пример 1. Методика получения заявляемого фотосенсибилизатора
К раствору 40 мг (0.06 ммоль) пурпурина 18 (1) в 5 мл пиридина прибавляли 0.5 мл (0.3 ммоль) гидразингидрата в токе аргона. Полученный раствор перемешивали в течение 0.5 ч при 20°C. Контроль за ходом реакции осуществляли спектрофотометрически. Смещение полосы Q в область 708 нм соответствует завершению реакции. Реакционную массу разбавляли 50 мл 1 N раствора HCl и перемешивали 2 ч на магнитной мешалке. Раствор переносили в делительную воронку и после расслоения нижний органический слой пурпурного цвета отделяли. Верхний водный слой коричнево-зеленого цвета многократно экстрагировали хлороформом до полного обесцвечивания. Хлороформные экстракты объединяли, сушили над безводным сульфатом натрия, упаривали, после чего остаток обрабатывали эфирным раствором диазометана. После отгонки растворителя в вакууме продукт (3) очищали с помощью препаративной тонкослойной хроматографии (ТСХ) в системе хлороформ - метанол с градиентом концентрации метанола от 0 до 20%.
Для получения метилового эфира 133-N-никотинилпурпуринимида (4) к раствору циклоимида (3) в 5 мл пиридина прибавляли 5-кратный мольный избыток хлорангидрида никотиновой кислоты, перемешивали 30 мин при 20°C. Смещение полосы Q в область 706 нм соответствует завершению реакции. Через 30 мин реакционную смесь разбавляли 10 мл хлороформа и нейтрализовали разбавленной HCl, после чего содержимое колбы переносили в делительную воронку. Нижний хлороформный слой красного цвета отделяли и промывали водой (2×20 мл). Верхний водный слой зеленого цвета экстрагировали хлороформом до полного обесцвечивания (3×30 мл). Хлороформные экстракты объединяли, сушили над безводным сульфатом натрия и упаривали досуха. Продукт (4) очищали с помощью препаративной ТСХ на силикагеле в системе хлороформ - метанол с градиентом концентрации метанола от 0 до 20%.
Для получения метилового эфира 133-N-(N-метилникотинил)пурпуринимида (5) к раствору циклоимида (4) в дихлорметане прибавляли 10-кратный мольный избыток йодметана и перемешивали 3 часа при кипячении. Контроль реакции осуществляли с помощью ТСХ, система хлороформ - метанол (объемное соотношение 3:1). Избыток йодметана упаривали на роторном испарителе. Продукт (5) очищали с помощью препаративной ТСХ на силикагеле в системе хлороформ - метанол с градиентом концентрации метанола от 0 до 40%.
Пример 2. Получение дисперсии метилового эфира 133-N-(N-метилникотинил)пурпуринимида с использованием кремофора
Растворяли 5 мг метилового эфира 133-N-(N-метилникотинил)пурпуринимида в 6 мл хлороформа. К 5 мл 4%-ного (масс.) раствора кремофора в дистиллированной воде с температурой 41-43°C при перемешивании и барботировании азота прибавляли вышеприготовленный раствор пурпуринимида в хлороформе порциями по 1 мл, добавляя каждую последующую порцию после полного испарения хлороформа из предыдущей. После добавления всего объема раствора субстанции в хлороформе и удаления остатков хлороформа током азота дисперсию охлаждали, доводили дистиллированной водой до первоначального объема и фильтровали через мембранный фильтр «Millipore» с размером пор 0,22 мкм.
Пример 3. Использование предлагаемого фотосенсибилизатора для фотодинамической инактивации биопленок Pseudomonas aeruginosa
Биопленки Pseudomonas aeruginosa выращивали в течение 18 ч при 37°C на колышках, погруженных в лунки 96-луночного планшета с бульонной культурой Pseudomonas aeruginosa, используя приспособление «Calgary Device» (фирма «Innovotech») (крышка для планшета с колышками, которые опускаются в каждую лунку). Выросшие биопленки отмывали от планктонных клеток, дважды опуская колышки в планшеты с дистиллированной водой, и погружали в 1 мМ раствор предлагаемого фотосенсибилизатора (кремофорная дисперсия метилового эфира 133-N-(N-метилникотинил)пурпуринимида).
После инкубации с фотосенсибилизатором в течение 60 минут крышку с колышками переносили в планшет с физиологическим раствором и облучали излучением лампового источника ЛФД-03-Биоспек с плотностью мощности излучения на биопленке примерно 30 мВт/см2. Изменение дозы облучения осуществлялось изменением времени облучения. После облучения биопленки из каждой лунки разрушали методом соникации и после десятикратного разведения водой из каждой лунки высевали по 20 мкл на шесть секторов чашки Петри с питательным агаром для подсчета жизнеспособных бактерий. Число выросших колоний подсчитывали после 24 часов инкубации в термостате при 37°C. Число выросших колоний в данном разведении умножали на 50×10n, где n - номер разведения. Таким образом, определяли количество живых бактерий в миллилитре (КОЕ/мл). После облучения дозой около 40 Дж/см2 (20 мин облучения) количество живых бактерий в миллилитре уменьшилось до нуля.
Проведенные исследования показали, что предлагаемый катионный фотосенсибилизатор на основе метилового эфира 133-N-(N-метилникотинил)-пурпуринимида обладает высокой антибактериальной эффективностью против бактерий в составе биопленок. Дополнительным преимуществом предлагаемого фотосенсибилизатора является то, что его спектральная полоса поглощения имеет максимум в диапазоне 706 нм, в котором собственное поглощение биологических тканей невелико. Это позволяет эффективно воздействовать и осуществлять лечение очагов инфекции с глубокой инфильтрацией в ткани.
1. Катионный пурпуринимид, представляющий собой метиловый эфир 133-N-(N-метилникотинил)пурпуринимида со структурной формулой:
2. Катионный пурпуринимид по п. 1, обладающий антибактериальной активностью.
3. Применение катионного пурпуринимида по п. 1 в качестве фотосенсибилизатора для фотодинамической инактивации бактериальных биопленок.
4. Применение по п. 3., где катионный пурпуринимид применяется в виде кремофорной дисперсии.