Пептидная защита против токсического воздействия ультрафиолетового излучения
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложен пептид длиной 5-9 аминокислот, состоящий из последовательности SEQ ID NO: 3, 5, 6, 8 или 10, необязательно амидированный на его карбокси-конце. Также с использованием вышеуказанного пептида предложен способ снижения активности активированной киназы контрольной точки клеточного цикла и способ снижении клеточной или тканевой токсичности, индуцированной воздействием УФ света. Предложена композиция и косметическое средство, которые включают вышеуказанный пептид. Группа изобретений позволяет защищать от токсического воздействия на кожу и/или мутагенеза, которые возникают в результате воздействия ультрафиолетового света. 9 н. и 13 з.п. ф-лы, 5 ил., 1 табл., 1 пр.
Реферат
Настоящая заявка испрашивает приоритет временной заявки на патент США № 61/262790, поданной 19 ноября 2009 г, которая полностью включена в настоящее описание путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к пептидам, обладающим биологической и терапевтической активностью. В частности, изобретение относится к коротким пептидам, которые защищают против вызванного мутагенами токсического действия на клетки/ткани. Например, пептиды по изобретению защищают против токсического действия на кожу, которое происходит после воздействия УФ света. Одна функция пептидов по изобретению заключается в блокировании фосфорилирования и поэтому активации определенных регуляторных белков клеточного цикла. Изобретение, кроме того, относится к способам применения пептидов по изобретению для снижения уровня токсического действия на клетки/ткани после воздействия мутагенов (например, УФ света).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Когда на кератиноциты действуют повреждающие ДНК элементы (мутагены), такие как ультрафиолетовое (УФ) излучение, контрольные точки клеточного цикла активируются, посредством этого блокируя клеточное деление. Остановка клеточного цикла в фазе G2 после вызванного мутагеном повреждения обеспечивает предоставление времени для репарации ДНК. Однако если ключевой процесс прерывается или ингибируется, то снижается частота вызывающих канцерогенез явлений (например, мутаций ДНК). Это было продемонстрировано in vitro и in vivo посредством нанесения кофеина на кожу перед и после УФ облучения (Lu et al., 2008, Cancer Res. 68:2523-2529; Heffernan et al, 2009, J. Invest. Dermatol. 129:1805-1815). Основой данного феномена является то, что кофеин ингибирует митотический путь контрольной точки, обеспечивая клеткам с поврежденной ДНК возможность приступить к митозу и погибнуть вследствие апоптоза, поскольку их ДНК неспособна к удовлетворительной репликации. Обеспечение возможности продолжения клеточного цикла, несмотря на мутацию/повреждение ДНК, и апоптозная гибель клеток, которая в результате происходит, предотвращает фиксацию вызванных мутагенами мутаций в пораженной ткани. Данный процесс посредством этого уменьшает число генетически измененных клеток, которые иначе могли бы развиться в конкрозные поражения, такие как карцинома.
Способность кофеина снижать канцерогенные эффекты УФ света на кожу вызвали интерес к использованию данного средства при терапевтических и косметических видах применения для ухода за кожей. Однако использование кофеина в продуктах для ухода за кожей проблематично с учетом отсутствия его специфичности. Кроме его оздоровительных эффектов, кофеин может вызвать нежелательные воздействия на кожу (например, расширение сосудов, сухость и т.д.). С учетом указанных недостатков, был предпринят поиск других подходов для предотвращения повреждающих эффектов мутагенов на кожу и связанных с ней тканей.
Использование коротких пептидов для разработки продуктов для ухода за кожей очень популярно вследствие их структуры на основе естественных аминокислот, специфичности, отсутствия токсичности и отсутствия побочных эффектов. Указанные качества делают пептиды подходящим исходным пунктом для разработки новых химиопревентивных средств для добавления к композициям для ухода за кожей. В настоящей патентной заявке описаны пептиды, обладающие хемопревентивными и химиотерапевтическими свойствами, могут применяться для защиты кожи от повреждающих эффектов солнечного света.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Вариант осуществления настоящего изобретения направлен на способ снижения активности киназы контрольной точки клеточного цикла. Такой способ может включать воздействие на киназу контрольной точки пептида, который имеет длину от пяти до девяти аминокислотных остатков и содержит SEQ ID NO:13. Киназа контрольной точки клеточного цикла в данном и других вариантах осуществления может находиться в активированном состоянии. Примеры пептидов, которые могут применяться в данном или других способах, описанных в настоящей патентной заявке, включают или состоят из SEQ ID NO:2, 3, 5, 6, 8 или 10.
Другими примерами пептидов, которые могут использоваться в способах, описанных в настоящей патентной заявке, являются те, которые имеют гистидиновый остаток, непосредственно прилегающий к последовательности SEQ ID NO:13. Другие пептиды могут быть амидированы на их карбокси-конце. Определенными примерами таких амидированных пептидов являются те, которые включают или состоят из SEQ ID NO:2, 3, 5, 6, 8 или 10.
Киназы контрольных точек, являющиеся мишенями описанных способов, могут включать или состоять из киназы-1 контрольной точки (Chkl) или киназы-2 контрольной точки (Chk2). Киназа контрольной точки может активироваться в результате повреждения ДНК в клетке. Такое повреждение ДНК может быть причинено мутагенным агентом. Примерами мутагенных агентов являются те, которые способны вызвать повреждение ДНК в коже (например, ультрафиолетовое излучение). Описанные способы могут также включать воздействие на фосфатазу cdc25 (цикла 25 клеточного деления) пептидом, описанным в настоящей патентной заявке; cdc25c является примером cdc25c, которая может быть мишенью в настоящем изобретении.
Другой вариант осуществления настоящего изобретения направлен на способ лечения кожи млекопитающего. Такой способ может включать снижение активности киназы контрольной точки клеточного цикла (например, Chk2) в коже путем воздействия на киназу контрольной точки описанным пептидом. Другой вариант осуществления настоящего изобретения направлен на лечение кожи млекопитающего нанесением описанного пептида на кожу.
Другой вариант осуществления настоящего изобретения направлен на пептид, который имеет длину от пяти до девяти аминокислотных остатков и включает SEQ ID NO:13. Примеры такого пептида включают или состоят из SEQ ID NO:2, 3, 5, 6, 8 или 10. Другие примеры пептидов по изобретению имеют гистидиновый остаток, который непосредственно примыкает к последовательности SEQ ID NO:13. Другие пептиды могут быть амидированы на их карбокси-конце. Определенными примерами таких амидированных пептидов являются те, которые включают или состоят из SEQ ID NO:2, 3, 5, 6, 8 или 10.
Другой вариант осуществления настоящего изобретения направлен на композицию, включающую пептид по настоящему изобретению, и фармацевтически приемлемый носитель. Композиция может быть представлена в форме аэрозоля, эмульсии, жидкости, лосьона, крема, пасты, мази, порошка или пены.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
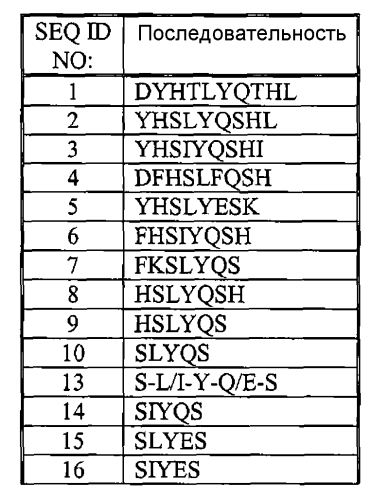
На фиг. 1 показаны аминокислотные последовательности определенных пептидов по изобретению (SEQ ID NO:l-10) при их совмещении друг с другом и SEQ ID NO:l1 (человеческой тирозиназой). Подчеркнутые остатки в определенных пептидах (SEQ ID NO:l-7) составляют консервативные аминокислотные замещения в отношении SEQ ID NO:11.
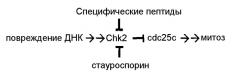
На фиг. 2 показано ингибирование активности киназы-2 контрольной точки (Chk2) стауроспорином или определенными пептидами по изобретению. Контрольная активность Chk2 показана первым столбиком. Пептиды, показанные на чертеже (SEQ ID NO:2-6 и 8-10) являются амидированными на корбокси-конце (-CON2).
На фиг. 3 показана аминокислотная последовательность человеческой Chk2 (SEQ ID NO:17). Эта последовательность такая же как последовательность, описанная на сетевом сайте Национального Центра Биотехнологической Информации США (NCBI) (или в Генном Банке) под номером доступа AAH04207.
На фиг. 4 показана аминокислотная последовательность человеческой Chkl (SEQ ID NO:18). Эта последовательность такая же, как последовательность, описанная на сетевом сайте NCBI (или в Генном Банке) под номером доступа AAC51736.
На фиг. 5 показана аминокислотная последовательность человеческой cdc25c (SEQ ID NO: 19). Эта последовательность такая же как последовательность, описанная на сетевом сайте NCBI (или в Генном Банке) под номером доступа AAR32098.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пептиды по изобретению (например, те, которые перечислены в таблице 1 и на фиг. 1) могут включать энантиомеры L- или D-аминокислот, или содержащие остатки одной энантиомерной формы, или комбинацию обеих форм. Пептиды могут, кроме того, наращиваться или модифицироваться, как описано в следующих не ограничивающих примерах, только до тех пор, пока их первичные аминокислотные последовательности остаются не измененными; таким образом, пептиды состоят из определенной аминокислотной последовательности, но могут включать определенные модификации. Карбокси-конец пептидов может быть кислотным (-COOH) или амидированным (например, -CONH2, -CONHR или -CONR2). Амидирование карбокси-конца может придать пептидам по изобретению меньшую восприимчивость к разрушению протеазами и увеличить их растворимость, по сравнению с их формами свободных кислот, обеспечивая поэтому повышенную терапевтическую активность. Пептиды могут также быть липидированными, что может обеспечить усиленное проникновение через кожу. Одна или более молекулярных связей, которые соединяют аминокислоты каждого пептида, могут представлять собой не пептидную связь. Такие не пептидные связи включают без ограничения имидо, эфиргидразиновые, семикарбазидные и азо связи.
| Таблица 1 | |
Разнообразные модификации могут быть внесены в пептиды по изобретению, пока сохраняются их первичные аминокислотные последовательности. Некоторые модификации могут использоваться для увеличения активности пептида, хотя другие модификации могут облегчать манипулирование пептидом. Функциональные группы пептидов, которые могут типично модифицироваться, включают гидроксильные, амино-, гуанидиновые, карбоксильные и амидные группы. Типичные, не ограничивающие реакции этих групп включают следующие: ацетилирование гидроксильных групп алкилгалидами; этерификацию, амидирование или гидрогенизацию (т.е., восстановление в спирт) карбоксильных групп; деамидирование, ацилирование, арилирование аминогрупп (например, первичной аминогруппы пептида или аминогруппы лизиновых остатков). SEQ ID NO:l-10 и/или 13, например, может быть амидирована на корбокси-конце (-CONH2).
Несмотря на приведенное выше обсуждение, пептиды по изобретению могут быть сконструированы с введением определенных аминокислотных изменений в одно или более положений аминокислотных остатков. Например, один, два или три остатка заменяются на сохраненный остаток или остатки. Стратегии сохранения аминокислот хорошо известны в данной области, например, хорошо известно, что лизин, фенилаланин, изолейцин, треонин и глутамат могут замещаться соответственно гистидином, тирозином, лейцином, серином и глутамином без значимого воздействия на структуру и функцию первоначального пептида. Необязательно, пептид по изобретению может иметь на одну аминокислоту меньше, по сравнению с любой из SEQ ID NO:l-10 или 13; или иметь на две аминокислоты меньше (прилегающих или не прилегающих). Вариантные формы пептида по изобретению должны быть, по меньшей мере, на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичны любой из SEQ ID NO:l-10 или 13. Вариантные формы пептидов по изобретению должны иметь, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90% или 95% активности или функции, которыми обладает любая из SEQ ID NO:l-10 или 13.
Примерами активности или функции, которыми обладают SEQ ID NO:l-10 и 13, являются хемопревентивное действие против онкологических заболеваний (например, карциномы, саркомы, меланомы, рака кожи), предотвращающее развитие предраковой клеточной популяции в ткани (например, коже), подвергнутой воздействию мутагенного/канцерогенного агента (например УФ излучения), блокирование остановки клеточного цикла и репарацию ДНК после воздействия на клетку (например, клетку кожи, кератиноцит, меланоцит или фибробласт) мутагенного/канцерогенного агента (например УФ излучения), блокирование активации cdc25c путем репарации повреждения ДНК, таким как путь, регулируемый через киназу контрольной точки (например, киназу-2 контрольной точки [Chk2]), блокирование и снижение токсичности (например в коже), связанной или вызванной воздействием мутагена/канцерогена (например, УФ излучения), блокирование или уменьшение негативных воздействий мутагена/канцерогена на характеристики здоровой кожи (например, тонус, эластичность, гидратацию, окрашивание, плотность, гладкость). Хемопревенция (хемопрофилактика) может относиться к применению агентов, таких как пептиды по изобретению, для снижения риска или задержки развития или рецидива неоплазии (например, злокачественных заболеваний, предраковых поражений, доброкачественных поражений в виде разрастания ткани). Токсическое действие на кожу, вызванное мутагенным агентом или любым другим агентом (например, химиотерапевтическим средством, раздражающим агентом), может проявляться в форме эритемы, алопеции (потери волос), фоточувствительности (повышенной чувствительности к солнечному свету), анамнестических реакций (например, воздействия химиотерапии на участок, ранее подвергнутый воздействию облучению), угревых (подобных пустулам) сыпей, некроза кожи, нейтрофильного эккринного гидраденита, эккринной плоскоклеточной метаплазии, гиперпигментации, изменений ногтей, мукозита, склеротических дермальных реакций, сосудистого повреждения, ксероза, отека (набухания), сыпи, старения кожи (например, истончения, сниженной эластичности, сморщивания, свисания, увеличенной пигментации (например, веснушчатость, солнечное лентиго, капельный гипомеланоз), телангиэктазий, ангиомы, пурпуры, солнечных угрей, коллоидной дегенерации кожи, себоррейных кератозов, образования пузырей, дерматита, вегетирующих/разрастающихся узелков (приподнятых над уровнем кожи плотных объемных образований), экссудативных бляшек, вегетирующей или некротической язвы с пустулами, рубцевания, панникулита, изъязвления, боли и/или ожогов. Под терминами «уменьшение», «ингибирование», «блокирование» или «предотвращение», используемыми в настоящем описании, подразумевается, что пептид по изобретению снижает частоту, тяжесть, величину, частоту осложнений или связанных симптомов состояния, по меньшей мере, на 7,5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 90% или 100%, по сравнению с тем, как состояние обычно протекало без применения пептида или композиции, содержащей пептид.
Хотя пептид по изобретению может быть получен без добавления других последовательностей, существует вариант включения последовательностей по изобретению внутрь более крупной последовательности. Например, пептид по изобретению может иметь дополнительные аминокислотные остатки, добавленные к любому из или обоим его N- и C-концам. Примером мог бы быть маркерный эпитоп, такой как Flag, который обычно используется для прослеживания белков; маркерные эпитопы, хорошо известные в данной области, включают, например, myc, His, HA (гемагглютинин). Таким образом, настоящее изобретение охватывает пептиды, которые или состоят из или содержат пептиды по изобретению. Хотя пептиды по изобретению могут быть предоставлены внутри более крупной последовательности (т.е., содержаться внутри нее), комбинация последовательности пептида по изобретению с дополнительной последовательностью (последовательностями) не должна составлять какой-либо белок или пептидную последовательность, которая естественно экспрессирована клеткой животного (например, клеткой человека). Когда формулировка, используемая в настоящей патентной заявке для описания, что пептид «состоит» из последовательности, то такой пептид, хотя и ограничивается определенной прилегающей аминокислотной последовательностью, может включать (т.е., быть конъюгирован) не аминокислотные части или другие пептиды/белки (такие пептиды/белки будут конъюгированы с пептидом по изобретению через не пептидную связь).
Пептиды по настоящему изобретению могут иметь длину 5, 6, 7, 8 или 9 смежных аминокислот и включать или состоять из SEQ ID NO:13 (S-L/I-Y-Q E-S). Не ограничивающими примерами таких пептидов являются SEQ ID NO:2, 3 и 5-10. Другими не ограничивающими примерами таких пептидов являются фрагменты SEQ ID NO:2, 3 и 5-8, которые содержат SEQ ID NO:13. Исходя из формулы SEQ ID NO:13, другие пептиды по настоящему изобретению могут иметь длину 5, 6, 7, 8, или 9 смежных аминокислот и включать или состоять из SEQ ID NO:14 (S-I-Y-Q-S), SEQ ID NO:15 (S-L-Y-E-S) или SEQ ID NO:16 (S-I-Y-E-S). Другие пептиды по настоящему изобретению могут содержать SEQ ID NO:13, где гистидиновый остаток непосредственно примыкает к последовательности SEQ ID NO:13; примерами таких пептидов являются SEQ ID NO:2, 3, 5, 6, 8 и 9. Все короткие пептиды, содержащие SEQ ID NO:13, связаны друг с другом на структурном уровне с учетом структурного/химического сходства между лейцином и изолейцином (т.е., положением 2 SEQ ID NO:13) и между глутамином и глутаматом (т.е., положением 4 SEQ ID NO:13). Другие аминокислоты, кроме лейцина и изолейцина, могут занимать положение 2 SEQ ID NO:13, такие как аланин, валин, глицин или метионин. Другие аминокислоты, кроме глутамина и глутамата, могут занимать положение 4 SEQ ID NO:13, такие как аспарагин, аспартат, аргинин или лизин.
Альтернативно, пептиды по настоящему изобретению могут иметь длину 5, 6, 7, 8 или 9 смежных аминокислот и содержать или состоять из SEQ ID NO:10 (S-L-Y-Q-S). Не ограничивающими примерами таких пептидов являются SEQ ID NO:2 и 7-9. Другими не ограничивающими примерами таких пептидов являются фрагменты SEQ ID NO:2, 7 и 8, которые содержат SEQ ID NO: 10. Другие пептиды по настоящему изобретению могут содержать SEQ ID NO:10, где гистидиновый остаток (H) непосредственно примыкает к последовательности SEQ ID NO:10; примерами таких пептидов являются SEQ ID NO:2, 8 и 9.
Все варианты осуществления пептидов по изобретению могут быть в «изолированном» состоянии. Например, «изолированный» пептид представляет собой пептид, который был полностью или частично очищен. В некоторых случаях, изолированный пептид является частью большей композиции, буферной системы или смеси реагентов. В других обстоятельствах, изолированный пептид может представлять собой очищенную t гомогенность. Композиция может включать пептид на уровне, по меньшей мере, примерно 50, 80, 90, или 95% (на молярной основе) всех других макромолекулярных видов, которые также присутствуют в ней. Пептиды по изобретению могут содержать гетерологичные комбинации компонентов. При осуществлении изобретения могут использоваться смеси пептидов по изобретению.
Пептиды по изобретению могут быть при необходимости конъюгированы с молекулами растворимого или нерастворимого носителя для модификации их свойств растворимости и для увеличения локальной концентрации пептидов в тканях-мишенях. Примеры молекул растворимых носителей включают полимеры полиэтиленгликоля (PEG) и поливинилпирролидона; примеры нерастворимых полимеров включают силикаты, полистирол и целлюлозу. Пептиды могут также быть микроинкапсулированы для увеличения их растворимости во время и после терапевтического применения; обычно, для инкапсулирования и стабилизации пептидов используются полиэфир и микросферы PEG.
Могут использоваться различные способы получения микросфер для инкапсулирования пептидов, в зависимости от гидрофильной или гидрофобной природы пептидной композиции, подлежащей инкапсулированию. Примеры последовательностей операций для таких способов можно найти в публикации Wang et al. (J Control. Release 17:23, 1991) и патенте США № 4324683, которые полностью включены в настоящую патентную заявку путем ссылки. Исследования высвобождения пептидов in vitro могут выполняться для определения относительной доступности пептида после включения в микросферу. Микросферы (200 мг) суспендируют в 2,5 мл забуференного фосфатом солевого раствора (PBS, pH 7,2) и перемешивают при 37°C и 100 об/мин в шейкере инкубаторного типа, используемом для экологического контроля (G-24, New Brunswick Scientific Co., Edison, N.J.). В определенные точки времени взятия проб (ежедневно в течение первых 4 дней и через день в последующем) буферный раствор полностью удаляют и замещают свежим PBS. Содержание пептида в PBS измеряют, используя способ Bradford или другой подходящий количественный анализ, обычно используемый для белкового анализа.
Следующие процедуры и параметры представлены только в целях рекомендаций, и они все хорошо известны специалистам в данной области. Все описанные пептиды могут быть синтезированы с использованием стандартной твердофазной химии синтеза пептидов с использованием Fmoc (9-фторенилметоксикарбонила) на пептидном синтезаторе Advanced ChemTech Apex 396 Multiple Peptide Synthesizer. Синтезатор Apex 396 оборудован реакционным блоком 40-луночного формата для получения до 40 пептидов одновременно в масштабе 0,15 ммоль. Пептиды могут быть получены в амидированной форме или в форме свободной кислоты с использованием стандартных аминокислот. Смолу сначала промывают и предварительно вызывают ее разбухание N,N-диметилформамидом (DMF). Для амидных смол Ринка, время набухания составляет один час. Защитную группу Fmoc удаляют 25% пиперидином в DMF (диметилформамиде) в течение 25 минут, после чего пиперидин полностью вымывается из смолы. Для регулирования процессов рацемизации, Fmoc аминокислотные мономеры предварительно активируют в эквимолярном растворе l-гидрокси-7-аза-бензотриазола (HOAt) в 0,5 M DMF. Амидные соединения получают с использованием 0-(7-азабензотриазол-l-ил)-1,1,3,3-тетраметилурония гексафторфосфата (HATU) PyBop® или 2-(lH-бензотриазол-l-ил-)-1,1,3,3-тетраметилурония гексафторфосфата (HBTU) в качестве активирующего агента и 2,5-5,0-кратного молярного избытка аминокислоты в основных условиях с использованием защищенного основания (диизопропилэтиламина). Время соединения составляет 1-1,5 часа с последующим промыванием и повторным соединением для осуществления двойного или тройного соединения перед снятием защиты и продолжением растущей пептидной цепи. Эффективность соединения контролируется с использованием стандартного теста Кайзера. После завершения пептидного синтеза на смоле, конечную Fmoc группу удаляют, как указано выше, и последовательности оставляют в форме свободного основания.
Расщепление кислотно-лабильной связи пептида со смолой осуществляют с использованием 95% трифторуксусной кислоты (TFA) и воды с добавлением соответствующего акцептора. После предоставления возможности расщеплению продолжаться в течение периода от примерно 30 минут до одного часа, высвободившиеся пептиды немедленно удаляют из блока расщепления и переносят в пробирки для удаления TFA под пониженным давлением. Затем пептиды готовы для очистки и анализа с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием колонки C18 с обращенной фазой и масс спектрометрии. Подтверждение первичной последовательности и препаративную очистку осуществляют с использованием системы LC/MS/MS (жидкостной хроматографии/масс спектрометрии/масс спектрометрии) (ABI API2000).
Обычно, в соответствии с приведенным выше протоколом, пептиды могут быть получены с использованием любого способа, известного специалистам в данной области, такого как способы, описанные в публикациях Merrifield (J Am Chem Soc. 85:2149, 1963); Carpino et al. (J Org Chem. 51:3732, 1986); Merrifield et al. (Anal Chem. 38:1905, 1966); или Kent et al. [High Yield Chemical Synthesis Of Biologically Active Peptides On An Automated Peptide Synthesizer Of Novel Design, EN: PEPTIDES 1984 (Ragnarsson, ed.) Almqvist and Wiksell Int., Stockholm (Sweden), pp. 185-188], которые все полностью включены в настоящую патентную заявку путем ссылки. Пептиды могут быть получены устройством, способным последовательно добавлять аминокислоты у растущей пептидной цепи. Однако пептиды могут быть также получены с использованием стандартной методологии фаз раствора, которая может использоваться для достижения крупномасштабного производства.
Дополнительные варианты осуществления настоящего изобретения направлены на способы применения описанных выше пептидов, такие как в препаративных формах или в качестве терапевтических средств. Эти способы могут включать применение одного пептида или множества пептидов в комбинации (т.е., смеси).
В определенных случаях, композиция по изобретению может располагаться внутри устройства, помещенного на кожу или под кожу. Такие устройства включают трансдермальные системы, имплантаты и инъекционные растворы, которые высвобождают вещества таким образом, чтобы они контактировали с кожей или волосяным фолликулом или пассивными, или активными механизмами высвобождения. Вещество может наноситься, например, местно на эпидермис через равномерные интервалы, например, один или два раза в день, в подходящем носителе в эффективной концентрации. Одна или более инъекций в кожу является другим путем введения пептидов по изобретению в кожу или любую другую ткань.
Композиции, используемые для доставки пептидов в способах, описанных в настоящей патентной заявке, могут быть представлены в форме аэрозоля, эмульсии, жидкости, лосьона, крема, пасты, мази, порошка, пены или другой фармацевтически приемлемой препартивной формы. Кроме того, пептиды могут доставляться с использованием менее сложных препаративных форм, таких как деионизированная/дистиллированная вода, PBS или стандартные медицинские солевые растворы. В целом, фармацевтически приемлемая препаративная форма включает любой носитель, подходящий для нанесения на кожу человека или слизистую оболочку. Такие фармацевтически приемлемые носители включают этанол, диметилсульфоксид, глицерол, диоксид кремния, крахмал и эквивалентные носители разбавители. Препаративная форма может необязательно иметь косметическую привлекательность и/или содержать другие агенты, такие как ретиноиды или другие пептиды, которые могут действовать в качестве адъювантов для терапевтического действия пептидов по изобретению. Антибиотики могут также добавляться к препаративной форме для отражения инфекции, посредством этого, максимального обеспечения возможности протекания процессов заживления. Концентрация пептида в композиции может составлять от примерно 0,1 мкг/мл до примерно 50 мкг/мл от примерно 0,1 мкг/мл до примерно 20 мкг/мл; однако окончательная используемая концентрация может варьироваться за указанные диапазоны, в зависимости от природы ткани-мишени, биологической активности пептида по изобретению и применения любого адъюванта или методики получения усиленного всасывания композиции. Такие определения находятся в пределах обычной практики в данной области. Например, концентрация пептида (пептидов), используемых при осуществлении настоящего изобретения, может составлять примерно 0,1, 1, 2, 5, 10, 15, 20, 25, 50, 75, 100, 200, 500 или 1000 мкг/мл.
Введение пептидов по изобретению и связанных композиций может осуществляться людям и животным, включая всех млекопитающих (например, свиней, коров, лошадей, овец, коз, мышей, крыс, кошек, собак, хорьков, приматов). Нанесение может также осуществляться в комбинации с типичными и/или экспериментальными материалами, такими как тканевые трансплантаты, продукты культуры ткани, кислород и перевязочные материалы. В целом, композиция может вводиться местно, перорально, трансдермально, системно или любым другим известным специалистам в данной области способом, который может использоваться для доставки пептидов по изобретению в ткань-мишень. Композиции могут также применяться в режиме in vitro или ex vivo, например, внесением или в клетки, или в трансплантаты пациента, растущие в культуре.
Ввиду их небольшого размера, ожидается, что пептиды способны самостоятельно увеличивать уровень проницаемости через кожу; однако определенные методики могут использоваться для усиления этого движения. Например, к пептидам могут добавляться липофильные (неполярные) группы или пептиды могут доставляться к коже в липофильном эксципиенте для усиления достижения пептидом рогового слоя для обеспечения возможности перемещения в нижние эпидермальные слои. Таким образом, такие липофильные модификации могут считаться имеющими пролекарственный эффект. Усилители проникновения, такие как известные растворители и поверхностно-активные вещества, могут использоваться в эксципиенте для обеспечения возможности лучшего всасывания пептида. Специальные методики, которые предусмотрены как используемые при усилении доступа пептида к являющейся мишенью ткани/повреждению, включают схемы инъекций, ионтофорез, электрофорез и ультразвук. Ионтофоретическое устройство состоит из двух электродов, погруженных в раствор электролита, и помещенных на кожу. Когда электрический ток подается через электроды, то через роговой слой создается электрическое поле, которое стимулирует доставку пептидов. Электропорация включает подачу высоковольтных электрических импульсов для увеличения проникновения через липидные бислои. Это отличается от ионтофореза по длительности и интенсивности подачи электрического тока (в ионтофорезе используется относительно постоянное низковольтное электрическое поле). Считается, что высоковольтный электрический импульс электропорации вызывает обратимое образование гидрофильных пор в липидных пластинчатых мембранах, которые могут обеспечить высокую степень усиления проникновения. Ультразвук подает на кожу звуковые волны, имеющие частоту более чем 16 кГц, что вызывает сжатие и расширение ткани, через которую проходят звуковые волны. Получаемые в результате изменения давления вызывают ряд процессов (например, кавитацию, смешивание, увеличение температуры), которые могут усилить проникновение пептидов.
Настоящее изобретение может включать один или более ингибиторов протеазы. Ингибитор протеазы может быть выбран для специфического нацеливания на протеазы, которые, как ожидается, разрушают выбранный биоактивный пептид; такой выбор может быть определен на основании длины и/или последовательности биоактивного пептида. Однако ингибиторы протеазы необязательно должны выбираться каким-то определенным образом; например, в настоящем изобретении может использоваться смесь ингибиторов протеазы, которая содержит два или более ингибитора. В определенных вариантах осуществления изобретения, ингибитор протеазы не представляет собой ингибитор, который специфичен для ингибирования вируса. В изобретение могут быть включены следующие типы ингибиторов протеазы: ингибиторы серин-протеазы, ингибиторы цистеин-протеазы, ингибиторы аспартат-протеазы, ингибиторы металлопротеазы, ингибиторы тиол-протеазы и ингибиторы треонин-протеазы.
Ингибиторы протеазы хорошо известны в данной области. Не ограничивающие примеры ингибиторов протеаз, которые могут быть включены в настоящее изобретение, включают ацетил-пепстатин, AEBSF (4-[2-Аминоэтил]бензолсульфонилфторид) гидрохлорид, ALLM (N-Ацетил-Leu-Leu-Met), ALLN (N-Ацетил-Leu-Leu-Nle-CHO), амастатин (Streptomyces sp.), ε-амино-n-капроновую кислоту, ингибитор аминопептидазы N, α1-антихимотрипсин, антипаин (гидрохлорид или дигидрохлорид), α2-антиплазмин, антитромбин ΙII α1-антитрипсин, p-APMSF (4-Амидинфенил-метансульфонилфторид) гидрохлорид, апротинин (например, из бычьих легких), ATBI (пептид из 11 аминокислотных остатков), бензамидин гидрохлорид, бестатин, сложный метиловый эфир бестатина, калпастатин, калпептин, ингибитор карбоксипептидазы, ингибитор каспазы, ингибитор II катепсина B, ингибитор I катепсина G, ингибитор Π катепсина, ингибитор III катепсина, ингибитор I катепсина, ингибитор I катепсина K, ингибитор II катепсина K, ингибитор III катепсина K, ингибитор I катепсина L, ингибитор II катепсина L, ингибитор IV катепсина L, ингибитор V катепсина L, ингибитор VI катепсина L, ингибитор катепсина S, ингибитор катепсина/субтилизина, химостатин, ингибитор I химотрипсина, цистатин, 1,5-дансил-glu-gly-arg хлорметилкетон дигидрохлорид, 3,4-дихлоризокумарин, диизопропилфторфосфат, ингибитор дипептидилпептидазы II, ингибитор I дипептидилпептидазы IV, ингибитор Π дипептидилпептидазы IV, ингибитор протеазы E-64, экотин, динатрий дигидрат EDTA (этилендиаминтетрауксусной кислоты), тетранатриеввая соль EDTA, EGTA (этиленгликольтетрауксусная кислота), ингибитор I эластазы, ингибитор II эластазы, ингибитор III эластазы, эластатинал, 6-амидин-2-нафтил-4-гуанидинбензоат диметансульфонат, glu-gly-arg-хлорметилкетон, 2-гуанидинэтилмеркаптоянтарная кислота, гексадецилсульфонилфторид, α-йодацетамид, кининоген, лейгистин, лейпептингемисульфат, α2-макроглобулин, DL-2-меркаптометил-3-гуанидинэтилтиопропаноевая кислота, пепстатин A, фенилметилсульфонилфторид, динатриевая соль фосфорамидона, трифторацетат PPack II, дигидрохлорид PPack, ингибитор II пропилэндопеепидазы, Na-тосил-lys хлорметилкетон гидрохлорид, Na-тосил-phe хлорметилкетон, ингибитор II трипептидилпептидазы, ингибитор трипсина (из кукурузы или сои), D-val-phe-lys хлорметилкетон гидрохлорид, l,3-di-(N-карбоксибензоил-L-лейцил-L-лейцил)аминоацетон, o-фенантролин, урсоловая кислота (например, экстракт розмарина), транексамовая кислота (4-[аминометил]циклогексан-l-карбоновая кислота) (продаваемая в США для клинического применения в виде Циклокапрона, и в Азии в виде Трансамина), Fmoc-Lys(Boc), Fmoc-Arg(Pmc), бензоил-Arg-нитроанилид, бензоил-Arg-нафтиламид и α-2-макроглобулин.
Ингибитор протеазы, используемый в изобретении, может представлять собой пептид или белок, такой как фермент. Не ограничивающими примерами таких ингибиторов являются серпины, которые включают альфа-1-анитрипсин, ингибитор комплемента I, антитромбин, альфа-1-антихимотрипсин, ингибитор I активатора плазминогена и нейросерпин.
Компоненты, которые обычно включаются в препараты для ухода за кожей, хорошо известны в данной области. Кроме компонента в виде биоактивного пептида, компоненты по настоящему изобретению могут содержать другие активные агенты, такие как ниацинамид, фитантриол, фарнезол, бисаболол и салициловая кислота. Ожидается, что определенные дополнительные активные агенты будут действовать синергично с компонентом в виде биоактивного пептида или продлят срок хранения препаративной формы.
Когда предполагается контакт композиции с кожей животного или человека, то должны быть выбраны дополнительные компоненты, которые подходят для нанесения на кератинозную ткань (т.е., устойчивые, имеющие низкую токсичность и гипоаллергенные). В Руководстве по ингредиентам косметических средств CTFA (Ассоциации косметических, парфюмерных и ароматизирующих средств) Cosmetic Ingredient Handbook, второе издание (1992), которое полностью включено в настоящую патентную заявку путем ссылки, описано широкое разнообразие не ограничивающих косметических и фармацевтических ингредиентов, обычно используемых в промышленности, выпускающей средства для ухода за кожей, которые подходят для использования в композициях по настоящему изобретению. Примеры данных ингредиентов включают: абразивные вещества, абсорбенты, эстетические компоненты, такие как отдушки, пигменты, красящие агенты, эссенциальные масла, средства для снижения чувствительности кожи, вяжущие средства и т.д. (например, гвоздичное масло, ментол, камфору, эвкалиптовое масло, эвгенол, ментиллактат, дистиллят гамамелиса), средства против угревой сыпи (например, резорцин, серу, салициловую кислоту, бензоилпероксид, эритромицин, цинк), агенты против спекания, агенты против пенообразования, антимикробные средства (например, йодпропилбутилкарбамат), антиоксиданты, связывающие агенты, биологические добавки, забуферивающие агенты, наполнители, хелатирующие агенты, химические добавки, денатурирующие агенты, наружные анальгетики, полимеры (например, сополимерэйкозена и винилпирролидона), агенты, придающие материалу непрозрачность, регуляторы pH, пропелленты, восстанавливающие агенты, вещества, усиливающие секрецию, средства для отбеливания и осветления кожи (например, гидрохинон, койевая кислота, аскорбиновая кислота [витамин C], аскорбилфосфат магния, аскорбилглюкозамин), средства, нормализующие состояние кожи (например, увлажнители, включая смешанные и окклюзивные), средства для смягчения и/или заживления кожи (например, пантенол и его производные [например, этилпантенол], алоэ вера, пантотеновую кислоту и ее производные, аллантоин, бисаболол, динатрий глицирризинат), загустители, материалы в виде частиц, структурирующие агенты и витамины. Многие из указанных агентов подробно описаны В патенте США № 6492326, который полностью включен в настоящую патентную заявку путем ссылки, в частности, в отношении описаний различных ингредиентов.
Композиции по настоящему изобретению могут содержать материал в виде частиц, такой как оксид металлов. Данные материалы в виде частиц могут быть пок