Улучшенная композиция для ингибирования пролиферации опухолевых клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению стимулированных дендритных клеток (ДК), и может быть использовано в медицине для иммунотерапии рака. Зрелую провоспалительную ДК получают путем ex vivo индуцирования ее созревания посредством обработки незрелой ДК такими веществами как натриевая соль полиинозиновой-полицитидиновой кислоты (поли-И:Ц), резиквимод (R848) и интерферон-гамма (ИФН-g), но не простагландином Е2 (ПГЕ2). Полученную ДК применяют при лечении рака у индивида посредством инъекции в опухоль. При этом указанная провоспалительная зрелая ДК является аллогенной по отношению к указанному индивиду. Изобретение позволяет эффективно ингибировать пролиферацию опухолевых клеток. 5 н. и 9 з.п. ф-лы, 14 ил., 6 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится к области лечения рака. В частности, изобретение относится к иммунотерапии рака, а точнее к клеточной иммунотерапии для ингибирования пролиферации опухолевых клеток.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Вакцины давно используют для профилактики инфекционных заболеваний, таких как вирусные или микробные инфекции. Опосредуемая клетками ветвь иммунной системы активно участвует в формировании защиты организма, его восстановлении после инфекций, а также препятствует дальнейшему инфицированию тем же антигеном. Предполагается, что клеточно-опосредованные иммунные механизмы могут быть полезными при лечении рака.
Дендритные клетки (ДК), самые активные антиген-презентирующие клетки (АПК), играют центральную роль в инициации и регуляции иммунного ответа. Они обладают уникальной способностью праймировать наивные Т-клетки, а также вызывать и стимулировать эффективные ответы цитотоксических Т-лимфоцитов (ЦТЛ). Предшественники дендритных клеток присутствуют в циркулирующей крови и могут быть быстро привлечены в очаги инфицирования или воспаления. Когда предшественники ДК дифференцируются в незрелые ДК, эффективность захвата и обработки ими экзогенных белковых антигенов сильно повышается. В ответ на различные стимулы, вызывающие созревание, такие как бактериальные и вирусные компоненты, экспрессирующие лиганды Toll-подобных рецепторов (TLR), воспалительные цитокины и/или специфические Т-клеточные взаимодействия (взаимодействие лигандов CD40/CD40), они инициируют процесс дифференцировки, который с одной стороны ведет к снижению захвата антигена и обрабатывающей способности, а с другой к повышенной экспрессии молекул, участвующих в одновременной стимуляции, а также белков главного комплекса гистосовместимости (МНС). Важно отметить, что мощность и продолжительность сигналов, индуцированных прямым распознаванием возбудителя (например, TLRs) или связыванием CD40, является критическим фактором, определяющим конкретные функции дендритных клеток. Таким образом, в периферических очагах дендритные клетки окончательно индуцируются активационными факторами, чтобы выполнить одну из двух взаимоисключающих функций, то есть мигрировать в лимфатические узлы (как зрелые мигрирующие ДК) для эффективного взаимодействия с Т-клетками, либо модифицировать микроокружение, производя большое количество медиаторов воспаления, в том числе хемокинов и цитокинов (как зрелые провоспалительные ДК).
Все существующие стратегии иммунотерапии рака, основанные на ДК, основаны на предпосылке, что качество Т-клеточного ответа зависит, главным образом, от способности мигрирующих ДК процессировать и презентировать опухолевые антигены Т-клеткам во вторичных лимфоидных органах, и создавать тем самым опухоль-специфичный ЦТЛ-ответ, который приводит к иммунологической атаке раковых клеток. Данные, полученные на различных моделях опухолей у мышей, показали, что такой ответ может быть запущен в соответствии с одной из трех основных стратегий, хорошо известных специалистам в этой области. Эти стратегии противоопухолевой иммунотерапии в настоящее время активно тестируют на людях, но все с ограниченным успехом.
Первая стратегия заключается в обеспечении активации и созревания мигрирующих ДК, загруженных антигеном пациента с опухолью ex vivo, ввести последующем введении их этому же пациенту. Нагрузку антигеном, как правило, осуществляют путем добавления антигенов, ассоциированных с опухолью (лизированные опухолевые клетки, белки, пептиды и нуклеиновые кислоты, кодирующие такие антигены), к незрелым ДК моноцитарного происхождения, с последующей активацией/созреванием загруженных антигеном ДК различными комбинациями воспалительных факторов. Предполагается, что повторно введенные ДК мигрируют в дренирующие лимфатические узлы, где они инициируют опухоль-специфичные Т-лимфоциты. Праймированные дендритными клетками Т-лимфоциты, в частности, ЦТЛ, перемещаются затем к опухоли, где они впоследствии вызывают апоптоз опухолевых клеток.
Однако в клинических условиях ex vivo манипуляция собственными, т.е. аутологическими, дендритными клетками пациента отнимает много времени и подвергает пациента повышенному риску инфицирования. Кроме того, трудоемким является сам процесс манипуляции, при котором ДК стимулируют опухолевыми антигенами и активируют с получением мигрирующих ДК, которые эффективно презентируют опухолевые антигены.
Вторая основная стратегия, которая позволяет избежать ex vivo культивирования мигрирующих ДК, полученных от пациента, включает введение опухолевых антигенов, в том числе облученных аллогенных клеток опухоли или плазмид, кодирующих опухолевые антигены, в интактные здоровые ткани пациента посредством подкожных или внутримышечных инъекций. Опухолевые антигены дополняют так называемыми адъювантами, которые вводят с целью инициации ДК-опосредованного иммунного ответа in vivo. В качестве адъювантов чаще всего используют хемокины, цитокины или плазмиды, кодирующие эти факторы, и/или факторы, вызывающие созревание ДК, такие как фактор некроза опухоли (ФНО-α), и/или агонисты ЦТЛ.
Однако, введение экзогенных антигенов опухоли представляет собой трудоемкий процесс.
Третья основная стратегия относится к применению адъюванта, который вводят непосредственно в опухоль, эта стратегия позволяет избежать ex vivo культивирования мигрирующих ДК, полученных от пациента, что является частью первой основной стратегии, кроме того, позволяет избежать потребности в экзогенных опухолевых антигенах, что является частью второй основной стратегии. Таким образом, адъювант применяют для непосредственного воздействия на ДК in vivo, при этом опухоль пациента служит источником опухолевых антигенов. Протестированные адъюванты аналогичны тем, которые описаны во второй основной стратегии: хемокины, цитокины или плазмиды, кодирующие эти факторы, и/или факторы, вызывающие созревание ДК, такие как фактор некроза опухоли (ФНО-α) и/или агонисты ЦТЛ.
Тем не менее, жизнеспособная опухоль может быть слабым источником опухолевых антигенов для привлеченных незрелых ДК в связи с недостаточным количеством умирающих, главным образом вследствие апоптоза. опухолевых клеток которые могут быть поглощены этими ДК.
Все три вышеперечисленные стратегии были испытаны на онкологических пациентах, но с ограниченным успехом. Таким образом, существует очевидная потребность в более эффективных терапевтических вакцинах и более совершенных методах лечения рака.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соответственно, предпочтительная цель настоящего изобретения состоит в том, чтобы преодолеть указанные выше недостатки в данной области, как по отдельности, так и в любой комбинации, а также в решении, по меньшей мере, упомянутых выше проблем посредством обеспечения: провоспалительных зрелых дендритных клеток, которые продуцируют высокие концентрации желаемых хемокинов и интерлейкина 12 (ИЛ-12); композиции, которая содержит указанные провоспалительные дендритные клетки; способу получения указанных провоспалительных дендритных клеток, к применению указанных провоспалительных клеток или указанной композиции в качестве лекарственного средства, а также к применению указанных дендритных клеток или указанной композиции при лечении рака.
Таким образом, согласно первому аспекту настоящего изобретения обеспечиваются провоспалительные дендритные клетки (ДК), которые были стимулированы до созревания ex vivo посредством обработки следующими веществами: натриевой солью полиинозиновой-полицитидиновой кислоты (поли-И:Ц), резиквимодом (R848) и гамма-интерфероном (ИФН-γ).
Во втором аспекте настоящего изобретения обеспечивается композиция, которая содержит провоспалительные дендритные клетки в соответствии с первым аспектом настоящего изобретения, а также мононуклеарные клетки периферической крови (МКПК).
В третьем аспекте настоящего изобретения обеспечивается способ получения провоспалительных дендритных клеток согласно первому аспекту настоящего изобретения. Указанный способ включает стадии: обеспечения мононуклеарных клеток периферической крови (МКПК), выделения моноцитов из указанных МКПК, получения из указанных моноцитов незрелых ДК (нДК), а также индуцирования созревания нДК путем добавления поли-И:Ц, R848 и ИФН-γ к нДК с получением провоспалительных ДК.
В четвертом аспекте настоящего изобретения обеспечивается способ получения композиции в соответствии со вторым аспектом настоящего изобретения. Указанный способ включает стадии: обеспечения мононуклеарных клеток периферической крови (МКПК) и зрелых провоспалительных ДК в соответствии с первым аспектом настоящего изобретения, и смешивания указанных МКПК и указанных провоспалительных зрелых ДК.
В пятом аспекте настоящего изобретения обеспечиваются провоспалительные ДК, полученные в соответствии с первым аспектом данного изобретения или композиция, полученная в соответствии со вторым аспектом данного изобретения для применения в качестве лекарственного средства.
Согласно шестому аспекту настоящего изобретения обеспечиваются провоспалительные ДК, полученные в соответствии с первым аспектом данного изобретения или композиция, полученная в соответствии со вторым аспектом данного изобретения, для применения в качестве лекарственного средства у пациента, который не является источником провоспалительных зрелых ДК или МКПК.
Согласно седьмому аспекту настоящего изобретения обеспечиваются провоспалительные ДК, полученные в соответствии с первым аспектом данного изобретения или композиция, полученная в соответствии со вторым аспектом данного изобретения для применения в качестве лекарственного средства при лечении рака.
Согласно восьмому аспекту настоящего изобретения обеспечиваются провоспалительные ДК, полученные в соответствии с первым аспектом данного изобретения, или композиция, полученная в соответствии со вторым аспектом данного изобретения, для применения в качестве лекарственного средства при лечении рака у пациента, который не является источником указанных провоспалительных зрелых ДК или МКПК.
Дальнейшие варианты реализации настоящего изобретения определяются в зависимых пунктах формулы изобретения.
Настоящее изобретение отличается от предшествующего уровня техники тем, что после отмены активационных стимулов оно обеспечивает продуцирование высоких концентраций желаемых цитокинов, таких как хемокин (С-Х-С участок) лиганд 9 (CXCL9), также известный как MIG, СС-хемокин 3 (CCL3), также известный как макрофагальный воспалительный белок 1-альфа (MIP-1α), фактор некроза опухолей альфа (ФНО-α), ИЛ-1β и ИЛ-12, и, таким образом, подходит для применения, например в виде инъекций, без наличия экзогенных факторов, стимулирующих созревание.
При введении в опухоль пациента аллогенным образом, то есть пациенту, который не являлся донором, от которого получены указанные провоспалительные ДК или МКПК, используемые для создания провоспалительных ДК, такие провоспалительные ДК будут активировать собственные ДК пациента, которые вследствие этого превратятся в мигрирующие ДК, загруженные опухолевыми антигенами. Этот эффект обусловлен способностью введенных провоспалительных ДК производить в большом количестве комбинации желаемых цитокинов и ИЛ-12, включая хемокин MIP-1α/CCL3, который рекрутирует (привлекает) дендритные клетки, естественные киллеры (NK-клетки) и Т-клетки памяти, хемокин MIG/CXCL9, который рекрутирует NK-клетки и Т-клетки памяти, а также цитокин ИЛ-12, активирующий NK клетки. Кроме того, одно из преимуществ зрелых ДК, таких как провоспалительные зрелые ДК, по сравнению с незрелыми ДК, состоит в том, что они могут усиливать активацию NK-клеток посредством межклеточных контактов. Тот факт, что провоспалительные ДК не зависят от сильного экзогенного активирования, например действия факторов созревания, является их преимуществом, в противном случае, присутствие в опухоли сильных экзогенных активирующих факторов может вызвать дифференцировку собственных ДК пациента, привлеченных в опухоль, в специфичные для пациента, т.е. собственные, провоспалительные ДК, а не в желаемые мигрирующие ДК, специфичные для пациента. Таким образом, чтобы обеспечить оптимальную возможность активировать NK-клетки, для достижения высокого уровня экспрессии молекул, таких как CD86, вероятно, будет необходима минимум 18-часовая стимуляция созревающих ДК. На основании данных, известных в данной области техники, активированные/зрелые ДК не могут продуцировать значительное количество ИЛ-12 после 18 часов стимуляции. Выработка интерлейкина сохраняется, если прервать активацию всего через 8 часов. Однако, эти ДК не будут иметь достаточно времени для усиления экспрессии соответствующих молекул, активирующих NK клетки.
Более того, известно, что пересадка аллогенных органов, тканей или зрелых ДК вызывает сильную иммунизацию, приводящую к увеличению количества аллореактивных CD4+ Т-клеток, которые являются специфичными для аллогенных МНС-пептидов, презентируемых на молекулах «своих» белков МНС класса II (self-МНС class II molecules, так называемый непрямой путь аллогенного распознавания). При использовании аллогенных провоспалительных ДК для внутриопухолевой инъекции указанные ДК впоследствии будут убиты (отторгнуты) иммунной системой реципиента, и, таким образом, станут источником высоко иммуногенных эпитопов CD4+ Т-хелперов (аллогенные МНС-пептиды), которые будут захвачены собственными рекрутированными ДК что, скорее всего, приведет к нарушению CD8 толерантности пациента, у котрого присутствует опухоль, к опухолевым антигенам. Указанные провоспалительные ДК, таким образом, будут выступать в качестве адъюванта, а не в качестве мигрирующих ДК, что как является преимуществом настоящего изобретения, так и отличает его от предшествующего уровня техники в данной области. Например, если простагландин Е2 (PGE2) включить в другие коктейли для созревания ДК, зрелая ДК станет мигрирующей клеткой, которая быстро покинет место инъекции (опухоль) - процесс, который является неблагоприятным в рамках данного изобретения.
При использовании аллогенных ДК, например у пациента, не являвшегося источником или донором провоспалительных зрелых ДК или МКПК, не требуется индивидуально готовить такой потенциальный адъювант для каждого конкретного пациента, что позволяет использовать крупномасштабное производство с последующими более низкими затратами на производство. Кроме того, такая вакцина может быть заморожена и отправлена на большие расстояния, что еще больше повышает ее коммерческую ценность.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Эти и другие аспекты, особенности и преимущества, которые присущи данному изобретению, станут очевидны и будут разъяснены на основании нижеследующего описания вариантов реализации настоящего изобретения, со ссылкой на прилагаемые чертежи, на которых:
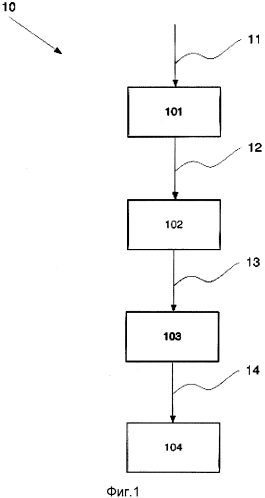
Фиг.1 Схематическая иллюстрация способа в соответствии с третьим аспектом настоящего изобретения.
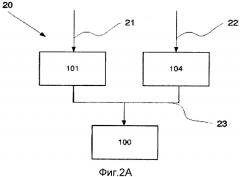
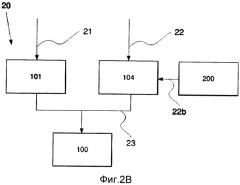
Фиг.2 Схематическая иллюстрация способа в соответствии с четвертым аспектом настоящего изобретения.
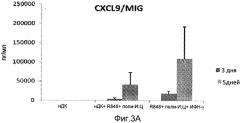
Фиг.3 Графики, демонстрирующие продукцию CCL3/MIP-1α (фиг.3С), CCL5/RANTES (фиг.3А) и CXCL9/MIG (фиг.3В) провоспалительными зрелыми ДК в соответствии с первым аспектом настоящего изобретения.
Фиг.4 График, демонстрирующий продукцию ИЛ-12 провоспалительными зрелыми ДК в соответствии с первым аспектом настоящего изобретения.
Фиг.5 Графики, демонстрирующие продукцию ИЛ-1β и ФНО-α композицией в соответствии со вторым аспектом настоящего изобретения.
Фиг.6 Графики, демонстрирующие продукцию ИЛ-1β и ФНО-α композицией в соответствии со вторым аспектом настоящего изобретения.
Фиг.7 График, демонстрирующий продукцию ИФН-γ композицией в соответствии со вторым аспектом настоящего изобретения.
Фиг.8 Графики цитофлуориметрического анализа (FACS), демонстрирующие влияние различных веществ на созревание незрелых ДК; (Фиг.8А-8С).
Фиг.9 Графики цитофлуориметрического анализа, демонстрирующие влияние провоспалительных зрелых ДК, в соответствии с первым аспектом настоящего изобретения, или композиции, в соответствии со вторым аспектом, на созревание незрелых ДК. (Фиг.9А-9D).
Фиг.10 График, демонстрирующий объем опухоли в исследовании, касающемся одного из вариантов реализации настоящего изобретения.
Фиг.11 Фотографии результатов гистопатологического анализа (первичная опухоль) в исследовании, касающемся одного из вариантов реализации настоящего изобретения.
Фиг.12 Фотографии контрольных результатов гистопатологического анализа (первичная опухоль) в исследовании, касающемся одного из вариантов реализации настоящего изобретения.
Фиг.13 Фотографии результатов гистопатологического анализа (вторичная опухоль) в исследовании, касающемся одного из вариантов реализации настоящего изобретения.
Фиг.14 Фотографии контрольных результатов гистопатологического анализа (вторичная опухоль) в исследовании, касающемся одного из вариантов реализации настоящего изобретения.
ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Для того чтобы специалисты в данной области имели возможность осуществить изобретение ниже будут более подробно описаны несколько вариантов реализации настоящего изобретения со ссылками на прилагаемые чертежи. Тем не менее, настоящее изобретение может быть реализовано в различных формах и не должно рассматриваться как ограниченное вариантами реализации, изложенными далее. Указанные варианты, главным образом, обеспечиваются для исчерпывающего и более тщательного описания изобретения, а также для полной передачи целей настоящего изобретения специалистам в данной области. Варианты реализации изобретения не ограничивают его, однако изобретение ограничивается только прилагаемыми пунктами формулы изобретения. Кроме того, терминология, используемая в подробном описании конкретных вариантов реализации, проиллюстрированных в прилагающихся чертежах, не предназначена для ограничения использования настоящего изобретения.
Адъюванты, вводимые в опухоль и предназначенные для индукции эффективного антиопухолевого иммунного ответа, скорее всего, должны вызвать 3 события в инъецированной опухоли, которые все важны для достижения ЦТЛ-опосредованного уничтожения опухоли.
Во-первых, незрелые ДК (нДК) должны быть привлечены в опухоль для контакта с опухолевым антигеном. В данной области техники хорошо известно, что хемокин MIP-1α/CCL3 активно стимулирует привлечение нДК, в том числе привлечение нДК в опухоль in vivo.
Во-вторых, чтобы сделать опухолевые антигены доступными для привлеченных нДК важно индуцировать апоптоз опухолевых клеток. В данной области техники существует несколько различных способов достижения этой цели, в том числе способы, которые вызывают привлечение в опухоль и активацию естественных киллеров (NK-клеток). На различных моделях у мышей неоднократно было показано, что первичное уничтожение чувствительных клеток опухоли NK-клетками, в основном за счет индукции апоптоза, эффективно вызывает последующее развитие ДК-опосредованного опухоль-специфичного ЦТЛ-ответа к родительским опухолевым клеткам, устойчивым к NK-клеткам. Известно, что NK-клетки экспрессируют рецептор хемокинов CXCR3. На нескольких моделях животных было продемонстрировано CXCR3-зависимое привлечение естественных киллеров. Одним из хорошо известных CXCR3-лигандов является MIG/CXCL9, существуют доказательства того, что NK-клетки накапливаются в опухоли после инъекции в нее MIG/CXCL9.
По-видимому, для эффективного уничтожения опухолевых клеток естественными киллерами также необходимо наличие факторов, активирующих NK-клетки, таких как ИЛ-12, который представляет собой мощный активатор антиопухолевой активности NK-клеток in vitro и in vivo.
В-третьих, должно быть индуцировано созревание привлеченных нДК в зрелые мигрирующие ДК.
Ранние стадии вирусной инфекции (обычно ведущие к Th1-опосредованному иммунному ответу), как правило, связаны с локальным привлечением и активацией, как ДК, так и NK-клеток. В недавнем исследовании проводилось изучение способности NK клеток периферической крови человека, которые были подвергнуты короткой (ночь) инкубации с ИЛ-12 или ИЛ-4, индуцировать созревание ДК. Примечательно, что только NK-клетки, которые были стимулированы ИЛ-12, могли вызвать существенное созревание ДК. Поэтому был сделан вывод, что NK-клетки, стимулированные ИЛ-12 в течение промежутка времени, сопоставимого со временем ответа in vivo, могут способствовать выбору соответствующих зрелых ДК для последующей инициации Th1-клеток во вторичных лимфоидных органах (5). Эти данные, полученные на иммунных клетках человека in vitro, соответствуют данным, полученным в ходе исследований на мышах in vivo, которые продемонстрировали, что Th1-опосредованные ответы значительно увеличиваются, когда введение мышам загруженных антигеном ДК сопровождается накоплением привлеченных NK-клеток, по сравнению с ситуациями, в которых привлечение NK-клеток отсутствует.
Также было показано, что созревание Th1-поляризующих ДК индуцируется растворимыми факторами, вырабатываемыми поликлонально активированными Т-клетками. Содержание нескольких растворимых факторов, включая CD40-лиганд, ФНО-α и ИФН-γ, было показано при обработке незрелых ДК кондиционированной Т-клетками средой (ТССМ), приготовленной из бесклеточных супернатантов анти-CD3-активированных Т-клеток или Т-клетками, активированными двойной стимуляцией антителами против CD3 и против CD28. Известно, что в отличие от умеренного усиления экспрессии ко-стимулирующих молекул, при добавлении среды кондиционированной отдельными цитокинами и моноцитами, обработка незрелых ДК ТССМ вызывает значительное дозазависимое увеличение экспрессии ко-стимулирующих молекул. Способность ТССМ вызывать такие фенотипические изменения дополнительно ингибируется нейтрализующими антителами, специфичными для CD40L, ФНО-α и ИФН-γ, что указывает на участие этих факторов, присутствующих в ТССМ, в созревании ДК. Важно отметить, что обработанные ТССМ ДК могут вырабатывать высокие уровни ИЛ-12, участвующего в развитии Th1 ответа.
Наконец, известно, что CD4+ Т-клетки играют ключевую роль в инициации, распространении и памяти, а также в выживании CD8+ ЦТЛ, помогая мигрирующим ДК во время межклеточного взаимодействия с антиген-специфичными CD8+ Т-клетками в дренирующих лимфатических узлах. Некоторые исследования в области иммунотерапии рака опирались на подход, заключающийся в том что, распознавание CD4+ Т-клетками II класса МНС-пептидов из опухолевого антигена дикого типа могло бы обеспечить необходимую помощь для ЦТЛ-индукции. Тем не менее, из-за развития толерантности CD4+ Т-клеток к указанным собственным белкам, которая возникает во время прогрессирования опухоли, помощь, которую обеспечивают пептиды из опухолевых антигенов, часто будет слабой или будет отсутствовать, что может ухудшить терапевтический эффект вакцины. Недавние исследования на мышах показали, что добавление в месте вакцинации чужеродных эпитопов CD4+ Т-хелперов к связанным с опухолью собственным белкам является достаточным условием для преодоления установленной CD8 толерантности к опухолевым антигенам.
Все вместе, эти данные свидетельствуют о том, что адъювант, вводимый в опухоль и предназначенный для индукции эффективного противоопухолевого адаптивного (Т-клеточного) иммунного ответа, должен характеризоваться высокой и устойчивой продукцией MIP-1α/MIP-1α/CCL3 (привлечение ДК, NK и Т-клеток), MIG/CXCL9 (привлечение NK-клеток и Т-клеток памяти), ИЛ-12р70 (высвобождение опухолевых антигенов и созревание мигрирующих ДК, опосредованное NK-клетками) и, наконец, наличием иммуногенных чужеродных белков, которые могут выступать в роли эпитопов CD4+ Т-клеток при ДК-опосредованном прайминге опухоль-специфичных CD8+ Т-клеток в дренирующих лимфатических узлах.
Дендритные клетки человека моноцитарного происхождения потенциально способны вырабатывать высокие уровни MIP-1α/CCL3, ИЛ-12р70 и M1G/CXCL9 при постоянный стимуляции определенными TLR-лигандами, которые также приводят к созреванию ДК. Указанные устойчиво активированные провоспалительные зрелые ДК должны быть отмыты перед введением в опухоль. Если ДК не отмыты, то одновременное введение стимулирующих агентов (направленных на индукцию провоспалительных ДК ех vivo), скорее всего, приведет также к сильной и продолжительной активации привлеченных в опухоль незрелых ДК, которая вызовет их дифференцировку в зрелые провоспалительные ДК, вместо желаемой дифференцировки в мигрирующие зрелые ДК. К сожалению, известно, что устранение стимулов, индуцирующих созревание, таких как TLR4 лиганд или CD40L в те моменты времени, когда ДК дифференцировались в зрелые ДК (как правило, минимум после 12 часов стимуляции), вызывает быстрое подавление синтеза воспалительных цитокинов, включая выработку ИЛ-12. Таким образом, следует применять активационные способы, которые стимулируют дифференцировку ДК в зрелые провоспалительные ДК с устойчивым продуцированием желаемых факторов после прекращения действия активационных стимулов.
В ходе работы над настоящим изобретением был найден способ получения провоспалительных зрелых ДК, которые производят удивительно высокие уровни желаемых хемокинов и ИЛ-12 после прекращения устойчивой стимуляция сильными активирующими факторами, в результате чего формируется пул ДК, свободных от стимулирующих факторов. Такие провоспалительные зрелые ДК можно вводить пациенту аллогенным способом, то есть пациенту, который не являлся источником указанных ДК.
Указанные провоспалительные зрелые ДК можно смешивать с мононуклеарными клетками периферической крови (МКПК) с получением композиции. Указанные провоспалительные зрелые ДК можно покрыть суперантигеном, таким как энтеротоксин В золотистого стафилококка (SEB), который вызовет поликлональнуюй активацию Т-клеток в популяции МКПК.
При введении пациенту, указанные провоспалительные зрелые ДК или композиции вызовут иммунный ответ, который в свою очередь приведет к развитию клеточного иммунного ответа против опухоли, с последующим уничтожением опухолевых клеток.
Данные эффект особенно устойчив, если пациент не является ни донором МКПК, ни источником указанных провоспалительных зрелых ДК, то есть они аллогенны для пациента. В таком случае, указанные провоспалительные зрелые ДК или композиция будут действовать в качестве чужеродных эпитопов CD4+ Т-хелперов.
Указанные провоспалительные зрелые ДК или композиция будут способствовать привлечению собственных ДК, NK- и Т клеток пациента в место инъекции, благодаря способности провоспалительных зрелых ДК вырабатывать высокие уровни соответствующих хемокинов, таких как MIP-1α/CCL3, и активировать привлеченные NK-клетки посредством межклеточных взаимодействий, а также способности провоспалительных зрелых ДК вырабатывать высокие уровни цитокина ИЛ-12, что приведет к антигенной загрузке собственных привлеченных ДК пациента иммуногенным опухолевым материалом из опухолевых клеток, уничтоженных естественными киллерами.
В предпочтительном варианте реализации композицию 100 вводят непосредственно в опухоль. Очень важной является способность привлекать ДК по всему объему опухоли, так как у большинства обследованных онкологических пациентов ДК были найдены в основном на периферии опухолей, что может ограничить их взаимодействие с опухолевыми клетками. Важно отметить, что потенциал хемокинов привлекать собственные циркулирующие ДК пациентов в опухоль подвергает опухолевые клетки воздействию свежих созревших/привлеченных ДК (в отличие от локальных ДК), которые могут быть меньше подвержены иммуносупрессивному воздействию опухолевой среды.
В одном из вариантов реализации настоящего изобретения в соответствии с фиг.1, предложен способ 10, согласно которому обеспечивают 11 мононуклеарные клетки периферической крови (МКПК) 101. Моноциты 102 изолируют 12 из указанных МКПК 101. Незрелые ДК (нДК) 103 получают 13 из указанных моноцитов 102 и созревание нДК 103 индуцируют 14 путем добавления индукторов активации поли-И:Ц, R848 и ИФН-γ к нДК103, с последующей промывкой для удаления всех активирующих факторов, что в результате приведет к получению провоспалительных зрелых ДК 104 свободных от стимулирующих факторов.
В одном из вариантов реализации настоящего изобретения стадия индукции 14 созревания нДК 103 дополнительно включает в себя добавление, по меньшей мере, одного из веществ, выбранных из группы, состоящей из: ИФН-α, ИЛ-1β и ФНО-α.
В одном из вариантов реализации настоящего изобретения получение 13 нДК индуцируют путем культивирования моноцитов в водной среде, которая содержит ИЛ-4 и ГМ-КСФ в течение 2-7 дней, например от 3 до 5 дней, или 3 или 5 дней.
В одном из вариантов реализации настоящего изобретения в соответствии с фиг.2А обеспечивается способ 20 получения композиции 100, такой как совместная культура провоспалительных ДК 104 и МКПК 101. Указанный способ включает обеспечение 21 мононуклеарных клеток периферической крови (МКПК) 101, получение 22 провоспалительных зрелых ДК 104, смешивание 23 указанных МКПК 101 и указанных провоспалительных зрелых ДК 104.
В одном из вариантов реализации настоящего изобретения в соответствии с фиг.2 В обеспечивается способ получения 20 композиции 100, который содержит дополнительную стадию обработки 22b провоспалительных зрелых ДК 104 суперантигеном 200 перед указанным смешиванием.
Указанные выше варианты реализации изобретения будут более подробно описаны далее.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Следующие способы экспериментальной реализации изобретения не ограничиваются конкретной формой, изложенной далее. Настоящее изобретение в некоторой степени ограничивается только прилагаемыми пунктами формулы изобретения и другие варианты реализации изобретения, отличные от вышеуказанных конкретных вариантов, в равной степени возможны в пределах формулы изобретения.
Выделение МКПК и моноцитов
Мононуклеары периферической крови (МКПК) 101 выделяли из периферической крови, полученной от здоровых доноров (Sahlgrenska sjukhuset, Гетеборг, Швеция), при помощи центрифугирования в градиенте плотности с использованием Lymphoprep (Nycomed, Pharma, Осло, Норвегия), хорошо известного специалистам в этой области. МКПК 101 ресуспендировали в среде Cellgro (Cell Genix, Фрайбург, Германия) до конечной концентрации 2,5β×106/мл с последующей инкубацией в плоскодонном 24-луночном иммунологическом планшете (1 мл/лунку) при 37°С, 6% С02. Через 2 часа не адгезированные клетки удаляли, в то время как оставшиеся прикрепившиеся клетки дважды промывали фосфатным буфером (ФБ, PBS), в результате были получены изолированные моноциты 102 (в основном состоящей из CD1 + клеток).
Получение ДК
Для того чтобы дифференцировать моноциты 102 в незрелые ДК 103, моноциты 102, взятые после процедуры выделения, культивировали в течение 3 или 5 дней в свежей водной среде, такой как среда Cellgro, дополненной индукторами, например рекомбинантным человеческим ИЛ-4 1000 Ед/мл и рекомбинантным человеческим ГМ-КСФ 1000 Ед/мл (все производства Cell Genix, Фрайбург, Германия).
Поучение незрелых ДК (нДК) моноцитарного происхождения 103 в среде с ИЛ-4 и ГМ-КСФ является повсеместно принятой in vitro моделью, и такие клетки могут рассматриваться как аналогичные периферическим тканевым ДК.
Созревание ДК
После 3 или 5 дней культивирования в среде Cellgro, дополненной ИЛ-4 и ГМ-КСФ, созревание незрелых ДК 103 было индуцированно добавлением к культуральной среде 20 мкг/мл поли-И:Ц (Sigma, Штайнхайм, Германия), иммуностимулятором, специфичным для TLR-3 рецепторов, также известным как полиинозиновая:полицитидиновая кислота, либо натриевой солью полиинозиновой:полицитидиновой кислоты и 2 мкг/мл R848 (Sigma, Штайнхайм, Германия), 7/8-лигандом Toll-подобного рецептора, также известного как резиквимод, либо комбинации поли-И:Ц и R848 дополненной 1000 Ед/мл гамма-интерферона (ИФН-γ, R&D systems, Миннеаполис, США). Для получения провоспалительных зрелых ДК 104 в соответствии с аспектом изобретения через 18 часов инкубации клетки отмывали три раза и затем вновь инкубировали в свежей среде (без добавления экзогенных активирующих факторов) в течение 24 часов.
Супернатанты культур собирали в соответствии с протоколами, хорошо известными специалистам в данной области.
Для определения уровней хемокина CCL3/MIP-1α, CCL5/RANTES, CXCL9/MIG, CCL2/Моноцитарного хемотаксического белка-1 (МСР-1) и цитокина интерлейкин 12 (ИЛ-12) супернатанты подвергали твердофазному ИФА (ELISA), описанному ниже.
Смешанная культура ДК и МКПК
МКПК 101 и провоспалительные зрелые ДК 104 были получены в соответствии с методиками, описанными выше.
Для достижения быстрого созревания и поликлональной активации Т-клеток из МКПК 101, на стадии созревания ДК к культуре добавили 0,01 мкг/мл SEB (R&D systems, Миннеаполис, США) за 30 минут до отмывки. После трехкратной отмывки в ФБ провоспалительные зрелые ДК 104 (2,5×105 клеток/мл) совместно культивировали в течение 24 часов с 1×106 клеток/мл аллогенных МКПК (выделенных из периферической крови здоровых доноров, как описано выше), общий объем среды составлял 1 мл.
Супернатант культуральной жидкости, полученной из смешанной культуры провоспалительных зрелых ДК 104 и аллогенных МКПК, так называемый MLR супернатант, собирали и затем хранили при температуре -80°С. Супернатанты позже анализировали с помощью ELISA на наличие известных факторов активации или созревания ДК, таких как ИФН-γ, ФНО-α и ИЛ-1β, как описано ниже. Супернатанты были исследованы на наличие известных факторов индуцирующих фенотипическое созревание нДК, в соответствии с описанной ниже методикой.
ELISA
Уровни CCL3/MIP-1α, CCL5/RANTES, CXCL9/MIG, CCL2/MCP-1, ИЛ-12, ФНО-α, ИЛ-1β и γ-интерферона измеряли при помощи твердофазного иммуноферментного анализа (ELISA) с применением набора Duo Set ELISA Development System, производства R&D systems (Миннеаполис, США) в соответствии с инструкциями производителя.
Оценка фенотипического созревания
Дендритные клетки моноцитарного происхождения 103 (нДК) были получены, как описано выше. После 5 дней инкубации в среде Cellgro, дополненной ИЛ-4 и ГМ-КСФ, незрелые ДК 103 инкубировали при 37°С в течение 24 часов в 300 мкл MLR супернатантов, описанных выше, и 100 мкл свежей среды Cellgro. ДК, культивированные без добавления супернатанта, использовали в качестве контроля. Чтобы определить, вызывают ли MLR супернатанты созревание, образцы окрашивали РЕ-конъюгированными антителами к CD86 человека в комбинации с FITC-конъюгированными антителами к CD83 человека. Мышиные IgG1 и IgG2, конъюгированные с FITC и РЕ, использовали в качестве изотипического контроля (все антитела производства BD Biosciences, Калифорния, США). Образцы анализировали методом проточной цитометрии (FACS) с помощью Cell Quest Software (BD Bioscience, Калифорния, США).
РЕЗУЛЬТАТЫ
Ниже обсуждаются результаты экспериментальной части.
Устойчивое продуцирование желаемых воспалительных хемокинов
Как показано на фигуре 3, продукция CCL3/MIP-1α (фиг.3С), CCL5/RANTES (фиг.3А) и CXCL9/MIG (фиг.3В) провоспалительными зрелыми ДК 104 от 3 исследованных доноров крови было выше, если нДК были индуцированы посредством культивирования в течение 5 дней в среде с ГМ-КСФ и ИЛ-4 перед комбинированной TLR стимуляции, т.е. индукции 14 созревания, по сравнению с культурой, инкубировавшейся в течение 3 дней в среде с ГМ-КСФ и ИЛ-4. Кроме того, комбинированная TLR стимуляция с добавлением ИФН-γ дала самые высокие уровни CCL3/MIP-1α и CXCL9/MIG, в то время как продукция CCL5/RANTES не зависела от добавления ИФН-γ.
Таким образом, провоспалительные дендритные клетки (ДК) стимулировали до созревания ex vivo, посредством обработки такими веществами как натриевая соль полиинозиновой-полицитидиновой кислоты (поли-И:Ц), резиквимодом (R848) и гамма-интерфероном (ИФН-γ).
В одном из вариантов реализации настоящего изобретения провоспалительные дендритные клетки (ДК) были дополнительно стимулированы, по меньшей мере, одним из веществ, выбранных из группы, состоящей из интерферона а (ИФН-α), интерлейкина-1 бета (ИЛ-1β) и фактора некроза опухоли α (ФНО-α).
Примечательно, что зарегистрированные высокие уровни соответствующих хемокинов продуцировались после удаления стимулов, индуцирующих созревание. То, что провоспалительны