Рекомбинантный штамм vv-gmcsf-s1/3 вируса осповакцины, продуцирующий секретируемый гранулоцитарно-макрофагальный колониестимулирующий фактор человека
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается рекомбинантного штамма вируса осповакцины. Охарактеризованный штамм сконструирован на основе штамма Л-ИВП вируса осповакцины и содержит встройку гена гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) человека, структура которого соответствует кДНК матричной РНК ГМ-КСФ человека, представленной в GenBank под номером Ml 1220.1. Ген ГМ-КСФ человека экспрессируется под контролем природного промотора р7.5К вируса осповакцины и продуцирует секретируемую форму биологически активного ГМ-КСФ человека в клетках млекопитающих на уровне 40 мкг на мл культуральной среды. Штамм VV-GMCSF-S1/3 депонирован в Государственной коллекции Роспотребнадзора возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-631 и может быть использован для разработки лекарственных средств для борьбы с онкологическими и инфекционными заболеваниями. 3 пр., 5 ил.
Реферат
Изобретение относится к рекомбинантным штаммам вируса осповакцины, продуцирующим секретируемый гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) человека, и может быть использовано в биотехнологии, в частности, в генетической инженерии для разработки вакцин и лекарственных средств нового поколения для борьбы с онкологическими и инфекционными заболеваниями.
Вирус осповакцины (ВОВ) имеет длительную и успешную историю медицинского применения в качестве живой вакцины при искоренении оспы на земном шаре (Как это было, 2011 [1]). В разных странах для вакцинации против оспы использовали разные штаммы вируса осповакцины. Одним из штаммов, который использовался в России, является Л-ИВП, биовариант штамма Листер (Lister) (Маренникова, 1998 [2]). Для предотвращения возможных поствакцинальных осложнений разработан целый ряд аттенуированных вариантов вируса осповакцины с делециями участков генома, ответственных за вирулентность (Максютов, 2011 [3]). Ген тимидинкиназы (tk) является фактором вирулентности ВОВ, инактивация которого приводит к существенной аттенуации вируса in vivo (Серпинский, 1996 [4]). Этот район генома широко используется для встройки чужеродных генов (трансгенов) с целью получения бивалентных вакцин (гены протективно значимых белков возбудителей вирусных и бактериальных заболеваний (Щелкунов, 2010 [5])) или онколитических препаратов (гены иммуностимулирующих, цитотоксических и других белков (Кочнева, 2012 [6]). Вставка в геном вируса генов цитокинов в качестве трансгенов является универсальной технологией для повышения иммуностимулирующей активности вируса как при вакцинации, так и при лечении онкологических заболеваний (Кочнева, 2012 [6]).
ГМ-КСФ - полипептидный цитокин, относится к группе гранулоцитарно-макрофагальных колониестимулирующих факторов. Стимулирует образование колоний гранулоцитов и макрофагов из ком митированных предшественников. ГМ-КСФ in vivo и in vitro не только стимулирует пролиферацию и созревание миелоидных клеток-предшественников, но может также усиливать различные функции зрелых эффекторных клеток: повышает способность нейтрофилов, макрофагов и эозинофилов к фагоцитозу и разрушению микроорганизмов (Weisbart, 1985 [7], Fleischmann, 1986 [8]), увеличивает антителозависимую клеточно-опосредованную цитотоксичность в отношении опухолевых клеток (Kushner, 1989 [9]).
ГМ-КСФ целесообразно использовать в случае комбинированного применения противоопухолевых препаратов вместе с химиотерапией для снижения тяжести нейтропении (Kim, 2006 [10]). Ранее ген ГМ-КСФ человека был встроен в геном двух штаммов вируса осповакцины WR (JX-963) (Thome, 2007 [11]) и Wyeth (JX-594) (Kirn, 2010 [12]) в район tk-гена под контролем ранне-позднего промотора W (Cochran, 1985 [13]). Эти штаммы в настоящее время успешно проходят испытания в качестве противоопухолевых препаратов (Kirn, 2010 [12]; Breitbach, 2011 [14]). В связи с этим полученный нами рекомбинантный штамм Л-ИВП со встройкой гена ГМ-КСФ также представляется перспективным онколитическим препаратом. Штамм Л-ИВП использовался в России для вакцинации против оспы и в ограниченном масштабе используется и в настоящее время, поэтому полученные на его основе препараты с аттенуированными свойствами имеют дополнительный шанс рассматриваться в качестве лекарственных средств на территории РФ.
Известен рекомбинантный не реплицирующийся в клетках человека поксвирус птиц для доставки ГМ-КСФ для усиления иммунного ответа на специфический антиген, который доставляется другим рекомбинантным вирусом (WO 0195919 (А2) - A recombinant non-replicating virus expressing GM-CSF and uses thereof to enhance immune responses)
Однако доставка ГМ-КСФ и антигена в разных векторах усложняет технологию дальнейшего их использования (по месту введения), а также может существенно снизить эффективность иммуностимуляции.
Известен рекомбинантный штамм вируса ВОВ, секретирующий ГМ-КСФ (US Patent 6548068, опубликованный в 2003 г., и продление в заявке США 20050186180, опубликованной в 2005 г.). В данных изобретениях рекомбинанты получали на основе штамма Wyeth вируса осповакцины, который использовался в качестве вакцинного в США. Для усиления иммунного ответа использована смесь рекомбинантного и исходного штаммов вируса, что повышает вероятность возникновения поствакцинальных осложнений. Также для встройки антигена и иммуномодулирующей молекулы авторы используют два разных рекомбинантных вируса, что представляет дополнительные трудности при вакцинации и колоколизации продуктов трансгенов в организме для индукции эффективного иммунного ответа. Для экспрессии трансгенов в данном аналоге использован сверхранний промотор Р40, который обеспечивает продукцию трансгенов только на самых ранних этапах вирусной инфекции. Кроме того, в данных публикациях не показана экспрессия гена ГМ-КСФ и его секреция в культуральную среду вообще. Для селекции рекомбинантов вируса осповакцины используют дополнительную встройку и экспрессию бактериального гена бета-галактозидазы, что может иметь негативные последствия при вакцинации.
Наиболее близким аналогом изобретения (прототипом) является рекомбинантный вариант ВОВ, полученный на основе американского вакцинного штамма Wyeth и несущий ген ГМ-КСФ человека в структурной части tk-гена под контролем ранне-позднего синтетического промотора ВОВ (Mastrangelo, 2000 [15] Патент США №6,093,700, опубликованный 25 июля 2000 года). Кроме гена ГМ-КСФ в структурную часть tk-гена данного штамма встроен также ген В-галактозидазы E.coli под контролем природного промотора ВОВ р7.5К. Штамм получил название JX-594 (от Jennerex Biotherapeutics, Inc.) и в настоящее времы проходит клинические испытания в качестве противоопухолевого препарата (Parato, 2012 [16]).
Однако штамм Wyeth вируса осповакцины никогда не использовался в России в качестве противооспенной вакцины, а уровень продукции ГМ-КСФ под контролем синтетического промотора в составе рекомбинантного штамма JX-594 очень низок - 20-40 пикограмм на мл культуральной среды при инфекции клеток с множественность 0,1 БОЕ/клетка (Kim, 2006 [10]). Кроме того, штамм JX-594, кроме гена ГМ-КСФ, несет в своем составе крупный фрагмент бактериальной ДНК свыше 3000 п. н. (ген β-галактозидазы E.coli) в непосредственной близости от гена ГМ-КСФ, который может дестабилизировать структуру всего района встройки и экспрессия которого под высокоэффективным промотором ВОВ р7,5К может негативно сказываться на жизнедеятельности клетки.
Техническим результатом заявляемого изобретения является создание более высокопродуктивного рекомбинантного штамма ВОВ, продуцирующего секретируемый ГМ-КСФ человека с эффективностью не ниже, чем 1 мкг/мл культуральной среды и пригодного для конструирования на его основе онколитических препаратов и поливалентных вакцин.
Указанный технический результат достигается созданием штамма рекомбинантного вируса осповакцины VV-GMCSF-S1/3, содержащего встройку кДНК матричной РНК ГМ-КСФ человека в структурной части гена вирусной тимидинкиназы, экспрессируемую под контролем природного промотора р7.5К ВОВ, продуцирующего секретируемый биологически активный ГМ-КСФ человека в клетках млекопитающих на уровне 1-40 мкг на мл культуральной среды и депонированный в Государственной коллекции Роспотребнадзора возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-631 (справка о депонировании штамма №0315/1381 от 26/04/2913 г. прилагается).
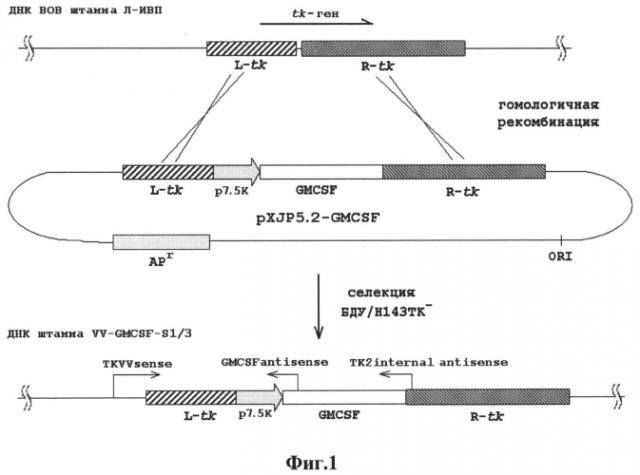
Создание штамма рекомбинантного вируса осповакцины VV-GMCSF-S1/3 достигается за счет гомологичной рекомбинации между ДНК ВОВ штамма Л-ИВП и плазмидной ДНК pXJP5.2-GMCSF (фиг. 1) в цитоплазме клеток CV-1 и последующей селекции рекомбинантов в клетках Η 143 ТК- с добавлением в культуральную среду бромдезоксиуридина (БДУ). Плазмида pXJP5.2-GMCSF была создана на основе pXJP5.2 (фиг. 2), которая обеспечивает встройку
трансгенов в район гена вирусной тимидинкиназы (tk) за счет наличия в ней фрагмента ДНК ВОВ штамма Л-ИВП, соответствующего позициям нуклеотидов 83070-84639 депонированного в GenBank штамма BOB Lister 107 (Accession DQ 121394), разделенного на левый (595 п.н.) и правый (933 п.н.) фланки с делецией 31 п.н. в центре tk-гена, в район которой введен природный промотор ВОВ р7.5К (276 п. н.) (Cochran, 1985[13]) и полилинкер для встройки трансгенов (фиг. 2). Полноразмерная ДНК копия (кДНК) матричной РНК ГМ-КСФ человека была выделена из полученной нами кДНК библиотеки, клонирована в универсальный вектор pUC19 и секвенирована. Структура клонированной кДНК ГМ-КСФ совпадала со структурой, депонированной в GenBank (Accession Ml 1220.1), но имела 4 дополнительных нуклеотида (АААА) на 3′ конце в поли-А тракте. Далее кДНК ГМ-КСФ в составе фрагмента 850 п. н., фланкированного сайтами рестрикции EcoRI и HindIII, была перенесена из плазмиды pUC19 в полилинкер pXJP5.2 с получением плазмиды pXJP5.2-GMCSF (фиг. 1).
Штамм VV-GMCSF-S1/3 характеризуется следующими признаками: Морфологические признаки. Штамм обладает свойствами типичного представителя ВОВ, но в отличие от векторного вируса имеет фенотип ТК-ГМКСФ+.
Физиолого-биохимические характеристики и культуральные свойства штамма. ДНК рекомбинантного ВОВ имеет длину около 200000 п.н. Наличие в его геноме встройки гена ГМ-КСФ человека подтверждено с помощью метода ПЦР (фиг. 3), экспрессия гена ГМ-КСФ человека подтверждена Western blot анализом культуральной среды и лизатов клеток CV-1, инфицированных рекомбинантным штаммом W-GMCSF-S1/3 (фиг. 4). Биологическая активность секретируемого рекомбинантного ГМ-КСФ была оценена в культуре клеток эритролейкоза человека TF-1, которая является ГМ-КСФ-зависимой и пролиферирует только в присутствии ГМ-КСФ и ряда других цитокинов человека (фиг. 5).
Заявляемый штамм вируса осповакцины, как платформа для конструирования противоопухолевых и вакцинных препаратов, обладает целым рядом преимуществ. Он реплицируется в цитоплазме инфицированных клеток в
автономных образованиях - вирусных фабриках, не контактирует с клеточным генетическим материалом, не встраивается в хромосомы, не имеет онкогенного потенциала. Вирус осповакцины способен индуцировать как гуморальный, так и клеточный иммунный ответ (Damon, 2007 [17]), что особенно важно для распознавания и уничтожения организмом клеток опухоли или клеток, инфицированных патогенными вирусами при разработке противовирусных поливалентных вакцин.
Заявляемый штамм вируса осповакцины VV-GMCSF-S1/3 получен на основе вакцинного штамма Л-ИВП, который широко применялся в медицинской практике для борьбы против оспы в России, но с 1980 года такая вакцинация прекращена вследствие искоренения натуральной оспы на земном шаре (Как это было, 2011 [1]). Таким образом, большинство людей не имеют антител к вирусам группы оспы, что существенно увеличивает эффективность использования вируса осповакцины в качестве противоопухолевого и поливакцинного препарата. Встройка гена ГМ-КСФ с одновременной инактивацией гена тимидинкиназы обеспечивает дополнительную аттенуацию и иммуногенность вируса.
Изобретение иллюстрируется следующими фигурами графических изображений:
- на фиг. 1 приведена схема конструирования рекомбинантного штамма VV-GMCSF-S1/3 путем гомологичной рекомбинации ДНК ВОВ и ДНК плазмиды pXJP5.2-GMCSF, в которой последовательно расположены: L-tk - левый фланк встройки, представляющий собой фрагмент генома ВОВ штамма Л-ИВП, соответствующий району 83070-83665 п.н. штамма Lister 107 (GenBank DQ 121394) и включающий 244 п.н. N-концевой части tk-гена; р7.5К - природный ранне-поздний промотор BOB; GMCSF - ДНК копия матричной РНК ГМ-КСФ человека; R-tk - правый фланк встройки, представляющий собой фрагмент генома ВОВ штамма Л-ИВП, соответствующий району 83696-84639 п. н. штамма Lister 107 (GenBank DQ 121394) и включающий 257 п.н. С-концевой части tk-гена; APr- ген устойчивости к ампициллину; ORI - область начала репликации. На ДНК штамма VV-GMCSF-S1/3 указаны позиции прямого праймера TKVVsense
и двух обратных праймеров: ТК2 internal antisense и GMCSF antisense. Эти праймеры использовали для выявления и подтверждения структуры рекомбинантного вируса;
- на фиг. 2 приведена физическая карта плазмидной ДНК pXJP5.2, на которой указаны: L-tk - левый фланк встройки, представляющий собой фрагмент генома ВОВ штамма Л-ИВП, соответствующий району 83070-83665 п. н. штамма Lister 107 (GenBank DQ 121394); р7.5К - природный ранне-поздний промотор ВОВ; полилинкер XbaI - EcoRI, содержащий уникальные сайты рестрикции для встройки трансгенов; R-tk - правый фланк встройки, представляющий собой фрагмент генома ВОВ штамма Л-ИВП, соответствующий району 83696-84639 п.н. штамма Lister 107 (GenBank DQ121394); APr-ген устойчивости к ампициллину; ORI - область начала репликации;
- на фиг. 3 приведен электрофоретический анализ в 1% агарозе ПЦР-фрагментов, амплифицированных с помощью двух специфических пар праймеров: TKVVsense×TK2 internal antisense (дорожки 1-2) и TKVVsense×GMCSF antisense (дорожки 3-4), позиции праймеров указаны на фиг. 1. Μ - маркер молекулярных весов М28 (НПО «СибЭнзим», Россия): 3000,1500,1000, 900,800,700…100 п. н. Дорожка 1 - Л-ИВП, фрагмент 748 п. о. (отсутствие встройки гена ГМ-КСФ); дорожка 2 - рекомбинант VV-GMCSF-S1/3, фрагмент 2092 п.н. (наличие встройки гена ГМ-КСФ); дорожка 3 - Л-ИВП, амплификации не происходит, так как последовательность, комплементарная праймеру GMCSF antisense, отсутствует; дорожка 4 - рекомбинант VV-GMCSF-S1/3, фрагмент 1018 п.н. (наличие встройки гена ГМ-КСФ);
- на фиг. 4 представлены данные анализа экспрессии гена ГМ-КСФ человека в составе рекомбинантного BOB W-GMCSF-S1/3. Электрофореграмма (А) и Western blot (Б). Размер негликозилированного зрелого ГМ-КСФ человека - 14.4 кДа (дорожка 5, негликозилированный ГМ-КСФ человека, продуцированный в клетках E.coli). Дорожки 1,3 - изоформы ГМ-КСФ человека, соответствующие различной степени гликозилирования белка: 1 - культуральная среда клеток CV-1, инфицированных рекомбинантом VV-GMCSF-S1/3, 48 час.инкубации; 2 -контроль, культуральная среда клеток CV-1, инфицированных Л-ИВП, 48 час
инкубации; 3 - лизат клеток CV-1, инфицированных рекомбинантом VV-GMCSF-S1/3, 48 час.инкубации; 4 - контроль, лизат клеток CV-1, инфицированных Л-ИВП, 48 час.инкубации; М- контроль М.в. 250,150, 100, 75; 50, 37, 25, 20, 15 кДа (BioRad, Kaleidoscope Prestained Standards). В Western blot анализе использовали в качестве первичных антител Rabbit anti-human GM-CSF Polyclonal antibody (PerroTech). В качестве вторичных антител - Anti-rabbit IgG (Whole molecu le) alkaline phosphatase conjugate (Sigma);
- на фиг. 5 представлены данные анализа биологической активности ГМ-КСФ человека, экспрессированного в составе рекомбинантного вируса осповакцины W-GMCSF-S1/3. На оси Υ показана биологическая активность ГМ-КСФ - % стимуляции пролиферации цитокин-зависимых клеток эритролейкоза человека TF-1. За 100% принимали количество живых клеток, выращенных в необработанной среде и при добавлении среды с клеток CV-1, инфицированных вирусом дикого типа Л-ИВП. На оси X - концентрация рекомбинантного прокариотического препарата ГМ-КСФ (калибровка) или разведение культуральной среды клеток CV-1, инфицированных рекомбинантом VV-GMCSF-S1/3 и исходным штаммом Л-ИВП (отрицательный контроль).
Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления.
Пример 1. Трансфекция клеток CV-1 рекомбинантной плазмидой pXJP5.2-GMCSF и получение рекомбинантного штамма BOB VV-GMCSF-S1/3
Для проведения трансфекции ДНК плазмиды pXJP5.2-GMCSF была наработана в препаративных количествах из 250 мл среды Лурия-Бертани и выделена с использованием набора лабораторных реагентов для выделения плазмидной ДНК, очищенной от эндотоксинов, EndoFree Plasmid Maxi Kit (QIAGEN).
Для получения рекомбинантного штамма вируса использовали реагент для трансфекции Lipofectamine™ LTX, 1 мл и реагент Plus (Invitrogen). Трансфекцию проводили на 90%-ном монослое клеток CV-1, выращенном в шестилуночных планшетах (Greiner). Клетки инфицировали вирусом осповакцины с множественностью 0,05 БОЕ/клетка, и через 1 час инкубации при 37°C добавляли
смесь плазмидной ДНК (5 мгк) + липофектамин (20 мкл) + Реагент Plus в соответствии с рекомендацией производителя в 1 мл среды Opti-MEM (Invitrogen). Через 1 час инкубации при 37°C в лунки добавляли 2 мл среды Opti-MEM и инкубировали при 37°C в атмосфере 5% CO2 еще 24-36 часов до развития цитопатического эффекта. Материал трижды замораживали-оттаивали и обрабатывали ультразвуком для получения гомогенной вирусной суспензии. Далее проводили селекцию рекомбинантов путем двукратного пассирования на монослое клеток Н143ТК- с добавлением бромдезоксиуридина (Sigma) в концентрации 25 мкг/мл среды DMEM (Invitrogen). Вирус клонировали методом бляшек под твердым агаровым покрытием и анализировали на наличие встройки гена ГМ-КСФ человека методом ПЦР с использованием праймеров
TKVVsense 20 п.н. 5′ cgatgttcttcgcagatgat 3′
ТК2 internal antisense 20 п.н. 5′ ttctgtgagcgtatggcaaa 3′
GMCSF antisense 20 п.н. 5′ gggctaaagttctctggagg 3′
Праймер TKVVsense расположен на вирусном геноме слева от фланкирующей последовательности плазмиды pXJP5.2-GMCSF и «привязывает» встройку гена ГМ-КСФ непосредственно к вирусной ДНК (фиг. 1). Праймер ТК2 internal antisense лежит внутри правого фланкирующего фрагмента вирусного генома, который является общим для плазмиды и вирусной ДНК (фиг. 1). С использованием пары праймеров TKVVsense×TK2 internal antisense при наличии встройки гена ГМ-КСФ с вирусной ДНК амплифицируется фрагмент 2092 п.н., а при отсутствии встройки (вирус «дикого» типа) - 748 п.н. При использовании пары праймеров TKVVsense×GMCSF antisense амплификация происходит только с рекомбинантной вирусной ДНК поскольку праймер GMCSF antisense лежит внутри гена ГМ-КСФ (фиг. 1) - при наличии встройки размер амплифицированного фрагмента составляет 1018 п.н., в случае вируса дикого типа - 0 (фиг. 3).
Вирусную ДНК для проведения ПЦР выделяли с использованием наборов «ДНК-сорб» (ЗАО «Интерлабсервис»). Отобранный рекомбинантный вариант W-GMCSF-S1/3 дважды реклонировали, нарабатывали на монослое клеток CV-1 и очищали центрифугированием в градиенте плотности с ахарозы (25-40%).
Титр вируса определяли методом бляшек на монослое клеток CV-1, окрашенном фиксирующим раствором кристаллического фиолетового (2 г/л кристаллический фиолетовый, 50 мл/л формальдегид, 100 мл/л этанол, вода). Очищенный рекомбинантный штамм BOB VV-GMCSF-S1/3 с титром 109БОЕ/мл хранится в расфасованном виде при -80°C.
Пример 2. Оценка продукции ГМ-КСФ человека рекомбинантным штаммом BOB VV-GMCSF-S1/3 ГМ-КСФ человека синтезируется в виде белка-предшественника (144 а.о.) с последующим отщеплением сигнального пептида (17 а.о.), таким образом, зрелый полипептид содержит 127 а.о. (14.4 кДа). Показано существование 16-ти различных изоформ ГМ-КСФ человека, продуцируемого в клетках эукариот. Эти изоформы, имеющие различный характер гликозилирования, обуславливают гетерогенность природного ГМ-КСФ и разброс молекулярных масс от 14.4 до 32 кДа.
Монослой клеток CV-1 (90% поверхности), выращенный в культуральном матрасе объемом 650 мл (Greiner), инфицировали рекомбинантным штаммом BOB VV-GMCSF-S1/3 или исходным штаммом ВОВ Л-ИВП с множественностью 1 БОЕ/кл. Инкубировали 24 часа при 37°C в атмосфере 5% CO2, поддерживающую среду (DMEM+2% фетальной бычьей сыворотки (HyClone)) удаляли, клетки разрушали лизирующим буфером (50mM TRIS-HCl pH 7.5, 150 тМ NaCl, 1% Triton Х-100, 5 тМ MgCl2, proteases inhibitor cocktail) в объеме 7 мл, проводили 3 раунда замораживания-оттаивания, затем трехкратную обработку ультразвуком (20 сек при 200-300 W с 10-ти сек охлаждением после каждой обработки), центрифугирование 14000 rpm, 30 мин, 4°C, супернатант анализировали в Western blot анализе с использованием в качестве первичных антител Rabbit anti-human GM-CSF Polyclonal antibody (PerroTech). В качестве вторичных антител - Anti-rabbit IgG (Whole molecu le) alkaline phosphatase conjugate (Sigma). Электрофоретическое разделение белков проводили в камере «BioRad» в 5% концентрирующем и 14% разделяющем акриламидном геле при V=100. Перенос белков с геля осуществляли в камере MiniTrans-Blot cell «BioRad» на мембрану Immun-Blot TMPVDF Membrane for
Protein Blotting 0,2µm при V=100 1 час 20 минут. Затем мембрану промывали буфером для переноса и помещали в блокирующий раствор - TBS pH 7,4 с 5% молоком (Skim Milk Powder, Biochemika, Fluka) на 1 час при комнатной температуре (КТ) на качалке. Отмывали мембрану 3 раза по 5 минут TBS pH 7,4 на качалке и инкубировали 16 часов, при +4°C с первичными антителами в рабочей концентрации 0,2 мкг/мл, в TBS pH 7,4 с 0,1% Tween-20 и 5% молока. После связывания с первичными антителами мембраны отмывали 3 раза по 5 минут TBS pH 7,4 с 0,1% Tween-20 на качалке, затем проводили связывание с вторичными антителами в рабочем разведении 1:5000 в TBS pH 7,4 с 0,1% Tween-20 и 5% молока в течение 1 часа при КТ на качалке. После связывания с конъюгатом отмывали 3 раза по 5 минут TBS pH 7,4 с 0,1% Tween-20 на качалке и 1 раз буфером для субстрата (АР - буфер: 100 mMTris, 100mM NaCl, pH 9,5 с добавлением 50 mM MgCl2). В качестве субстрата использовали BCIP (5-bromo-4-chloro-3-indolyl phosphate) и NBT (NitroBluetetrazolium). Останавливали реакцию промыванием мембраны в дистиллированной воде.
Полученные результаты показывают, что ГМ-КСФ выявляется только в культуральной среде и лизатах клеток CV-1, инфицированных рекомбинантным штаммом W-GMCSF-S1/3 (фиг. 4). В клетках, инфицированных Л-ИВП, ГМ-КСФ не выявляется. В культуральной среде представлена секретированная форма ГМ-КСФ с большим молекулярным весом (фиг. 4, дорожка 1, 25-32 кДа) вследствие более полного гликозилирования, в отличие от внутриклеточного ГМ-КСФ, выявленного в лизатах клеток, где представлен широкий диапазон изоформ ГМ-КСФ (фиг. 4, дорожка 3, 18-32 кДа). В качестве положительного контроля использовали негликозилированную форму ГМ-КСФ, полученную в клетках E.coli (фиг. 4, дорожка 5, 14.4 кДа).
Пример 3. Анализ биологической активности ГМ-КСФ человека, экспрессированного в составе рекомбинантного вируса осповакцины VV-GMCSF-S1/3
Биологическую активность ГМ-КСФ человека, секретируемого из клеток CV-1, инфицированных рекомбинантом W-GMCSF-S1/3, оценивали по уровню стимуляции пролиферации клеток эритролейкоза человека TF-1. Данный тест
основан на способности ГМ-КСФ-зависимых клеток линии TF-1 пролиферировать только в присутствии ГМ-КСФ. Пролиферативную активность оценивали микрометодом на 96-луночных культуральных планшетах (Costar) с использованием реагента ХТТ (Monks, 1991 [18]; Scudiere, 1988 [19]) и культуральной среды ДМЕМ, полученной через 48 часов после заражения клеток CV-1 рекомбинантным VV-GMCSF-S1/3 или контрольным (дикий тип, штамм Л-ИВП) ВОВ. Перед использованием культуральную среду осветляли центрифугированием 10 минут при 5000 об./мин. Для оценки концентрации ГМ-КСФ в культуральной среде использовали очищенный и охарактеризованный препарат рекомбинантного ГМ-КСФ, полученного в клетках E.coli (Гилева, 1997 [20]). Для проведения эксперимента в среде RPMI (Invitrogen) с добавлением 10% фетальной бычьей сыворотки готовили 2-кратные разведения культуральной среды от инфицированных VV-GMCSF-S1/3 клеток CV-1 в диапазоне 1:500 -1:4000 (фиг. 5) или рекомбинантного белка ГМ-КСФ до конечных концентраций 0,1; 1; 2; 4; 8 нг/мл (калибровка). В качестве отрицательного контроля использовали среду RPMI и культуральную среду клеток CV-1, инфицированных исходным штаммом ВОВ Л-ИВП. В лунки 96-луночного планшета вносили 50 мкл вышеуказанных разведений или контрольных образцов и добавляли 50 мкл суспензии клеток TF-1 в среде RPMI с добавлением 10% фетальной бычьей сыворотки по 2×104 клеток/лунка. Планшеты помещали в термостат при температуре 37°C, 5% CO2, влажности 85% и инкубировали 72 часа. После инкубации в каждую тестируемую лунку добавляли 50 мкл реагента ХТТ (Sigma) и PMS (Fluka), который получали добавлением к рабочему раствору с содержанием ХТТ 1 мг/мл раствора PMS 1,25 мМ из расчета: на каждый мл ХТТ - 20 мкл PMS. Планшет инкубировали еще 4 часа и определяли оптическую плотность ОП490/620 на планшетном спектрофотометре SpectraCount (Packard). Каждую точку делали в пяти повторностях, определяли среднее значение и дисперсию для различных концентраций культуральной среды и очищенного рекомбинантного белка ГМ-КСФ, строили гистограмму зависимости ОП от разведений и концентрации. Стимуляцию пролиферации TF-1 клеток рассчитывали в процентах по отношению к контролю. За 100% принимали
количество живых клеток в отрицательном контроле. Из фиг. 5 следует, что пролиферативная активность культуральной среды от инфицированных VV-GMCSF-S1/3 клеток CV-1 соответствует концентрации 40 мкг/мл калибровочного белка ГМ-КСФ.
Таким образом, вышеизложенные результаты (примеры 1-3) подтверждают достижение заявляемого технического результата, а именно: создан рекомбинантный штамм BOB VV-GMCSF-S1/3, продуцирующий секретируемый биологически активный ГМ-КСФ человека в клетках млекопитающих на уровне 40 мкг на мл культуральной среды.
Источники научно-технической и патентной информации
1) КАК ЭТО БЫЛО: программа глобальной ликвидации оспы в воспоминаниях ее участников. // Под ред. С.С. Маренниковой. - ЦЭРИС, Новосибирск, 2011. - 276 с.
2) Маренникова С.С, Щелкунов С.Н. Патогенные для человека ортопоксвирусы. // М.: КМК Scientific Press Ltd. - 1998. - 386 с.
3) Максютов Р.А. и др. Разработка современных противооспенных вакцин. // Вопросы вирусологии. - 2011. - Т. 56. - №6. - С.4-8.
4) Серпинский О.И. и др. 1996. Конструирование рекомбинантных вариантов ортопоксвирусов путем встройки чужеродных генов в межгенный промежуток вирусного генома. // Молекуляр. биология. - 1996. - №30. - С.1064-1073.
5) Щелкунов С.Н. Генетическая инженерия. // Сибирское университетское издательство, Новосибирск. - 2010. - 514 с.
6) Кочнева Г.В. и др. Онколитические поксвирусы. // Молекулярная генетика, микробиология и вирусология. - 2012. - №1 - С.8-15.
7) Weisbart R.H. et al. Human granulocyt-macrophage colony-stimulating factor is a neutrophil activator. // Nature. - 1985. - Vol.314. - P. 361-363.
8) Fleischmann J. et al. Granulocyte-macrophage colony-stimulating factor enhances phagocytosis of bacteria by human neutrophils. // Blood. - 1986. - V. 68(3) - P. 708-711.
9) Kushner B.H et al. GM-CSF enhances 3F8 monoclonal antibody-dependent cellular cytoxicity against human melanoma and neuroblastoma. // Blood. - 1989. - V. 73(7) - P. 1936-1941.
10) Kim J.H. et al. Systemic armed oncolytic and immunologic therapy for cancer with JX-594, a targeted poxvirus expressing GM-CSF. // Molecular Therapy. - 2006. - V. 14. - P. 361-370.
11) Thorne S. et al. Rational strain selection and engineering creates a broad-spectrum, systemically effective oncolytic poxvirus, JX-963. // J. Clin. Invest. - 2007. - V. 117. - P. 3350-3358.
12) Kirn D. Oncolytic vaccinia virus cancer therapy // U.S.A. Patent # 2010/0303714 A1 - 2010.
13) Cochran M.A. et al. In vitro mutagenesis of the promoter region for a vaccinia virus gene: evidence for tandem early and late regulatory signals. // J. Virol. - 1985. - V. 54(1). - P. 30-37.
14) Breitbach C. et al. Intravenous delivery of a multi-mechanistic cancer-targeted oncolytic poxvirus in humans. // Nature. - 2011. - V. 477. - P. 99-102.
15) Mastrangelo M.J. et al. Method of inducing an immune response using vaccinia virus recombinants encoding GM-CSF. // USA Patent #6,093,700. - 2000 (прототип).
16)Мarato R. et al. The oncolytic poxvirus JX-594 selectively replicates in and destroys cancer cells driven by genetic pathways commonly activated in cancers. // Molecular Therapy. - 2012. - V. 20. - P. 749-758.
17) Damon I. Poxviridae. In: Knipe D. M. and Howley P. M. Fields Virology. 5th ed. // Lippincott Williams and Wilkins, Philidelphia. - 2007. - P. 2948-2974.
18) Monks A. et al. Feasibility of a High-Flux Anticancer Drug Screen Using a Diverse Panel of Cultured Human Tumor Cell Lines // Journal of the National Cancer Institute. - 1991. - V. 83. N 11. - P. 757-766.
19) Scudiere D.A. et al. Evaluation of a Soluble Tetrazolium/Formazan Assay for Cell Growth and Drug Sensitivity in Culture Using Human and Other Tumor Cell Lines. // Cancer Research. - 1988. - V. 48. - P. 4827-4833.
20) Гилева И.П. и др. Рекомбинантная плазмидная ДНК p280GM, кодирующая полипептид со свойствами гранулоцитарно-макрофагального колониестимулирующего фактора человека, и штамм E.coli SG 20050/p280GM - продуцент полипептида со свойствами гранулоцитарно-макрофагального колониестимулирующего фактора человека. // ПатентРФ 2091488, опубликован 27.09.1997, бюл. №27.
Рекомбинантный штамм VV-GMCSF-S1/3, сконструированный на основе штамма Л-ИВП вируса осповакцины, содержащий встройку гена гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) человека, структура которого соответствует кДНК матричной РНК ГМ-КСФ человека, представленной в GenBank под номером Ml 1220.1, в центральной части гена вирусной тимидинкиназы между позициями 83665 и 83696 п.н. (GenBank DQ 121394); ген ГМ-КСФ человека экспрессируется под контролем природного промотора р7.5К вируса осповакцины и продуцирует секретируемую форму биологически активного ГМ-КСФ человека в клетках млекопитающих на уровне 40 мкг на мл культуральной среды; штамм VV-GMCSF-S1/3 депонирован в Государственной коллекции Роспотребнадзора возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-631.