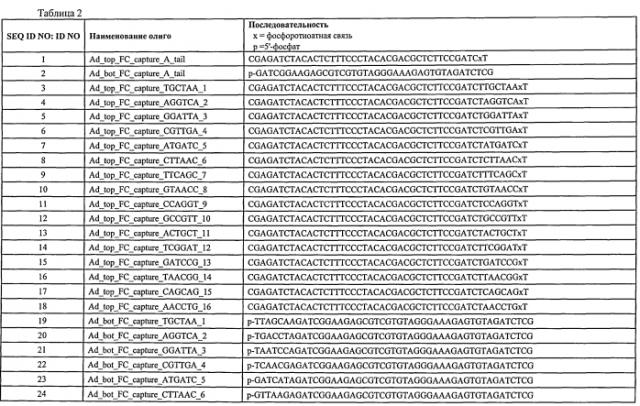
Прямой захват, амплификация и секвенирование днк-мишени с использованием иммобилизированных праймеров
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу захвата и амплификации избранной последовательности и набору для его осуществления. Способ включает получение субстрата, представленного твердофазной подложкой, содержащего первую и вторую популяции связанных с поверхностью олигонуклеотидов, где данные олигонуклеотиды распределены случайным образом относительно друг друга на субстрате. Гибридизируют первый член первой популяции с синтетическим олигонуклеотидом отбора, содержащим участок, который гибридизируется с первым членом, и участок, который содержит геномную последовательность. Удлиняют первый член первой популяции для получения дуплекса, который содержит связанный с подложкой праймер отбора, содержащий последовательность, комплементарную геномной последовательности. Удаляют олигонуклеотид отбора путем денатурации, оставив удлиненный, связанный с подложкой праймер отбора. Гибридизируют связанный с подложкой праймер отбора с фрагментированным геномом, содержащим фрагмент нуклеиновой кислоты, включающий геномную последовательность. Удлиняют связанный с подложкой праймер отбора для получения продукта удлинения, который содержит последовательность, комплементарную фланкирующей последовательности, где фланкирующая последовательность фланкирует геномную последовательность. Амплифицируют геномный продукт на субстрате с помощью мостиковой ПЦР с использованием неудлиненных членов первой и второй популяции связанных с поверхностью олигонуклеотидов, для получения продукта ПЦР. Предложенное изобретение позволяет осуществить обогащение мишени непосредственно на субстрате, используемом для секвенирования. 2 н. и 17 з.п. ф-лы, 18 ил., 4 табл., 1 пр.
Реферат
Перекрестная ссылка
Данная заявка претендует на приоритет предварительной заявки на патент США номер 61/386390, поданной 24 сентября 2010 года, и номер 61/485062, поданной 11 мая 2011 года, каковые заявки полностью включены в настоящий документ во всей полноте
Права правительства
Данное изобретение выполнено при поддержке Правительства на основании контракта HG000205, полученного от Национального Института Здоровья. Правительство имеет определенные права на данное изобретение.
Уровень техники
Во многих способах секвенирования, в частности, в способах ре-секвенирования (т.е., способах, в которых локус повторно секвенируется), мишень вначале захватывается, а потом секвенируется. Было разработано несколько методологий направленного захвата и внедрено в высокоэффективные системы секвенирования. В частности, для захвата ДНК-мишени могут применяться методы, основанные на гибридизации, использующие шарики или микроматрицы, и технологии, базирующиеся на растворах, использующих молекулярные инверсионные зонды или геномные циркуляризационные олигонуклеотиды. Захваченная ДНК затем готовится для секвенирования. Для приготовления обогащенного образца ДНК часто используются сложные молекулярно-биологические протоколы и в определенных случаях получение библиотеки секвенирования включает много ферментных реакций, этапов очистки и отбора по размеру при помощи гель-электрофореза. Процесс подготовки образца для секвенирования захваченной ДНК-мишени может быть трудоемким и последующие манипуляции с образцом могут вызвать отклонения в составе ДНК и повысить уровень ошибки секвенирования.
Сущность изобретения
Здесь предоставляются способы для захвата и амплификации фрагмента нуклеиновой кислоты, например, фрагмента генома или кДНК, приготовленной из РНК. Также предоставляются наборы для осуществления способа на практике. В определенных вариантах воплощения способ включает: а) получение субстрата, содержащего первую популяцию связанных с поверхностью олигонуклеотидов, и вторую популяцию связанных с поверхностью олигонуклеотидов, где члены первой и второй популяций связанных с поверхностью олигонуклеотидов пространственно не направлены на субстрат; б) гибридизацию первого члена первой популяции связанных с поверхностью олигонуклеотидов с олигонуклеотидом отбора, включающим участок, который гибридизируется с первым членом, и участок, который содержит геномную последовательность, в) удлинение первого члена первой популяции связанных с поверхностью олигонуклеотидов для получения связанного с подложкой праймера отбора, который содержит последовательность, комплементарную геномной последовательности; г) гибридизацию связанного с подложкой праймера отбора с фрагментом нуклеиновой кислоты (например, с геномным фрагментом или кДНК), содержащим геномную последовательность; д) удлинение связанного с подложкой праймера отбора для получения продукта удлинения, который содержит последовательность, которая фланкирует геномную последовательность, например, в геноме; е) амплификацию продукта удлинения на субстрате, например, путем мостиковой ПЦР с использованием неудлиненных членов первой и второй популяций связанных с поверхностью олигонуклеотидов для получения продукта ПЦР.
В определенных вариантах воплощения способ включает: а) получение субстрата, содержащего первую популяцию связанных с поверхностью олигонуклеотидов и вторую популяцию связанных с поверхностью олигонуклеотидов, где первая и вторая популяции связанных с поверхностью олигонуклеотидов пространственно не направлены на субстрат; б) гибридизацию первого члена первой популяции связанных с поверхностью олигонуклеотидов с олигонуклеотидом отбора, содержащим участок, который гибридизируется с первым членом, и участок, который содержит геномную последовательность; в) удлинение первого члена первой популяции связанных с поверхностью олигонуклеотидов для получения связанного с подложкой праймера отбора, который содержит последовательность, которая комплементарна геномной последовательности; г) гибридизацию связанного с подложкой праймера отбора с фрагментом нуклеиновой кислоты, содержащим геномную последовательность; д) удлинение связанного с подложкой праймера отбора для получения продукта удлинения, который содержит последовательность, которая фланкирует геномную последовательность, например, в геноме; и е) амплификацию продукта удлинения, например, используя мостиковую ПЦР на субстрате для получения продукта ПЦР.
В зависимости от того, как выполняется способ, адаптер может быть лигирован либо к геномному фрагменту перед гибридизацией, либо к продукту удлинения после того, как связанный с подложкой праймер отбора будет удлинен. Дистальный адаптер может гибридизироваться со связанным с поверхностью олигонуклеотидом (который сам по себе может быть продуктом удлинения, получаемым путем матричного удлинения второй популяции связанных с поверхностью олигонуклеотидов), тем самым обеспечивая проведение мостиковой ПЦР. Праймер отбора может также содержать связывающий сайт праймера секвенирования, который может быть применен для секвенирования продукта ПЦР.
Описываемый выше способ находит применение в способах ре-секвенирования, в которых доступна последовательность референсного локуса, и тот же локус следует ре-секвенировать во множестве тестовых образцов. В этом применении создается олигонуклеотид отбора для гибридизации с олигонуклеотидом на субстрате, и участок, который фланкирует локус, который следует ресеквенировать. Этот локус захватывается на субстрате и затем амплифицируется перед секвенированием. Например, единичный локус или множественные различные локусы (например, до 10, 50, 100, 200 или 1000 или более локусов) могут быть захвачены из образца, который получен от одного индивидуума или от множества индивидуумов (например, до 10, 50, 100, 200 или 1000 или более индивидуумов).
В определенных вариантах воплощения способ включает: а) получение субстрата, содержащего первую популяцию связанных с поверхностью олигонуклеотидов и вторую популяцию связанных с поверхностью олигонуклеотидов, где первая и вторая популяции связанных с поверхностью олигонуклеотидов случайным образом рассеяны на субстрате и пространственно не направлены; б) гибридизацию первого члена первой популяции связанных с поверхностью олигонуклеотидов с олигонуклеотидом отбора, содержащим участок, который гибридизируется с первым членом, и участок, который содержит геномную последовательность; в) удлинение первого члена первой популяции связанных с поверхностью олигонуклеотидов для получения связанного с подложкой праймера отбора, который содержит последовательность, комплементарную геномной последовательности; г) гибридизацию связанного с подложкой праймера отбора с пришитым к адаптеру фрагментом (например, с пришитым к адаптеру геномным фрагментом), содержащим геномную последовательность; д) удлинение связанного с подложкой праймера отбора для получения продукта, содержащего последовательность, которая фланкирует геномную последовательность (например, в геноме), и последовательность адаптера, лигированного с адаптером геномного фрагмента; и е) амплификацию продукта с использованием мостиковой ПЦР для получения продукта ПЦР.
В альтернативных вариантах воплощения способ может включать: а) получение субстрата, содержащего первую популяцию связанных с поверхностью олигонуклеотидов и вторую популяцию связанных с поверхностью олигонуклеотидов, где первая и вторая популяции связанных с поверхностью олигонуклеотидов случайным образом рассеяны на субстрате и пространственно не направлены; б) гибридизацию первого члена первой популяции связанных с поверхностью олигонуклеотидов с олигонуклеотидом отбора, содержащим участок, который гибридизируется с первым членом, и участок, который содержит геномную последовательность; в) удлинение первого члена первой популяции связанных с поверхностью олигонуклеотидов для получения связанного с подложкой праймера отбора, который содержит последовательность, комплементарную геномной последовательности; г) удлинение связанного с подложкой праймера отбора для получения продукта, который содержит последовательность, которая фланкирует геномную последовательность; д) лигирование двуцепочечного адаптера с продуктом для получения продукта, модифицированного адаптером; и е) амплификацию продукта, модифицированного адаптером, с использованием мостиковой ПЦР для получения продукта ПЦР.
В конкретных случаях способ далее может включать: i. лигирование геномных фрагментов с адаптером, который содержит сайт для праймера секвенирования и нуклеотидную последовательность, такую же, как и вторые связанные с поверхностью олигонуклеотиды, ii. гибридизацию дотированных с адаптером геномных фрагментов с первым членом первой популяции связанных с поверхностью олигонуклеотидов, ii. удлинение первого члена первой популяции связанных с поверхностью олигонуклеотидов, с которыми гибридизируется лигированный с адаптером фрагмент; и iv. гибридизацию содержащего адаптер конца продукта удлинения со вторым связанным с подложкой полинуклеотидом, тем самым создавая мостик и способствуя мостиковой ПЦР.
Краткое описание фигур
Определенные аспекты следующего детального описания лучше всего воспринимаются, если их читать вместе с сопутствующими иллюстрациями. Подчеркивается, что исходя из общепринятой практики, различные характеристики иллюстрации не предназначены для масштабирования. С другой стороны, направления различных характеристик произвольно расширены или уменьшены для ясности. Иллюстрации включают следующие фигуры:
Фиг.1. Обзор одного из вариантов воплощения рассматриваемого способа, называемого «OS-Seq» (олигонуклеотид-селективного секвенирования). (a) OS-Seq является способом направленного ре-секвенирования, который органично интегрирован в платформу Illumina NGS (Next Generation Sequencing - секвенирование нового поколения). Для этого способа нужны мишень-специфические олигонуклеотиды, библиотека секвенирования и набор Illumina для создания кластеров. Захват мишеней, процессинг и секвенирование выполняются на системе NGS. Данные, получаемые от каждого праймера-зонда, являются намеченнымии специфическими для цепи. Здесь показан медианный профиль покрытия для OS-Seq-366. (b) Процессинг OS-Seq включает три этапа: гибридизацию, удлинение, опосредованное ДНК-полимеразой, и денатурацию ДНК. Этап 1; Используются мишень-специфические олигонуклеотиды для преобразования праймеров проточной ячейки в праймеры-зонды. В системе секвенирования Illumina два типа праймеров (названные С и D) иммобилизированы на проточной ячейке со спаренными концами. В OS-Seq подгруппа D праймеров модифицируется до праймеров-зондов с использованием комплексной библиотеки олигонуклеотидов. Олигонуклеотиды имеют последовательности, которые гибридизируются с праймерами проточной ячейки D типа. Гибридизированные олигонуклеотиды затем используются в качестве матрицы для ДНК полимеразы, и D праймеры удлиняются. После денатурации мишень-специфические праймеры-зонды случайным образом иммобилизируются на проточной ячейке. Этап 2: Геномные мишени в одноадаптерной библиотеке захватываются с применением праймеров-зондов. Подготовка образца для секвенирования для Illumina включает добавление специфических ДНК адаптеров к фрагментам геномной ДНК. Эти адаптеры содержат в себе сайты для секвенирующих праймеров и для иммобилизированных праймеров проточной ячейки. В OS-Seq мы используем модифицированный адаптер для приготовления одноадапторных библиотек из геномной ДНК. Мишени в одноадаптерной библиотеке захватываются во время гибридизации в условиях высокого нагрева своими комплементарными праймерами-зондами. Захваченные фрагменты одноадаптерной библиотеки используются в качестве матрицы для ДНК полимеразы, и праймеры-зонды удлиняются. Денатурация высвобождает ДНК матрицы из иммобилизированных мишеней. Этап 3: Иммобилизированные мишени становятся совместимыми с секвенированием Illumina. При секвенировании Illumina требуется твердофазная амплификация фрагментов иммобилизированной библиотеки секвенирования с использованием праймеров С и D. В OS-Seq во время гибридизации в условиях низкого нагрева хвосты одиночных адаптеров иммобилизованных мишеней гибридизируются с праймерами С типа на поверхности проточной ячейки, что стабилизирует мостиковую структуру. 3' концы иммобилизированных мишеней и С праймеры удлиняются с использованием ДНК полимеразы. После денатурации формируются два комплементарных иммобилизированных фрагмента библиотеки секвенирования, содержащие полные примирующие сайты С и D, и они совместимы с твердофазной амплификацией. После этих трех этапов OS-Seq иммобилизированные мишени структурно идентичны по отношению к стандартной библиотеке со спаренными концами Illumina, и они амплифицируются и далее обрабатываются с использованием стандартных наборов и протоколов Illumina. Принципы данного способа могут быть применены и с другими секвенирующими платформами, (с) Показан профиль покрытия вдоль гена KRAS из анализа OS-Seq-366. На оси x представлены положения оснований по отношению к началу экзона 1 и указаны экзоны KRAS. (d) Оценка однородности выходов у праймер-зонд нуклеотидов, синтезированных на колонке и на матрице. Однородность захвата сравнивалась между олигонуклеотидами, синтезированными на колонке (синим цветом, n=366), и олигонуклеотидами, синтезированными на матрице (красным цветом, n=11742). На оси x олигонуклеотиды рассортированы по выходу захваченных последовательностей, на оси y - нормализованный выход праймера-зонда. Для расчета нормализованного выхода каждый выход олигонуклеотида делился на средний выход от всех олигонуклеотидов.
Фиг.2: Подготовка библиотеки секвенирования для OS-Seq. Общая схема фрагментации геномной ДНК, восстановления концов, наращивание А-«хвоста» (добавление липких 3'-А концов ДНК). В приготовлении библиотек OS-Seq использовалось лигирование адаптера и ПЦР.
Фиг.3. Разработка стратегий для OS-Seq. (а) Праймеры-зонды были помещены на расстоянии 10 оснований от экзона или (b) покрывали каждые 500 оснований внутри больших экзонов.
Фиг.4. Генерирование OS-Seq олигонуклеотидов. Колоночный синтез дал в результате большое количество зрелых 101-мерных OS-Seq олигонуклеотидов, которые были готовы для применения в анализе. Микроматричный синтез был применен для наработки пулов с высоким содержанием олигонуклеотидов. Олигонуклеотиды - предшественники были амплифицированы с использованием праймеров, которые вводили дополнительные последовательности в олигонуклеотиды. Было применено вырезание урацила для отщепления сайта амплификации праймера от кодирующих цепей OS-seq олигонуклеотидов.
Фиг.5. Структуры олигонуклеотидных компонентов в OS-Seq. (а) Зрелые 101-мерные OS-Seq олигонуклеотиды содержали мишень-специфический сайт и последовательности, кодирующие секвенирующий праймер 2 и праймер проточной ячейки «D». (b) Олигонуклеотиды, полученные путем микроматричного синтеза, были амплифицированы с использованием праймеров, которые вводили Урацил на 5' конце OS-Seq олигонуклеотида и дополнительные активные сайты для секвенирования. (с) Адаптер для OS-Seq содержал выступающий конец - Т (липкий конец ДНК) для лигирования липкого конца ДНК с геномными фрагментами, содержащими А-«хвост». В дополнение, в адаптере двуцепочечной ДНК (дцДНК) присутствовала индексирующая последовательность наряду с праймером «С» проточной ячейки.
Фиг.6. Описания распределений размера вставки, встречающихся в данных OS-Seq. Фрагментирование геномной ДНК дает фрагменты между 200 и 2кб. Приготовление библиотеки секвенирования добавляет одинаковый адаптер к концам фрагментов. ПЦР амплификация искажает распределение размера фрагмента. Сайты-мишени случайным образом распределены среди фрагментов одноадаптерной библиотеки. Фрагменты библиотеки были иммобилизированы на проточной ячейке и расстояние между праймером-зондом и адаптером определяло размер вставки геномной ДНК. Для амплификации иммобилизированной ДНК-мишени применена мостиковая ПЦР (в общем, твердофазная ПЦР предпочтительно амплифицирует более короткие фрагменты). После кластерной амплификации и процессинга иммобилизированные фрагменты секвенируются с использованием двух сайтов. Считывание 1 начинается с геномной ДНК и Считывание 2 начинается с синтетических праймеров-зондов. Считывание 1 используется для оценки последовательности геномной ДНК из данных OS-Seq.
Фиг.7. Воспроизводимость OS-Seq. (а) Техническая воспроизводимость OS-Seq. Были проанализированы две идентичные библиотеки с использованием OS-Seq. Итоги секвенирования отдельных праймеров-зондов сравнивались среди технических реплик. (b) Биологическая воспроизводимость OS-Seq. Были приготовлены две различные библиотеки геномной ДНК с использованием индексированных адаптеров. Библиотеки были проанализировали в одном и том же эксперименте OS-Seq. На фигуре итоги специфического захвата праймера-зонда сравниваются среди двух независимых биологических реплик.
Фиг.8А-В. Влияние содержания ГЦ на выход таргетинга. Для анализа воздействия содержания ГЦ на эффективность праймеров-зондов мы определяли содержание ГЦ у каждой мишень-специфической последовательности праймера-зонда. Мы классифицировали праймеры-зонды, которые потерпели неудачу (захватили 0 мишеней). Пропорции потерпевших неудачу праймеров-зондов сравнивались между категориями, различными по процентному содержанию ГЦ. Ось Х представляет процентный состав рассортированных по ГЦ категорий, и ось У показывает пропорцию потерпевших неудачу праймеров-зондов в каждой категории содержания ГЦ.
Фиг.9А-В. Сравнение хода работ по процессингу между OS-Seq и стохастическими способами создания библиотек.
Определения
Если только в этом документе не определено иным образом, все технические и научные термины, используемые в данном документе, имеют то же значение, что и обыкновенно понимается обычным специалистом в области техники, к которой относится данное изобретение. Хотя на практики или при тестировании настоящего изобретения могут использоваться любые способы и материалы, схожие или эквивалентные тем, которые описаны в данном документе, здесь приводятся предпочтительные способы и материалы.
Все патенты и публикации, включая все последовательности, раскрываемые в таких патентах и публикациях, упоминаемых здесь, явным образом включены в данный документ посредством ссылки.
Числовые диапазоны охватывают числа, определяющие диапазон. Если не указано иным образом, нуклеиновые кислоты пишутся слева направо в ориентации от 5' до 3'; аминокислотные последовательности пишутся слева направо, соответственно, в ориентации от амино до карбокси.
Предоставленные здесь заголовки не являются ограничениями различных аспектов или вариантов воплощения изобретения. Соответственно, термины, определенные непосредственно ниже, более полно определяются посредством ссылки на описание в целом.
Если не определено иным образом, все технические и научные термины, используемые в данном документе, имеют то же значение, что и обыкновенно понимается обычным специалистом в области техники, к которой относится данное изобретение. Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994), и Hale & Markham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, N.Y. (1991) предоставляют специалисту общее значение многих терминов, используемых в данном документе. Тем не менее, некоторые термины определятся ниже для полной ясности и удобства ссылки.
Термин «образец» в данном контексте относится к материалу или смеси материалов, как правило, хотя не обязательно, в жидкой форме, содержащему один или более искомых анализируемых материалов Используемые здесь анализируемые образцы нуклеиновой кислоты могут быть комплексом, в этом они содержат множественные различные молекулы, которые содержат последовательности. Фрагментированная геномная ДНК или кДНК, полученная из мРНК млекопитающих (например, мыши или человека), являются типичными представителями комплексных образцов. Комплексные образцы могут иметь более чем 104, 105, 106 или 107 различных молекул нуклеиновой кислоты. Мишень ДНК может происходить из любого источника, такого, как геномная ДНК, кДНК (или РНК) или искусственных ДНК конструктов. Любой образец, содержащий нуклеиновую кислоту, например, геномную ДНК, приготовленную из клеток культуры тканей, образца ткани или фиксированных образцов ткани, заключенных в парафин (FRET), могут быть использованы здесь.
Термин «нуклеотид», как подразумевается, включает те функциональные группы, которые содержат не только известные пуриновые и пиримидиновые основания, но также и другие гетероциклические основания, которые подверглись модификации. Такие модификации включают метилированные пурины или пиримидины, ацилированные пурины или пиримидины, алкилированные рибозы или другие гетероциклы. В дополнение, термин «нуклеотид» включает те функциональные группы, которые содержат гаптен или флуоресцентные метки, и могут содержать не только обычные сахара рибозу и дезоксирибозу, но также и другие сахара. Модифицированные нуклеозиды или нуклеотиды также включают модификации сахарной функциональной группы, например, когда одна или более из гидроксильных групп заменены атомами галогенов или алифатическими группами, функционализированы в качестве эфиров, аминов или подобных.
Термин «нуклеиновая кислота» и «полинуклеотид» в данном документе используются взаимозаменяемо для описания полимера любой длины, например, большего чем, приблизительно, 2 основания, большего чем, приблизительно, 10 оснований, большего чем, приблизительно, 100 оснований, большего чем, приблизительно, 500 оснований, большего чем 1000 оснований, вплоть до, приблизительно, 10000 или более оснований, состоящего из нуклеотидов, например, дезоксирибонуклеотидов или рибонуклеотидов, и может быть получен ферментативным путем или синтетически (например, ПНА (пептид-нуклеиновая кислота), как описано в U.S. Patent No. 5948902 и в цитированных там ссылках), который может гибридизироваться со встречающимися в природе нуклеиновыми кислотами в соответствии с последовательностями аналогично тому, как это происходит с двумя встречающимися в природе нуклеиновыми кислотами, например, может участвовать во взаимодействиях образования пар оснований Уотсона-Крика. Встречающиеся в природе нуклеотиды включают гуанин, цитозин, аденин и тимин (соответственно, Г, Ц, А и Т).
Термин «образец нуклеиновой кислоты» в данном контексте обозначает образец, содержащий нуклеиновые кислоты.
Термин «полинуклеотид-мишень» в данном контексте относится к искомому изучаемому полинуклеотиду. В определенных вариантах воплощения полинуклеотид-мишень содержит одну или более искомых изучаемых последовательностей.
Термин «олигонуклеотид» в данном контексте обозначает одноцепочечный мультимер нуклеотида от 2 до 200 нуклеотидов, до 500 нуклеотидов в длину. Олигонуклеотиды могут быть синтетическими, или могут быть получены ферментативным путем и, в некоторых вариантах воплощения, составляют от 30 до 150 нуклеотидов в длину. Олигонуклеотиды могут содержать рибонуклеотидные мономеры (т.е., могут быть олигорибонуклеотидами) или дезоксирибонуклеотидные мономеры. Олигонуклеотид может быть в длину, например, от 10 до 20, от 11 до 30, от 31 до 40, от 41 до 50, 51-60, от 61 до 70, от 71 до 80, от 80 до 100, от 100 до 150 или от 150 до 200 нуклеотидов.
Термин «гибридизация» относится к процессу, при помощи которого цепь нуклеиновой кислоты соединяется с комплементарной цепью путем спаривания оснований, как это известно в данной области техники. Нуклеиновая кислота, как считается, является «селективно гибридизируемой» с последовательностями референсной нуклеиновой кислоты, если две нуклеиновые кислоты специфически гибридизируются одна с другой в условиях гибридизации и отмывания от умеренно жестких до жестких. Условия гибридизации от умеренно жестких до жестких известны (см., например, Ausubel, et al., Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons 1995 и Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Edition, 2001 Cold Spring Harbor, N.Y.). Один пример жеских условий гибридизации включает гибридизацию при, приблизительно, 42°C в 50% формамиде, 5Х SSC (раствор цитрата и хлорида натрия), 5Х растворе Денхардта, 0,5% SDS (додецил сульфат натрия) и 100 мкг/мл денатурированной ДНК-носителя с последующим двукратным отмыванием в 2Х SSC и 0,5% SDS при комнатной температуре и еще два раза в 0,1 Х SSC и 0,5% SDS при 42°С.
Термин «двойная спираль» или «соединенный в виде двойной спирали» в данном контексте описывает два комплементарных полинуклеотида, спаренных по основаниям, т.е., сгибридизированных вместе.
Термин «амплификация» в данном контексте относится к созданию одной или более копий нуклеиновой кислоты-мишени с использованием в качестве матрицы нуклеиновой кислоты-мишени.
Термины «установление», «измерение», «определение», «оценка», «испытание» и «анализирование» в данном документе используются взаимозаменяемо для отсылки к любой форме измерения и включают определение того, присутствует ли этот элемент или нет. Эти термины включают оба - количественные и/или качественные определения. Оценка может быть относительной или абсолютной. «Оценка наличия» включает определение присутствующего количества чего-либо, наряду с определением того, присутствует ли это или отсутствует.
Термин «применение» имеет свое традиционное значение и, как таковой, означает использование, например, ввод в действие, способа или композиции для достижения цели. Например, если для создания файла используется программа, программа выполняется для создания файла, файл обычно является продуктом программы. В другом примере, если используется компьютерный файл, к нему обычно получают доступ, его читают и информацию, хранящуюся в файле, используют для достижения цели. Сходным образом, если используется уникальный идентификатор, например, штрих-код, этот уникальный идентификатор обычно считывается для идентификации, например, объекта или файла, связанного с уникальным идентификатором.
В данном контексте, термин «Tm» относится к температуре плавления двойной спирали олигонуклеотидов, при которой половина двойных спиралей остается загибридизированными и половина двойных спиралей диссоциируют на одиночные цепи. Tm двойной спирали олигонуклеотиднов может быть определена экспериментально или предсказана путем использования следующей формулы Tm=81,5+16,6(log10[Na+])+0,41 (фракция Г+Ц) - (60/N), где N - длина цепи и [Na+] менее чем 1 М. См. Sambrook and Russell (2001; Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Press, Cold Spring Harbor N.Y., ch. 10). Существуют другие формулы для предсказания Tm двойных спиралей олигонуклеотидов, и одна формула может быть более или менее подходящей для данного условия или набора условий.
Термин «свободный в растворе» в данном контексте описывает молекулу, такую, как полинуклеотид, которая не связана с другой молекулой или не привязана к другой молекуле.
Термин «денатурация» в данном контексте относится к разделению двойной спирали нуклеиновой кислоты на две одиночные цепи.
Термин «геномная последовательность» в данном контексте относится к последовательности, которая имеет место в геноме. Поскольку РНК транскрибируются из генома, этот термин охватывает последовательность, существующую в ядерном геноме организма, наряду с последовательностями, которые присутствуют в кДНК копиях РНК (например, мРНК), транскрибируемых из такого генома.
Термин «геномный фрагмент» в данном контексте относится к участку генома, например, генома животного или растения, такого как геном человека, обезьяны, крысы, рыбы или насекомого, или растения. Геномный фрагмент может быть и может не быть дотированным с адаптером. Геномный фрагмент может быть адаптер-лигированным (в этом случае он имеет адаптер, дотированный с одним или с обоими концами фрагмента, с, по меньшей мере, 5' концом молекулы) или может не быть адаптер-лигированным.
В определенных случаях олигонуклеотид, используемый в описываемом в данном документе способе, может быть сконструирован с использованием референсного геномного участка, т.е., геномного участка с известной нуклеотидной последовательностью, например, хромосомного участка, последовательность которого депонирована, например, в базе данных Genbank Национального Центра Биотехнологической Информации или в других базах данных. Такой олигонуклеотид может быть применен при анализе, который использует образец, содержащий тестируемый геном, где тестируемый геном содержит связывающий сайт для олигонуклеотида.
Термин «дотирование» в данном контексте относится к катализируемому ферментами соединению концевогонуклеотида на 5' конце первой молекулы ДНК с концевым нуклеотидом на 3' конце второй молекулы ДНК.
Термин «адаптер» относится как к двуцепочечным, так и к одноцепочечным молекулам.
«Множество» содержит, по меньшей мере, 2 члена. В определенных случаях множество может иметь, по меньшей мере, 10, по меньшей мере, 100, по меньшей мере, 100, по меньшей мере, 10000, по меньшей мере, 100000, по меньшей мере, 106, по меньшей мере, 107, по меньшей мере, 108 или, по меньшей мере, 109 или более членов.
Если две нуклеиновые кислоты «комплементарны», каждое основание одной из нуклеиновых кислот образует пару с соответствующими нуклеотидами в другой нуклеиновой кислоте. Термин «комплементарный» и «полностью комплементарный» в данном документе используются в качестве синонимов.
«Сайт связывания праймера» относится к сайту, с которым праймер гибридизируется в олигонуклеотиде или в его комплементарной цепи.
Термин «разделение» в данном контексте относится как к физическому разделению двух элементов (например, по размеру, аффинности, т.п.), так и деградации одного элемента, при этом другой элемент остается интактным.
Термин «секвенирование» в данном контексте относится к способу, при помощи которого определяют тип, по меньшей мере, 10 последовательных нуклеотидов (например, тип, по меньшей мере, 20, по меньшей мере, 50, по меньшей мере, 100 или, по меньшей мере, 200 или более последовательных нуклеотидов) полинуклеотида.
Термин «пространственно не направленный» в контексте субстрата, содержащего связанную с поверхностью популяцию олигонуклеотидов, которые пространственно не направленны, относится к субстрату, содержащему поверхность, содержащую различные олигонуклеотидные молекулы, которые не расположены в определенном порядке или положении по отношению одна к другой, т.е. находятся в случайных положениях или случайным образом рассеяны по отношению одна к другой. Не требуется, чтобы такой субстрат был плоским, и в некоторых случаях он может быть в форме шариков. Субстраты, содержащие пространственно или оптически направленные популяции единичного олигонуклеотида (например, микроматрицы или кодированные шарики, т.п.) исключены из этого определения. Субстрат, содержащий первую популяцию связанных с поверхностью олигонуклеотидов и вторую популяцию связанных с поверхностью олигонуклеотидов, где первая и вторая популяции связанных с поверхностью олигонуклеотидов пространственно не направлены, относится к субстрату, содержащему, по меньшей мере, две популяции различных олигонуклеотидов, которые случайным образом распределены по субстрату. Субстрат может быть, например, плоским или в форме шариков.
Термин «адаптер-лигированный» в данном контексте относится к нуклеиновой кислоте, которая была лигирована с адаптером. Адаптер может быть лигирован к 5' концу или к 3' концу молекулы нуклеиновой кислоты.
Термин «удлинение» в данном контексте относится к удлинению праймера путем добавления нуклеотидов с использованием полимеразы. Если праймер, который отжигается к нуклеиновой кислоте, удлиняется, нуклеиновая кислота действует в качестве матрицы для реакции удлинения.
Термин «мостиковая ПЦР» относится к твердофазной полимеразной цепной реакции, при которой праймеры, которые удлиняются в реакции, присоединяются к субстрату своими 5' концами. Во время амплификации ампликоны формируют мостик между присоединенными праймерами. Мостиковая ПЦР (которая также может называться «кластерной ПЦР») используется в платформе Illumina Solexa. Мостиковая ПЦР и платформа Illumina Solexa, в основном, описаны в разнообразных публикациях например, Gudmundsson et al (Nat. Genet. 2009 41:1122-6), Out et al (Hum. Mutat. 2009 30:1703-12) и Turner (Nat. Methods 2009 6:315-6), US patent 7115400, и публикации заявок №№. US20080160580 и US20080286795.
Термин «штрих-код последовательность» в данном контексте относится к уникальной последовательности нуклеотидов, которая используется для идентификации и/или прослеживания источника полинуклеотида в реакции. Штрих-код последовательность может быть на 5'-конце или на 3'-конце олигонуклеотида. Штрих-код последовательности могут широко варьировать по размеру и составу, и последующие ссылки предоставляют руководство для отбора наборов штрих-код последовательностей для конкретных вариантов воплощения: Brenner, U.S. Pat. No. 5635400; Brenner et al, Proc. Natl. Acad. Sci., 97: 1665-1670 (2000); Shoemaker et al, Nature Genetics, 14: 450-456 (1996); Morris et al, European patent publication 0799897A1; Wallace, U.S. Pat. No. 5981179; и подобные. В конкретных вариантах воплощения штрих-код последовательность может иметь длину в диапазоне от 4 до 36 нуклеотидов, или от 6 до 30 нуклеотидов, или от 8 до 20 нуклеотидов.
Другие определения терминов могут появляться по всему описанию.
Подробное описание примерных вариантов воплощения
Определенные признаки рассматриваемого способа, описаны с отсылкой на Фиг.1, которая иллюстрирует вариант воплощения, в котором перед гибридизацией фрагмента с субстратом к фрагменту лигируют адаптеры. В альтернативных вариантах воплощения адаптер может быть добавлен позже по протоколу. Этот способ, в общем, включает получение субстрата, который содержит, по меньшей мере, два связанных с поверхностью олигонуклеотида с различающейся последовательностью, которые пространственно рассеяны один от другого. Такие субстраты в настоящее время применяются в технологии секвенирования Solexa Illumina и описаны в разнообразных ссылках, например, US patent no. 7115400 и публикация №№ US20080160580 и US20080286795, которые включены в данное раскрытие посредством ссылки. Некоторые из вариантов воплощения, изложенные ниже, могут описывать применение способа для изолирования фрагментов генома. Эти варианты воплощения могут быть легко адаптированы к другим типам последовательностей, например, кДНК или синтетической ДНК.
В определенных вариантах воплощения первый член первой популяции связанных с поверхностью олигонуклеотидов гибридизируется с олигонуклеотидом отбора, который содержит а) участок, который гибридизируется с первым членом, и участок, сайт праймера секвенирования и б) участок, который содержит геномную последовательность-мишень. Количество олигонуклеотида отбора, используемого на этом этапе, может быть оптимизировано таким образом, что достаточное количество олигонуклеотидов первой популяции остаются негибридизированными с олигонуклеотидом отбора и доступными для использования на этапе мостиковой ПЦР, который происходит позже по протоколу. Первый член первой популяции связанных с поверхностью олигонуклеотидов удлиняется для получения двойной спирали, которая содержит связанный с подложкой праймер отбора, который содержит последовательность, комплементарную. геномной последовательности-мишени. Олигонуклеотид отбора удаляется денатурацией, чтобы оставить удлиненный, связанный с подложкой праймер отбора. Удлиненный, связанный с подложкой праймер отбора затем гибридизируется с адаптер-лигированным геномным фрагментом (который может быть получен путем фрагментирования геномной ДНК, химическим, физическим путем или путем использования фермента, и затем лигированием адаптеров с концами полученных в результате фрагментов), содержащим геномную последовательность-мишень, последовательность, которая фланкирует геномную последовательность-мишень, и адаптерную последовательность на 5' конце одной из цепей или обеих цепей. Связанный с подложкой праймер отбора удлиняется