Штамм бактериофага citrobacter freundii cf17, способный лизировать патогенные штаммы citrobacter freundii
Иллюстрации
Показать всеИзобретение относится к микробиологии и касается штамма бактериофага Citrobacter freundii, способного лизировать патогенные штаммы Citrobacter freundii и содержащего ген, кодирующий рибонуклеотидредуктазу III. Предложенный штамм бактериофага выделен из клинического образца гнойной раны на культуре бактерий тест-штамма Citrobacter freundii АТСС 8090 и депонирован в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» под номером Ph-1311. Штамм бактериофага обладает литической активностью по отношению к бактериям Citrobacter freundii и пригоден для создания препарата для лечения заболеваний, вызванных указанными бактериями. 4 ил., 5 пр.
Реферат
Изобретение относится к области медицинской микробиологии и касается штамма бактериофага Citrobacter freundii CF17, который может быть использован при создании новых препаратов для лечения заболеваний, вызываемых бактериями Citrobacter freundii.
Представители вида Citrobacter freundii, относящиеся к семейству Entrobacteriaceae, широко распространены в природе, их выделяют из образцов воды, почвы, фекалий животных и человека [1, 2, 3]. Некоторые штаммы входят в состав нормальной микрофлоры кишечника, в то же время представителей вида Citrobacter freundii часто выделяют из клинических образцов, связанных с оппортунистическими инфекциями. Они могут вызывать вспышки гастроэнтеритов и токсикоинфекций, менингиты, заболевания мочевыводящих путей, гнойные внутрибольничные инфекции и даже сепсис у детей и взрослых людей [4, 5, 6]. В общей сложности, патогенные штаммы Citrobacter freundii являются причиной более 25% всех инфекций, поражающих пациентов с иммунодефицитным состоянием [6].
В связи с этим существует необходимость разработки новых препаратов для лечения инфекций, вызванных Citrobacter freundii. В этом плане полезными могут оказаться бактериофаги.
Известен биопрепарат для профилактики и лечения сальмонеллеза животных, содержащий штаммы бактериофагов Phagum Salmonella choleraesuis CS1-ДЕП, и/или Phagum Salmonella choleraesuis CS2-Aen, и/или Phagum Salmonella enteritidis SPZ-1-ДЕП, и/или Phagum Salmonella enteritidis SPZ-2-ДЕП, и/или Phagum Salmonella enteritidis SPZ-3-ДЕП, и/или Phagum Salmonella enteritidis А-1-ДЕП, и/или Salmonella enteritidis F-6-ДЕП, и/или Phagum Salmonella enteritidis ЮН-1-ДЕП, и/или Phagum Salmonella enteritidis ЮН-2-ДЕП, и/или Phagum Salmonella enteritidis С-1-ДЕП, и/или Phagum Salmonella enteritidis Г-1-ДЕП, взятые в эффективном количестве [7]. Недостатком известного биопрепарата является отсутствие в нем соответствующего бактериофага, обладающего способностью лизировать патогенные штаммы Citrobacter freundii.
Известен препарат пиобактериофага поливалентного очищенного, включающий в себя бактериофаги Staphylococcus, Streptococcus, Proteus, Klebsiella, Ε. coli, Pseudomonas aeruginosa [8]. Способ получения пиобактериофага включает культивирование бактерий и бактериофагов Staphylococcus, Streptococcus, Proteus, Klebsiella, E. coli, Pseudomonas aeruginosa в ферментерах с использованием экспоненциально размножающейся бактериальной популяции и с последующим сведением полученных фаголизатов в единый объем.
Недостатком известного препарата является ограниченный спектр активности в отношении бактерий рода Serratia и Enterobacter, связанный с отсутствием в нем соответствующих бактериофагов.
Наиболее ближайшим к заявляемому штамму - прототипом, является антибактериальная композиция и штамм бактериофага Escherichia coli, специфичный к бактериям семейства Entrobacteriaceae, используемый для получения такой композиции [9]. Композиция включает фильтрат фаголизата Escherichia coli, полученный с использованием штамма бактериофага Escherichia coli, депонированного в коллекции музея микроорганизмов ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph 64, фильтрат фаголизата Escherichia coli, содержащий коли бактериофаг, фильтрат стафилококкового фаголизата, фильтрат сальмонеллезного фаголизата, фильтрат фаголизата Listeria monocyctogenes и целевые добавки в количестве 1,0÷95,0 мас. % от массы композиции.
Недостатком данной композиции является отсутствие литической активности в отношении бактерий Citrobacter freundii.
Задачей изобретения является создание бактериофага Citrobacter freundii, обладающего литической активностью по отношению к бактериям Citrobacter freundii.
Техническим результатом предлагаемого изобретения является получение бактериофага Citrobacter freundii CF17, обладающего литической активностью по отношению к бактериям Citrobacter freundii и пригодного для создания препарата для лечения заболеваний, вызванных бактериями Citrobacter freundii.
Штамм бактериофага Citrobacter freundii CF17 выделен из клинического образца гнойной раны на культуре бактерий тест-штамма Citrobacter freundii АТСС 8090 и депонирован в Коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» (ФБУН ГНЦ ВБ «Вектор») под номером Ph-1311. Заявляемый штамм бактериофага обладает литической активностью в отношении бактерий Citrobacter freundii. Штамм бактериофага Citrobacter freundii CF17 размножается на непатогенном лабораторном тест-штамме Citrobacter freundii АТСС 8090.
Штамм бактериофага Citrobacter freundii CF17 характеризуется следующими свойствами:
морфология негативных колоний: на чувствительном бактериальном штамме формирует прозрачные круглые негативные колонии диаметром около 1 мм; вторичный рост отсутствует;
- подавляет рост бактерий клинического штамма Citrobacter freundii CF17 ККЭМТК 1772 до пятого десятикратного разведения при титровании по Аппельману;
- геном содержит двунитевую ДНК размером приблизительно 110 тыс. пар оснований; ДНК гидролизуется ферментами PstI, EcoRI, HindIII, SalI, DraI. Эндонуклеаза PstI расщепляет ДНК штамма бактериофага Citrobacter freundii CF17 на семь фрагментов, EcoRI расщепляет ДНК на восемь фрагментов, HindIII - на 10 фрагментов;
- фрагмент ДНК бактериофага Citrobacter freundii CF17 размером около 2100 н.п., получаемый расщеплением эндонуклеазами рестрикции SalI и DraI, содержит ген, кодирующий рибонуклеотидредуктазу III, последовательность гена значительно отличается от соответствующих последовательностей родственных бактериофагов и поэтому является маркерным признаком бактериофага Citrobacter freundii CF17;
- для размножения штамма бактериофага Citrobacter freundii CF17 используется не патогенный штамм бактерий Citrobacter freundii CF17 АТСС 8090.
Штамм бактериофага Citrobacter freundii CF17 хранится в виде стерильного фаголизата при 4°C.
Изобретение иллюстрируется следующими фигурами:
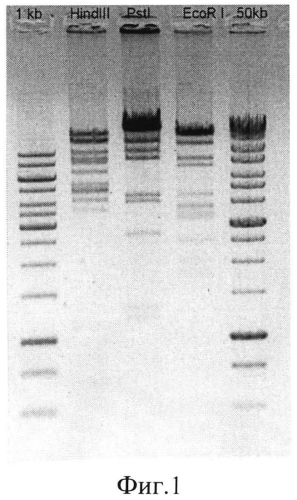
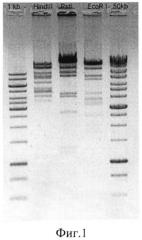
Фиг. 1. Гидролиз ДНК штамма бактериофага Citrobacter freundii CF17 эндонуклеазами рестрикции HindIII (дорожка 2); PstI (дорожка 3); EcoRI (дорожка 4); 1, 5 - маркеры молекулярных масс 1 kb и 50 kb соответственно.
Фиг. 2. Нуклеотидная последовательность гена, кодирующего рибонуклеотидредуктазу III бактериофага Citrobacter freundii CF17.
Фиг. 3. Аминокислотная последовательность рибонуклеотидредуктазы III бактериофага Citrobacter freundii CF17.
Фиг. 4. Филогенетическое древо, построенное методом объединения ближайших соседей на основе множественного выравнивания последовательностей гена, кодирующего рибонуклеотидредуктазу III бактериофага Citrobacter freundii CF17 и филогенетически близких к нему других бактериофагов.
Для лучшего понимания сущность изобретения иллюстрируется следующими примерами.
Пример 1. Получение фаголизата штамма бактериофага Citrobacter freundii CF17.
К 10 мл ночной культуры Citrobacter freundii АТСС 8090 добавляют 40 мл среды LB (на 1 л среды 10 г триптона Bacto, 5 г дрожжевого экстракта Bacto, 10 г NaCl) и 100 мкл суспензии штамма бактериофага Citrobacter freundii CF17 с концентрацией 109 БОЕ/мл. Смесь выдерживают в течение 10 минут при 37°C без перемешивания, после чего инкубируют на качалке при 180 оборотах в минуту и температуре 37°C до наступления лизиса бактериальной культуры, добавляют хлороформ до 20%-ного содержания и интенсивно перемешивают в течение 30 мин. Обломки клеток удаляют низкоскоростным центрифугированием (10000 g, 15 мин), очищенный фаголизат стерилизуют пропусканием через фильтр с диаметром пор 0.22 мкМ и титруют методом двойных агаровых слоев. Концентрацию бактериофага выражают в количестве бляшкообразующих единиц (БОЕ) в 1 мл фаголизата. В полученном фаголизате она составляет 109 БОЕ/мл.
Пример 2. Проверка литической активности штамма бактериофага Citrobacter freundii CF17 в отношении бактерий клинического штамма Citrobacter freundii КЭМТК 1772.
Литическую активность штамма бактериофага Citrobacter freundii CF17 в отношении бактерий штамма Citrobacter freundii ККЭМТК 1772 проверяют методом Аппельмана. В пробирках, содержащих 4,5 мл бульона LB, делают последовательные десятикратные разведения штамма бактериофага Citrobacter freundii CF17 с исходным титром 109 БОЕ/мл и в каждую из них вносят по 5 мкл ночной бульонной культуры штамма Citrobacter freundii КЭМТК 1772. Кроме того, готовят две контрольные пробирки: в одной контрольной пробирке к 4,5 мл бульона LB добавляют только 5 мкл ночной бульонной культуры штамма Citrobacter freundii КЭМТК 1772, во второй - только 0,5 мл штамма бактериофага Citrobacter freundii CF17. Пробирки инкубируют в термостате при температуре 37°C двое суток. Результат исследования оценивают визуально. Во всех пробирках до пятого десятикратного разведения бактериофага среда остается прозрачной, также как в контрольной пробирке, содержащей только штамм бактериофага Citrobacter freundii CF17. В пробирке с шестым десятикратным разведением, где концентрация бактериофага наименьшая, и в контрольной пробирке, содержащей только бактерии штамма Citrobacter freundii КЭМТК 1772, наблюдается помутнение среды.
Пример 3. Выделение ДНК бактериофага Citrobacter freundii CF17.
ДНК бактериофага Citrobacter freundii CF17 выделяют из фаголизата, полученного, как описано в Примере 1. К фаголизату добавляют рибонуклеазу (РНКазу) и дезоксирибонуклеазу (ДНКазу) до конечных концентраций 5 мкг/мл и инкубируют при 37°C в течение часа. Затем к полученному раствору добавляют 0,5М ЭДТА до конечной концентрации 20 мМ, протеинкиназу К до конечной концентрации 100-200 мкг/мл и 10% SDS до конечной концентрации 0,5%. Смесь инкубируют 3 часа при 55°C. ДНК выделяют методом экстракции фенолом/хлороформом. ДНК из полученного экстракта осаждают добавлением изопропанола в количестве 0,8 от объема раствора и 5М NaCl в количестве 0,05 от объема раствора. Смесь выдерживают 20 минут при комнатной температуре. Раствор центрифугируют 15 мин при 14000 об/мин на центрифуге Eppendorf miniSpin plus. Осадок растворяют в деионизованной воде. К полученному раствору добавляют 2,5 объема перегнанного 96% этилового спирта и 0,05 объема 5М NaCl, после чего проводят переосаждение ДНК в течение ночи при -20°C. Затем раствор центрифугируют 15 мин при 14000 об/мин, осадки промывают 70%-ным и 96%-ным перегнанным этиловым спиртом, высушивают в термостате при 37°C и растворяют осадки в деионизованной воде. Гомогенность препарата ДНК бактериофага проверяют электрофорезом в 0,6%-ном агарозном геле.
Пример 4. Ферментативный гидролиз ДНК штамма бактериофага Citrobacter freundii CF17.
Готовят рестрикционную смесь, содержащую 0,1 мкг/мл ДНК бактериофага Citrobacter freundii CF17, 1 единицу активности соответствующей эндонуклеазы рестрикции (СибЭнзим, Россия), 2 мкл 10-кратного рестрикционного буфера, прилагаемого фирмой-производителем к этой эндонуклеазе рестрикции, и деионизованную воду - до общего объема 20 мкл. Смесь инкубируют при температуре 37°C в течение 1 часа. Электрофорез проводят в горизонтальном электрофорезном аппарате в Трис-боратном буфере при напряженности электрического поля 8-10 вольт/см в течение 1 часа. После 15 мин окрашивания в водном растворе бромистого этидия (0,4 мкг/мл) гель визуализируют под УФ-лампой. Результат ферментативного гидролиза ДНК штамма бактериофага Citrobacter freundii CF17 эндонуклеазами рестрикции HindIII, PstI и EcoRI иллюстрирует фиг. 1, на которой видно, что эндонуклеаза PstI расщепляет ДНК штамма бактериофага Citrobacter freundii CF17 на семь фрагментов, эндонуклеаза EcoRI расщепляет ДНК на восемь фрагментов, эндонуклеаза HindIII - на 10 фрагментов.
Пример 5. Определение нуклеотидной последовательности фрагмента ДНК бактериофага Citrobacter freundii CF17.
ДНК бактериофага Citrobacter freundii CF17, очищенную, как описано в Примере 3, обрабатывают одновременно эндонуклеазами рестрикции SalI и DraI (СибЭнзим, Россия), как указано в примере 3, продукты гидролиза анализируют в 1% агарозном геле и элюируют фрагмент размером около 2100 п. н., который затем встраивают в векторную плазмиду pUC18, обработанную эндонуклеазами рестрикции SalI и SmaI (СибЭнзим, Россия), с помощью ДНК-лигазы фага Т4. Проводят трансформацию клеток Escherichia coli XL 1-Blue полученным продуктом лигирования и высевают трансформированные клетки на твердую агаризованную среду LB-агар, содержащую ампициллин в концентрации 100 мкг/мл. Растят клетки в течение 18 часов при 37°C, лизаты полученных колоний анализируют методом ПЦР с использованием праймеров M13/pUC direct (-46): 5′-GCCAGGGTTTTCCCAGTCACGA-3′ и M13/pUC reverse (-46): 5′-GAGCGGATAACAATTTCACACAGG-3′ (Promega, США). Реакционная смесь для ПЦР содержит 10 пмоль праймеров M13/pUC direct (-46) и M13/pUC reverse (-46); смесь dNTP (по 0,25 мМ каждого); 2 мкл буфера Green Buffer; 0,5 мкл ДНК-матрицы; 1 ед. акт. Taq-ДНК-полимеразы (Fermentas, Литва). Реакцию проводят следующим образом: 1 стадия - денатурация ДНК - 94°C, 30 сек, 2 стадия - отжиг праймеров - 54°C, 30 сек, 3 стадия - реакция полимеризации - 72°C, 1 мин, 30 циклов. Результаты амплификации анализируют методом электрофореза в 1% агарозном геле. Для полученных ПЦР-фрагментов определяют нуклеотидные последовательности с использованием праймеров M13/pUC direct и M13/pUC reverse, реакцию секвенирования ведут с использованием реактивов BigDye Terminator v3.1 и 5Х Sequencing Buffer (Applied Biosystems, США) в условиях, указанных производителем.
Полученные последовательности ПЦР-фрагментов анализируют с использованием базы данных GenBank. Результаты анализа показывают, что ПЦР-фрагмент содержит последовательность гена, кодирующего рибонуклеотидредуктазу III. Последовательности гена и кодируемого им белка приведены на фиг. 2 и 3. Результаты филогенетического анализа, приведенного на фиг. 4, свидетельствуют о том, что последовательность гена, кодирующего рибонуклеотидредуктазу III бактериофага Citrobacter freundii CF17, отличается от соответствующих ближайших последовательностей, и, следовательно, эта последовательность может служить маркерным признаком бактериофага Citrobacter freundii CF17.
Таким образом, заявленный штамм бактериофага Citrobacter freundii CF17 обладает литической активностью в отношении бактерий клинического штамма Citrobacter freundii КЭМТК 1772, способен размножаться на непатогенном штамме бактерий Citrobacter freundii CF17 АТСС 8090 и содержит ген, кодирующий рибонуклеотидредуктазу III, имеющий нуклеотидную последовательность SEQ ID NO 1, представленную на фиг. 2, являющуюся его маркерным признаком. Предложенный штамм бактериофага Citrobacter freundii CF17 может быть использован при создании антимикробных препаратов, вызывающих гибель бактерий Citrobacter freundii.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Семенова Е.А., Белькова Е.И., Пищик В.Н., Вассер Н.Р. Изучение факторов патогенности у различных представителей рода Citrobacter. Микробиол. Ж. 1993. 55(4): 75-81.
2. Drożdżyńska A, Pawlicka J, Kubiak Ρ, Kośmider A, Pranke D, Olejnik-Schmidt A, Czaczyk K. Conversion of glycerol to 1,3-propanediol by Citrobacter freundii and Hafnia alvei - newly isolated strains from the Enterobacteriaceae. N Biotechnol. 2014. 31(5):402-10.
3. Gordon D.M., FitzGibbon F. The distribution of enteric bacteria from Australian mammals: Host and geographical effects. Microbiology. 1999. 145(10): 663-671.
4. Badger J.L., Stins M.F., Kim K.S. Citrobacter freundii invades and replicates in human brain microvascular endothelial cells. Infect Immun. 1999; 67(8): 4208-15.
5. Doran Tarence I. The role of Citrobacter in clinical disease of children Review. Clin. Infec. Diseases. 1999; 28(2): 384-394.
6. Whalen J. G., Mully T. W., English, J. C. Spontaneous citrobacter freundii infection in an immunocompetent patient". Archives of Dermatol. 2007. 143 (1): 124-125.
7. Патент RU 2232808 C1, оп. 20.07.2004. Светоч Э.А., Веревкин В.В., Попова В.М., Красильникова В.М. Биопрепарат на основе бактериофагов для профилактики и лечения сальмонеллеза животных.
8. Патент RU 2153534 C1, оп. 27.07.2000. Ворошилова Н.Н., Казакова Т.Б., Боговазова Г.Г. и др. Способ получения пиобактериофага поливалентного.
9. Патент RU 2518303 С2, оп. 10.06.2014. Рубальский М.О., Афанасьев С.С., Алешкин В.А. и др. Композиция антибактериальная, штамм бактериофага Escherichia coli, используемый для получения такой композиции.
Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii, содержащий ген, кодирующий рибонуклеотидредуктазу III, имеющий нуклеотидную последовательность SEQ ID NO 1, представленную на фиг. 2, депонированный в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» под номером Ph-1311.