Способ получения биомассы активированных автохтонных микроорганизмов-биодеструкторов n-фосфонометилглицина (глифосата)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложен способ получения биомассы активированных автохтонных микроорганизмов-деструкторов N-фосфонометилглицина (глифосата). Перед началом культивирования в состав жидкой среды вносят 0,05-0,4 мкг·см-3 глифосата и стабилизированную с использованием эмульгатора сорбитана моностеарата эмульсию перфтордекалина. Конечное содержание перфтордекалина в жидкой питательной среде - 1,0% по массе, сорбитана моностеарата - 0,0005% по массе. На протяжении всего цикла культивирования дробно, с интервалом 2-4 часа, вводят повышающиеся при каждом введении в 1,25-2,5 раза количества глифосата, начиная с количеств глифосата, равных исходному содержанию его в культуральной среде. Преимуществом изобретения является возможность за один цикл глубинного культивирования получать культуры бактерий и микромицетов, обладающих повышенной в 150-200 раз устойчивостью к глифосату и способностью к деструкции глифосата, в 7-11 раз превышающей биодеструктивную активность исходных автохтонных изолятов. 3 табл., 2 пр.
Реферат
I. Область техники, к которой относится изобретение
Изобретение относится к микробиологии, биотехнологии, экологии, а также к сельскому хозяйству и может быть использовано для получения активированной биомассы почвенных автохтонных микроорганизмов-биодеструкторов N-фосфонометилглицина (глифосата), самого используемого в мировой практике гербицида системного действия, зарегистрированного более чем в 120 странах под различными торговыми марками (Раундап, Граунд Био, Ураган, Глисол и др.), предназначенного для обработки посевов широкого спектра сельскохозяйственных культур, в садах и парках, в водном и лесном хозяйстве, способного накапливаться в почве, водной среде и растениях, в результате чего создаются предпосылки для интенсивного загрязнения окружающей среды и негативного влияния на людей и животных.
II. Уровень техники
Известны способы получения биомассы микроорганизмов-биодеструкторов ксенобиотиков фосфонатов за счет выделения накопительных и чистых культур из почв, загрязненных ими, в том числе глифосатом, с последующим отбором штаммов, обладающих повышенной биодеструктивной активностью в отношении глифосата на лимитированных по фосфору «голодных» средах с использованием в качестве источника фосфора глифосата или АМФК, селекцией и выращиванием на средах, содержащих определенные концентрации этих ксенобиотиков (Харечко А.Т. и др. Применение микроорганизмов для деструкции опасных веществ, загрязняющих окружающую среду / Ж. Рос. хим. об-ва им. Д.И. Менделеева. 1993, т. XXXVII, №3. - С. 40-43; Кононова С.В., Несмеянова М.А. Фосфонаты и их деградация микроорганизмами / Биохимия, 2002. - т. 67. - №2. - С. 220-233; Кузнецова Е.М., Чмипъ В.Д. Глифосат: поведение в окружающей среде и уровни остатков /Современные проблемы токсикологии, 2010. - №1. - С. 87-95; Кравцов К.С. и др. Выделение из окружающей среды микроорганизмов, способных разлагать фосфонаты / Химическая и биологическая безопасность, 2006, №6. - С. 3-9; Шушкова Т.В. Биодеструкция глифосата почвенными бактериями / Дис. канд. биол. наук / Пущино. - 2010. - 132 с.).
Недостатком применяемых способов является то, что ни один из них не позволяет получить биомассу автохтонных активированных микроорганизмов-биодеструкторов глифосата в процессе одного цикла культивирования. Для ее получения требуется длительная предварительная работа по подготовке микробных культур биодеструкторов и оптимизации сред, культивирование в «голодных» по фосфору и другим компонентам средах, а также полноценных по питанию средах, что приводит к снижению биодеструктивной активности и/или выходу биомассы, пригодной для интродукции в почву, загрязненную ксенобиотиком, утрате природной адаптивности получаемых культур с низкой устойчивостью к стрессорным химическим, физическим и биологическим факторам внешней среды.
Наиболее близким к заявляемому способу аналогом является способ, основанный на использовании почвенных глифосатустойчивых изолятов бактерий, отбираемых последовательно на средах с возрастающими концентрациями ксенобиотика, и их глубинном культивировании в жидкой среде с определенной концентрацией ксенобиотика для получения биомассы биодеструктора, обладающего повышенной устойчивостью к глифосату (см. статью Бакулин В.М. Использование почвенных глифосатустойчивых изолятов бактерий рода Pseudomonas в биотехнологии деградации фосфонометилглицина / В.М. Бакулин и др. // Ветеринарная медицина. - 2012, №3-4. - С. 17-19).
Общим существенным признаком у заявляемого способа с аналогом является использование выделенных из почв загрязненных глифосатом и продуктами его разложения микроорганизмов и их использование для получения биомассы биодеструкторов путем глубинного культивирования в жидких питательных средах с глифосатом (см. Семенов С.М. Лабораторные среды для актиномицетов и грибов / СМ. Семенов // Москва. - 1990. - 240 с.; Равилов, A.З. Микробиологические среды / A.З. Равилов и др. // Казань. - 1999. - 398 с.).
К недостаткам указанного аналога относятся:
- необходимость проведения длительной селекционной работы для получения высокого уровня устойчивости к глифосату;
- использование при получении биомассы только одной концентрации глифосата в жидкой среде, при этом если она будет велика, то рост культуры будет подавляться избытком глифосата, если мала - то биодеструктивная активность культуры будет низкая;
- отсутствие корреляции между достигаемым уровнем устойчивости выделенного штамма и биодеструктивной активностью получаемой на его основе при глубинном культивировании биомассы (высокий уровень устойчивости не гарантирует активность биодеструкции глифосата);
- полученная указанным способом биомасса биодеструктора утрачивает быстроту адаптации к изменяющимся условиям окружающей среды и не способна занять экологическую нишу в сравнении с аборигенной для данной местности (почвы) однотипной (тех же видов) микрофлоры, имеющей специфические механизмы природного антагонизма (конкурентное вытеснение, бактериоцины и др.).
III. Сущность изобретения заключается в следующем.
Была поставлена задача - разработать способ получения биомассы активированных микроорганизмов-биодеструкторов глифосата в процессе одного цикла культивирования.
Поставленная задача решается путем использования разработанного способа глубинного выращивания культур в ходе одного цикла культивирования аборигенных микроорганизмов-биодеструкторов в жидких средах на обычной питательной основе, в которые перед началом культивирования вносятся субмикробостатические концентрации глифосата и эмульгированный с сорбитаном моностеаратом перфтордекалин с последующим дробным с интервалом 2-4 часа введением субмикробостатических, постепенно повышающихся в 1,25-2,5 раза количеств глифосата.
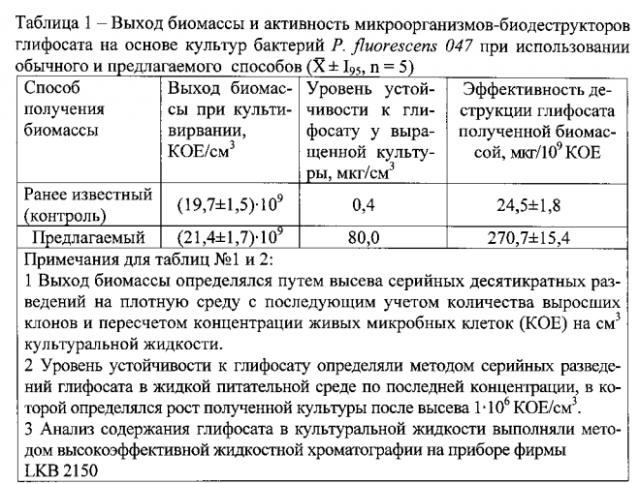
Предлагаемый способ получения биомассы активированных автохтонных микроорганизмов-биодеструкторов глифосата позволяет за один цикл глубинного культивирования получать культуры бактерий и микромицетов, обладающих повышенной в 150-200 раз устойчивостью к глифосату в культуральной среде и способностью к деструкции глифосата полученной биомассой, в 7-11 раз превышающей биодеструктивную активность исходных автохтонных изолятов. При этом по выходу биомассы данный способ не уступает принятому способу культивирования биодеструкторов глифосата.
Сущность технического решения - способ получения биомассы активированных микроорганизмов-биодеструкторов глифосата поясняется следующим. Внесение в питательную среду субмикробостатических концентраций глифосата приводит к селективному давлению в культуральной среде и отбору микроорганизмов-биодеструкторов, сочетающих способность к интенсивному росту и разложению ксенобиотика в процессе роста. При этом последующее дробное введение повышающихся субмикробостатических концентраций глифосата под контролем роста культур биодеструкторов приводит к постоянному повышению селективного давления и отбору наиболее устойчивой и активной в плане биодеструкции популяции клеток и одновременному возрастанию биомассы биодеструкторов за счет полноценности натуральной среды и присутствия в среде эмульгированного перфтордекалина.
Наличие в культуральной среде глифосата является стрессовым химическим фактором для микроорганизмов, поэтому в культуральную среду вводится в качестве мощного антистрессового компонента эмульгированный перфтордекалин, обеспечивающий улучшение питания и интенсификацию роста микроорганизмов-биодеструкторов в условиях негативного влияния глифосата (Перфторорганические соединения, стрессы и выживаемость микроорганизмов / С.В. Дармова, М.К. Бакулин и др. Сборник «Наука-Производство-Технологии-Экология. - 2009. - С. 137-139).
Перфтордекалин (ПФД, химическая формула - C10F18), ТУ 95-1233 - бесцветная прозрачная негорючая жидкость без запаха, с вязкостью 2,74 мм2×сСт-1 при 25°С, плотностью 1,945 г/см3 и температурой кипения 155°С. ПФД не служит питательным веществом, не утилизируется микроорганизмами и является лучшим из перфторорганических соединений для использования в биотехнологических процессах в качестве мощного антистрессового фактора и одновременно активатора роста микробной культуры биодеструкторов (Иваницкий Г.Р. Биофизика на пороге нового тысячелетия: перфторуглеродные среды и газотранспортные кровезаменители / Г.Р. Иваницкий // Биофизика. - 2001. - №1. - С. 5-33; Иваницкий Г.Р. Наноконтейнеры на основе перфторуглеродов с функцией переноса оксида азота / Г.Р. Иваницкий // Биофизика. - 2008. - №2. - С. 367-377; Бакулин М.К. Теория и практика использования перфторуглеродов «голубой крови» при глубинном культивировании биодеструкторов / М.К. Бакулин и др. Теоретическая и прикладная экология. 2010, №4, стр. 4-8).
В качестве биодеструкторов использовали микробные изоляты, выделенные из почвы, подвергавшейся в течение четырех лет восьмикратной обработке глифосатом: грамотрицательную аэробную бактерию Pseudomonas fluorescens 047, способную к росту в жидкой среде, содержащей 0,4 мкг·см-3 глифосата, грамположительную факультативно-анаэробную бактерию Bacillus cereus 41 и митоспоровый микромицет Aspergillus niger 17, способные к росту в жидкой среде содержащей 0,05 мкг·см-3 глифосата (см. статью Бакулин В.М. Выделение бактерий рода Pseudomonas из почвы, загрязненной ксенобиотиком фосфонометилглицином / В.М. Бакулин и др. // Ветеринарная медицина. - 2012. - №1. - С. 9-11).
Культивирование осуществляли при температуре 30°C в биологических реакторах БИОР (Йошкар-Ола) или BIOSTAT В Plus (Sartorius) в режиме постоянного перемешивания и принудительной аэрации (расход воздуха: 0,5 объема воздуха на объем среды в минуту) при прочих равных условиях.
Общим с заявляемым способом является то, что для культивирования использовали среды, обычно применяемые для выращивания указанных микроорганизмов.
Для выращивания микроорганизмов-биодеструкторов на основе культур бактерий P. fluorescens 047 к Bacillus cereus 41 использовали жидкую питательную среду на основе ферментативного гидролизата казеина, имеющую в своем составе следующее соотношение компонентов, г/л:
| KH2PO4 | 2,2 |
| K2HPO4 | 1,7 |
| MgSO4 | 0,6 |
| Na2S2O3 | 0,6 |
| аминный азот | 130 мг % |
| водородные ионы | 7,1 ед. pH |
Для выращивания биодеструкторов на основе культуры митоспорового микромицета Aspergillus niger 17 использовали жидкую синтетическую среду Стейнберга с добавлением соевой муки, имеющую в своем составе следующее соотношение компонентов, г/л:
| соевая мука | 20,0 |
| сахароза | 50,0 |
| NH4NO3 | 1,9 |
| KH2PO4 | 0,35 |
| MgSO4×7H2O | 0,25 |
| FeCl2 | 0,0004 |
| ZnCl2 | 0,0004 |
| CuCl2 | 0,0001 |
| MnCl2 | 0,0001 |
| MoCl2 | 0,00002 |
| CaCl2 | 0,00002; |
| водородные ионы | 6,3 ед. pH |
Готовая стабилизированная с использованием сорбитана моностеарата эмульсия перфтордекалина асептически вносится в стерильные жидкие питательные среды (конечное содержание перфтордекалина в жидких питательный средах равно 1,0% по массе; конечное содержание сорбитана моностеарата в жидких питательный средах равно 0,0005% по массе от общего количества использованных питательных сред), которые затем используется для выращивания биодеструкторов.
В среды перед культивированием вносится глифосат в количествах, обеспечивающих начальную концентрацию ксенобиотика, к которой устойчивы микроорганизмы.
Посевные культуры вносились в среду в количествах, достаточных для создания концентрации бактерий в среде при посеве 1,0·108 бактерий в см, культуры аспергилл - 1,0·107 конидий в см3. Для культуры P. fluorescens 047 начальная концентрация глифосата в жидкой среде 0,4 мкг·см-3; для Bacillus cereus 41 и As- pergillus niger 17-0,05 мкг·см-3. Через 4 часа после начала культивирования в среды дополнительно вносится глифосат для культуры P. fluorescens 047 глифосат из расчета 0,4 мкг·см-3 и затем по схеме (схема 1) каждые два часа в возрастающих концентрациях: 0,8-1,5-4,0-8,0-10,0-20,0-50,0-80,0 мкг·см-3; для культуры Bacillus cereus 41 через 4 часа после начала культивирования дополнительно вносится 0,05 мкг·см-3 глифосата и затем каждые два часа по схеме (схема 2): 0,1-0,2-0,5-1,0-2,5-6,0-15,0-20,0 мкг·см-3; для культуры Aspergillus niger 17 через 4 часа после начала культивирования дополнительно вносится 0,05 мкг·см-3 глифосата и затем через каждые 4 часа по схеме (схема 3): 0,1-0,5-1,0-2,0-5,0-10,0-15,0-15,0 мкг·см-3. Культивирование бактерий продолжается 28 часов, аспергилл - 56 часов.
Пример 1. Получение биомассы микроорганизмов-биодеструкторов глифосата на основе культуры бактерий P. fluorescens 047 и В. cereus 41 (таблицы 1 и 2) осуществляют в жидкой питательной среде на основе ферментативного гидролизата казеина следующего состава, г/л:
| KH2PO4 | 2,2 |
| K2HPO4 | 1,7 |
| MgSO4 | 0,6 |
| Na2S2O3 | 0,6 |
| аминный азот | 130 мг % |
| водородные ионы | 7,1 ед. pH |
| исходная концентрация водородных ионов | 7,2 ед. pH |
Перед культивированием в стерильных условиях в среду добавляют готовую стабилизированную с использованием эмульгатора сорбитана моностеарата эмульсию перфтордекалина (конечное содержание перфтордекалина в жидкой питательной среде составляет 1,0% по массе; конечное содержание сорбитана моностеарата в жидкой питательной среде равно 0,0005% по массе от общего количества использованной питательной среды).
Исходная посевная концентрация бактерий в среде 1,0·108 живых микробных клеток / см3. Глифосат в культуральную среду с P. fluorescens 047 вносится по схеме 1. Его начальная концентрация в жидкой среде 0,4 мкг·см-3. Через 4 часа после начала культивирования в среду дополнительно вносится 0,4 мкг·см-3 глифосата и затем каждые два часа в возрастающих концентрациях: 0,5-1,5-4,0-8,0-10,0-20,0-50,0-80,0 мкг глифосата/см-3 культуральной среды.
Культивирование бактерий продолжается 28 часов (таблица 1).
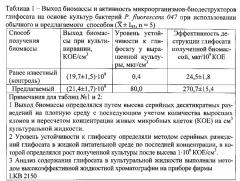
Для культуры Bacillus cereus 41 начальная концентрация глифосата в жидкой среде 0,05 мкг·см-3, через 4 часа после начала культивирования дополнительно вносится 0,05 мкг·см-3 глифосата и затем каждые два часа по схеме (схема 2): 0,1-0,2-0,5-1,0-2,5-6,0-15,0-20,0 мкг·см-3.
Культивирование бактерий продолжается 28 часов (таблица 2).
Пример 2. Получение биомассы микроорганизмов-биодеструкторов глифосата на основе культуры микромицетов Aspergillus niger 17 осуществляют в питательной среде на основе жидкой синтетической среды Стейнберга с добавлением соевой муки, имеющую в своем составе следующее соотношение компонентов, г/л:
| соевая мука | 20,0 |
| сахароза | 50,0 |
| NH4NO3 | 1,9 |
| KH2PO4 | 0,35 |
| MgSO4×7H2O | 0,25 |
| FeCl2 | 0,0004 |
| ZnCl2 | 0,0004 |
| CuCl2 | 0,0001 |
| MnCl2 | 0,0001 |
| MoCl2 | 0,00002 |
| CaCl2 | 0,00002 |
| водородные ионы | 6,3 ед. pH |
Перед культивированием в стерильных условиях в среду добавляют готовую стабилизированную с использованием эмульгатора сорбитана моностеарата эмульсию перфтордекалина (конечное содержание перфтордекалина в жидкой питательной среде составляет 1,0% по массе; конечное содержание сорбитана моностеарата в жидкой питательной среде равно 0,0005% по массе от общего количества использованной питательной среды).
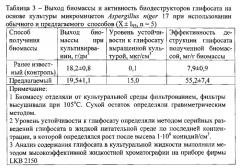
Глифосат в культуральную среду с Aspergillus niger 17 вносится перед культивированием в концентрации 0,05 мкг·см-3, через 4 часа после начала культивирования дополнительно вносится 0,05 мкг·см-3 глифосата и затем через каждые 4 часа по схеме (схема 3): 0,1-0,5-1,0-2,0-5,0-10,0-15,0-15,0 мкг·см-3 Культивирование аспергилл продолжают - 56 часов (таблица 3).
Способ получения биомассы активированных автохтонных микроорганизмов-биодеструкторов N-фосфонометилглицина (глифосата) в результате одного цикла глубинного культивирования культур аборигенных микроорганизмов-биодеструкторов в жидких средах на обычных, используемых для их выращивания, питательных основах, отличающийся тем, что перед началом культивирования в состав жидкой среды вносят субмикробостатические концентрации глифосата - 0,05-0,4 мкг·см-3 и стабилизированную с использованием эмульгатора сорбитана моностеарата эмульсию перфтордекалина, причем конечное содержание перфтордекалина в жидкой питательной среде составляет 1,0% по массе, конечное содержание сорбитана моностеарата равно 0,0005% по массе от общего количества использованной жидкой питательной среды, затем дробно на протяжении всего цикла культивирования многократно, с интервалом 2-4 часа, вводят субмикробостатические, повышающиеся при каждом введении в 1,25-2,5 раза количества глифосата, начиная с количеств глифосата, равных исходному содержанию его в культуральной среде.