Средство на основе производного урацила для терапии болезни альцгеймера
Иллюстрации
Показать всеИзобретение относится к новому производному урацила - 1,3-бис[5-(орто-нитробензил-этиламино)пентил-1]-6-метилурацилу, соответствующему структурной формуле, указанной ниже. Соединение предназначено для использования в терапии болезни Альцгеймера.
Приведены показатели антихолинэстеразной активности соединения, по общетоксическому действию и данные в условиях скополаминовой и генетической модели при терапии симптомов болезни Альцгеймера. 2. н.п. ф-лы, 5 табл., 6 пр.
Реферат
Изобретение относится к органической химии гетероциклических соединений и может быть использовано в фармакологии и медицине для терапии болезни Альцгеймера.
Болезнь Альцгеймера - самое распространенное нейродегенеративное заболевание, характеризующееся увеличением продукции патологического бета-амилоида. Основной фактор риска болезни - возраст: частота возникновения болезни после 60 лет удваивается каждые пять лет и к 85 годам достигает 30%. Заболевание сопровождается деменцией, множественным когнитивным дефицитом, прогрессирующими нарушениями памяти: у больных проявляется множественный недостаток познавательной функции, в том числе расстройство памяти, связанное с ухудшением запоминания новой и воспроизведением ранее усвоенной информации.
Ведущая роль в патогенезе болезни Альцгеймера придается центральному холинергическому дефициту, который лежит в основе когнитивных расстройств и определяет выраженность клинических проявлений болезни.
Ингибиторы АХЭ традиционно применяются в медицинской практике при заболеваниях, терапия которых требует продления времени действия ацетилхолина в синаптической щели (миастении Гравис и болезнь Альцгеймера). Однако применение традиционных ингибиторов АХЭ эффективно лишь в отношении основных симптомов данных заболеваний (мышечной слабости и нарушений памяти), но, к сожалению, никак не влияет на этиологию заболевания. Данный недостаток существенно ограничивает применение антиАХЭ препаратов. В случае болезни Альцгеймера существуют предпосылки считать, что ингибиторы АХЭ способны оказывать влияние и на этиологию заболевания, уменьшая агрегацию бета-амилоида. Однако данное утверждение справедливо не для всех ингибиторов АХЭ, а только для соединений, места связывания которых включают так называемый «периферический анионный пункт» данного фермента. К сожалению, ассортимент ингибиторов АХЭ, связывающихся с «периферическим анионным центром» АХЭ, в настоящее время крайне ограничен.
Поиск новых соединений для терапии болезни Альцгеймера, расширяющих арсенал известных средств указанного назначения, является актуальной задачей.
Исследования, проведенные авторами, выявили новый класс ингибиторов холинэстераз - аммониевые производные 6-метилурацила ациклического и макроциклического строения, обладающие способностью высокоизбирательно блокировать ацетилхолинэстеразу млекопитающих [Доклады РАН. - 1998. - Т. 362, №1. С. 68-70: Доклады РАН. - 2001. - Т. 376, №6. - С. 818-822; Совр. проблемы токсикол. - 2004. - №3. - С. 25-33; Доклады РАН. - 2005. - Т. 401, №1. - С. 120-123; Хим. фарм. ж. - 2005. - Т. 39, №5. - С. 15-19; Совр. вопросы токсикол. - 2006. - №2. - С. 13-22; Chem. - biol. Interactions. - 2008. - Vol. 175. - P. 286-292; MedChemComm. - 2014. - Vol. 5. - N 11. - P. 1729-1735]. Некоторые из найденных производных 6-метилурацила было предложено использовать для лечения синдромов патологической мышечной слабости [Патент РФ №2534903, опубл. 10.12.2014]. Кроме того, расчетными методами были определены места их связывания с ферментом - в районе «периферического анионного пункта» АХЭ [MedChemComm. - 2014. - Vol. 5. - N 11. - P. 1729-1735].
Известно, что 6-метилурацил и его производные являются физиологически активными веществами и широко применяются в лечебной практике. Например, препараты Метилурацил и Пентоксил обладают анаболической активностью. Эти препараты ускоряют процессы клеточной регенерации; способствуют заживлению ран, стимулируют клеточные и гуморальные факторы иммунитета. У лекарственных средств, созданных на основе метилурацила и пентоксила, помимо способности стимулировать лейкопоэз и эритропоэз были выявлены и другие свойства - повышать фагоцитоз, резистентность к инфекции, поствакцинальный иммунитет, стимулировать репаративные процессы, оказывать противовоспалительное действие, вызывать анаболический и антикатаболический эффект, иммуностимулирующий эффект и др. Обнаружены также антитоксические и антиоксидантные, мембраностабилизирующие свойства
Технический результат - новое химическое соединение на основе триалкиламинопроизводного 6-метилурацила, способное купировать симптомы болезни Альцгеймера.
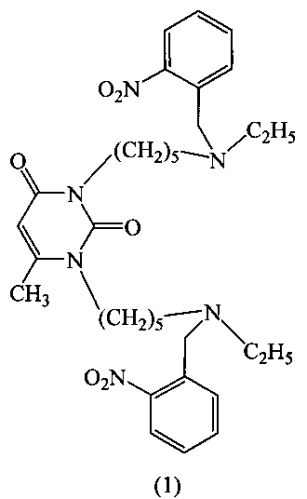
Сущность изобретения составляет новое соединение - 1,3-бис[5-(орто-нитробензил-этиламино)пентил-1]-6-метилурацил формулы (1):
и возможность его применения для терапии болезни Альцгеймера.
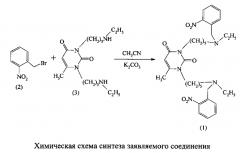
Заявляемое соединение (1) получено алкилированием 1,3-бис(5-этиламинопентил-1)-6-метилурацила (3) продажным орто-нитробензил-бромидом (2) согласно приведенной ниже химической схеме. Соединение (3) и способ его получения описаны [Р.Х. Гиниятуллин, А.С. Михайлов, В.Э. Семенов и др. / Изв. АН. Сер. хим. - 2003. - Т. 52. - №7. - С. 1511-1515].
Пример 1. Синтез 1,3-бис[5-(орто-нитробензилэтиламино)пентил]-6-метилурацила (1).
К перемешиваемой при 50-55°C суспензии 1.50 г (10.9 ммоль) К2СО3 в 100 мл раствора 1.50 г (3.5 ммоль) соединения (3) по каплям добавляют раствор 1.66 г (7.7 ммоль) в 25 мл CH3CN. По окончании прикапывания, реакционную массу перемешивают при температуре 50-55°C в течение 8 ч, после чего упаривают в вакууме и к остатку добавляют 100 мл CHCl3. Образовавшийся осадок отфильтровывают, фильтрат концентрируют и хроматографируют через колонку с SiO2. Колонку промывают последовательно петролейным эфиром и серным эфиром. После упаривания последнего элюата получают 1.74 г (80%) соединения (1) в виде масла.
1,3-Бис[5-(орто-нитробензилэтиламино)пентил]-6-метилурацил (1) имеет следующие физико-химические характеристики: масло; спектр ЯМР 1Н (500 МГц) в CDCl3, δ, м.д.: 0.94-0.98 (м., 6Н, 2NCH2CH3), 1.26-1.30 (м., 4Н, 2СН2), 1.42-1.46 (м., 4Н, 2СН2), 1.57-1.61 (м., 4Н, 2СН2), 2.22 (с., 3Н, CурСН3), 2.38-2.41 (м., 4Н, 2NCH2), 2.44-2.48 (м., 4Н, 2NCH2), 3.74-3.77 (м., (т., 2Н, NypCH2, J=7.8 Гц), 3.82 (с, 4Н, NCH2Ph), 3.86-3.89 (м., (т., 2Н, NypCH2, J=7.7 Гц), 6.61 (с., 1Н, СУРН), 7.34-7.38 (м., 2Н, 2ArH), 7.50-7.64 (м., 4Н, 4ArH), 7.73-7.76 (м., 2Н, 2ArH); ИК-спектр в тонком слое, ν, см-1: 2935 с., 2861 сл., 2810 сл., 1700 с., 1661 о.с., 1621 о.сл., 1578 о.сл., 1528 о.с., 1468 с., 1449 с., 1432 с., 1362 с., 1304 сл., 1207 сл., 1160 с., 1056 сл., 859 сл., 817 сл., 785 сл., 769 о.сл., 730 с., 668 сл., 626 сл; MALDI-MS (матрица - пара-нитроанилин): 621.2 [М-Н]+, 622.2 [М]+, 623.2 [М+Н]+, 645.2 [M+Na]+, рассчитано для C33H46N6O6 621.3, 622.4, 623.4, 645.3, соответственно. Найдено, %: С 63.72, Н 7.48, N 13.43. Брутто-формула C33H46N6O6. Вычислено, %: С 63.65, Н 7.45, N 13.49.
Заявляемое соединение представляет собой светло-коричневое маслообразное вещество, растворимое в метиловом спирте, этиловом спирте, хлороформе, диметилформамиде, диметилсульфоксиде, не растворимое в воде.
Биологическая активность
Пример 2. Определение антихолинэстеразной активности соединения формулы (1)
Регистрацию ферментативной реакции осуществляли согласно методу Элмана [Ellman G.L., Courtney K.D., Andres V. Jr., Feather-Stone R.M. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol 1961, №7, C. 88-95]. Анализ зависимости активности холинэстеразы от концентрации ингибитора проводили уравнением Хилла (Hill) с вычислением среднеэффективной концентрации - IC50. Ацетилхолинэстераза и бутирилхолинэстераза человека были куплены в Sigma-Aldrich. Результаты ингибиторной активности заявляемого соединения, приведенные в таблице 1, свидетельствуют о том, что соединение проявляло высокую антихолинэстеразную активность, показывая большую эффективность в отношении ацетилхолинэстеразы (АХЭ) по сравнению с бутирилхолинэстеразой (БуХЭ).
Пример 3. Определение общетоксического действия соединения (1).
Изучение общетоксического действия соединения (1) проводили согласно «Методическим указаниям по изучению общетоксического действия фармакологических веществ» [М., Медицина. 2005. Под ред. Р.У. Хабриева] на беспородных белых мышах обоего пола массой 19,0±2,0 г., содержавшихся на стандартном рационе питания в условиях природного режима освещения помещения при комнатной температуре. Данные токсикологической оценки соединений приведены в таблице 1. Для сравнения, ЛД50 донепезила гидрохлорида (антихолинэстеразное средство) для мышей при пероральном применении составляет 45.2 мг/кг, а при внутрибрюшинном введении составляет 5 мг/кг массы тела.
Таким образом, заявляемое соединение обладает более высокой антихолинэстеразной активностью и на порядок меньшей токсичностью, чем донепезила гидрохлорид.
Пример 4. Терапия симптомов болезни Альцгеймера в условиях фармакологической (скополаминовой) модели
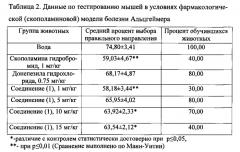
Соединение (1) было протестировано in vivo на способность улучшать рабочую память мышей в условиях фармакологической (скополаминовой) модели болезни Альцгеймера. Фармакологическую модель болезни Альцгеймера создавали по методике, описанной в статье [Busquet Р, Capurro V, Cavalli A, Piomelli D, Reggiani A, Bertorelli R. Synergistic effects of galantamine and memantine in attenuating scopolamine-induced amnesia in mice. J Pharmacol Sci. - 2012. - Vol. 120. - N 4. - P. 305-9]. Эксперименты проводились на белых беспородных мышах обоего пола массой 22,0±2,0 г, содержавшихся в условиях природного режима освещения помещения при комнатной температуре. Животные были разделены на 7 групп (n=10). Болезнь была смоделирована путем внутрибрюшинных инъекций мышам 1 мг/кг водного раствора скополамина гидробромида (Sigma-Aldrich) в течение 14 дней за 20 минут до начала эксперимента. За 40 минут до начала эксперимента четырем опытным группам животных внутрибрюшинно вводили заявляемое соединение из 0.1%-го водного раствора этанола в дозах 1, 5, 10 и 15 мг/кг. Пятой группе мышей вводили водный раствор донепезила гидрохлорида - ингибитора ацетилхолинэстеразы центрального действия, традиционно применяемого в терапии болезни Альцгеймера (Sigma-Aldrich) в дозе 0,75 мг/кг. В качестве отрицательного контроля использовали группу животных, получавших только скополамина гидробромид. Контрольной группе животных вводили только эквивалентное количество воды для инъекций (ОАО «Новосибхимфарм»).
Выводы о состоянии рабочей памяти были сделаны на основании тестирования мышей в Т-образном лабиринте в модели «вознаграждаемое чередование» в течение 14 дней по методике, описанной в статье [Robert М J Deacon, J Nicholas P Rawlins T-maze alternation in the rodent. Nature protocols. 2006. - Vol. 1. - N 1. P. 7-12].
В опытах над животными на фармакологической (скополаминовой) модели болезни Альцгеймера была подобрана эффективная для коррекции амнезии доза соединения (1) (таблица 2). Это доза составила 5 мг/кг при внутрибрюшинном введении. Аналогичный эффект достигался инъекцией донепезила гидрохлорида в дозе 0.75 мг/кг. Соединение (1) показало себя на уровне традиционно применяемого в клинике препарата.
Критерием обученности в эксперименте являлось выполнение животным более 80% (5, или 6 из 6) правильных заходов в рукав с едой в течение трех дней подряд (отдельно для каждого животного). Так, в опытной группе все 10 мышей выполнили это условие - обучилось 100%. Средний процент правильного выбора направления был подсчитан для группы животных, чтобы отразить статистически значимое увеличение процента выбора правильного направления в опытных группах. Так, в опытной группе средний процент выбора правильного направления равен 75, так как отражает в себе все дни эксперимента (в том числе и первые дни, когда животное только начинало обучаться и выполняло меньше 80% правильных заходов) и показатели всех животных в группе.
Пример 5. Терапия симптомов болезни Альцгеймера в условиях генетической модели.
Соединение (1) было протестировано in vivo на способность улучшать рабочую память мышей в условиях генетической модели болезни Альцгеймера. Эксперименты проводили на трансгенных мышах генотипа B6C3-Tg(APP695)85Dbo Tg(PSENI)85Dbo, экспрессирующих химерный мышиный/человеческий белок-предшественник амилоида и мутантный человеческий пресенелин-1. Линия была закуплена в The Jackson Laboratry (США) и содержалась в питомнике лабораторных животных «Пущино» (г. Пущино, Московская область) в условиях природного режима освещения помещения при комнатной температуре.
Животные были разделены на 4 группы (n=9-13). За 20 минут до начала эксперимента опытной группе трансгенных животных вводили внутрибрюшинно соединение (1) из 0.1%-го водного раствора этанола в дозе 5 мг/кг. Второй группе трансгенных животных вводили водный раствор донепезила гидрохлорида (Sigma-Aldrich) дозе 1 мг/кг. Третьей группе трансгенных мышей и контрольной группе нетрансгенных мышей вводили только эквивалентное количество воды для инъекций (ОАО «Новосибхимфарм»).
Выводы о состоянии рабочей памяти были сделаны на основании тестирования мышей в Т-образном лабиринте в модели «вознаграждаемое чередование» в течение 14 дней.
В опытах на животных с генетической моделью болезни Альцгеймера доза 5 мг/кг соединения (1) при внутрибрюшинном введении оказалась эффективной для коррекции нарушений памяти и восстанавливала количество «чередований» в Т-образном лабиринте до показателей здоровых животных (таблица 3).
Пример 6. Оценка бета-амилоидных отложений и их относительной площади в головном мозге животных с генетической моделью болезни Альцгеймера
Соединение (1) было протестировано in vivo на способность уменьшать количество и площадь амилоидных бляшек в головном мозге трансгенных мышей генотипа B6C3-Tg(APP695)85Dbo Tg(PSENI)85Dbo. Оценка бета-амилоидных отложений и их относительной площади осуществлялась после окончания экспериментов в Т-образном лабиринте на срезах головного мозга мышей (20 мкм) с применением флуоресцентного красителя Thioflavin S и флуоресцентного микроскопа Olympus BX51W1, по методике, описанной в статье [http://library.med.utah.edu/WebPath/HISTHTML/-MANUALS/MANUALS.html].
Результаты окрашивания срезов головного мозга трансгенных мышей в области гиппокампа и префронтальных зон коры головного мозга на агрегированный бета-амилоид, приведены в таблицах 4 и 5. Данные свидетельствуют о достоверном уменьшении количества и площади, занимаемой бляшками в зубчатой извилине, зоне СА3 гиппокампа и коре головного мозга трансгенных мышей, получавших соединение (1) по сравнению с трансгенными мышами, получавшими только воду. Наиболее выражено уменьшение бляшек в зоне СА3 гиппокампа (снижение количества в среднем на 76% и площади в среднем на 79%) и коре головного мозга (снижение количества в среднем на 50% и площади в среднем на 52%). Введение донепезила гидрохлорида достоверно уменьшило количество и площадь амилоидных бляшек в коре головного мозга (снижение количества на 30% и площади на 48%), но не оказало влияние на уменьшение амилоидных бляшек в зонах гиппокампа.
Этот факт делает соединение формулы (1) перспективным кандидатом в качестве лекарственного средства для терапии болезни Альцгеймера.
Предложено новое соединение - 1,3-бис[5-(орто-нитробензил-этиламино)пентил-1]-6-метилурацила, которое:
- в дозе 5 мг/кг при внутрибрюшинном способе введения купирует симптомы болезни Альцгеймера;
- обладает значительно более низкой токсичностью (ЛД50 51.48 мг/кг при внутрибрюшинном способе введения, лабораторные мыши), чем у стандартного лекарственного средства - донепезила гидрохлорида.
1. 1,3-бис[5-(орто-нитробензил-этиламино)пентил-1]-6-метилурацил формулы:
2. Применение соединения по п. 1 для терапии болезни Альцгеймера.