Способ криоконсервации пазушных почек in vitro растений осины
Иллюстрации
Показать всеИзобретение относится к области биотехнологии растений и лесному хозяйству. Изобретение представляет собой способ криоконсервации пазушных почек in vitro растений осины, заключающийся в изоляции пазушных почек, предварительном их обезвоживании в средах, содержащих осмолитики, переносе почек в криопробирки, криоконсервации криопробирок с почками в жидком азоте, оттаивании почек и посткриогенной регенерации из них растений, отличающийся тем, что на этапе обезвоживания перед быстрым замораживанием сначала почки помещают в раствор I, содержащий питательную среду и осмолитики (WPM с добавлением к сахарозе (0,2-0,5М) глицерола (1,7-2,5М)), затем почки переносят в раствор II, содержащий питательную среду и осмолитики (WPM, сахароза (0,2-0,5М), глицерол (2,5-3,5М), этиленгликоль (1-1,5М), диметилсульфоксид (1,5-2М)), с последующим переносом в жидкость для замораживания (WPM, содержащая сахарозу (0,2-0,5М), глицерол (3,5-4М), этиленгликоль (1,5-2,5М), диметилсульфоксид (1,5-2М)). Изобретение позволяет проводить прямую регенерацию из почек, обеспечивая генетическую сохранность in vitro культур ценных селекционных генотипов и генетически модифицированных клонов осины и выживаемость до 80% после криохранения в течение года. 1 з.п. ф-лы, 3 ил., 1 табл.
Реферат
Изобретение относится к области биотехнологии растений и лесному хозяйству и может быть использовано для сохранения генетических ресурсов и создания криобанка особо ценных и траснформированных клонов in vitro растений осины (Вепринцев Б.Н. Консервация генетических ресурсов. / Б.Н Вепринцев, Н.Н. Ротт - Пущино: ОНТИ НЦБИ АН СССР. - 1980. - 15 с.).
В современной биотехнологии поддержание растений в культуре in vitro является одним из передовых способов сохранения генотипических особенностей растений. Однако указанный способ является материально затратным, поэтому наиболее перспективным способом сохранения генетических ресурсов рассматривается криоконсервация изолированных меристем из пазушных почек. Использование эффективного и современного способа криосохранения меристем осины, позволяющего отказаться от программируемых замораживателей, необходимых для медленного замораживания растительного материала и специального оборудования для обезвоживания материала, может интенсифицировать создание криобанков ценных и трансформированных клонов in vitro растений осины.
Осина (Populus tremula) и ее гибриды широко используется в биотехнологии как модель для изучения различных аспектов генетики лесных древесных растений по ряду причин: относительно небольшой размер генома и возможность его эффективной трансформации, быстрый рост, простота клонального микроразмножения и выращивания in vitro. В лесном хозяйстве осина начинает занимать приоритетное направление для использования в целлюлозно-бумажной промышленности, химической промышленности и для получения стройматериалов. Поэтому криоконсервация in vitro культур рассматривается как способ долгосрочного сохранения растений, обладающих ценными свойствами.
Известно несколько способов криохранения растений, в частности известны методы для криоконсервации ряски (патент США US 20120190004 A1). Методы включают в себя инкубацию с обезвоживающим криозащитном растворе, который содержал около 1,9 M диметилсульфоксид, около 2,4 M этиленгликоля, около 3,2 M глицерина и около 0,4 M сахарозы. Указанное состояние обезвоживания имеет продолжительность от примерно 5 дней до примерно 35 дней при прохладных температурных условиях (от 2°C до 25°C). Замораживание осуществлялось в обезвоживающем растворе, охлаждение до -150°C культуры ряски осуществляли медленным снижением температуры криоконсерванта (скорость замораживания от 1°C до 25°C в час). Размораживание культуры ряски осуществляли при температуре в пределах от 15°C до 40°C. Среда для восстановления содержала сахарозу в концентрации от 0,5 M и 1,5 М. Выживаемость после замораживания в среднем составила 60%. Описанный метод является очень трудоемким и ресурсозатратным. Возможность использования данного способа для других растений не описана и, очевидно, потребует дополнительных модификаций метода и финансовых затрат.
Известен также способ криоконсервации различных голосемянных и покрытосемянных растений (патенты США US 5965438 A, US 20030031998 A1). Предварительно обработанные клетки подготавливали к действию пониженных температур с помощью предварительной инкубации в жидкостях с криопротекторами и лиофилизации клеток. Сочетание лиофилизации и удаления воды криопротекторами обеспечивает обезвоживание растительной клетки от 80% до около 95% воды. Раствор для замораживания включал в себя диметилсульфоксид (1 - 50%), пропиленгликоль (около 5-25%), глицерин (около 0-50%), полиэтиленгликоль - 8000 (около 5-20%), этиленгликоль (около 10-75%), этиленгликоль/сорбит (около 60/20 весовых процентов до примерно 10/60 весовых процентов) и этиленгликоль/сорбит (около 40/30 весовых процентов). Осуществлялось быстрое замораживание путем непосредственного погружения в жидкий азот. Клетки быстро размораживали при температуре +30°C. Выживаемость эксплантов не указана. Использовались суспензионные культуры, что усложняет процесс регенерации и получения генетически однородного материала. Возможность использования данного способа для культуры древесных растений, в частности осины, не оценивалось.
Запатентовано изобретение «способ криосохранения меристем земляники, изолированных из растений in vitro» (заявка на изобретение №2002113550/13 от 24.05.2002 с решением о выдаче патента от 02.09.2003). В этом способе растения земляники, размноженные in vitro, закаливали в течение 1-2 месяца на модифицированной питательной среде, дополненной 6% сахарозой или глюкозой, обработку изолированных меристем перед замораживанием (18-19 часов) проводили на жидкой питательной среде с криопротекторами (6% сахарозы или глюкозы и 5-7% диметилсульфоксида), апексы охлаждали в криоампулах, заполненных раствором 6% сахарозы или глюкозы и 7-9% диметилсульфоксида, содержащим лед, в программируемом замораживателе по оригинальной программе со скоростью 0,3-0,33°C/мин до (-38-40)°C, затем со скоростью 9-11°C/мин до -75°C с погружением в жидкий азот (-196°C) на срок не менее часа, посткриогенное восстановление растений из оттаявших меристем, освобожденных от избытка криопротекторов, проводили на модифицированной питательной среде с 0,5-1 мг/л бензиламинопурина и 3%-ными глюкозой или сахарозой. Данный метод не пригоден для сохранения меристемной ткани древесных растений, в частности осины. Метод неудобен подбором условий постепенного замораживания.
Способ криосохранения in vitro меристем, изолированных из растений земляники садовой (Fragaria L.) (заявка на изобретение № от 2006103654/13 от 08.02.2006 с решением о выдаче патента от 08.02.2006) включает в себя закаливание растений-доноров на твердой агаризованной питательной среде, дополненной 5-10% сахарозой в течение 2-8 недель, предкультивирование апексов 46-50 часов на агаризованной питательной среде, дополненной 0,79-0,81 M сахарозы и 0,5-1,0 мг/л паклобутразола ([1-(4-хлорофенил)-4,4-диметил-2(1,2,4-триазол-1-ил)пентан-3-ол], последующее высушивание, в потоке стерильного воздуха, апексов в течение 3-4 часов для удаления 70-80% воды, погружение криоампул с апексами в жидкий азот (-196°C) на срок не менее часа, оттаивание сначала при +38-40°C 1-5 сек в водяной бане, а затем при комнатной температуре на стерильной фильтровальной бумаге, посткриогенное восстановление растений из оттаявших меристем на модифицированной питательной среде проводилось с использованием 0,5 мг/л бензиламинопурина и 3% сахаров (сахароза + глюкоза). Способ трудоемкий, высушивание в потоке стерильного воздуха неконтролируемо.
Наиболее близким техническим решением из описанных по криоконсервации является «A cryopreservation method maintaining the genetic fidelity of a mode forest tree, Populus trémula L. × Populus tremuloides Michx.» (Jokipii S., Ryynänen L., Kallio P.T., Aronen T., Häggman H. // Plant Science 2004, №166, PP. 799-806). В статье описывается методика криоконсервации почек осины с предварительным кратковременным депонированием при низких положительных температурах на среде MS, содержащей 0,09 М сахарозы. Почки постепенно замораживались со скоростью 10°C/ч до -38°C в среде, содержащей 0,25 мл жидкости без гормонов MS и 1 мл криосреды (10% полиэтиленгликоль 6000 глюкозы и 10% диметилсульфоксид). Криопробирки с растительным материалом хранили в жидком азоте. По прошествии четырех недель образцы оттаивали при 37°С в водяной бане, затем промывали жидкой среде MS в течение 30 минут и культивировали на полутвердые MS среды, содержащей 2,22 µМ ВАР и 2,85 µМ IAA, для регенерации растений. Однако при таких условиях растения долго хранили (не более 4 недель). Описанный способ требует долгой подготовки растительного материала, неудобен вследствие постепенной заморозки.
Целью предлагаемого изобретения является создание способа быстрой криоконсервации особо ценных и трансформированных клонов in vitro растений осины и сохранение их промежуток времени до 12 месяцев.
Поставленная цель достигается за счет того, что при проведении криоконсервации используется поэтапная смена сред, обеспечивающая дегидратацию пазушных растительных почек и возможность быстрой «шоковой» заморозки в жидком азоте.
Суть изобретения заключается в том, что для криоконсервации используют изолированные пазушные почки из in vitro растений осины, содержащие мелкие меристемные клетки, которые предварительно обезвоживают в средах, содержащих осмолитики, сначала почки помещают в раствор I, содержащий WPM (Lloyd G., McCown В., Commercially feasiblemicropropagation of mountain laural (Kalmla latlfolia) by use of shoot tip cultures. Ccmb Proc Intl Soc 1980. 30: PP. 421-427.) с добавлением к сахарозе (0,2-0,5М) таких осмолитиков как глицерола (1,7-2,5М). После инкубации с раствором I почки переносят в раствор II, содержащий WPM, сахарозу (0,2-0,5М), глицерол (2,5-3,5М), этиленгликоль (1-1,5М), диметилсульфоксид (1,5-2М). Раствор II меняют на жидкость для заморозки, содержащую WPM, сахарозу (0,2-0,5М), глицерол (3,5-4М), этиленгликоль (1,5-2,5М), диметилсульфоксид (1,5-2М). Физические свойства жидкости для заморозки обеспечивают возможность непосредственного переноса криопробирок из комнатной температуры в жидкий азот. Размораживание осуществлялось при температуре +40°С. Экспланты инкубируют в среде для промывки WPM содержащей сахарозу (1-1,5М) и переносят на среду для восстановления MSm - модифицированную среду Murashige и Skoog (Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture // Physiol. Plant, 1962. - Vol. 15, №2. - P. 473-497.), содержащую 25-30 мг/мл сахарозы, 0,5-1 мг/мл индолил-3-масляной кислоты, 3,5-4 мг/мл N6-(2-изопентил) аденина. В результате использование малообводненных пазушных почек и поэтапной смены сред с различной концентрацией осмолитиков позволяет быстро и с минимальными манипуляциями сохранять растения осины с выживаемостью до 80% сроком до года. Способ подходит для криоконсервации in vitro культур осины как генетически модифицированных клонов, так и ценных селекционных генотипов отобранных в природе.
Анализ известных способов криоконсервации in vitro микрорастений трансгенной и нетрансгенной осины в условиях, проведенный по научно-технической и патентной документации, показал, что совокупность существенных признаков заявляемого способа неизвестна из уровня техники, следовательно, он соответствует такому условию патентоспособности изобретения как «новизна».
Предлагаемый способ реализуется следующим образом.
1. В нестерильных условиях готовятся питательные среды и растворы, содержащие питательные среды и осмолитики, для криоконсервации и восстановления культуры растений осины. В них добавляются необходимые количества макро-, микроэлементов, хелата железа, мио-инозита, объем доводится дистиллированной водой, рН 5,6-5,8. Растворяются необходимые количества сахарозы и осмолитиков (этиленгликоль и глицерол). После этого добавляется навеска агара. Среда разливается по колбам; автоклавирование проводится при 1 атм. (=1 изб. атм.) в течение 25 минут. В охлажденную до 55°С среды и жидкости в ламинар-боксе добавляются стерильные растворы гормонов и диметилсульфоксид в необходимых концентрациях. Полученная среда для восстановления разливается по стерильным культуральным сосудам. Все дальнейшие манипуляции с растительным материалом производятся в ламинар-боксе в условиях стерильного воздуха.
2. Из микрорастений осины изолируют фрагменты размером 2-3 мм, содержащие по одной пазушной почке. Для обезвоживания почки помещают на 30 мин в раствор I, далее экспланты переносят в раствор II на 10 мин. Инкубация происходит при комнатной температуре.
3. В криопробирки объемом 1,5 мл с жидкостью для заморозки вносят по 25 обезвоженных почек. Инкубируют 10 мин при комнатной температуре, жидкость меняется и добавляется свежая. Криопробирки с эксплантами сразу переносят в жидкий азот. Хранение проводят в жидком азоте в течение года.
4. Размораживание осуществляется при температуре +40°С на водяной бане в течение 1 минуты. После экспланты переносятся в среду для промывки и инкубируются в ней течение 20 мин при комнатной температуре. Далее они переносятся на среду для восстановления и культивируются до прорастания побегов из пазушных почек. Восстановление осуществляется при длиннодневном режиме освещения 16 часов «день», 8 часов «ночь» интенсивностью 5000 люкс, при температуре +22°С. Процент выживания оценивается после 2 недель инкубации на среде для восстановления.
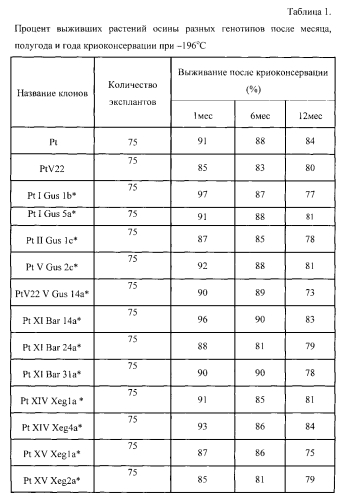
Кроме криоконсервации растений дикого типа, данный способ пригоден для длительной криоконсервации растений генетически модифицированной осины с рекомбинантными генами. Была проведена криоконсервация разных нетрансформированных генотипов осины (Pt, PtV22) и трансгенных растений осины с разными рекомбинантными генами (Gus, Bar, Xeg,). Выживаемость и трансгенных и нетрансгенных клонов всех генотипов после года криоконсервации в жидком азоте составляла в среднем 80% (таблица 1).
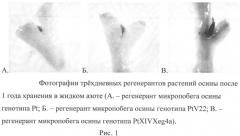
На рисунке 1 показаны размороженные трехдневные экспланты после года криоконсервации в жидком азоте. На рисунке видно, что дифференцированная ткань стебля и черешка листа отмирает и обесцвечивается, жизнеспособной остается только почка, обеспечивая прямую регенерацию без каллусообразования.
На рисунке 2 показаны двухнедельные экспаланты после года криоконсервации в жидком азоте. Доказано, что идет прямая регенерация без образования каллуса, а следовательно, генотип сохраняется без изменения после процесса замораживания. Сохранение экспрессии рекомбинантных генов в трансгенных растениях осины после года криохранения при температуре -196°С подтверждено методом ОТ-ПЦР на селективного гена nptII (рис. 3).
Преимуществом предложенного способа проведения криоконсервации in vitro растений осины является сохранение параметров микрорастений. Предложенный способ криоконсервации не является затратным, так как требует лишь смены осмолитических сред без закупки дополнительного оборудования для обезвоживания и медленного замораживания. Также данный способ отличается быстротой исполнения и не требует длительной подготовки растений к криоконсервации. Поэтому способ может быть успешно использован для научных исследований, сохранения ценных генотипов осины или для создания криобанков посадочного материала растений в лесном хозяйстве.
1. Способ криоконсервации пазушных почек in vitro растений осины, заключающийся в изоляции пазушных почек, предварительном их обезвоживании в средах, содержащих осмолитики, переносе почек в криопробирки, криоконсервации криопробирок с почками в жидком азоте, оттаивании почек и посткриогенной регенерации из них растений, отличающийся тем, что на этапе обезвоживания перед быстрым замораживанием сначала почки помещают в раствор I, содержащий питательную среду и осмолитики (WPM с добавлением к сахарозе (0,2-0,5М) глицерола (1,7-2,5М)), затем почки переносят в раствор II, содержащий питательную среду и осмолитики (WPM, сахароза (0,2-0,5М), глицерол (2,5-3,5М), этиленгликоль (1-1,5М), диметилсульфоксид (1,5-2М)), с последующим переносом в жидкость для замораживания (WPM, содержащая сахарозу (0,2-0,5М), глицерол (3,5-4М), этиленгликоль (1,5-2,5М), диметилсульфоксид (1,5-2М)).
2. Способ по п.1, отличающийся тем, что в качестве растений осины используются генетически модифицированные растения осины с рекомбинантными генами.