Штамм бактериофага staphylococcus aureus sa20, обеспечивающий разрушение биопленок, образуемых бактериями рода staphylococcus
Иллюстрации
Показать всеИзобретение относится к микробиологии и касается штамма бактериофага Staphylococcus aureus. Предложенный штамм обеспечивает разрушение биопленок, образуемых бактериями рода Staphylococcus, и содержит ген, кодирующий альфа-субъединицу рибонуклеотидредуктазы 1b. Штамм депонирован в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» под номером Ph-1312. Штамм бактериофага обладает широким спектром литической активности в отношении тест-штаммов и клинических изолятов бактерий рода Staphylococcus и может быть использован при создании антимикробных препаратов, вызывающих гибель бактерий рода Staphylococcus. 7 ил., 1 табл., 8 пр.
Реферат
Изобретение относится к области медицинской микробиологии и представляет собой штамм бактериофага Staphylococcus aureus SA20, обладающий высокой вирулентностью в отношении планктонных клеток и биопленок, образованных бактериями рода Staphylococcus.
Бактерии рода Staphylococcus, входящие в семейство Staphylococcaceae, представляют собой грамположительные факультативно-анаэробные аспорогенные бактерии шаровидной формы. Большинство бактерий из этого рода в норме обитают на коже и слизистых человека и животных, а также входят в состав почвенных микробных сообществ [1]. Считается, что стафилококковые инфекции, более 85% которых вызваны бактериями Staphylococcus aureus, опасны для новорожденных и для людей с ослабленным или нарушенным иммунитетом. В последние годы участились случаи гнойно-септических поражений у людей, вызванных стафилококками, а при нарушении работы иммунной системы у пациентов инфицирование и гнойно-некротические процессы в ранах могут вызывать и другие бактерии рода Staphylococcus - Staphylococcus capitis, Staphylococcus epidermidis, Staphylococcus haemolyticus, Staphylococcus pseudintermedius и др. Фактором, осложняющим лечение инфекций, вызванных стафилококками, является способность этих бактерий образовывать биопленку на поверхности пораженных участков тканей. Формирование биопленок ухудшает возможность доставки антибактериальных терапевтических средств в очаг воспаления, следствием чего является наличие у бактерий повышенной устойчивости к воздействию антибактериальных препаратов [2]. Кроме того, в последние годы серьезной проблемой является приобретение клиническими изолятами бактерий, включая бактерии рода Staphylococcus, множественной устойчивости к антибиотикам. В связи с этим существует необходимость в средствах лечения, способных разрушать биопленки, сформированные бактериями рода Staphylococcus, включая антибиотикоустойчивые бактерии. Таким средством лечения могут быть литические бактериофаги, способные разрушать антибиотикоустойчивые бактерии. Важным свойством некоторых литических бактериофагов является способность к разрушению биопленок, сформированных патогенными микроорганизмами. Эффект разрушения биопленки может быть опосредован как размножением бактериофага в ходе литического цикла развития, так и за счет действия продуцируемых бактериофагом специфических белков-лизинов.
Известен штамм бактериофага КСТС 11154 BP, обладающий литической активностью против Staphylococcus aureus [3]. Данный бактериофаг относится к группе phi 29 - подобных фагов семейства Podoviridae, которое объединяет известные умеренные фаги, в описании патента не указывается литический спектр бактериофага и примеры строятся на использовании одного чувствительного штамма S. aureus, выделенного от маститных коров.
Известен штамм бактериофага КАСС 9700IP, обладающий литической активностью против Staphylococcus aureus [4]. В описании патента не указывается литический спектр бактериофага и примеры строятся на использовании одного чувствительного штамма S. aureus, выделенного от маститных коров.
Известен препарат пиобактериофага поливалентного очищенного, включающего в себя бактериофаги Staphylococcus, Streptococcus, Proteus, Klebsiella, Ε. coli, Pseudomonas aeruginosas также и бактериофаги Serratia и Enterobacter. Способ получения пиобактериофага поливалентного включает культивирование бактерий и бактериофагов Staphylococcus, Streptococcus, Proteus, Klebsiella, Ε. coli, Pseudomonas aeruginosa в жидкой питательной среде с последующей очисткой путем микро- и ультрафильтрации, при этом дополнительно проводят культивирование бактерий и бактериофагов Serratia и Enterobacter, а также очистку полученных бактериофагов Serratia и Enterobacter, которые вводят в состав препарата [5]
Известный поливалентный пиобактериофаг обладает широким спектром литической активности, в том числе против некоторых штаммов Staphylococcus aureus.
Недостатком известных бактериофагов является отсутствие литической активности в отношении ряда штаммов Staphylococcus aureus, включая штаммы с множественной устойчивостью к антибиотикам (MRSA), а также в отношении Staphylococcus capitis, Staphylococcus epidermidis, Staphylococcus haemolyticus, Staphylococcus pseudintermedius и др. Кроме того, недостатком известных бактериофагов является то, что способность разрушать биопленки у них отсутствует или слабо выражена.
Наиболее близким прототипом к заявляемому штамму является видоспецифический вирулентный штамм Staphylococcus aureus SA18, проявляющий литическую активность в отношении широкого спектра штаммов Staphylococcus aureus, включая штаммы MRSA. Штамм бактериофага Staphylococcus aureus SA18 выделен из клинического материала, и депонирован в Государственной Коллекции патогенных микроорганизмов и клеточных культур (ГКПМ - ОБОЛЕНСК) Государственного научного центра прикладной микробиологии и биотехнологии (ФБУН ГНЦ ПМБ) под регистрационным номером Ph 62 [6].
Недостатком прототипа является отсутствие литической активности в отношении стафилококковых бактерий, не принадлежащих к виду Staphylococcus aureus, а также отсутствие способности разрушать биопленки, сформированные различными стафилококками.
Задачей изобретения является получение стафилококкового бактериофага, способного разрушать биопленки, сформированные различными штаммами Staphylococcus aureus и других видов стафилококков.
Техническим результатом изобретения является получение штамма бактериофага Staphylococcus aureus SA20 (бактериофага SA20), обладающего широким спектром литической активности в отношении бактерий рода Staphylococcus и способного разрушать биопленки, сформированные различными штаммами Staphylococcus aureus, Staphylococcus capitis, Staphylococcus epidermidis, Staphylococcus haemolyticus, Staphylococcus intermedius, Staphylococcus pseudintermedius и других видов стафилококков, в ходе литического цикла размножения бактериофага SA20 или за счет продукции литических фаговых белков-лизинов.
Указанный результат достигается путем выделения бактериофага из мазков зева и миндалин добровольцев, характеризации выделенного бактериофага морфологическими, биохимическими и молекулярно-генетическими методами, исследования у выделенного бактериофага спектра литической активности в отношении широкого спектра штаммов Staphylococcus aureus и штаммов других видов стафилококков, а также исследования способности выделенного бактериофага эффективно разрушать биопленки, сформированные бактериями рода Staphylococcus.
Сущность изобретения заключается в следующем.
Штамм бактериофага Staphylococcus aureus SA20 выделен из клинических образцов (мазки зева и миндалин добровольцев) и депонирован в Коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки Государственный научный центр вирусологии и биотехнологии «Вектор» под номером Ph-1312.
Штамм бактериофага Staphylococcus aureus SA20 характеризуется следующими свойствами.
Морфологические признаки.
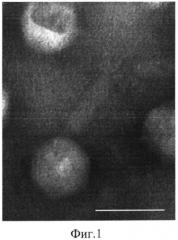
На газоне чувствительного бактериального штамма Staphylococcus aureus АТСС 25923 бактериофаг Staphylococcus aureus SA20 образует прозрачные округлые пятна лизиса диаметром 1,5-2 мм, вторичный рост отсутствует. Бактериофаг Staphylococcus aureus SA20 на электронной микрофотографии выглядит как типичный представитель семейства Myoviridae. Головка бактериофага имеет икосаэдрическую форму, диаметр 85 нм, хвост состоит из цилиндрической части длиной 100-105 нм, диаметром 20 нм, базальной пластинки и «иглы».
Геном бактериофага Staphylococcus aureus SA20 представлен двуцепочечной ДНК, размером приблизительно 140 тыс п.н. и имеет HindIII-фрагмент размером 3911 п.н., содержащий ген, кодирующий альфа-субъединицу рибонуклеотидредуктазы 1b, являющийся его маркерным признаком и свидетельствующий о принадлежности бактериофага Staphylococcus aureus SA20 к семейству Myoviridae.
Бактериофаг Staphylococcus aureus SA20 размножается на штамме Staphylococcus aureus АТСС 25923 на обычных питательных средах (Luria-Bertani бульон/агар) при температуре 37°C в течение 16-18 часов. Бактериофаг Staphylococcus aureus SA20 сохраняет литическую активность при температуре 4°C-6°C в пептонной воде в течение 1 года. Бактериофаг хранится с сохранением титра в течение 1 года с добавлением глицерина до конечной концентрации 15% при -20°С.
Физико-химические свойства бактериофага Staphylococcus aureus SA20. Литическая активность бактериофага полностью инактивируется при нагреве в течение 60 мин при температуре 65°C. Жизнеспособность сохраняется в диапазоне рН 5.6-11.4. Однократное замораживание-оттаивание бактериофага Staphylococcus aureus SA20 приводит к снижению титра на 5 порядков, а двухкратное замораживание - оттаивание приводит к полной инактивации бактериофага. Бактериофаг Staphylococcus aureus SA20 устойчив к 20% раствору хлороформа в течение часа. Экспозиция ультрафиолетом в течение 5 минут приводит к инактивации бактериофага Staphylococcus aureus SA20.
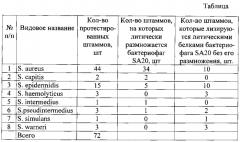
Литический спектр бактериофага Staphylococcus aureus SA20. Для оценки круга штаммов-хозяев бактериофага использовали 72 штамма бактерий Staphylococcus spp. из Коллекции экстремофильных микроорганизмов и типовых культур ИХБФМ СО РАН, включая 44 штамма Staphylococcus aureus и 28 штаммов бактерий других видов из рода Staphylococcus. В них входят штаммы стафилококков, полученные из клинических образцов, образцов сточных вод, и штаммы, полученные из международной коллекции АТСС. Предварительно видовую принадлежность бактерий использованных штаммов подтверждают путем секвенирования гена 16S pРНК.
Бактериофаг Staphylococcus aureus SA20 способен размножаться в 34 из 44 протестированных штаммов Staphylococcus aureus, а также в 2 из 2 протестированных штаммов Staphylococcus capitis, в 5 из 15 протестированных штаммов Staphylococcus epidermidis, в 1 из 1 протестированного штамма Staphylococcus intermedius и в 1 из 3 протестированных штаммов штаммах Staphylococcus pseudintermedius. Спектр литической активности заявленного бактериофага Staphylococcus aureus SA20 представлен в таблице.
Литический цикл развития бактериофага Staphylococcus aureus SA20 в вышеперечисленных штаммах бактерий из рода Staphylococcus обусловливает способность бактериофага Staphylococcus aureus SA20 разрушать биопленки, сформированные этими штаммами.
Кроме того, бактериофаг Staphylococcus aureus SA20 способен разрушать биопленки, сформированные 10 из 44 протестированных штаммов Staphylococcus aureus, а также 10 из 15 протестированных штаммов Staphylococcus epidermidis, 3 из 3 протестированных штаммов штаммах Staphylococcus haemolyticus, 2 из 3 протестированных штаммов Staphylococcus pseudintermedius, одним штаммом Staphylococcus simulans и 2 из 2 протестированных штаммов Staphylococcus warneri. Поскольку при разрушении биопленок, сформированных бактериями вышеперечисленных штаммов, концентрация фаговых частиц до и после воздействия заявленного бактериофага Staphylococcus aureus SA20 не изменялась, следовательно, разрушение биопленки обеспечивают белки-лизины бактериофага Staphylococcus aureus SA20. Спектр активности белков-лизинов заявленного бактериофага Staphylococcus aureus SA20 представлен в таблице.
Таким образом, впервые получен бактериофаг Staphylococcus aureus SA20, принадлежащий к семейству Myoviridae, способный разрушать биопленки, сформированные бактериями широкого спектра штаммов Staphylococcus aureus и штаммов других видов из рода Staphylococcus. Изобретение иллюстрируется следующими фигурами.
Фиг. 1. Электронная микрофотография частиц бактериофага Staphylococcus aureus SA20. Негативное контрастирование уранилацетатом, просвечивающая электронная микроскопия. Длина масштабной линии соответствует 100 нм.
Фиг. 2. Нуклеотидная последовательность гена, кодирующего альфа-субъединицу рибонуклеотидредуктазы 1b бактериофага Staphylococcus aureus SA20.
Фиг. 3. Аминокислотная последовательность альфа-субъединицы рибонуклеотидредуктазы 1b бактериофага Staphylococcus aureus SA20.
Фиг. 4. Филогенетическое древо, построенное методом объединения ближайших соседей на основе множественного выравнивания последовательности гена альфа-субъединицы рибонуклеотидредуктазы 1b бактериофага Staphylococcus aureus SA20 и филогенетически близких к нему бактериофагов других генотипов.
Фиг. 5. Разрушение биопленки, сформированной Staphylococcus aureus MRSA АТСС 43300, бактериофагом Staphylococcus aureus SA20. А - биопленка Staphylococcus aureus АТСС 43300 без бактериофага, Б -биопленка после воздействия бактериофага Staphylococcus aureus ST20. Окраска генцианвиолетом.
Фиг. 6. Разрушение биопленки, сформированной Staphylococcus capitis КЭМТК 1849, бактериофагом Staphylococcus aureus SA20. А - биопленка Staphylococcus capitis КЭМТК 1849 без бактериофага. Б - биопленка после воздействия бактериофага Staphylococcus aureus SA20, В - биопленка после воздействия коммерческого Бактериофага стафилококкового. Окраска генцианвиолетом.
Фиг. 7. Разрушение биопленки, сформированной клиническим изолятом Staphylococcus aureus КЭМТК 1834, белками-лизинами бактериофага Staphylococcus aureus SA20. А - биопленка Staphylococcus aureus КЭМТК 1834 без бактериофага, Б - биопленка после воздействия бактериофага Staphylococcus aureus SA20, В - биопленка после воздействия коммерческого Бактериофага стафилококкового. Окраска генцианвиолетом.
Для лучшего понимания сущности предлагаемого изобретения, оно иллюстрируется следующими примерами осуществления.
Пример 1. Получение фаголизата штамма бактериофага Staphylococcus aureus SA20.
В 250 мл бульона LB (на 1 л среды 10 г триптона Bacto, 5 г дрожжевого экстракта Bacto, 10 г NaCl) вносят 5 мл ночной культуры Staphylococcus aureus АТСС 25923 и выращивают клетки в течение 4 часов при 37°С при постоянном перемешивании с частотой 200 об/мин. Затем в клеточную культуру вносят бактериофаг Staphylococcus aureus SA20, после чего клетки продолжают инкубировать в течение 12 часов в тех же условиях. Концентрация бактериофагом Staphylococcus aureus SA20 в полученных фаголизатах составляет (1-3)×109 част./мл.
Пример 2. Проверка литической активности штамма бактериофага Staphylococcus aureus SA20 в отношении бактерий Staphylococcus aureus или других бактерий из рода Staphylococcus.
На первом этапе готовят серию разведений суспензии бактериофага Staphylococcus aureus SA20 известной концентрации в растворе 0,15 M растворе NaCl. Затем 100 мкл соответствующего разведения смешивают с 100 мкл ночной культуры соответствующего штамма Staphylococcus aureus или других бактерий из рода Staphylococcus. Полученную суспензию вносят в 10 мл расплавленного до 42°С 0,7% LB-arapa и после быстрого перемешивания содержимое пробирки выливают на поверхность 1,5% LB-arapa в чашке Петри. После застывания верхнего слоя чашку переворачивают и инкубируют в термостате при 37°С в течение 16-18 ч. Пятна лизиса бактериофага Staphylococcus aureus SA20 на газоне бактериальной культуры подсчитывают для определения концентрации бактериофага в анализируемой системе. Результаты проверки литической активности бактериофага Staphylococcus aureus SA20 в отношении 44 штаммов Staphylococcus aureus и 28 штаммов других бактерий из рода Staphylococcus представлены в таблице. Из этой таблицы видно, что бактериофаг Staphylococcus aureus SA20 способен литически размножаться в бактериях 34 штаммов Staphylococcus aureus и 9 штаммов других бактерий из рода Staphylococcus. Также из таблицы видно, что бактериофаг Staphylococcus aureus SA20 способен лизировать бактерии 10 штаммов Staphylococcus aureus и 19 штаммов других бактерий из рода Staphylococcus за счет белков-лизинов.
Пример 3. Определение морфологии вирионов бактериофага Staphylococcus aureus SA20 методом электронной микрофотографии.
Исследование проводят методом негативного контрастирования. Образец фаголизата, полученный, как описано в Примере 1, очищают методом дифференциального центрифугирования и фиксируют в 1% растворе глутарового альдегида, приготовленного на 0,1 M фосфатном буфере (рН 7,0). Фиксированный бактериофаг Staphylococcus aureus SA20 наносят на коллодиевые подложки, укрепленные на никелевых сетках. Нанесенные на подложки образцы контрастируют 1% водным раствором уранилацетата и изучают с использованием трансмиссионного электронного микроскопа JEM 1400 (JOL, Япония). На электронной микрофотографии, представленной на фиг. 1, видно, что бактериофаг Staphylococcus aureus SA20 выглядит, как типичный представитель семейства Myoviridae. Головка бактериофага имеет икосаэдрическую форму, диаметр 85 нм, хвост состоит из цилиндрической части длиной 100-105 нм, диаметром 20 нм, базальной пластинки и «иглы».
Пример 4. Выделение ДНК бактериофага Staphylococcus aureus SA20.
ДНК бактериофага Staphylococcus aureus SA20 выделяют из фаголизата, полученного, как описано в Примере 1. К фаголизату добавляют РНКазу и ДНКазу до конечных концентраций 5 мкг/мл и инкубируют при 37°С в течение часа. Затем к полученному раствору добавляют 0,5М ЭДТА до конечной концентрации 20 мМ, протеинкиназу К до конечной концентрации 100-200 мкг/мл и 10% SDS до конечной концентрации 0,5%. Смесь инкубируют 3 часа при 55°С. ДНК выделяют методом экстракции фенолом/хлороформом. ДНК из полученного экстракта осаждают добавлением изопропанола в количестве 0,8 от объема раствора и 5М NaCl в количестве 0,05 от объема раствора. Смесь выдерживают 20 минут при комнатной температуре. Раствор центрифугируют 15 мин при 14000 об/мин на центрифуге Eppendorf miniSpin plus. Осадок растворяют в деионизованной воде. К полученному раствору добавляют 2,5 объема перегнанного 96% этилового спирта и 0,05 объема 5М NaCl, после чего проводят переосаждение ДНК в течение ночи при -20°С. Затем раствор центрифугируют 15 мин при 14000 об/мин, осадки промывают 70%-ным и 96%-ным перегнанным этиловым спиртом, высушивают в термостате при 37°С и растворяют осадки в деионизованной воде. Гомогенность препарата ДНК бактериофага Staphylococcus aureus SA20 проверяют электрофорезом в 0,6%-ном агарозном геле.
Пример 5. Определение нуклеотидной последовательности фрагмента ДНК бактериофага Staphylococcus aureus SA20.
На первом этапе получают HindIII-фрагмент ДНК бактериофага Staphylococcus aureus SA20. Для этого к 0,1 мкг/мл ДНК бактериофага Staphylococcus aureus SA20, очищенной, как описано в Примере 3, добавляют 1 единицу активности эндонуклеазы рестрикции HindIII (СибЭнзим, Россия), 2 мкл 10-кратного рестрикционного буфера, прилагаемого фирмой-производителем к этой эндонуклеазе рестрикции, и деионизованную воду - до общего объема 20 мкл. Смесь инкубируют при температуре 37°С в течение 1 часа. Продукты гидролиза анализируют в 1% агарозном геле и элюируют фрагмент размером около 3911 п.н. Затем полученный HindIII-фрагмент ДНК бактериофага встраивают в векторную плазмиду pUC18, обработанную эндонуклеазами рестрикции HindIII (СибЭнзим, Россия), с помощью ДНК-лигазы фага Т4. Продуктом лигирования трансформируют клетки Escherichia coli XL 1-Blue, которые высевают на твердую агаризованную среду LB-arap, содержащую ампициллин в концентрации 100 мкг/мл. Трансформированные клетки растят в течение 18 часов при 37°С. Лизаты полученных колоний анализируют методом ПЦР с использованием праймеров M13/pUC direct: 5′-GCCAGGGTTTTCCCAGTCACGA-3′ и M13/pUC reverse: 5′-GAGCGGATAACAATTTCACACAGG-3′ и набора для проведения ПЦР GeneAmpR XL PCR Kit (Applied Biosystems, США) согласно инструкции производителя. Результаты амплификации анализируют методом электрофореза в 1% агарозном геле.
На втором этапе секвенируют полученный ПЦР-фрагмент с использованием праймеров M13/pUC direct и M13/pUC reverse, реакцию секвенирования ведут с использованием реактивов BigDye Terminator v3.1 и 5Х Sequencing Buffer (Applied Biosystems, США) в условиях, указанных производителем. Полученные последовательности ПЦР-фрагментов анализируют с использованием базы данных GenBank. По результатам анализа заказывают вторую пару праймеров SA20/dir 5′-ATGCTAGAGAAGTTATGACA-3′ и SA20/for 5′-ATAACTTCTCTAGCATCATG-3′ для продолжения секвенирования ПЦР-фрагмента; при этом секвенирования ведут, как описано выше.
Полученные последовательности ПЦР-фрагментов анализируют с использованием базы данных GenBank. Результаты анализа показывают, что ПЦР-фрагмент содержит последовательность гена, кодирующего альфа-субъединицу рибонуклеотидредуктазы 1b. Последовательности гена и кодируемого им белка приведены на фиг. 2 и фиг. 3. Результаты филогенетического анализа, приведенного на фиг. 4, свидетельствуют о том, что последовательность гена, кодирующего альфа-субъединицу рибонуклеотидредуктазы 1b бактериофага Staphylococcus aureus SA20, отличается от соответствующих ближайших последовательностей, и, следовательно, эта последовательность может служить маркерным признаком бактериофага Staphylococcus aureus SA20.
Пример 6. Разрушение биопленки, сформированной бактериями Staphylococcus aureus АТСС43300, за счет размножения бактериофага Staphylococcus aureus SA20 в ходе литического цикла развития.
Формирование биопленки тест-штамма Staphylococcus aureus АТСС43300 проводят на покровном стекле в бульоне LB в течение пяти суток при температуре 37°С. К сформированной биопленке добавляют бактериофаг Staphylococcus aureus SA20 до конечной концентрации фаговых частиц 3,3×107 БОЕ/ мл и инкубируют в течение 20 часов при температуре 37°С. Подсчет частиц бактериофага проводят в культуральной жидкости до воздействия бактериофага Staphylococcus aureus SA20 на биопленку и после инкубации с биопленкой. Воздействие бактериофага на биопленку оценивают визуально по мутности питательной среды, а также методом световой микроскопии, окрашивая покровные стекла с биопленкой генцианвиолетом. Результаты световой микроскопии иллюстрирует фиг. 5, из которой видно, что в контрольном образце с биопленкой Staphylococcus aureus АТСС43300, не обработанной бактериофагом Staphylococcus aureus SA20, наблюдается сплошной рост Staphylococcus aureus (фиг. 5А); среда остается мутной. В опытном образце после инкубации биопленки с бактериофагом Staphylococcus aureus SA20 на покровном стекле виден клеточный дебрис, увеличенные в размере мертвые клетки и остатки матрикса биопленки, за счет которого клетки прикрепляются к покровному стеклу (фиг. 5Б); среда остается прозрачной, а концентрация фаговых частиц увеличивается на порядок и составляет 2,6×108 БОЕ/мл. Эти результаты свидетельствуют о разрушении биопленки за счет размножения бактериофага Staphylococcus aureus SA20 в ходе литического цикла развития.
Пример 7. Разрушение биопленки, сформированной бактериями Staphylococcus capitis КЭМТК 1849, за счет размножения бактериофага Staphylococcus aureus SA20 в ходе литического цикла развития.
Формирование биопленки Staphylococcus capitis КЭМТК 1849 проводят на покровном стекле в бульоне LB в течение пяти суток при температуре 37°С. К сформированной биопленке добавляют бактериофаг Staphylococcus aureus SA20 до конечной концентрации фаговых частиц 6×106 БОЕ/мл или коммерческий препарат Бактериофаг стафилококковый производства НПО «Микроген» в исходном титре производителя 105 БОЕ/мл и инкубируют в течение 20 часов при температуре 37°С. Подсчет частиц бактериофага проводят в культуральной жидкости до воздействия бактериофагов и после инкубации с биопленкой. Воздействие бактериофагов на биопленку оценивают визуально по мутности питательной среды, а также методом световой микроскопии, окрашивая покровные стекла с биопленкой генцианвиолетом. Результаты световой микроскопии иллюстрирует фиг. 6, из которой видно, что в контрольном образце, не обработанном бактериофагами, наблюдается многослойная биопленка, сформированная Staphylococcus capitis КЭМТК 1849 (фиг. 6А), среда мутная. В опытном образце после инкубации биопленки с бактериофагом Staphylococcus aureus SA20 на покровном стекле видны увеличенные в размере мертвые клетки, фрагменты матрикса и небольшой фрагмент биопленки размером 2×2 мм, содержащей S. capitis КЭМТК 1849 (фиг. 6Б); среда остается прозрачной, концентрация частиц бактериофага Staphylococcus aureus SA20 увеличивается на два порядка и составляет 6×108 БОЕ/мл. В образце биопленки, инкубированной с прототипным Бактериофагом стафилококковым, сохраняется значительная часть биопленки (примерно 22×22 мм) с жизнеспособными клетками Staphylococcus capitis (фиг. 6В). Эти результаты свидетельствуют о разрушении биопленки, сформированной Staphylococcus capitis, за счет размножения бактериофага Staphylococcus aureus SA20 в ходе литического цикла развития, что не обеспечивается прототипным бактериофагом.
Пример 8. Разрушение биопленки, сформированной бактериями клинического изолята Staphylococcus aureus КЭМТК 1834, за счет продукции бактериофагом Staphylococcus aureus SA20 белков-лизинов.
Формирование биопленки проводят на покровном стекле в бульоне LB в течение пяти суток при температуре 37°С. Предварительно по биохимическим свойствам и результатам секвенирования гена 16S РНК использованный штамм определяют как Staphylococcus aureus, причем бактериофаг Staphylococcus aureus SA20 не дает фагового потомства на клетках этого штамма. К сформированной биопленке добавляют бактериофаг Staphylococcus aureus SA20 до конечной концентрации 2,6×1010 БОЕ/мл или коммерческий препарат Бактериофаг стафилококковый производства НПО «Микроген» в исходном титре производителя 105 БОЕ/мл и инкубируют в течение 20 часов при температуре 37°С. Подсчет частиц бактериофага проводят в культуральной жидкости до воздействия бактериофагов на биопленку и после инкубации с биопленкой. Воздействие бактериофага на биопленку оценивают визуально по мутности питательной среды, а также методом световой микроскопии, окрашивая покровные стекла с биопленкой генцианвиолетом. Результаты световой микроскопии иллюстрирует фиг. 7, из которой видно, что в контрольном образце с биопленкой Staphylococcus aureus КЭМТК 1834, не обработанной бактериофагами, наблюдается сплошной рост бактерий Staphylococcus aureus (фиг. 7А), среда мутная. В опытном образце после инкубации биопленки с бактериофагом Staphylococcus aureus SA20 на покровном стекле виден клеточный дебрис и остатки матрикса биопленки, за счет которого клетки прикрепляются к покровному стеклу (фиг. 7Б); среда остается прозрачной с содержанием частиц бактериофага Staphylococcus aureus SA20 1,1×1010 БОЕ/ мл. В образце биопленки, инкубированной с прототипным Бактериофагом стафилококковым, биопленка сохраняется на большей части стекла (примерно 22×22 мм) (фиг. 7 В), титр прототипного бактериофага составляет 1,3×105 БОЕ/мл.
Эти результаты свидетельствуют о том, что разрушение биопленки произошло за счет белков-лизинов бактериофага Staphylococcus aureus SA20.
Таким образом, впервые получен штамм бактериофага Staphylococcus aureus SA20, обладающий широким спектром литической активности в отношении бактерий рода Staphylococcus и способный разрушать биопленки, сформированные различными штаммами Staphylococcus aureus, Staphylococcus capitis, Staphylococcus epidermidis, Staphylococcus haemolyticus, Staphylococcus intermedius, Staphylococcus pseudintermedius в ходе литического цикла размножения бактериофага Staphylococcus aureus SA20 или за счет продукции литических фаговых белков-лизинов.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Madigan M., Martinko J. Brock Biology of Microorganisms (11th ed.). 2005. Prentice Hall. ISBN 0-13-144329-1.
2. Wang R., Khan В., Cheung G., Bach T., Jameson-Lee M., Kong K., Queck S., Otto M. Staphylococcus epidermidis surfactant peptides promote biofilm maturation and dissemination of biofilm-associated infection in mice. // J. Clin. Invest. 2011. V. 121, P. 238-248.
3. Патент US 8043613 B2, опубл. 25.10.2011.
4. Патент US 8071352 B2, опубл. 06.12.2011.
5. Патент RU 2153534 C1, опубл. 27.07.2000.
6. Патент RU 2503716 C1, опубл. 10.01.2014.
Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus, содержащий ген, кодирующий альфа-субъединицу рибонуклеотидредуктазы 1b, имеющий нуклеотидную последовательность SEQ ID NO 1, представленную на фиг. 2, депонированный в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» под номером Ph-1312.