Способ получения вирусного антигена и вакцин
Иллюстрации
Показать всеНастоящее изобретение относится к фармацевтической промышленности. Предложены способ получения вирусного антигена из оболочечного вируса и применение этого способа в производстве вакцинного препарата, содержащего указанный вирусный антиген. Предложенный способ включает получение и осветление жидкости, содержащей оболочечный вирус, получение концентрированного жидкого продукта, солюбилизацию оболочечного вируса, находящегося в концентрированном жидком продукте, отделение вирусного антигена и его очитку. При этом после стадии получения концентрированного жидкого продукта непосредственно следует стадия солюбилизации оболочечного вируса, присутствующего в концентрированном жидком продукте. Стадия солюбилизации осуществляется путем добавления детергента или смеси детергентов, содержащей катионный детергент. Предложенный способ выделения позволяет получить высокий выход выделенного вирусного антигена при минимальном количестве стадий, при этом получаемый вирусный антиген имеет высокую чистоту. Предложенный способ получения вирусного антигена может быть использован в фармацевтической промышленности для получения вакцинного препарата. 2 н. и 26 з.п. ф-лы, 2 ил., 9 табл., 4 пр.
Реферат
Область техники изобретения
Настоящее изобретение принадлежит к области фармацевтической промышленности и относится к способу получения фармацевтической композиции, содержащей вирусный антиген из оболочечного вируса.
Описание уровня техники изобретения
В настоящее время вирусы, которые используют для производства фармацевтических композиций, таких как вакцинные препараты или их промежуточные формы, размножают в системах культивирования на основе яиц или на основе клеток. Независимо от соответствующей используемой системы, обработка вирусных антигенов из каждой системы культивирования является очень важным и решающим шагом в производстве фармацевтических композиций, таких как вакцинные препараты. Что касается системы на основе яиц, основным требованием обработки является достаточное удаление яично-эмбриональных белков, таких как овальбумин, а что касается системы на основе клеток, обработка должна соответствовать таким требованиям, как значительное уменьшение количества ДНК клеток-хозяев и белков клеток-хозяев. Кроме того, не относящиеся к продукту вирусы должны быть в значительной степени удалены.
Что касается очистки вирусных белков, в EP 1982727 A1 раскрыт способ очистки вирусного мембранного белка, включающий стадии отделения клеток, микроносителей и клеточных агломератов от культуральной среды путем осаждения, проведения химической инактивации указанного осадка и солюбилизации указанного осадка, добавления холата натрия, центрифугирования смеси, уменьшения количества детергента путем обработки амберлитом и проведения аффинной хроматографии с последующим элюированием целевого белка.
В US 2011/0014230 A1 описан способ получения вакцинных антигенов, включающий, главным образом, стадию инактивации очищенных вирионов с последующим расщеплением указанных вирионов при помощи детергента.
В US 2009/0060950 A1 раскрыт способ получения противовирусных вакцин, включающий стадии размножения вируса в клетке, накопления указанного вируса в клеточном супернатанте, инактивации указанного вируса, очистки его ультрацентрифугированием в градиенте плотности и обработки его детергентом.
В US 4327182 раскрыт способ получения очищенной субъединичной вакцины против гриппа с использованием метода мембранной фильтрации.
В US 6048537 описан способ получения очищенных антигенов вируса гриппа, включающий стадии концентрирования, очистки и фрагментации.
Другими документами, которые относятся к способам очистки, являются US 2010/0119552 A1; US 2010/0158944 A1; Kalbfuss et al., 2007, Biotech & Bioeng. Vol. 96, No. 5, pp 932-944; Onions et al., 2010, Biologicals, Vol.38, pp 544-551; US 2008/0118970; WO 03/097797; Goerke et al., 2005, Biotechnology and Bioengeneering, Vol. 91, No. 1, pp 12-21; Krober et al., Chem. Eng. Technology 2010, Vol. 33, pp 941-959 и WO 2010/052214 A2.
Несмотря на описанные выше способы, по-прежнему существует потребность и, следовательно, задача создания усовершенствованного способа получения вирусного антигена, в частности, препарата вирусного антигена, и конкретно, фармацевтической композиции, такой как вакцина. В частности, существует необходимость в способе получения, обеспечивающем высокий выход продукта при относительно низкой стоимости производства, который не зависит от штамма вируса, для которого необходимо лишь минимальное количество стадий и который при этом соответствует строгим требованиям низкого содержания ДНК и белков клеток-хозяев, а также посторонних веществ.
Сущность изобретения
Настоящее изобретение относится к следующим аспектам, объектам и предпочтительным вариантам осуществления, которые, соответственно, отдельно или в сочетании, способствуют достижению цели настоящего изобретения:
(1) Способ получения вирусного антигена из оболочечного вируса, включающий следующие стадии в указанном порядке:
a) обеспечение жидкости, содержащей оболочечный вирус,
b) осветление жидкости, содержащей указанный оболочечный вирус, приводящее к получению жидкого продукта, содержащего указанный оболочечный вирус,
c) уменьшение объема жидкого продукта, полученного после стадии b), для получения концентрированного жидкого продукта,
d) солюбилизация оболочечного вируса, присутствующего в жидком продукте, путем добавления детергента или смеси детергентов, содержащей или состоящей из катионного детергента, к концентрированному жидкому продукту, полученному на стадии c),
e) отделение вирусных ядер от композиции, полученной после стадии d),
f) необязательно, удаление катионного детергента из композиции, полученной после стадии e),
и
g) очистка вирусного антигена,
при этом за стадией c) непосредственно следует стадия d).
В предпочтительном варианте осуществления основную стадию очистки, в частности, основную стадию очистки, направленную на очистку оболочечного вируса, предпочтительно хроматографию, не проводят до стадии e). После стадии e) проводят основную стадию очистки. Эта основная стадия очистки, имеющая место после стадии e), направлена на очистку вирусного антигена. Она не направлена на очистку целого вируса или целых вирионов, соответственно. Что касается определения термина «основная стадия очистки» (или «основной способ очистки», соответственно), ссылка делается на определение, приведенное в другом разделе данного документа.
В следующем предпочтительном варианте осуществления единственную выполняемую стадию хроматографии выполняют на стадии g).
В следующем предпочтительном варианте осуществления центрифугирование в градиенте плотности (например, ультрацентрифугирование в градиенте плотности, например, ультрацентрифугирование в градиенте сахарозы) не проводят до стадии e).
В следующем варианте осуществления можно применять дополнительную стадию инактивации вируса, такую как стадия химической инактивации вируса, и/или дополнительную стадию удаления вируса. Тем не менее, вполне возможно, что при применении настоящего изобретения использование такой дополнительной стадии инактивации вируса и/или дополнительной стадии удаления вируса не является необходимым для достижения достаточной инактивации любых патогенов и достаточной очистки, то есть, для достижения инактивации и очистки, которые отвечают соответствующим предписаниям. Это является преимуществом, поскольку пропуск такой дополнительной стадии инактивации вируса и/или дополнительной стадии удаления вируса также способствует усовершенствованию способа, например, с точки зрения минимизации стресса, которому подвергаются желаемые вирусные антигены, и/или уменьшения продолжительности процесса. Однако если проводят дополнительную стадию инактивации вируса, такую как стадия химической инактивации вируса, и/или дополнительную стадию удаления вируса, эту стадию/и не проводят между стадиями c) и d). Как описано в другом разделе, непосредственное следование за стадией c) стадии d), среди прочего, способствует повышению выхода вирусного антигена. В другом аспекте указанную дополнительную стадию инактивации вируса и/или дополнительную стадию удаления вируса не проводят до стадии e). В следующем варианте осуществления указанную дополнительную стадию инактивации и/или дополнительную стадию очистки, например, проводят после стадии g). Кроме того, если проводят такую дополнительную стадию инактивации вируса и/или дополнительную стадию удаления вируса, концентрация химических веществ, необходимая и используемая для получения конечного продукта, который отвечает предписаниям, ниже по сравнению с концентрацией химических веществ, обычно необходимой и используемой для получения конечного продукта, который отвечает предписаниям. Это может быть выгодно, например, с точки зрения уменьшения создаваемого стресса и химических модификаций применительно к вирусным антигенам. Это может стать дополнительным преимуществом для эффективности продукта и, возможно, стабильности продукта.
В соответствии с настоящим изобретением, термин «очистка вирусного антигена» означает основные способы очистки или основные стадии очистки, такие способы очистки, как хроматография или ультрацентрифугирование в градиенте плотности. В одном варианте осуществления основной способ очистки не включает селективную мембранную фильтрацию. Используемой хроматографией может быть ионообменная хроматография, хроматография гидрофобного взаимодействия, комбинированная хроматография, псевдоаффинная хроматография, аффинная хроматография, жидкостно-жидкостная хроматография и тому подобное. В соответствии с настоящим изобретением, термин «основной способ очистки» или «основная стадия очистки» относится к способам, которые являются основными способами очистки, используемыми для очистки (конечного) желаемого продукта. Иными словами, основные способы/стадии очистки направлены на специфическую очистку (конечного) желаемого продукта. В настоящем изобретении, например, указанный (конечный) желаемый продукт представляет собой вирусный антиген, который нужно очистить, но не целый оболочечный вирус до солюбилизации. Другие способы, которые не являются «основным способом очистки», могут служить различным целям, например, цели осветления, цели концентрирования или цели осаждения, иногда с сопутствующим эффектом дополнительной очистки желаемого (конечного) продукта. Результатом применения такой стадии способа, не являющейся «основной стадией очистки» или «основным способом очистки», является то, что эффект очистки желаемого (конечного) продукта после осуществления такого способа/стадии ниже по сравнению с эффектом очистки, который достигается при осуществлении «основного способа/стадии очистки». После проведения основной стадии очистки, предпочтительно, не проводят дополнительные стадии очистки (например, в целях выполнения соответствующих предписаний, вследствие того, что примеси все еще присутствуют в композиции). Стадии удаления вируса и инактивации, такие как стадии химической инактивации, не рассматриваются в качестве основных стадий очистки с этой точки зрения. В соответствии с настоящим изобретением, такие «основные стадии/способы очистки» не проводят до стадии e).
(2) Способ по пункту (1), отличающийся тем, что после стадии d) и до стадии g) удаляют детергент, который был добавлен на стадии d).
В одном варианте осуществления не используют стадию хроматографии для удаления детергента.
(3) Способ по пункту (1) или (2), отличающийся тем, что коэффициент уменьшения объема на стадии c) составляет по меньшей мере 4, предпочтительно по меньшей мере 5.
В предпочтительном варианте осуществления коэффициент уменьшения объема составляет по меньшей мере 4, предпочтительно по меньшей мере 5, или по меньшей мере 9, более предпочтительно по меньшей мере 12, даже более предпочтительно по меньшей мере 13, или по меньшей мере 15, и наиболее предпочтительно по меньшей мере 20, или по меньшей мере 25. Типичный максимальный коэффициент уменьшения объема составляет 30, 35, 40 или 45.
В одном варианте осуществления уменьшение объема на стадии c) проводят на одной единственной стадии. В соответствии с настоящим изобретением, выражение «одна единственная стадия» означает, что проводят только одну стадию уменьшения объема, и эту единственную стадию уменьшения объема не повторяют.
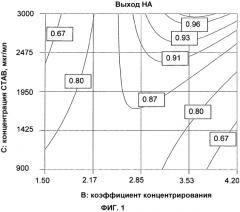
(4) Способ по любому из пунктов (1)-(3), отличающийся тем, что конечная концентрация катионного детергента составляет по меньшей мере примерно 2000 мкг/мл, также предпочтительно по меньшей мере примерно 2500 мкг/мл, также предпочтительно по меньшей мере примерно 3000 мкг/мл, также предпочтительно по меньшей мере примерно 3500 мкг/мл, также предпочтительно по меньшей мере примерно 4000 мкг/мл, также предпочтительно по меньшей мере примерно 4500 мкг/мл, также предпочтительно по меньшей мере примерно 5000 мкг/мл, также предпочтительно по меньшей мере примерно 5500 мкг/мл и также предпочтительно по меньшей мере примерно 6000 мкг/мл.
(5) Способ по любому из предшествующих пунктов, отличающийся тем, что катионный детергент имеет в основе катионы четверичного аммония, такие как цетилтриметиламмоний бромид или другие соли алкилтриметиламмония, соли алкиламина, такие как стеариламиноацетат или кокосовый алкиламиноацетат, бензалкония хлориды и бромиды, например, бензэтония хлорид или метилбензэтония хлорид, стеариламинполигликолевый эфир или олеиламинполигликолевый эфир, предпочтительно, катионный детергент представляет собой цетилтриметиламмоний бромид (CTAB).
В следующем варианте осуществления детергент представляет собой смесь детергентов, которая включает, в качестве детергентов, катионный детергент, описанный в данном документе, предпочтительно CTAB, и неионный детергент, описанный в данном документе, предпочтительно член семейства Tween, предпочтительно Tween-80.
(6) Способ по любому из предшествующих пунктов, отличающийся тем, что за стадией b) непосредственно следует стадия c), за которой непосредственно следует стадия d).
В следующем варианте осуществления за стадией d) непосредственно следует стадия e).
(7) Способ по любому из предшествующих пунктов, отличающийся тем, что не происходит замены детергента.
(8) Способ по любому из предшествующих пунктов, отличающийся тем, что нуклеазу или другой расщепляющий ДНК фермент, предпочтительно бензоназу®, не добавляют до стадии d), предпочтительно нуклеазу не добавляют на всех стадиях способа.
(9) Способ по любому из предшествующих пунктов, отличающийся тем, что оболочечный вирус выбран из группы, состоящей из оболочечных РНК вирусов, оболочечных ДНК вирусов или оболочечных ретровирусов, при этом оболочечные РНК вирусы включают флавивирусы, тогавирусы, коронавирусы, вирусы гепатита D, филовирусы, рабдовирусы, буньявирусы, ортомиксовирусы, парамиксовирусы и аренавирусы, и оболочечные ДНК вирусы включают гепаднавирусы, вирусы герпеса и поксвирусы, предпочтительно, оболочечный вирус выбран из оболочечных РНК вирусов, более предпочтительно, оболочечный вирус представляет собой ортомиксовирус, наиболее предпочтительно вирус гриппа, такой как вирус гриппа A, B или C.
(10) Способ по любому из предшествующих пунктов, отличающийся тем, что жидкость на стадии a) получена из культуры для размножения оболочечного вируса на основе клеток или культуры для размножения оболочечного вируса на основе яиц.
(11) Способ по пункту (10), отличающийся тем, что культура для размножения оболочечного вируса на основе клеток содержит клетки клеточной линии млекопитающего, предпочтительно клеточной линии животного.
(12) Способ по любому из пунктов (10) или (11), отличающийся тем, что клетки клеточной линии млекопитающего выбраны из группы, состоящей из Vero, PerC6, BHK, 293, COS, PCK, MRC-5, MDCK, MDBK и WI-38, предпочтительно, клетки представляют собой клетки MDCK.
(13) Способ по любому из пунктов (10)-(12), отличающийся тем, что клетки культивируют как адгезивные клетки.
(14) Способ по пункту (10), отличающийся тем, что культура для размножения оболочечного вируса на основе яиц включает куриные яйца.
(15) Способ по любому из предшествующих пунктов, отличающийся тем, что жидкость на стадии a) получают с использованием одноразового биореактора.
Использование одноразового биореактора может способствовать дальнейшему усовершенствованию способа по настоящему изобретению по сравнению с общепринятыми способами, например, в отношении самого полученного продукта, например, с точки зрения качества и/или чистоты. Это, в частности, является преимуществом, если способ применяют в крупном масштабе, например, в промышленных масштабах.
(16) Способ по любому из предшествующих пунктов, отличающийся тем, что стадию осветления b) проводят с применением метода, выбранного из группы, состоящей из центрифугирования, проточной фильтрации вдоль потока и глубинной фильтрации.
В одном варианте осуществления условия центрифугирования соответствуют, например, равно или менее чем 10000 g RCF (относительной центробежной силы) в течение менее чем 2 мин, предпочтительно, равно или менее чем 3000 g RCF в течение равно или менее чем 2 мин, более предпочтительно, равно или менее чем 500 g RCF в течение равно или менее чем 2 мин, даже более предпочтительно, равно или менее чем 300 g RCF в течение равно или менее чем 2 мин. В соответствии с настоящим изобретением, «g» относится к стандартному ускорению, вследствие силы тяжести на поверхности земли.
В одном варианте осуществления для проточной фильтрации вдоль потока размер пор микрофильтрационных мембран составляет, например, по меньшей мере 0,2 мкм, предпочтительно по меньшей мере 0,45 мкм, и даже более предпочтительно по меньшей мере 0,65 мкм.
В одном варианте осуществления для глубинной фильтрации, например, используют фильтры 0,2 мкм-7 мкм. Кроме того, в целях дальнейшего повышения выхода продукта и/или предотвращения засорения фильтра можно использовать предварительный фильтр.
(17) Способ по любому из предшествующих пунктов, отличающийся тем, что стадию концентрирования c) проводят, применяя метод, выбранный из группы, состоящей из проточной фильтрации вдоль потока (TFF), ультрацентрифугирования и осаждения. TFF представляет собой TFF ультрафильтрацию или TFF ультрафильтрацию и диафильтрацию на одной стадии (TFF ультрафильтрация/диафильтрация).
В одном варианте осуществления, если для стадии c) используют проточную фильтрацию вдоль потока, порог отсечения по молекулярной массе ультрафильтрационных мембран может, например, быть равен или менее чем 1000 кДа, предпочтительно равен или менее чем 750 кДа, более предпочтительно равен или менее чем 500 кДа, даже более предпочтительно равен или менее чем 300 кДа и наиболее предпочтительно 100-300 кДа. В предпочтительном варианте осуществления порог отсечения по молекулярной массе ультрафильтрационных мембран составляет не менее чем 50 кДа.
В предпочтительном варианте осуществления при применении проточной фильтрации вдоль потока на стадии c) уменьшение объема находится в диапазоне 5-40 раз, предпочтительно объем уменьшается более чем в 10 раз, более предпочтительно объем уменьшается более чем в 15 раз. Предпочтительно, чтобы объем уменьшался не более чем в 30 раз. Это может приводить к улучшению результатов следующих стадий обработки.
В одном варианте осуществления, если для стадии c) используют ультрацентрифугирование, условия ультрацентрифугирования могут соответствовать, например, 30000 g-200000 g в течение более чем 10 мин. В предпочтительном варианте осуществления при применении ультрацентрифугирования на стадии c) объем при ультрацентрифугировании уменьшается более чем в 10 раз, предпочтительно более чем в 20 раз, более предпочтительно более чем в 30 раз, даже более предпочтительно более чем в 40 раз.
В одном варианте осуществления, если концентрирование проводят путем осаждения, подходящие химические вещества известны специалистам в данной области и могут, например, представлять собой соль, метиловый и этиловый спирт, и полиэтиленгликоль в соответствующей концентрации. Подходящие химические вещества в соответствующей концентрации осаждают продукт, например, частицы, содержащие вирусный антиген, но не оказывают или оказывают минимальный отрицательный эффект на указанные вирусные антигены. Химические вещества выбирают таким образом, что они не вступают в реакцию с (конечным) желаемым продуктом, например, вирусными антигенами. В предпочтительном варианте осуществления при применении осаждения на стадии c) объем уменьшается более чем в 10 раз, предпочтительно более чем в 20 раз, более предпочтительно более чем в 30 раз, даже более предпочтительно более чем в 40 раз.
(18) Способ по любому из предшествующих пунктов, отличающийся тем, что на стадии d) солюбилизацию проводят в течение периода времени и при температуре, которые достаточны для солюбилизации практически всех оболочечных вирусов, присутствующих в жидком продукте.
Как правило, период времени и температура, достаточные для солюбилизации практически всех оболочечных вирусов, могут быть определены специалистом в данной области. В одном варианте осуществления период времени составляет от 0,2 ч до 20 ч при температуре выше 0°C, предпочтительно при температуре от 2°C до 30°C, предпочтительно период времени составляет от 0,5 ч до 6,0 ч при температуре 2-25°C, и более предпочтительно при температуре 2-8°C.
(19) Способ по любому из предшествующих пунктов, отличающийся тем, что, в случае ее проведения, стадию e) проводят, применяя способ, выбранный из группы, состоящей из ультрацентрифугирования и проточной фильтрации вдоль потока.
В одном варианте осуществления, если на стадии e) используют ультрацентрифугирование, условия ультрацентрифугирования для осаждения предпочтительно соответствуют 30000 g - 200000 g в течение более чем 10 мин, предпочтительно более чем 60000 g в течение более чем 30 мин, более предпочтительно более чем 90000 g в течение более чем 30 мин, даже более предпочтительно более чем 120000 g в течение более чем 30 мин.
В одном варианте осуществления, если на стадии e) используют проточную фильтрацию вдоль потока, порог отсечения по молекулярной массе ультрафильтрационных мембран предпочтительно составляет более чем 100 кДа и более предпочтительно, более чем 300 кДа. Кроме того, порог отсечения по молекулярной массе мембран предпочтительно составляет не более чем 500 кДа.
(20) Способ по любому из предшествующих пунктов, отличающийся тем, что стадию f) проводят, применяя хроматографию, предпочтительно, хроматографию выбирают из группы, состоящей из ионообменной хроматографии, хроматографии гидрофобного взаимодействия, аффинной хроматографии, комбинированной хроматографии, псевдоаффинной хроматографии, жидкостно-жидкостной хроматографии и эксклюзионной хроматографии, более предпочтительно, хроматографию выбирают из группы, состоящей из ионообменной хроматографии, хроматографии гидрофобного взаимодействия, псевдоаффинной хроматографии, аффинной хроматографии и эксклюзионной хроматографии.
(21) Способ по любому из предшествующих пунктов, отличающийся тем, что вирусный антиген является частью оболочечного вируса, предпочтительно вирусный антиген представляет собой вирусный белок, и более предпочтительно вирусный антиген представляет собой вирусный белок, такой как вирусный поверхностный белок.
(22) Способ по любому из предшествующих пунктов, отличающийся тем, что вирусный белок представляет собой вирусный поверхностный белок HA и/или NA из вируса гриппа. В другом варианте осуществления вирусный белок представляет собой белок M из вируса гриппа.
(23) Способ по любому из предшествующих пунктов, включающий дополнительную стадию формулирования полученного вирусного антигена в фармацевтическую композицию.
(24) Способ по пункту (23), отличающийся тем, что фармацевтическая композиция представляет собой вакцинный препарат или его промежуточную форму, предпочтительно фармацевтическая композиция представляет собой вакцину против оболочечного вируса, более предпочтительно, фармацевтическая композиция представляет собой вакцину против вируса гриппа.
(25) Способ по любому из предшествующих пунктов, отличающийся тем, что стадия g) включает применение композиции, имеющей проводимость в диапазоне от равно или более чем 3,0 до менее чем 5,0 мсек/см, предпочтительно от равно или более чем 3,5 до равно или менее чем 4,7 мсек/см, даже более предпочтительно в диапазоне от равно или более чем 3,6 до равно или менее чем 4,65 мсек/см, в условиях температуры 25°C.
В предпочтительном варианте осуществления стадия g) включает стадию хроматографии, такой как ионообменная хроматография, и композиция, имеющая вышеуказанную проводимость, представляет собой буфер, например, буфер для нанесения и/или буфер для уравновешивания, содержащий соль, который подходит для использования в сочетании с соответствующим используемым хроматографическим методом.
Проводимость композиции можно измерять любым подходящим методом, известным специалисту в данной области, например, с использованием электронных устройств, таких как измеритель проводимости.
(26) Способ по любому из предшествующих пунктов, отличающийся тем, что стадия g) включает применение композиции, имеющей молярную концентрацию в диапазоне от равно или более чем 1,0 M до равно или менее чем 3,5 M, предпочтительно в диапазоне от равно или более чем 1,0 M до равно или менее чем 3,0 M, более предпочтительно в диапазоне от равно или более чем 1,5 M до равно или менее чем 3,0 M, и даже более предпочтительно в диапазоне от равно или более чем 1,5 M до равно или менее чем 2,6 M, в условиях температуры 25°C.
В предпочтительном варианте осуществления стадия g) включает стадию хроматографии, такой как хроматография гидрофобного взаимодействия, и композиция, имеющая вышеуказанную молярную концентрацию, представляет собой буфер, например, буфер для нанесения и/или буфер для уравновешивания, содержащий соль, который подходит для использования в сочетании с соответствующим используемым хроматографическим методом.
Молярную концентрацию можно измерять любым подходящим методом, известным специалисту в данной области.
Использование композиции, описанной в пунктах (25) и/или (26), может еще больше способствовать усовершенствованию способа получения вирусного антигена, в частности, с точки зрения выхода вирусного антигена.
(27) Применение способа производства вакцинного препарата, содержащего вирусный антиген, полученный из культуры для размножения оболочечного вируса на основе клеток, включающего следующие стадии в указанном порядке:
i) уменьшение объема жидкого продукта, содержащего оболочечный вирус, полученный из культуры для размножения оболочечного вируса на основе клеток, тем самым, получение концентрированного жидкого продукта, и
ii) солюбилизация оболочечного вируса, присутствующего в жидком продукте, путем добавления детергента или смеси детергентов, содержащей катионный детергент, к концентрированному жидкому продукту, полученному на стадии i),
при этом за стадией i) непосредственно следует стадия ii), и
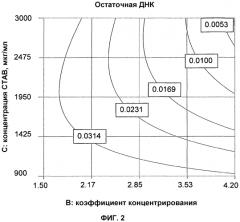
при этом уменьшение ДНК клеток-хозяев, присутствующей в вакцинном препарате, составляет по меньшей мере 2,5 log, предпочтительно по меньшей мере 3,0 log, более предпочтительно по меньшей мере 3,5 log, даже более предпочтительно по меньшей мере 4,0 log.
Уменьшение на по меньшей мере 2,5 log ДНК клеток-хозяев в вакцинном препарате достигается путем сочетания только стадий i) и ii), в лучшем случае, дополнительно, стадий b), e), f) и/или g) пункта (1). В любом случае, дополнительные относящиеся к ДНК стадии, в частности, стадии обработки ДНК-расщепляющим ферментом и удаляющая ДНК хроматография (аффинная хроматография, гель-хроматография и тому подобное), и/или стадии инактивации, необязательно или даже совсем не нужно проводить для достижения вышеуказанного уменьшения содержания ДНК клеток-хозяев. В случае проведения дополнительных относящихся к ДНК стадий и/или стадий инактивации, эти стадии (и, таким образом, способ в целом) можно проводить существенно усовершенствованным образом, например, с точки зрения экономичности способа, поскольку, например, требуется значительно более низкое количество расщепляющего ДНК фермента или композиции для инактивации, чтобы достичь вышеуказанного уменьшения содержания компонентов клеток-хозяев.
Что касается терминов «вакцинный препарат», «вирусный антиген», «на основе клеток», «жидкий продукт», «оболочечный вирус» и «детергент», делается ссылка на спецификацию.
В предпочтительном варианте осуществления до стадии i) из жидкого продукта, содержащего оболочечный вирус, удаляют клеточный детрит и/или микроносители.
(28) Применение по пункту (27), отличающееся тем, что стадии i) и ii) соответствуют стадиям c) и d), описанным в вышеприведенных пунктах.
(29) Применение по пункту (27) или (28), отличающееся тем, что до стадии i) проводят стадии a) и b), описанные в вышеприведенных пунктах, и после стадии ii) проводят стадии e), f) и/или g), описанные в вышеприведенных пунктах.
Подробное описание изобретения
Настоящее изобретение далее будет описано более подробно с помощью предпочтительных вариантов осуществления и примеров, которые, однако, приведены исключительно для иллюстративных целей и никоим образом не должны рассматриваться как ограничивающие объем настоящего изобретения.
Вирусы, которые используют для получения фармацевтических композиций, таких как вакцинные препараты или их промежуточные формы, можно размножать в системах либо на основе клеток, либо на основе яиц. В зависимости от соответствующей используемой системы указанные фармацевтические композиции обычно классифицируют либо как композиции на основе яиц, либо как композиции на основе клеток. Для вакцинных препаратов или вакцин основным требованием обработки является достаточное удаление примесей, например, в случае систем размножения вируса на основе яиц, яично-эмбриональных белков, таких как овальбумин, а также удаление не относящихся к продукту вирусов, а в случае систем размножения вируса на основе клеток, в процессе обработки должны быть выполнены дополнительные требования, такие как значительное снижение количества ДНК клеток-хозяев и белков клеток-хозяев.
В контексте настоящего изобретения неожиданно было обнаружено, что сочетание конкретных стадий способа, выполняемых в определенном порядке, создает усовершенствованный способ по сравнению с общепринятыми способами, например, в отношении самого процесса, например, с точки зрения упрощения всего процесса, и/или в отношении получаемых продуктов, например, с точки зрения качества, выхода и/или чистоты. Применяя способ по настоящему изобретению, можно получать указанные полезные и удивительные эффекты при условии, что способ включает стадию уменьшения объема жидкого продукта, содержащего размноженные вирусы, что приводит к концентрированию вируса (также называемого вирусными частицами) и других составляющих в указанном жидком продукте, и стадию солюбилизации, на которой происходит солюбилизация вируса, присутствующего в уменьшенном объеме жидкого продукта. В частности, и в отличие от способов предшествующего уровня техники, стадия очистки, присутствующая в способе по настоящему изобретению, имеет место только после завершения стадии солюбилизации и, кроме того, ее применяют к вирусному антигену, вместо того, чтобы применять к целым вирусным частицам. Таким образом, благодаря применению способа по настоящему изобретению, можно избежать больших потерь продукта, трудоемкой, продолжительной и дорогостоящей стадии(й) очистки, предназначенной для, и направленной на очистку целых вирусных частиц до солюбилизации, при этом получая композиции с удовлетворительными чистотой и выходом. Более того, стадии солюбилизации непосредственно предшествует стадия уменьшения объема. Не желая быть связанными какой-либо теорией, авторы изобретения считают, что эти стадии, то есть, стадия солюбилизации, непосредственно следующая за стадией уменьшения объема, могут способствовать преимуществам способа, поскольку стадия концентрирования c) может увеличивать концентрацию ДНК клеток-хозяев, что, в свою очередь, может быть выгодным с точки зрения эффективности осаждения.
Удивительно, и в отличие от общепринятых способов получения фармацевтических композиций, таких как вакцины, содержащие вирусный антиген, способ по настоящему изобретению представляет собой усовершенствованный, надежный способ, позволяющий получать повышенный выход продукта, и в то же время требующий меньшее число стадий способа по сравнению с общепринятыми способами. Это сокращенное число необходимых стадий способа дополнительно способствует повышению надежности способа, а также снижению производственных затрат и времени, обычно необходимого для получения вакцинных композиций. Это особенно полезно в случае пандемической или сезонной вспышки вирусной инфекции, такой как грипп, поскольку появляется необходимость в быстром производстве и выпуске пандемической или сезонной вакцины на рынок, и еще более полезно в случае, если вакцины производят с использованием культуральных систем для размножения вируса на основе яиц, которые, как известно, занимают очень много времени.
Более того, с уменьшением числа стадий в способе, применяемом к фармацевтической композиции, уменьшается стресс, налагаемый на присутствующий вирус и вирусные антигены, что может приводить к повышению эффективности и стабильности конечного продукта (например, вакцины) и его промежуточных форм.
Кроме того, с применением способа по настоящему изобретению, несмотря на снижение количества стадий в способе по сравнению с общепринятыми способами, можно производить вакцинные препараты, которые отвечают конкретным административным требованиям относительно допустимого максимального количества примесей белка и ДНК. Например, для вакцинных препаратов против гриппа максимальное допустимое количество в настоящее время (2011) составляет 120 мкг белка, не являющегося гемагглютинином, (HA)/дозу и 10 нг ДНК/дозу (в этом случае, 1 доза соответствует 500 мкл вакцинного препарата). Дополнительным преимуществом способа по настоящему изобретению является то, что его можно применять независимо от вируса, который размножают в системе на основе клеток или на основе яиц. Таким образом, например, если для размножения вирусов используют систему на основе клеток, способ по настоящему изобретению обеспечивает значительное уменьшение примесей ДНК клеток-хозяев, а если для размножения вирусов используют систему на основе яиц, способ обеспечивает уменьшение примесей, связанных с культивированием в яйце.
Благодаря повышенному выходу полученного вирусного антигена, большее число доз вакцины можно получать на производственную партию. Это может, например, быть особенно полезным в случае повышенного спроса на вакцинные препараты, что происходит, например, при сезонных вспышках гриппа.
Типичной и полезной вакциной, о которой идет речь, является вакцина против гриппа, в частности, субъединичная вакцина.
Кроме того, способ по настоящему изобретению можно применять с различными штаммами вируса, это означает, что способ является менее зависимым от штамма. Это особенно важно при использовании вирусов, у которых наблюдается постоянный дрейф и изменчивость генома, таких как вирусы гриппа.
В целом, способ по настоящему изобретению может представлять собой значительно усовершенствованный способ, например, с точки зрения надежности, выхода продукта, времени и затрат на производство, а также примесей, присутствующих в конечном продукте или его промежуточных формах.
Таким образом, в одном аспекте настоящее изобретение относится к способу получения вирусного антигена из оболочечного вируса, включающему следующие стадии в указанном порядке:
a) обеспечение жидкости, содержащей оболочечный вирус,
b) осветление жидкости, содержащей указанный оболочечный вирус, с получением жидкого продукта, содержащего указанный оболочечный вирус,
c) уменьшение объема жидкого продукта, полученного после стадии b), с получением концентрированного жидкого продукта,
d) солюбилизация оболочечного вируса, присутствующего в жидком продукте, путем добавления детергента или смеси детергентов, содержащей катионный детергент, к концентрированному жидкому продукту, полученному на стадии c),
e) отделение вирусных ядер от композиции, полученной после стадии d),
f) необязательно, удаление катионного детергента из композиции, полученной после стадии e),
и
g) очистка вирусного антигена,
при этом за стадией c) непосредственно следует стадия d).
Вирусный антиген получают из оболочечного вируса. Эти оболочечные вирусы могут быть любыми оболочечными ДНК или РНК вирусами, с одно- или двухцепочечным геномом, смысловым или антисмысловым, непрерывным или сегментированным. Например, вирусы выбирают из группы оболочечных РНК вирусов, оболочечных ДНК вирусов или ретровирусов, при этом группа оболочечных РНК вирусов включает флавивирусы, тогавирусы, коронавирусы, вирусы гепатита D, филовирусы, рабдовирусы, буньявирусы, ортомиксовирусы, парамиксовирусы и аренавирусы, и при этом группа оболочечных ДНК вирусов включает гепаднавирусы, вирусы герпеса и поксвирусы. В предпочтительном варианте осуществления вирусы выбирают из группы оболочечных РНК вирусов, вк