Пестицидные композиции
Иллюстрации
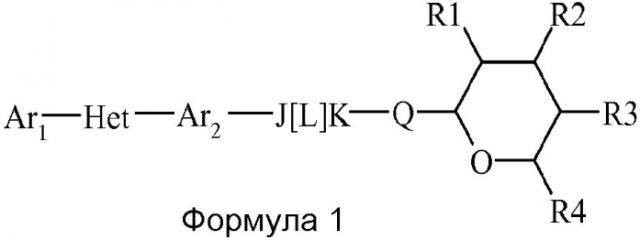
Показать всеИзобретение относится к сельскохозяйственной промышленности, в частности к пестицидным соединениям и их применению. Пестицидная композиция включает соединения, имеющие следующую структуру:
где:
(a) Ar1 представляет собой замещенный фенил, где указанный замещенный фенил содержит один или более заместителей, независимо выбранных из C1-С6галогеналкила и C1-С6галогеналкокси,
(b) Het представляет собой триазолил;
(c) Ar2 представляет собой фенил;
(d) J представляет собой CRJ1RJ2, где RJ1 и RJ2 являются водородами;
(e) L представляет собой простую связь;
(f) K представляет собой NRK1;
(g) Q представляет собой О;
(h) R1 представляет собой C1-С6алкокси;
(i) R2 представляет собой C1-С6алкокси;
(j) R3 представляет собой ОН или С1-С6алкокси;
(k) R4 представляет собой С1-С6алкил и
(l) RK1 независимо выбран из Н, С1-С6алкила, С(=O)(C1-С6алкила) и С(=O)(С1-С6алкил)С(=O)О(С1-С6алкила). Предлагаемая пестицидная композиция обеспечивает эффективный способ борьбы с сельскохозяйственными вредителями. 3 н. и 1 з.п. ф-лы, 3 табл., 11 пр.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет временной заявки США № 61/377116, поданной 26 августа 2010 года. Полное содержание данной временной заявки включено в настоящее описание посредством ссылки.
Область техники, к которой относится изобретение
Изобретение, раскрытое в настоящем описании, относится к способам получения соединений, которые являются полезными в качестве пестицидов [например, акарицидов, инсектицидов, моллюскицидов и нематоцидов), к таким соединениям и к способам применения таких соединений для борьбы с вредителями.
Предпосылки создания изобретения
Вредители являются причиной миллионов случаев смертности людей по всему миру каждый год. Кроме того, существует более десяти тысяч видов вредителей, которые приводят к потерям в сельском хозяйстве. В мировом масштабе сельскохозяйственные потери составляют до миллиардов долларов США ежегодно.
Термиты вызывают повреждения всех видов частных и общественных сооружений. В мировом масштабе потери от повреждений, вызываемых термитами, составляют до миллиардов долларов США ежегодно.
Вредители пищевых запасов поедают и портят хранящиеся пищевые продукты. В мировом масштабе потери от повреждений, вызываемых вредителями пищевых запасов, составляют до миллиардов долларов США ежегодно, но, что более важно, они лишают людей необходимой пищи.
Существует насущная потребность в новых пестицидах. У некоторых вредителей развивается резистентность к пестицидам, которые используют в настоящее время. Сотни видов вредителей являются резистентными к одному или нескольким пестицидам. Развитие резистентности к некоторым более старым пестицидам, таким как DDT, карбаматы и органофосфаты, хорошо известно. Но резистентность развивается и к некоторым новым пестицидам.
Поэтому существует множество причин, включая указанные выше причины, приводящих к необходимости в новых пестицидах.
Определения
Примеры, представленные в определениях, как правило, не являются исчерпывающими и не должны рассматриваться как ограничивающие изобретение, раскрытое в настоящем описании. Следует понимать, что заместитель должен соответствовать правилам химического связывания и ограничениям пространственной совместимости в отношении конкретного соединения, к которому он присоединяется.
"Группа акарицидов" определена под заголовком "АКАРИЦИДЫ".
"AI Группа" определена в настоящем описании сразу после определения "Группа гербицидов".
"Алкенил" означает ациклический ненасыщенный (по меньшей мере, одна углерод-углеродная двойная связь) разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например винил, аллил, бутенил, пентенил и гексенил.
"Алкенилокси" означает алкенил, дополнительно включающий углерод-кислородную простую связь, например аллилокси, бутенилокси, пентенилокси, гексенилокси.
"Алкокси" означает алкил, дополнительно включающий углерод-кислородную простую связь, например метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и трет-бутокси.
"Алкил" означает ациклический насыщенный разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например метил, этил, пропил, изопропил, бутил и трет-бутил.
"Алкинил" означает ациклический ненасыщенный (по меньшей мере одна углерод-углеродная тройная связь) разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например этинил, пропаргил, бутинил и пентинил.
"Алкинилокси" означает алкинил, дополнительно включающий углерод-кислородную простую связь, например пентинилокси, гексинилокси, гептинилокси и октинилокси.
"Арил" означает циклический ароматический заместитель, состоящий из водорода и углерода, например фенил, нафтил и бифенил.
"Циклоалкенил" означает моноциклический или полициклический ненасыщенный (по меньшей мере одна углерод-углеродная двойная связь) заместитель, состоящий из углерода и водорода, например циклобутенил, циклопентенил, циклогексенил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
"Циклоалкенилокси" означает циклоалкенил, дополнительно включающий углерод-кислородную простую связь, например циклобутенилокси, циклопентенилокси, норборненилокси и бицикло[2.2.2]октенилокси.
"Циклоалкил" означает моноциклический или полициклический насыщенный заместитель, состоящий из углерода и водорода, например циклопропил, циклобутил, циклопентил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
"Циклоалкокси" означает циклоалкил, дополнительно включающий углерод-кислородную простую связь, например циклопропилокси, циклобутилокси, циклопентилокси, норборнилокси и бицикло[2.2.2]октилокси.
"Группа фунгицидов" определена под заголовком "ФУНГИЦИДЫ".
"Галоген" означает фтор, хлор, бром и йод.
"Галогеналкокси" означает алкокси, дополнительно содержащий от одного до максимально возможного количества одинаковых или различных галогенов, например фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2-тетрафторэтокси и пентафторэтокси.
"Галогеналкил" означает алкил, дополнительно содержащий от одного до максимально возможного количества одинаковых или различных галогенов, например фторметил, трифторметил, 2,2-дифторпропил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
"Группа гербицидов" определена под заголовком "ГЕРБИЦИДЫ".
"Гетероциклил" означает циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным или полностью ненасыщенным, где циклическая структура содержит по меньшей мере один углерод и по меньшей мере один гетероатом, где указанный гетероатом представляет собой азот, серу или кислород. Примеры ароматических гетероциклилов включают, но не ограничиваются ими, бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразолил, тиазолинил, тиазолил, тиенил, триазинил и триазолил. Примеры полностью насыщенных гетероциклилов включают, но не ограничиваются ими, пиперазинил, пиперидинил, морфолинил, пирролидинил, тетрагидрофуранил и тетрагидропиранил. Примеры частично ненасыщенных гетероциклилов включают, но не ограничиваются ими, 1,2,3,4-тетрагидрохинолинил, 4,5-дигидрооксазолил, 4,5-дигидро-1Н-пиразолил, 4,5-дигидроизоксазолил и 2,3-дигидро[1,3,4]оксадиазолил.
"Группа инсектицидов" определена под заголовком "ИНСЕКТИЦИДЫ".
"Группа нематоцидов" определена под заголовком "НЕМАТОЦИДЫ".
"Группа синергистов" определена под заголовком "СИНЕРГИЧЕСКИЕ СМЕСИ и СИНЕРГИСТЫ"
Подробное описание изобретения
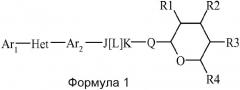
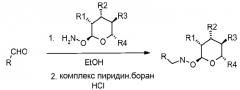
В настоящем изобретении раскрыты соединения, имеющие следующую формулу ("Формула 1"):
где:
(а) Ar1 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил,
где указанные замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил содержат один или более заместителей, независимо выбранных из H, OH, F, Cl, Br, I, CN, NO2, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C3-С6циклоалкила, C3-С6галогенциклоалкила, C3-С6гидроксициклоалкила, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C3-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)NRxRy, (C1-С6алкил)NRxRy, C(=О)(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила, фенокси, замещенного фенила и замещенного фенокси (где такой замещенный фенил и замещенный фенокси содержат один или более заместителей, независимо выбранных из H, OH, F, Cl, Br, I, CN, NO2, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C3-С6циклоалкила, C1-С6галогенциклоалкила, C1-С6гидроксициклоалкила, C1-С6циклоалкокси, C1-С6галогенциклоалкокси, C1-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)NRxRy, (C1-С6алкил)NRxRy, C(=О)(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила и фенокси);
(b) Het представляет собой 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, содержащее один или более гетероатомов, независимо выбранных из азота, серы или кислорода, и где Αr1 и Ar2 не находятся в ортоположении относительно друг друга (но могут быть в мета- или параположении, например, для пятичленного кольца они представляют собой 1,3, и для 6-членного кольца они представляют собой либо 1,3, либо 1,4), и где указанное гетероциклическое кольцо также может быть замещено одним или более заместителями, независимо выбранными из H, OH, F, Cl, Br, I, CN, NO2, оксо, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C1-С6циклоалкила, C1-С6галогенциклоалкила, C1-С6гидроксициклоалкила, C1-С6циклоалкокси, C1-С6галогенциклоалкокси, C1-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)NRxRy, (C1-С6алкил)NRxRy, C(=О)(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила, фенокси, замещенного фенила и замещенного фенокси (где такой замещенный фенил и замещенный фенокси содержат один или более заместителей, независимо выбранных из H, OH, F, Cl, Br, I, CN, NO2, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C3-С6циклоалкила, C3-С6галогенциклоалкила, C3-С6гидроксициклоалкила, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C3-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)NRxRy, (C1-С6алкил)NRxRy, C(=О)(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила и фенокси);
(c) Ar2 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил,
где указанные замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил содержат один или более заместителей, независимо выбранных из H, OH, F, Cl, Br, I, CN, NO2, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C3-С6циклоалкила, C3-С6галогенциклоалкила, C1-С6гидроксициклоалкила, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)NRxRy, (C1-С6алкил)NRxRy, C(=О)(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила, фенокси, замещенного фенила и замещенного фенокси (где такой замещенный фенил и замещенный фенокси содержат один или более заместителей, независимо выбранных из H, OH, F, Cl, Br, I, CN, NO2, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C3-С6циклоалкила, C3-С6галогенциклоалкила, C3-С6гидроксициклоалкила, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)NRxRy, (C1-С6алкил)NRxRy, C(=О)(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C1-С6галогеналкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила и фенокси);
(d) J представляет собой CRJ1RJ2;
(e) L представляет собой простую связь;
(f) K представляет собой NRK1;
(g) Q представляет собой О;
(h) R1 представляет собой H, OH, F, Cl, Br, I, оксо, C1-С6алкил, C1-С6галогеналкил, C1-С6алкокси, C3-С6циклоалкокси, C1-С6галогеналкокси, C2-С6алкенилокси, (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил)О(C1-С6алкокси), OC(=О)(C1-С6алкил), OC(=О)(C3-С6циклоалкил), OC(=О)(C1-С6галогеналкил), OC(=О)(C2-С6алкенил) или NRxRy;
(i) R2 представляет собой H, OH, F, Cl, Br, I, оксо, C1-С6алкил, C1-С6галогеналкил, C1-С6алкокси, C3-С6циклоалкокси, C1-С6галогеналкокси, C1-С6алкенилокси, (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил)О(C1-С6алкокси), ОС(=О)(C1-С6алкил), OC(=О)(C3-С6циклоалкил), ОС(=О)(C1-С6галогеналкил), OC(=О)(C2-С6алкенил) или NRxRy;
(j) R3 представляет собой H, OH, F, Cl, Br, I, оксо, C1-С6алкил, C1-С6галогеналкил, C1-С6алкокси, C3-С6циклоалкокси, C1-С6галогеналкокси, C2-С6алкенилокси, (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил)О(C1-С6алкокси), OC(=О)(C1-С6алкил), OC(=О)(C3-С6циклоалкил), OC(=О)(C1-С6галогеналкил), OC(=О)(C2-С6алкенил) или NRxRy;
(k) R4 представляет собой H, C1-С6алкил, C1-С6галогеналкил, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенилокси, (C1-С6алкил)О(C1-С6алкил) и
(l) RJ1, RJ2 и RK1 независимо выбраны из H, OH, F, Cl, Br, I, CN, NO2, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C3-С6циклоалкила, C3-С6галогенциклоалкила, C3-С6гидроксициклоалкила, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C3-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)NRxRy, (C1-С6алкил)NRxRy, C(=О)(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила и фенокси,
где каждый алкил, галогеналкил, гидроксиалкил, циклоалкил, галогенциклоалкил, гидроксициклоалкил, циклоалкокси, галогенциклоалкокси, гидроксициклоалкокси, алкокси, галогеналкокси, алкенил, алкинил, фенил и фенокси необязательно замещены одним или более заместителями, независимо выбранными из OH, F, Cl, Br, I, CN, NO2, оксо, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C3-С6циклоалкила, C3-С6галогенциклоалкила, C3-С6гидроксициклоалкила, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C3-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)NRxRy, (C1-С6алкил)NRxRy, C(=О)(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила и фенокси;
(m) n равно 0, 1 или 2 и
(n) Rx и Ry независимо выбраны из H, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C3-С6циклоалкила, C1-С6галогенциклоалкила, C3-С6гидроксициклоалкила, C1-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6гидроксициклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенила, C2-С6алкинила, S(=О)n(C1-С6алкила), S(=О)n(C1-С6галогеналкила), OSO2(C1-С6алкила), OSO2(C1-С6галогеналкила), C(=О)H, C(=О)OH, C(=О)(C1-С6алкила), C(=О)О(C1-С6алкила), C(=О)(C1-С6галогеналкила), C(=О)О(C1-С6галогеналкила), C(=О)(C3-С6циклоалкила), C(=О)О(C3-С6циклоалкила), C(=О)(C2-С6алкенила), C(=О)О(C2-С6алкенила), (C1-С6алкил)О(C1-С6алкила), (C1-С6алкил)S(C1-С6алкила), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкила), фенила и фенокси.
В другом варианте осуществления Ar1 представляет собой замещенный фенил. В другом варианте осуществления Ar1 представляет собой замещенный фенил, содержащий C1-С6галогеналкокси заместитель.
В другом варианте осуществления Het представляет собой триазолил.
В другом варианте осуществления Ar2 представляет собой фенил.
В другом варианте осуществления RJ1 и RJ2 представляют собой H.
В другом варианте осуществления RK1 представляет собой H, C(=О)(C1-С6алкил), C(=О)(C1-С6алкил)C(=О)О(C1-С6алкил), C(=О)(C1-С6алкил)C(=О)OH.
Получение пираноза-промежуточных соединений
Для получения соединений по настоящему изобретению можно использовать множество различных пираноз (в различных структурных формах, например D и L). Например, можно использовать следующий, не являющийся исчерпывающим перечень пираноз: рибоза, арабиноза, ксилоза, ликсоза, рибулоза, ксиолулоза, аллоза, альтроза, глюкоза, манноза, гулоза, идоза, галактоза, талоза, псикоза, фруктоза, сорбоза, тагатоза, фукоза, микароза, хиновоза, алеандроза, рамноза и паратоза.
Как правило, пираноза-промежуточные соединения можно получить способами, описанными ранее в химической литературе и у Crouse et al., в патентной публикации США № 2009/0209476 A1, полное описание которой специально включено в настоящее описание посредством ссылки.
Получение триарил-промежуточных соединений
Соединения по настоящему изобретению получают путем связывания описанного выше пираноза-промежуточного соединения с триарильным промежуточным соединением, Ar1-Het-Ar2, посредством ковалентного линкера J[L]KQ (определен выше). Для получения соединений по настоящему изобретению можно использовать множество различных триарильных предшественников, при условии, что они содержат подходящую функциональную группу на Ar2. Подходящие функциональные группы включают амино, оксоалкильную, формильную или группу карбоновой кислоты. Такие триарильные промежуточные соединения можно получить способами, описанными ранее в химической литературе и у Crouse et al., в патентной публикации США № 2009/0209476 A1, полное описание которой специально включено в настоящее описание посредством ссылки.
Получение оксим-связанных соединений
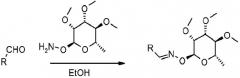
Оксим-связанные соединения можно получить из соответствующих арилальдегидов или кетонов путем взаимодействия с соответствующим 2-гидроксиламиносахаром в органическом растворителе, таком как метиловый спирт (MeOH) или этиловый спирт (EtOH), при температурах в диапазоне от 0 до 100°C.
Получение гидроксиламин-связанных соединений
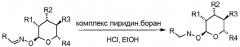
Гидроксиламин-связанные соединения можно получить из соответствующих оксим-связанных соединений через восстановление с использованием комплекса пиридин•боран в органическом растворителе, таком как EtOH. Альтернативно, соединения можно получить при помощи двухстадийной методики из альдегида или кетона путем взаимодействия с 2-гидроксиламиносахаром, с последующим восстановлением с использованием комплекса пиридин•боран в органическом растворителе, таком как EtOH, при температурах в диапазоне от 0 до 100°C.
Дальнейшее преобразование гидроксиламин-связанных соединений можно осуществить различными способами, такими как образование соли с использованием хлористоводородной кислоты в диоксане в растворителе, таком как диэтиловый эфир (Et2O); ацилирование азота при помощи хлорангидрида или ангидрида кислоты в присутствии основания, такого как пиридин; или алкилирование азота при помощи алкилгалогенида в присутствии основания, такого как диизопропилэтиламин (DIEA) или карбонат калия, в органическом растворителе, таком как тетрагидрофуран (ТГФ, THF).
Ацилирование азота также можно осуществить многостадийным способом, включающим ацилирование 2-гидроксиламиносахара и восстановление альдегида до соответствующего спирта, с последующим взаимодействием с тетрабромидом углерода с получением соответствующего бромида. Затем осуществляют взаимодействие бромида и ацилированного гидроксиламиносахара в присутствии основания, такого как гидрид натрия, в органическом растворителе, таком как ТГФ, с получением ацилированого соединения.
ПРИМЕРЫ
Примеры представлены в целях иллюстрации и не должны рассматриваться как ограничивающие изобретение, раскрываемое в настоящем описании, только вариантами осуществления, раскрытыми в этих примерах.
Исходные вещества, реагенты и растворители, которые были получены из коммерческих источников, использовали без дополнительной очистки. Безводные растворители закупали под торговой маркой Sure/Seal™ у компании Aldrich и использовали в том виде, как они были получены. Температуру плавления определяли на капиллярном устройстве для определения температур плавления Thomas Hoover Unimelt или на автоматической системе для определения температур плавления OptiMelt от компании Stanford Research Systems, и они являются нескорректированными. Для соединений использовали их известные названия в соответствии с программами наименования, входящими в ISIS Draw, ChemDraw или ACD Name Pro. Если такие программы не могли определить название соединения, для этого использовали традиционные правила наименования. Спектральные данные 1Н ЯМР представлены в миллионных долях (м.д.) (δ) и были записаны при 300, 400 или 600 МГц, и спектральные данные 13C ЯМР представлены в м.д. (δ) и были записаны при 75, 100 или 150 МГц, если не указано иное.
Примеры 1-9 иллюстрируют получение дополнительных соединений, полезных для осуществления различных вариантов осуществления настоящего изобретения.
Пример 1: Получение О-((2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-ил)-N-{4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}гидроксиламина (соединение 1)
К раствору О-((2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-ил)оксима 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензальдегида (P-1; 257 миллиграмм (мг), 0,429 миллимоль (ммоль)) в 190-градусном этиловом спирте (EtOH; 10 миллилитров (мл)) при комнатной температуре добавляли комплекс пиридин•боран (200 микролитров (мкл), 1,99 ммоль) одной порцией. Затем добавляли по каплям 3 нраствор хлористоводородной кислоты (HCl; 1,4 мл). Когда добавление было завершено, смесь перемешивали при комнатной температуре в течение 23 часов (ч). Смесь затем разбавляли смесью EtOH/вода (H2O) и обрабатывали насыщенным раствором бикарбоната натрия (NaHCO3). Полученную водную смесь экстрагировали этилацетатом (EtOAc; 2×). Органические экстракты объединяли, сушили, промывали насыщенным раствором соли и сушили над безводным сульфатом натрия (Na2SO4). Растворитель выпаривали при комнатной температуре в условиях вакуума. Полученное неочищенное вещество очищали хроматографией на силикагеле (элюируя 50% EtOAc в гексане). Указанный в заголовке продукт (164 мг, 63%) выделяли в виде белого липкого твердого вещества.
1H ЯМР (300 МГц, CDCl3) δ: 8,60 (с, 1H), 8,22-8,16 (м, 2H), 7,87-7,80 (м, 2H), 7,50 (д, J=8,2 Гц, 2H), 7,46-7,38 (м, 2H), 6,04 (с, 1Н), 5,01 (д, J=1,4 Гц, 1H), 4,18 (с, 2H), 3,84-3,28 (м, 12H), 3,11 (дд, J=12,0, 6,5 Гц, 1H), 1,30 (ддд, J=20,9, 10,3, 4,6 Гц, 6H); ESI МС m/z 603 (M+H).
Пример 2: (2S,3S,4R,5R,6S)-4,5-Диметокси-2-метил-6-(N-{4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}аминоокси)тетрагидропиран-3-ол (соединение 2)
Указанное в заголовке соединение получали, как описано в примере 1, исходя из О-((2S,3R,4R,5S,6S)-5-гидрокси-3,4-диметокси-6-метилтетрагидропиран-2-ил)оксима 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензальдегида (P-2; 173 мг, 0,30 ммоль). Желаемый продукт (113 мг, 66%) выделяли в виде бесцветного стеклообразного вещества: т.пл. 50-58°C.
1H ЯМР (300 МГц, CDCl3) δ: 8,61 (д, J=5,1 Гц, 1H), 8,30-8,13 (м, 2H), 7,93-7,76 (м, 2H), 7,51 (д, J=8,3 Гц, 2H), 7,41 (д, J=9,0 Гц, 2H), 6,10 (с, 1H), 5,07 (д, J=1,5 Гц, 1H), 4,18 (д, J=6,9 Гц, 2H), 3,76-3,12 (м, 10Н), 2,44 (с, 1H), 1,48-1,28 (м, 3H); ESI МС m/z 576 (M+2H), 575 (M+H).
Пример 3: Получение N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-О-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (соединение 3)
Раствор 4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензальдегида (P-3; 203 мг, 0,610 ммоль) и О-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (P-4; 179 мг, 0,81 ммоль) в EtOH (20 мл) нагревали до температуры кипения с обратным холодильником в атмосфере N2 в течение 16 часов. Смесь затем охлаждали до комнатной температуры и добавляли комплекс пиридин•боран (200 мкл, 1,99 ммоль), с последующим добавлением по каплям 3 нраствора HCl (2 мл, 6,0 ммоль). Смесь оставляли для перемешивания при комнатной температуре в течение 28 часов и затем упаривали при комнатной температуре в условиях вакуума для уменьшения объема. Концентрированную смесь разбавляли EtOAc и промывали насыщенным раствором NaHCO3. Водный раствор экстрагировали дополнительным количеством EtOAc. Органические фракции объединяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4 и упаривали при комнатной температуре в условиях вакуума. Полученное неочищенное вещество очищали хроматографией на силикагеле (элюируя 50% EtOAc в гексане→100% EtOAc в одну стадию). Указанный в заголовке продукт (223 мг, 68% исходя из P-3) получали в виде белого стеклообразного вещества.
1H ЯМР (300 МГц, CDCl3) δ: 8,59 (с, 1H), 8,2-8,14 (м, 2H), 7,89-7,75 (м, 2H), 7,58-7,34 (м, 4H), 6,08 (д, J=15,0 Гц, 1H), 5,01 (дд, J=13,5, 6,1 Гц, 1H), 4,16 (д, J=9,4 Гц, 2H), 3,71-3,41 (м, 8H), 3,42-3,24 (м, 4H), 3,10 (т, J=9,4 Гц, 1H), 1,61 (д, J=19,8 Гц, 1H), 1,38-1,24 (м, 3H); l3C ЯМР (101 МГц, CDCl3) δ: 163,15, 148,37, 141,60, 138,97, 135,51, 129,64, 129,30, 126,65, 122,37, 121,66, 121,20, 119,10, 99,78, 25 82,04, 80,98, 76,20, 68,35, 60,83, 58,63, 57,61, 56,52, 50,59, 17,81,; ESI МС m/z 539 (M+H).
Пример 4: Получение гидрохлорида N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-О-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (соединение 4)
Раствор N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-О-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (3; 87,5 мг, 0,162 ммоль) в диэтиловом эфире (Et2O; 8,75 мл) обрабатывали путем добавления по каплям HCl (4M в диоксане) до тех пор, пока больше не осаждалось твердое вещество. Полученную суспензию подвергали центрифугированию и растворитель декантировали. Твердое вещество суспендировали с использованием свежего Et2O, центрифугировали и растворитель декантировали. Полученное твердое вещество сушили упариванием при комнатной температуре в условиях вакуума с получением указанного в заголовке продукта (70 мг, 75%) в виде белого твердого вещества: т.пл. 107-121°С.
1Н ЯМР (300 МГц, CD3OD) δ: 9,46 (д, J=2,8 Гц, 1H), 8,37-8,17 (м, 2H), 8,15-7,96 (м, 2H), 7,73 (д, J=8,3 Гц, 2H), 7,63-7,41 (м, 2H), 5,45 (д, J=2,4 Гц, 1H), 4,75-4,58 (м, 2H), 3,83-3,24 (м, 17H), 3,11 (дд, J=9,2, 8,3 Гц, 1H), 1,25 (д, J=6,2 Гц, 3H), 1,18 (тд, J=7,2, 2,8 Гц, 2H); ESI МС m/z 539 (M+H, основание).
Пример 5: Гидрохлорид О-((2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-ил)-N-{4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}гидроксиламина (соединение 5)
Указанное в заголовке соединение получали, как описано в примере 3, исходя из О-((2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-ил)-N-{4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}гидроксиламина (105 мг, 0,17 ммоль). Указанный в заголовке продукт (110 мг, 100%) выделяли в виде белого твердого вещества: т.пл. 115-119°C.
1H ЯМР (400 МГц, CD3OD) δ: 9,44 (д, J=7,1 Гц, 1H), 8,28 (д, J=8,3 Гц, 2H), 8,16-7,96 (м, 2H), 7,74 (д, J=8,3 Гц, 2H), 7,55 (д,,J=9,0 Гц, 2H), 5,47 (д, J=2,2 Гц, 1H), 4,69 (с, 2H), 3,82-3,25 (м, 12H), 3,14 (д, J=9,1 Гц, 1H), 1,38-1,20 (м, 6H); ESI МС m/z 603 (M+H, основание).
Пример 6: Получение N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-N-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)ацетамида (соединение 6)
Раствор N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-О-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (3; 94,4 мг, 0,175 ммоль) в пиридине (2 мл) обрабатывали ацетилхлоридом (70 мкл, 0,98 ммоль) и смесь оставляли для перемешивания при комнатной температуре в течение 2,5 часов. Смесь затем упаривали при комнатной температуре в условиях вакуума для уменьшения объема. Концентрат разбавляли EtOAc и промывали 1 нраствором HCl. Водный слой экстрагировали 3 раза EtOAc. Органические фракции объединяли и сушили над безводным MgSO4. Растворитель затем выпаривали при комнатной температуре в условиях вакуума. Полученное неочищенное вещество очищали хроматографией на силикагеле (элюируя 50% EtOAc в гексане→90% EtOAc в гексане в одну стадию). Указанный в заголовке продукт (96,8 мг, 95%) выделяли в виде бесцветного полутвердого вещества.
1H ЯМР (300 МГц, CDCl3) δ: 8,56 (с, 1H), 8,16 (д, J=8,4 Гц, 2H), 7,87-7,69 (м, 2H), 7,39 (д, J=8,1 Гц, 4H), 5,19 (дд, J=9,3, 6,6 Гц, 2H), 4,71 (д, J=16,1 Гц, 1H), 3,70-3,28 (м, 12H), 3,12 (дд, J=9,2, 7,9 Гц, 1H), 2,24 (с, 3H), 1,60 (с, 1H); 13C ЯМР (101 МГц, CDCl3) δ: 163,17, 141,89, 135,74, 129,76, 128,21, 126,89, 122,44, 121,26, 81,74,79,82, 73,74, 69,61, 60,33, 58,86, 58,10, 21,05, 18,12; ESI МС m/z 581 (M+H).
Пример 7: Получение N-Метил-N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-О-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (соединение 7)
К раствору N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-О-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (3; 205 мг, 0,38 ммоль) в тетрагидрофуране (ТГФ; 10 мл) добавляли диизопропилэтиламин (DIEA; 300 мкл, 1,7 ммоль) с последующим добавлением метилиодида (250 мкл, 4,0 ммоль). Полученный раствор нагревали до температуры кипения с обратным холодильником. Через 1 час, из-за видимого осаждения кватернизированного DIEA, к смеси добавляли безводный карбонат калия (K2CO3) вместе с метилиодидом (200 мкл, 3,2 ммоль) и суспензию оставляли для перемешивания при температуре кипения с обратным холодильником еще в течение 21 часов. Смесь затем охлаждали до комнатной температуры, разбавляли H2O и экстрагировали EtOAc (2×). Органические фракции объединяли, промывали насыщенным раствором соли, сушили над безводным Na2SO4 и упаривали при комнатной температуре в условиях вакуума. Полученное неочищенное вещество очищали хроматографией на силикагеле (элюируя 60% EtOAc в гексане). Указанный в заголовке продукт (131 мг, 63%) выделяли в виде бледно-желтого твердого вещества: т.пл. 93-100°C.
1H ЯМР (400 МГц, CDCl3) δ: 8,63 (д, J=4,1 Гц, 1H), 8,16 (д, J=8,3 Гц, 2H), 7,88-7,75 (м, 2H), 7,52 (т, J=10,7 Гц, 2H), 7,39 (т, J=9,5 Гц, 2H), 4,37 (д, J=13,2 Гц, 2H), 3,98-2,89 (м, 15H), 1,25 (дд, J=24,7, 6,2 Гц, 3H); ESI МС m/z 553 (M+H).
Пример 8: Получение N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-N-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)полуамида янтарной кислоты (соединение 8)
К раствору N-{4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензил}-О-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (3; 140 мг, 0,26 ммоль) в пиридине (5 мл) добавляли янтарный ангидрид (большой избыток) и смесь перемешивали при комнатной температуре в течение 3,5 часов. Смесь разбавляли EtOAc и промывали 1 н. раствором HCl. Водную фракцию экстрагировали EtOAc (2×). Органические фракции объединяли, промывали насыщенным раствором соли, сушили над безводным MgSO4 и упаривали при комнатной температуре в условиях вакуума. Полученное неочищенное вещество очищали хроматографией на силикаге