Способ получения пористого сплава на основе никелида титана
Иллюстрации
Показать всеИзобретение относится к металлургии, а именно к получению пористых металлических материалов методом самораспространяющегося высокотемпературного синтеза, и может использоваться в медицинской имплантологии. Пористый сплав на основе никелида титана получают из шихты, уплотненной до пористости 45-50% при температуре предварительного подогрева 400-450°С. Полученный пористый сплав подвергают нескольким циклам химического травления в растворе азотной и плавиковой кислот до появления металлического блеска, после чего образец погружают в воду на 10-12 часов. Ускоряется прорастание тканей и повышается долговечность функционирования пористого имплантата в организме за счет оптимизации размеров пор и перегородок, уменьшения их разброса, а также увеличения их удельной поверхности. 1 з.п. ф-лы, 6 ил.
Реферат
Изобретение относится к металлургии, конкретно к технологии получения пористых металлических материалов методом самораспространяющегося высокотемпературного синтеза, и может использоваться в медицинской имплантологии.
Пористые сплавы на основе никелида титана получают все большее распространение в медицине благодаря их высокой биосовместимости, обусловленной химической инертностью, развитой поверхностью и сходством с живыми тканями по механическим свойствам. В качестве имплантатов пористые сплавы на основе никелида титана способны замещать фрагменты костей, хрящей и других каркасных образований / Медицинские материалы и имплантаты с памятью формы / Гюнтер В.Э., Дамбаев Г.Ц., Сысолятин П.Г. и др. Томск, изд-во Том. ун-та, 1998. 486 с. Кроме того, в последнее время пористые имплантаты успешно используются как клеточные инкубаторы для культивирования стволовых клеток, имеющих тенденцию дифференцироваться в любые клеточные типы тканей взрослого организма и иметь их характерные и функциональные характеристики / James E. Dennis, Pierre Charbord. Origin and differentiation of human and murine stroma. // Stem Cells. 2003. Vol.19; №3. P.220-229./
Пути дальнейшего совершенствования пористых сплавов в том и другом аспектах применения связаны с оптимизацией их структурных характеристик в направлении повышения эффективности культивации клеточного материала и обеспечения долговечности функционирования имплантата в организме ввиду общей тенденции увеличения продолжительности жизни при любых формах применения имплантатов. В основе настоящего изобретения лежит экспериментальное установление соответствия между структурными особенностями пористого сплава на основе никелида титана и его инкубационными и биомеханическими качествами, в частности зависимости эффективности прорастания тканей от степени шероховатости стенок пор, наличия в них мелкомасштабной (субмикронной) структуры.
Известен способ получения пористого сплава на основе никелида титана методом самораспространяющегося высокотемпературного синтеза (СВС) /Сплавы с памятью формы в медицине, В.Э.Гюнтер, В.В. Котенко и др. Изд. Томского госуниверситета, г. Томск, 1986, с.50/. Способ включает следующие основные этапы: формовку шихты из смеси порошков титана, никеля и легирующих элементов в цилиндрической оправке, предварительный подогрев, инициацию реакции СВС и охлаждение. Недостатком известного способа является неполное соответствие структурных характеристик получаемого сплава требованиям высоких темпов прорастания тканями и механической долговечности. Среди известных источников информации нет полных сведений о критериях указанного соответствия, а также путях его достижения. Поскольку пористый сплав характеризуется индивидуальным статистическим распределением пор и перегородок по размерам, шероховатости и субмикронной структуре, существует потребность сформулировать оптимальные параметры распределения и способ приближения к ним. Развитость поверхности на микроскопическом уровне достаточно адекватно отражается характеристикой удельной поверхности пористого материала.
Технический результат изобретения - ускорение прорастания тканей и повышение долговечности функционирования пористого имплантата в организме за счет оптимизации размеров пор и перегородок, уменьшения их разброса, а также увеличения их удельной поверхности.
Технический результат достигается тем, что при осуществлении способа получения пористого сплава на основе никелида титана, включающего формовку шихты из смеси порошков титана, никеля в цилиндрической оправке, предварительный подогрев, инициацию реакции СВС и охлаждение, отличие состоит в том, что шихту уплотняют до пористости 45-50%, а температуру предварительного подогрева выбирают в пределах 400-450°С. Улучшению технического результата способствует то, что полученный пористый сплав подвергают нескольким циклам химического травления, включающим погружение на 2-3 сек в раствор азотной и плавиковой кислот с последующей промывкой под струей воды, вплоть до появления металлического блеска, после чего образец погружают в воду на 10-12 часов.
Сущность изобретения поясняется фигурами 1-6.
Выбор параметров процесса получения пористого сплава на основе никелида титана определяется следующими соображениями.
Уплотнение шихты может производиться от насыпного состояния (порядка 15% пористости) до максимально утрамбованного - порядка 65%, превышение которого уже связано с повреждением оправки. При малой плотности трамбовки материал получается чрезмерно рыхлым, с крупными порами, большой размер которых снижает действие капиллярных сил, отвечающих за адгезию и удержание биологических жидкостей в имплантате. При большой плотности трамбовки материал получается близким к монолиту, с чрезмерно мелкими порами и с большим процентом замкнутых пор; малый размер пор ограничивает транспорт жидкостей и ограничивает распространение клеточных элементов, имеющих конечные размеры. Экспериментально установлено, что оптимальная структура пористости - со средним размером пор 100-150 мкм - получается в указанном диапазоне плотностей трамбовки 45-50%. Для получения оптимальной степени уплотнения шихту насыпают в кварцевую трубку и трамбуют в вертикальном положении. Степень уплотнения легко контролируется по уменьшению высоты насыпанной шихты в трубке.
Температура предварительного подогрева влияет на статистическое распределение пор по размерам. При низкой температуре предварительного подогрева процесс СВС происходит с дефицитом тепла, и составляющие шихты (порошки никеля и титана) не проплавляются целиком. Вследствие этого получается многофазный хрупкий материал из слабо скрепленных частиц никеля, титана и их произвольных соединений. Начиная с температуры 400°C подавляющая часть исходных компонентов трансформируется в многофазный сплав с достаточной механической прочностью и развитой пористой поверхностью. При температуре предварительного подогрева выше 450°C расплавление шихты в процессе СВС достигает такой степени, что пористая структура получается сглаженной, содержит значительное количество крупных пор и не обладает необходимой шероховатостью для полноценной адгезии биоматериала.
Сочетание режимов уплотнения шихты и температуры предварительного подогрева обеспечивает структуру пористого материала, близкую к оптимальной с точки зрения статистического распределения пор по размеру, по преобладанию открытых пор, по шероховатости перегородок.
Распределение пор и перегородок по размеру радикально влияет на механическую прочность пористого сплава в условиях длительного функционирования в организме при постоянной подвижности. Для металлических имплантатов из никелида титана особое значение имеет сходство между их деформационными характеристиками и аналогичными характеристиками биологических тканей. По мере увеличения пористости сплав проявляет все большую деформируемость, что связано с утончением межпоровых перегородок. Это обстоятельство позволяет подбирать для конкретных тканей, интегрируемых с имплантатом, величину пористости, придающую максимальное подобие механических свойств. Наряду с интегральной деформационной способностью, большое значение имеет однородность пористой структуры. Перегородки с одинаковым поперечным сечением испытывают при изгибе и сжатии пористого имплантата одинаковые напряжения, в то время как для более толстых перегородок при тех же макроскопических деформациях локальные напряжения и деформации оказываются значительно больше, чем для более тонких перегородок. В местах локализации повышенных напряжений в первую очередь развиваются дислокации, ведущие к постепенному разрушению имплантата. Таким образом, чем меньше доля укрупненных пор, тем меньше вероятность развития пластической деформации и выхода имплантата из строя в прижизненный период. Экспериментально отмечено, что в режимах уплотнения шихты и предварительного подогрева, указанных в формуле изобретения, наряду с оптимальным средним размером пор и высокой шероховатостью поверхности обеспечивается одномодальное распределение пор и перегородок по размеру с небольшим разбросом. Оптимальный средний размер пор для наилучшей прорастаемости клеток экспериментально определен в пределах 100-150 микрон.
Химическое травление циклическим погружением в смесь кислот обеспечивает вскрытие и растравливание наиболее мелких, субмикронных элементов пористой структуры. Время погружения от 3 до 4 сек обосновано требованиями равномерности контакта пористой поверхности с раствором кислот и возможности контролирования процесса. В момент погружения раствор проникает в глубину пористого образца постепенно. Поэтому при малом времени погружения равномерное смачивание не обеспечивается. При времени погружения больше 4 сек увеличивается вероятность чрезмерного протравливания, характеризующегося не только уничтожением субмикронных пор, но и увеличением числа пор крупного размера, что ведет к уменьшению адгезионной способности пористой структуры по отношению к биотканям. Промывка под струей воды обеспечивает завершение каждого отдельного цикла травления. Цикличный характер травления позволяет визуально контролировать состояние структуры образца и принимать решение о достижении оптимального состояния поверхности. Признаком этого служит появление металлического блеска, свидетельствующего о снятии оксидной пленки. В результате травления по предлагаемой методике шероховатость поверхности пор достигает максимума, а в перегородках между порами появляются дополнительные каналы. Как правило, выбирают травитель, содержащий HNO3 (30 мл), HF (10 мл), H2O (30 мл1), температура смеси составляет 50-70°C. Окончательная промывка образца погружением в воду на 10-12 часов обеспечивает радикальное удаление остатков травителя и предотвращает его разрушающее воздействие на субмикронные поры.
Результатом выбора режимов при получении пористого сплава на основе никелида титана методом СВС является структура материала, оптимальная как по инкубационным, так и по механическим свойствам.
Эффективность заявляемого способа подтверждается результатами микроскопического исследования самих образцов пористого сплава, включая фотографирование и расчет распределения по размерам пор, а также наблюдение темпов и качества прорастания образцов клеточными культурами.
На фиг.1 представлены микрофотографии двух образцов пористого сплава. Первый из них, именуемый далее «образец типа а», был получен в соответствии с заявляемым способом (при степени уплотнения 45%, температуре предварительного подогрева 450°C и с проведенным циклическим травлением. Второй, именуемый далее «образец типа б», был получен при температуре предварительного подогрева 600°C (б) и без травления. «Образец а» обладает развитой, извилистой структурой с шероховатой поверхностью стенок пор и множеством субмикронных пор (фиг.1, а). «Образец б» имеет гладкую, словно оплавленную поверхность пор, содержит малое количество микропор (фиг.1, б), вследствие чего обладает низкими адгезивными свойствами. В связи с этим такая поверхность менее пригодна для культивирования клеток, чем у вышеприведенного образца «а».
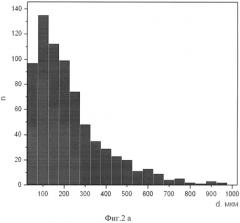
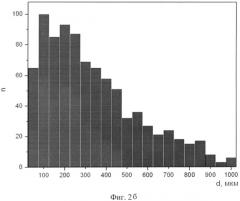
На фиг.2а, б представлены гистограммы распределения пор по размерам для тех же образцов. Судя по гистограмме фиг.2, а, можно видеть, что у «образца типа а», полученного при температуре предварительного подогрева 400°C, преобладают поры размером порядка 100-150 микрон, в то время как у «образца типа б» с температурой подогрева 600°C (фиг.2, б) размеры пор имеют более широкий разброс, в основном, в пределах от 100 до 450 мкм, причем встречаются поры размером вплоть до 1000 микрон. Ввиду такого значительного разброса в получаемом пористом материале в большом количестве присутствуют утолщенные перемычки, ограничивающие свободу деформации имплантата вместе с тканями и служащие локальными источниками дислокации, ведущими к более раннему механическому разрушению.
Наличие субмикронной пористой структуры является важным преимуществом материала, полученного в соответствии с заявляемым способом, от других материалов, получаемых путем СВС. На фиг.3 представлена гистограмма распределения субмикронных пор в образце типа «а». Можно видеть, что в дополнение к порам с размерами 1-150 микрон и более присутствуют поры с размерами от единиц до сотен нанометров, не встречающиеся в образце «б».
На фиг.4-6 представлены результаты культивирования клеточных структур. Культивирование клеточных культур было проведено на полученных образцах пористо-проницаемого никелида титана с использованием клеток костного мозга. Перед испытанием образцы-инкубаторы стерилизовали при 180°C в течение 60 мин. В качестве клеточного материала были использованы костномозговые стволовые клетки мышей-гибридов F1 CBA/j. В стерильных условиях извлекали бедренную кость. Костный мозг вымывали с помощью шприца во флаконы. Концентрацию клеток доводили до 4Н106/мл полной среды, засевали на инкубаторы из пористого никелида титана и помещали в 50 мл пластиковые флаконы фирмы "Coming". Культивирование in vivo происходило в среде, которая состояла: из среды DMEM-F12 ("ПанЭко", РФ), 10% эмбриональной телячьей сыворотки ("HyClone", США), гентамицина 40 мкг/мл ("ПанЭко", РФ), глутамина 250 мг/л ("ПанЭко", РФ). В систему с остеогенной дифференцировкой были введены дифференцировочные добавки: бета-глицерофосфат 3 мг/мл ("Sigma", США) в комбинации с 0,15 мг/мл аскорбиновой кислоты ("Sigma", США). Инкубаторы с клетками содержали при 37°C при 100% влажности с 5% СО2. Образцы на исследование отбирали на 7, 14, 21 сут. Образцы фиксировали в течение 1 ч в 2,5% глютаральдегиде ("Sigma", США), затем промывали 3 раза в PBS среде (15 мин каждый). Далее образцы фиксировали 1 ч в 1% тетраоксиде осмия ("Sigma", США), промывали 3 раза в PBS и затем дегидратировали, пропуская через ряд растворов этанола (30, 50, 70, 90, 100%) по 15 мин в каждом. Каждый образец инкубатора был исследован на растровом электронном микроскопе Quanta 200-3D.
Анализ развития клеток в разные сроки в образцах-инкубаторах «а» и «б», полученных разными способами, показал, что рост, размножение клеток и образование тканей идут в них в целом по одним и тем же механизмам. Однако в образцах типа «б» эти процессы идут гораздо медленнее, чем в образцах типа «а». Особенности взаимодействия клеток с поверхностью инкубаторов заключаются в том, что клетки прикрепляются чаще и в больших количествах на развитую, шероховатую микропористую поверхность, где имеется множество мелких субмикронных пор, служащих дополнительными хранилищами питательных сред. Клетки прикрепляются к стенкам мелких пор, затем начинают активно расти, размножаться и заполнять все поровое пространство. Структурный анализ роста клеток костного мозга в структуре пористых инкубаторов, полученных разными методами, выявил ряд различий.
На 7 сутки в инкубаторах типа «а» наблюдается на стенках пор и по всему объему высокая плотность отдельных клеток и их скоплений. Большое количество псевдоподий выстилают поверхность стенок пор, что подтверждает активный процесс размножения и жизнедеятельности клеток (фиг.4, а). В образцах типа «б» в указанный срок количество и плотность клеток на стенках пор и объеме заметно ниже (фиг.4, б). Сквозь клеточную массу просматривается структура стенок пор. Отмечаются в основном отдельные клетки.
На 14 сутки поровое пространство инкубатора типа «а» начинает заполняться тканевыми структурами различной плотности (фиг.5, а). Отдельные клетки лишь изредка просматриваются в этой ткани. Массивные псевдоподии сменили характер распространения с поверхностного на объемный, что говорит об активном заполнении инкубатора тканевыми структурами. Совокупность клеток и массивных волокон образует растущую ткань. Плотность этого слоя ткани такова, что структура материала никелида титана уже не просматривается. Контуры клеток потеряли свою сферичность и практически не выделяются в общей массе ткани. В образце инкубатора типа «б» также наблюдается дальнейший рост числа клеток, их развитие и размножение (фиг.5, б). Однако плотность их в объеме инкубатора не высока, отмечается выраженная неоднородность развития клеточной массы в порах разного размера. В отдельных порах наблюдаются лишь отдельные клетки с псевдоподиями, тогда как в других порах начинается процесс тканеобразования, состоящий из генерации крупных волокон и межклеточного матрикса.
На 21-е сутки инкубаторы типа «а» заполнены практически полностью образовавшейся тканью (фиг.6, а). Процесс образования ткани прошел как в массивных, так и в малых порах. Ткань в порах плотная, имеет определенный структурный рисунок, характеризующийся наличием плотных волокон и тяжей, что говорит о ее зрелости. В порах инкубатора типа «б» наблюдается заметная неоднородность в степени заполнения пор (рис.6, б). В отдельных порах (чаще крупных) присутствуют колонии клеток, в других (мелких) - клетки с плотными тяжами, подиями, большое количество межклеточного матрикса или уже сформированная ткань. То есть, при сохранении последовательности механизмов и этапов тканеобразования в целом, процесс роста тканей в порах образца «а» опережает по времени развитие тканей в образце «б». Главными факторами «отставания» в развитии тканевых структур у образца «б» являются его структурные характеристики, а именно гладкая поверхность стенок пор с малым количеством микропор - потенциальных мест прикрепления клеток.
Таким образом, результаты экспериментов показывают, что интеграционная связь клеток костного мозга с пористо-проницаемыми инкубаторами на основе никелида титана в принципе имеет место для образцов обоих типов: как получаемых известным способом, так и получаемых в соответствии с заявляемым способом. Вместе с тем, экспериментальные результаты демонстрируют преимущества заявляемого способа, который обеспечивает ускоренное развитие тканевых структур в получаемых пористых имплантатах, служащих эндопротезами или клеточными инкубаторами. Помимо этого, достигаемое уменьшение разброса размеров пор обеспечивает повышенную механическую устойчивость пористых имплантатов в функционирующем организме.
1. Способ получения пористого сплава на основе никелида титана, включающий формовку шихты из смеси порошков титана и никеля в цилиндрической оправке, предварительный подогрев, инициацию реакции СВС и охлаждение, отличающийся тем, что шихту уплотняют до пористости 45-50%, а температуру предварительного подогрева выбирают в пределах 400-450°С.
2. Способ получения пористого сплава на основе никелида титана по п.1, отличающийся тем, что полученный пористый сплав подвергают нескольким циклам химического травления, включающим погружение на 2-3 сек в раствор азотной и плавиковой кислот с последующей промывкой под струей воды, вплоть до появления металлического блеска, после чего образец погружают в воду на 10-12 часов.