Ингибитор протеинкиназы торк с направленным хемопревентивным действием in vitro
Иллюстрации
Показать всеИзобретение относится к медицине, конкретно к онкологии, и касается ингибиторов, обладающих направленным хемопревентивным действием через подавление активности протеинкиназы ТОРК. Применение фукоидана из бурой водоросли Fucus evanescens в качестве ингибитора протеинкиназы ТОРК с направленным хемопревентивным действием in vitro. Вышеописанное средство эффективно в качестве ингибитора протеинкиназы ТОРК с направленным хемопревентивным действием in vitro. 3 ил., 5 пр.
Реферат
Изобретение относится к медицине, конкретно к онкологии, и касается природных ингибиторов протеинкиназы ТОРК, обладающих направленным хемопревентивным действием in vitro.
Основным элементом всех митоген активируемых протеинкиназных (МАРК) путей принято считать трехкомпонентный протеинкиназный каскад. Внутри этого корового компонента сигнальных путей МАРК фосфорилируются и активируются протеинкиназами МКК (МАРК киназы/МАРКК). МКК, в свою очередь, фосфорилируются и активируются протеинкиназами МККК (МАРК киназы киназы/МАРККК). В клетках млекопитающих экспрессируется 3 группы по-разному регулируемых МАРК: ERK1/2, р38 (р38α/β/χ/δ) и JNK1/2/3 [Johnson G.L. et. al. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases. Science. 2002; 298(5600): 1911-1920]. Активация протеинкиназ семейства ERK связана с трансформацией нормальных клеток в раковые и стимуляцией пролиферации, а активация протеинкиназ семейств р38 и JNK - с индукцией апоптоза [Dhillon A.S. et.al. MAP kinase signalling pathways in cancer. Oncogene. 2007; 26(22): 3279-3290], [Zhang W. et. al. МАРК signal pathways in the regulation of cell proliferation in mammalian cells. Cell Res. 2002; 12(1): 9-18].
TOPK (Lymphokine-activated killer T-cell-originated protein kinase) представляет собой недавно обнаруженную серин-треонин протеинкиназу, которая является членом МАРКК семейства и участвует во многих клеточных процессах, в том числе трансформации нормальных клеток в раковые, пролиферации и апоптозе клеток, а также в воспалительных процессах [Ayllon V. et. al. РВК/ТОРК promotes tumour cell proliferation through p38 МАРК activity and regulation of the DNA damage response. Oncogene. 2007; 26(24): 3451-3461]. Исследования показали, что избыточная экспрессия киназы ТОРК наблюдается при развитии лейкемии, меланомы, рака кишечника, молочной железы и рака легких человека [Zhu F. et. al. Bidirectional signals transduced by TOPK-ERK interaction increase tumorigenesis of HCT116 colorectal cancer cells. Gastroenterology. 2007; 133(1): 219-231], [Simons-Evelyn M. et. al. PBK/TOPK is a novel mitotic kinase which is upregulated in Burkitt′s lymphoma and other highly proliferative malignant cells. Blood Cells Mol. Dis. 2001; 27(5): 825-829]. Установлено, что киназа ТОРК активирует ERK2 (киназа, регулирующая внеклеточные сигналы) и наоборот, что приводит к развитию рака ободочной и прямой кишки человека [Zhu F. et.al. Bidirectional signals transduced by TOPK-ERK interaction increase tumorigenesis of HCT116 colorectal cancer cells. Gastroenterology. 2007; 133 (1):219-231]. Повышенная экспрессия TOPK коррелирует с трансформацией клеток, индуцированной активацией онкогена H-Ras, фосфорилированием протеинкиназы JNK, индуцированной УФ излучением, и с подавлением экспрессии онкосупрессора р53 [Hu F. et.al. PBK/TOPK interacts with the DBD domain of tumor suppressor р53 and modulates expression of transcriptional targets including p21. Oncogene. 2010; 29 (40):5464-5474], [Oh S.M. et.al. T-lymphokine-activated killer cell-originated protein kinase functions as a positive regulator of c-Jun-NH2-kinase 1 signaling and H-Ras-induced cell transformation. Cancer Res. 2007, 67 (11):5186-5194].Таким образом, киназа TOPK является перспективной мишенью для предотвращения трансформации нормальных клеток в опухолевые и развития рака.
Несмотря на стремительные успехи в развитии современной медицины и биологии, рак остается неизлечимой болезнью, которая ежегодно уносит миллионы человеческих жизней. По данным ВОЗ одну треть всех случаев возникновения рака можно предотвратить, и, прежде всего с профилактикой рака тесно связано рациональное питание. Поэтому изучение хемопреветивного действия веществ, входящих в состав пищевых продуктов или выделенных из природных источников, и создание на их основе лекарственных средств направленного действия, является одним из основных направлений борьбы с этим заболеванием.
Известно, что такие пищевые продукты, как черный и зеленый чай [Park A.M. et.al. Signal transduction pathways: targets for green and black tea polyphenols. J. Biochem. Mol. Biol. 2003; 36 (1):66-77], виноград [She Q.B. et.al. Inhibition of cell transformation by resveratrol and its derivatives: differential effects and mechanisms involved. Oncogene. 2003; 22 (14):2143-2150], имбирь, кофе [Nomura M. et.al. Suppression of cell transformation and induction of apoptosis by caffeic acid phenethyl ester. Mol. Carcinog. 2001; 31 (2):83-89], картофель [Liu G. et. al. Proteinase inhibitors I and II from potatoes block UVB-induced AP-1 activity by regulating the AP-1 protein compositional patterns in JB6 cells. Proc. Natl. Acad. Sci. USA. 2001; 98 (10):5786-5791], Morinda citrifolia (Noni) [Liu G. et.al. Two novel glycosides from the fruits of Morinda citrifolia (noni) inhibit AP-1 transactivation and cell transformation in the mouse epidermal JB6 cell line. Cancer Res. 2001; 61 (15):5749-5756] содержат вещества (EGCG, резвератрол, 6-джинжерол, кофеиновая кислота, протеазные ингибиторы, гликозиды), которые влияют на активность митоген активируемых протеинкиназ (МАРК) и транскрипционных факторов (АР-1), играющих определяющую роль в зарождении и развитии опухолей. Однако клинические исследования резвератрола и EGCG показали, что ежедневное принятие данных веществ, приводит к их накоплению в организме и, как следствие, вызывает побочные эффекты Mereles D. et. al. Epigallocatechin-3-gallate (EGCG) for Clinical Trials: More Pitfalls than Promises? Int. J. Mol. Sci. 2011; 12(9): 5592-5603], [Tome-Carneiro J. et. al. Resveratrol and clinical trials: the crossroad from in vitro studies to human evidence. Curr. Pharm. Des. 2013; 19(34): 6064-6093].
Известны синтетические ингибиторы некоторых МАРК: AZ 628 (Raf ингибитор) [Khazak V. et. al. Selective Raf inhibition in cancer therapy. Expert. Opin. Ther. Targets. 2007; 11(12): 1587-1609], PD98059 (MEK1 ингибитор) [Watterson D.M. et. al. US 20100317665 A1, 16.12.2010], [Kojima K. et. al. Mitogen-activated protein kinase kinase inhibition enhances nuclear proapoptotic function of p53 in acute myelogenous leukemia cells. Cancer Res. 2007; 67(7): 3210-3219], HI TOPK 032 (селективный TOPK ингибитор) [Kim D.J. et. al. Novel TOPK inhibitor HI-TOPK-032 effectively suppresses colon cancer growth. Cancer Res. 2012; 72(12): 3060-3068]. Однако многие синтетические ингибиторы киназ имеют ряд побочных действий: страдают такие важные органы, как печень, почки, селезенка, костный мозг, пищеварительная система, кожа [Takara К. et. al. Cytotoxic effects of 27 anticancer drugs in HeLa and MDR1-overexpressing derivative cell lines. Biol. Pharm. Bull. 2002; 25(6): 771-778].
Наиболее близким к предлагаемому техническому решению является применение фукоидана из Saccharina cichorioides в качестве блокатора EGF-индуцированной неопластической трансформации JB6 С141 клеток посредством ингибирования активации рецептора эпидермального фактора роста (EGFR), протеинкиназ МАРК каскада и АР-1 комплекса [Вищук О.С. Структура и противоопухолевая активность фукоиданов бурых водорослей морей Дальнего Востока России // Автореферат диссертации на соискание кандитата химических наук, Владивосток, 2012].
Фукоиданы представляют собой класс сульфатированных полисахаридов, имеющих L-фукозу в качестве основной структурной единицы, но отличающихся друг от друга положением и степенью сульфатирования и ацетилирования, моносахаридным составом и молекулярными массами.
Известно, что фукоиданы бурых водорослей обладают противоопухолевой активностью [Wang Н. et. al. Seaweed polysaccharides with anticancer potential. Botanica Marina. 2008; 51(2): 313-319, [Jiao G. et. al. Chemical structures and bioactivities of sulfated polysaccharides from marine algae. Marine drugs. 2011; 9(2): 196-223].
Молекулярный механизм их противоопухолевого действия связывают с индукцией апоптоза и ингибированием ангиогенеза [Boo H.J. et. al. Fucoidan from Undaria pinnatifida Induces Apoptosis in A549 Human Lung Carcinoma Cells. Phytother. Res. 2011; 25(7): 1082-1086], [Aguayo A. et. al. Angiogenesis in acute and chronic leukemias and myelodysplastic syndromes. Blood. 2000; 96(6): 2240-2245]. Показано, что фукоиданы способны индуцировать апоптоз клеток рака толстой кишки человека НСТ 15, НТ-29 и НСТ 116 [Kim E.J. et. al. Fucoidan present in brown algae induces apoptosis of human colon cancer cells. BMC Gastroenterol. 2010; 10: 96].
Задачей изобретения является расширение арсенала средств-ингибиторов протеинкиназы ТОРК с направленным хемопревентивным действием.
Поставленная задача достигается применением фукоидана из бурой водоросли Fucus evanescens в качестве ингибитора протеинкиназы ТОРК с направленным хемопревентивным действием in vitro.
Фукоидан из Fucus evanescens, обозначенный далее FeF, имеет отличную от фукоиданов из Saccharina gurjanovae и S. cichorioides структуру. FeF представляет собой полисахарид, состоящий из 1→3- и 1→4-связанных остатков α-L-фукопиранозы, частично ацетилированных и сульфатированных преимущественно по положению С2, и менее по С4 и соответственно имеет свой уникальный молекулярный механизм противоопухолевого действия. [Vishchuk O.S. et. al. The fucoidans from brown algae of Far-Eastern seas: anti-tumor activity and structure-function relationship. Food. Chem. 2013; 141(2): 1211-1217].
FeF запатентован в качестве средства, обладающего антикоагулянтным и иммунотропным действием [Шевченко Н.М. и др. RU 2247574 С2, 10.03.2005] и средства, индуцирующего созревание дендритных клеток [Звягинцева Т.Н. и др. RU 2361598 С1, 20.07.2009].
Заявителем впервые показано, что фукоидан из Fucus evanescens блокирует in vitro EGF-индуцированную активацию белков митоген-активируемого протеинкиназного каскада через ингибирование протеинкиназы ТОРК.
Технический результат, обеспечиваемый изобретением, заключается в направленном ингибирующем действии фукоидана из Fucus evanescens на активность ТОРК, что обусловлено непосредственным взаимодействием полисахарида и протеинкиназы.
ТОРК обладает структурными и функциональными особенностями, отличающими ее от остальных членов семейства МАРКК, и предположение о том, что фукоидан из Fucus evanescens будет ингибировать этот белок с направленным хемопревентивным действием in vitro не является очевидным фактом.
Заявителем впервые показано in vitro, что фукоидан из Fucus evanescens взаимодействует с протеинкиназой ТОРК и, как следствие, специфически блокирует образование колоний в клетках карциномы толстого кишечника человека. Экспериментально доказано, что влияние фукоидана из F. evanescens на самопроизвольное формирование колоний в клетках карциномы толстого кишечника человека происходит через ингибирование протеинкиназы ТОРК. Для данного эксперимента использовали клеточные линии с различным уровнем экспрессии ТОРК. Установлено, что в опухолевых клетках с высоким уровнем ТОРК (НСТ 8) процент ингибирования самопроизвольного формирования колоний выше, чем в клетках со средним (НТ-29) и низким (WiDr) уровнем ТОРК. Таким образом, фукоидан из F. evanescens является специфическим ингибитором протеинкиназы ТОРК in vitro.
Заявляемое средство-ингибитор не обладает токсичностью in vitro и in vivo. Технология его производства экологически чистая, а источник получения - бурая водоросль Fucus evanescens широко распространена на побережье Охотского моря России. Все эти преимущества открывают возможности для производства FeF и его применения в качестве ингибитора ТОРК.
Изобретение проиллюстрировано следующими чертежами:
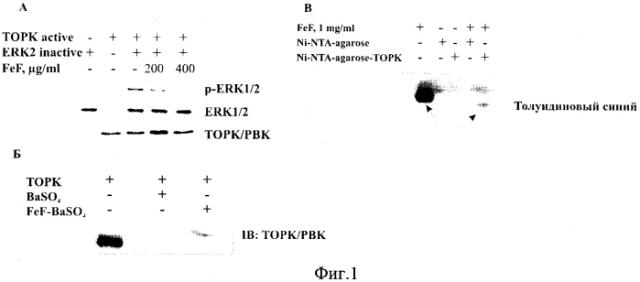
На фиг. 1 представлено действие фукоидана FeF на киназную активность протеинкиназы ТОРК (А) и связывание FeF с протеинкиназой ТОРК (Б, В).
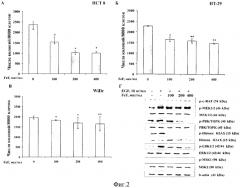
На фиг. 2 представлено действие FeF на рост колоний клеток карциномы толстого кишечника человека НСТ 8, НТ-29 и WiDr с разным уровнем экспрессии протеинкиназы ТОРК (А-В) и молекулярный механизм его действия на модели клеток НСТ 8 (Г).
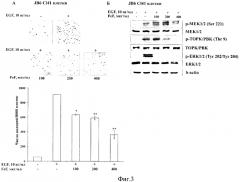
На фиг. 3 представлено действие FeF на неопластическую трансформацию, индуцированную EGF (А) и молекулярный механизм его хемопревентивного действия на модели клеток JB6 С141 (Б).
Изобретение иллюстрируется примерами.
Принятые сокращения
ВМЕ (Basal Medium Eagle) - питательная среда для культур клеток
c-Raf - киназа, кодируемая генами c-raf
DMEM (Dulbecco′s Modified Eagle Medium) - питательная среда для культур клеток млекопитающих
EGF (Epidermal Growth Factor) - эпидермальный фактор роста
EGFR (Epidermal Growth Factor Receptor) - рецептор эпидермального фактора роста
ERK (extracellular signal-regulated protein kinase) - киназа, регулирующая внеклеточные сигналы
FBS - (Fetal Bovine Serum) - эмбриональный бычий альбумин
Histone Н2АХ (Н2А histone family, member X) - гистон семейства Н2АХ
JNK (Jun N-terminal kinase) - Jun N-концевая киназа
МАРК - митоген активируемые протеинкиназы
McCoy′s 5A (McCoy′s 5A Modified Medium) - питательная среда для культивирования клеток млекопитающих
МЕК (Mitogen-activated protein kinase kinase) - киназа MAP киназ
MEM (Minimum Essential Medium) - питательная среда для культивирования клеток млекопитающих
MSK 1 (Mitogen and stress activated protein kinase 1) - митоген и стресс активируемая протеинкиназа 1
PBS (Phosphate-buffered saline) - фосфатно-солевой буфер
RPMI 1640 (Roswell Park Memorial Institute) - питательная среда для культур клеток млекопитающих
PVDF (Polyvinylidene difluoride membrane) - PVDF мембрана
SD - стандартное отклонение от среднего
SDS (sodium dodecyl sulphate) - додецилсульфат натрия
ТОРК (Lymphokine-activated killer T-cell-originated protein kinase) - киназа, кодируемая генами РВК
ТРА - форболовый эфир
АТФ - аденозинтрифосфат
БСА - бычий сывороточный альбумин
ДТТ - дитиотреитол
М - моль/литр
мкг - микрограмм
мкл - микролитр
мл - миллилитр
мМ - миллимоль/литр
нг - нанограмм
ТФУ - трифторуксусная кислота
УФ-излучение - ультрафиолетовое излучение
ЭГТА - этиленгликоль тетраацетат
ЭДТА - этилендиамин тетрауксусная кислота
Клеточные линии
В эксперименте использовали эпидермальные клетки мыши JB6 С141 (АТСС # CRL-2010) и клетки карциномы толстого кишечника человека НСТ 8 (АТСС # CCL-244™), НТ-29 (АТСС # НТВ-38), Widr (АТСС # CCL-218™) из американской коллекции клеточных культур (АТСС, США).
Культивирование клеток
Эпидермальные клетки мыши JB6 С141 (АТСС # CRL-2010), клетки карциномы толстого кишечника человека НСТ 8 (АТСС # CCL-244™), НТ-29 (АТСС # НТВ-38) и Widr (АТСС # CCL-218™) культивировали в питательных средах MEM, 5% FBS; DMEM, 10% FBS; McCoy′s 5А, 10% FBS и RPMI 1640, 10% FBS соответственно с добавлением L-глутамина (200 мМ), пенициллина (100 ед/л) и стрептомицина (100 мкг/л). Клеточные линии культивировали в инкубаторе MCO-18AIC («SANYO», Япония) при температуре 37°С, 5% СО2.
Статистическая обработка данных проведена с использованием t-критерия Стьюдента в условиях заданной доверительной вероятности: *р<0,05, **р<0,01, ***р<0,001 [программа SigmaPlot 2000, версия 6, (SPSS Inc., США)].
Пример 1. Определение действия FeF на киназную активность протеинкиназы ТОРК (in vitro киназный метод).
Данный метод основан на способности протеинкиназ катализировать перенос фосфата от АТФ к специфическому (серину, треонину или тирозину) аминокислотному остатку белка-субстрата. Ингибиторы протеинкиназ блокируют реакцию фосфорилирования последующих в киназном каскаде протеинкиназ и тем самым предотвращают трансформацию клеток и развитие рака.
Реакционная смесь содержала 10 мкл активированной протеинкиназы ТОРК (1-1,5 мкг), 10 мкл ее субстрата - неактивированную протеинкиназу ERK2 (0,3-1 мкг), 10 мкл АТФ (10 мМ), 1 мкл FeF (100, 200, 400, 800 мкг/мл) и 3 мкл киназного буфера (10Х) (коммерческий препарат фирмы «Cell Signaling Technology», США). Активированную протеинкиназу ТОРК смешивали с FeF и инкубировали в течение 15-30 минут при 32-37°С. Затем добавляли неактивированную протеинкиназу ERK2, АТФ, киназный буфер и инкубировали в течение 1,5-2 ч при 32-37°С. Контрольные пробы: контроль 1 - неактивированная протеинкиназа ERK2 (0,3-1 мкг), АТФ (10 мМ) и 1X киназный буфер; контроль 2 - активированная протеинкиназа ТОРК (1-1,5 мкг), АТФ (10 мМ) и 1X киназный буфер; контроль 3 - смесь активированной протеинкиназы ТОРК (1-1,5 мкг) и неактивированного субстрата - протеинкиназы ERK2 (0,3-1 мкг), АТФ (10 мМ) и 1X киназного буфера.
Эксперимент проводили трижды для подбора концентраций реагентов и оптимальных условий, при которых действие заявляемого средства проявлялось в большой степени. Для окончательного эксперимента использовали активированную протеинкиназу ТОРК (1 мкг), 10 мкл ее субстрата - неактивированную протеинкиназу ERK2 (1 мкг), 10 мкл АТФ (10 мМ), 1 мкл FeF (200, 400 мкг/мл) и 3 мкл киназного буфера (10 X) Активированную протеинкиназу ТОРК смешивали с FeF и инкубировали в течение 20 минут при 32°С. Затем добавляли неактивированную протеинкиназу ERK2, АТФ, киназный буфер и инкубировали в течение 1,5 ч при 32°С.
Полученные образцы смешивали с 1X буфером для растворения образца (62,5 мМ трис - HCl/SDS буфер (рН 6,8), 350 мМ ДТТ, 0,01% бромфиноловый синий (ВРВ), 10% глицерин, Н2О.) и проводили гель-электрофорез в 12% полиакриламидном геле. Затем белки с геля переносили на PVDF мембрану. Иммуногибридизацию проводили с использованием первичных антител phospho-ERK 1/2 (Tyr 202/Tyr 204), ТОРК, ERK 1/2 в разведении 1:1000 и вторичных антител, конъюгированных с ферментами пероксидазы хрена (1:3000). Белки детектировали с помощью хемолюминесцентного реагента ECL Plus «Amersham» на приборе ChemiDoc™ MP Imaging System (Bio Rad).
В приведенном примере установлено, что FeF блокирует активность протеинкиназы ТОРК, тем самым, останавливая передачу сигнала от ТОРК к субстрату ERK2 и предотвращая трансформацию клеток и рост клеток карциномы толстого кишечника человека (Фиг. 1А).
Пример 2. Определение способности FeF связываться с протеинкиназой ТОРК in vitro.
Раствор FeF (100 мг/мл) смешивали с 10% раствором BaCl2 в соотношении 1:1 и инкубировали при температуре 4°С в течение 12 ч. Затем проводили осаждение нерастворимого FeF четырьмя объемами 96% этанола. Осадок дважды промывали 96% этанолом и сушили на воздухе.
Связывание FeF с протеинкиназой ТОРК in vitro. Фукоидан в нерастворимой форме FeF-BaSO4 (10 мг) инкубировали при постоянном перемешивании с рекомбинантной протеинкиназой ТОРК (4 мг) в связывающем буфере (50 мМ трис (рН 7,5), 5 мМ EDTA, 150 мМ NaCl, 1 мМ DTT, 0,1% NP-40, 2 мг/мл БСА, 0,02 мМ фенилметилсульфонилфлюорид, 1X раствор ингибиторов протеаз) при температуре 4°С в течение 12 ч. Затем осадок трижды промывали связывающим буфером. Результат связывания FeF-BaSO4 с ТОРК детектировали с помощью метода Вестерн-блотинг с использованием первичных антител ТОРК (1:1000).
Получение Ni-NTA-agarose-TOPK смолы. Рекомбинантный белок ТОРК (0.5 мг) смешивали с 400 мкл Ni-NTA-agarose смолы (Qiagen, Hilden, Germany). Реакционную смесь инкубировали при 4°С в течение 12 ч при постоянном перемешивании. Смолу с лигандом (Ni-NTA-agarose-TOPK) промывали 50 мл PBS.
Аффинное связывание фукоидана с ТОРК протеинкиназой.
FeF (10 мг/мл) инкубировали с Ni-NTA-agarose-TOPK или с Ni-NTA-agarose (контроль) в реакционном буфере (50 мМ Tris (рН 7,5), 5 мМ ЭДТА, 150 мМ NaCl, 1 мМ ДТТ, 0,01% Triton Х-100, 2 мкг/мл БСА, 0,02 мМ фенилметилсульфонилфторид, 1X ингибитор протеаз) при 4°С в течение 12 ч при постоянном перемешивании. Смолу промывали 30 мл реакционного буфера 5 раз.
Результат связывания FeF с киназой ТОРК анализировали с помощью электрофореза в 1% агарозном геле. Данный метод служит для разделения макромолекул (полисахаридов) на основе их размера или электрического заряда. Электрофорез проводили в трис-боратном буфере (20 мМ Tris-HCl, 80 мМ Н3ВО3, 0,1 М ЭДТА) при силе тока 20 mA в течение 2 ч. Окрашивание гелей проводили красителем Толуидиновым синим. Интенсивность окрашивания полос регистрировали с помощью программы «Quality One» (Bio Rad, США)
Таким образом, методами молекулярной и клеточной биологии установлено, что протеинкиназа ТОРК является мишенью для фукоидана из бурой водоросли F. evanescens (Фиг. 1Б, В).
Доказательство физиологической значимости взаимодействия фукоидана из F. evanescens и ТОРК подтверждено экспериментами, приведенными в примерах 3-5.
Пример 3. Подбор оптимальных концентраций FeF и определение его способности ингибировать неопластическую трансформацию нормальных клеток, индуцированную EGF, и рост колоний клеток карциномы толстого кишечника человека (метод мягкого агара).
Метод мягкого агара основан на том, что нормальные клетки, находящиеся в неприкрепленном состоянии в толще мягкого агара под действием различных индуцирующих факторов (EGF, ТРА, УФ-изучение) трансформируются в раковые клетки, тогда как раковые клетки в мягком агаре дают рост клеточных колоний без индуцирующих факторов. Вещества, обладающие противоопухолевым действием, ингибируют эти процессы [Colburn N. et. al. Dissociation of mitogenesis and late-stage promotion of tumor cell phenotype by phorbol esters: mitogen-resistant variants are sensitive to promotion. Proc. Natl. Acad. Sci. USA. 1981; 78(11): 6912-6916].
Эксперимент выполнен на модели эпидермальных клеток мыши JB6 С141 и клеток карциномы толстого кишечника человека НСТ 8, НТ-29, WiDr, как описано Colburn с некоторыми модификациями. FeF был растворен в PBS.
Трансформацию эпидермальных клеток мыши JB6 С141 проводили под действием эпидермального фактора роста (EGF). Клетки JB6 С141 (2,4×104 клеток/мл) обрабатывали EGF (10 нг/мл) и FeF (50, 100, 200, 400, 800 мкг/мл) в 1 мл 0,33% ВМЕ агара, содержащем 10% FBS. Затем раствор перемешивали и аккуратно наслаивали поверх 0,5% ВМЕ агара, содержащего EGF (10 нг/мл) и FeF в тех же концентрациях. Положительный контроль - клетки, обработанные EGF (10 нг/мл) и PBS. Отрицательный контроль - клетки, обработанные PBS. Клетки культивировали в СО2-инкубаторе в течение 14 дней. Количество и размер колоний клеток были оценены с использованием обратимого микроскопа («Motic АЕ 20», Китай) и Motic Image Plus программы. Были выполнены два независимых эксперимента для подбора оптимальных концентраций FeF, при которых его действие было наиболее выраженным. Поскольку средство при концентрации 50 мкг/мл ингибировало трансформацию JB6 С141 клеток менее чем на 10%, а при концентрации 800 мкг/мл - практически на 90%, то для определения действия заявляемого средства на неопластическую трансформацию нормальных клеток, индуцированную EGF, были выбраны концентрации FeF 100, 200, 400 мкг/мл.
Фукоидан из бурой водоросли F. evanescens в концентрациях 100, 200, 400 мкг/мл ингибировал неопластическую трансформацию JB6 С141 клеток, индуцированную EGF, на 30, 35 и 60% соответственно (Фиг. 2А).
Пример 4. Установление молекулярного механизма хемопревентивного действия FeF (метод Вестерн-блоттинг).
Вестерн-блоттинг (иммуноблотинг) - современный высокочувствительный аналитический метод, используемый для определения в образце специфичных белков с помощью антител. Метод основан на комбинации гель-электрофореза и иммунохимической реакции «антиген-антитело». С помощью гель-электрофореза белки разделяются в полиакриламидном геле. Далее белки переносят на PVDF мембрану. Затем их детектируют с использованием антител методом «сэндвича»: сначала белки связываются с первичными (моно- или поликлональными) антителами, которые, в свою очередь, связываются со вторичными антителами, конъюгированными с ферментами (пероксидазой хрена или щелочной фосфатазой). Визуализация исследуемого белка достигается путем проведения соответствующей биохимической реакции с образованием продукта, который определяется колориметрическим, хемилюминесцентным или флуоресцентным методами детекции. Количество белка оценивается с помощью денситометрии.
Приготовление лизата клеток. Эпидермальные клетки мыши JB6 С141 (3,0×105) и клетки рака кишечника НСТ 8 (с высоким уровнем экспрессии ТОРК) (3,0×105) рассеивали на чашки Петри (60 мм) и культивировали в 3 мл питательной среды MEM, 5% FBS и DMEM, 10% FBS соответственно при температуре 37°С, 5% СО2 в течение 24 ч. Затем удаляли среду, омывали клетки 3 мл PBS (процедуру повторяли 2 раза) и добавляли 3 мл MEM или DMEM, не содержащую FBS. Через 12 ч клеточные культуры обрабатывали FeF различной концентрации (100, 200, 400 мкг/мл) и инкубировали в течение 48 ч. Клетки обрабатывали EGF (10 нг/мл) и помещали в СО2 - инкубатор на 15 мин. Затем чашки Петри с клеточными культурами ставили на лед, удаляли питательную среду. Клетки омывали 3 мл холодного PBS, добавляли 300 мкл лизирующего буфера (50 мМ трис (рН 7,4), 150 мМ NaCl, 1 мМ ЭДТА, 1 мМ ЭГТА, 10 мг/мл апротинина, 10 мкг/мкл леупептина, 5 мМ фенилметансульфонилфторид, 1 мМ ДТТ, 1% Тритон Х-100) и оставляли при 0°С в течение 30 мин.
Клеточные стенки разрушали с помощью ультразвукового дезинтегратора Vibra-cell CV 18 («Sonic», Южная Корея), лизат клеток центрифугировали при 13000 об/мин в течение 15 мин. Супернатант использовали для последующих экспериментов.
Электрофорез в полиакриламидном геле. Разделение белков проводили в вертикальном полиакриламидном геле (процент геля зависел от молекулярной массы детектируемых белков) в SDS-трис-глициновом буфере, при 20 мА по методу Леммли [Laemmli U. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227(5259): 680-685].
Перенос белков на PVDF мембрану. Белки с полиакриламидного геля переносили на PVDF мембрану в трис-глициновом буфере при 150 мА. После переноса белков, мембрану трижды промывали 10 мл PBST (1X PBS, 0,05% Tween-20) в течение 10 мин.
Мембрану инкубировали в 10 мл 5% раствора блокирующего буфера (обезжиренное сухое молоко, 1X PBST) при комнатной температуре в течение 1 ч, затем ее трижды промывали 10 мл PBST в течение 10 мин.
Детектирование белков на мембране. Иммуногибридизацию проводили с использованием первичных антител phospho-c-Raf (Ser 259), phospho-MEK 1/2 (Ser 221), phospho-ERK 1/2 (Tyr 202/Tyr 204), phospho-TOPK (Thr 9), phospho-Histone H2AX, phospho-MSK 1 (Thr 581), MEK 1/2, ERK 1/2, TOPK, Histone H2AX, MSK 1, β-актин. Мембрану инкубировали в 10 мл первичных антител (в разведении 1:1000) при 4°С в течение 12 ч. Затем PVDF мембрану промывали в 10 мл PBST 10 мин/три раза и обрабатывали вторичными антителами, конъюгированными с ферментами пероксидазы хрена (в разведении 1:3000) при комнатной температуре в течение 1 ч. После стандартной отмывки мембраны, белки проявляли с помощью хемолюминесцентного реагента ECL Plus «Amersham» на приборе ChemiDoc™ MP Imaging System (Bio Rad).
FeF с увеличением концентрации (100, 200, 400 мкг/мл) эффективно ингибировал индуцированное EGF фосфорилирование протеинкиназ ТОРК, ERK1/2, а также следующих за ними в МАРК каскаде Histone Н2АХ, MSK 1 киназ в нормальных клетках JB6 С141 и клетках карциномы толстого кишечника человека НСТ 8. Поскольку FeF не ингибировал активацию c-Raf и МЕК киназ, но эффективно ингибировал фосфорилирование ТОРК протеинкиназы и ее субстратов, протеинкиназа ТОРК была предложена в качестве мишени, с которой связывается FeF и тем самым блокирует клеточную трансформацию и развитие рака кишечника человека (Фиг. 2Б и Фиг. 3Г).
Пример 5. Для исследования действия FeF на формирование и рост колоний раковых клеток были выбраны клеточные линии рака кишечника человека с разным уровнем экспрессии протеинкиназы ТОРК: высокий уровень экспрессии киназы ТОРК в клетках НСТ 8, средний и низкий уровни экспрессии этого белка в НТ-29 и WiDr клетках рака кишечника соответственно [Zhu F. et. al. Bidirectional signals transduced by TOPK-ERK interaction increase tumorigenesis of HCT116 colorectal cancer cells. Gastroenterology. 2007; 133(1): 219-231]. Выбранные клеточные культуры (3×104 клеток/мл) обрабатывали FeF (50-800 мкг/мл) в 1 мл 0,33% ВМЕ агара, содержащем 10% FBS. Затем раствор перемешивали и аккуратно наслаивали поверх 0,5% ВМЕ агара, содержащего FeF в тех же концентрациях. Контрольные клетки обрабатывали PBS. Затем клетки культивировали в CO2 - инкубаторе в течение 7-14 дней (в зависимости от линии клеток). Количество и размер колоний клеток были оценены с использованием обратимого микроскопа «Motic АЕ 20» и Motic Image Plus программы. Так же, как и в случае эксперимента, описанного выше, были выполнены два независимых эксперимента для подбора оптимальных концентраций FeF. Для определения действия заявляемого средства на формирование колоний клеток карциномы толстого кишечника человека были выбраны концентрации FeF 100, 200, 400 мкг/мл.
FeF в концентрациях 100, 200, 400 мкг/мл ингибировал формирование и рост колоний клеток карциномы толстого кишечника человека НСТ 8 (высокий уровень ТОРК) на 35, 57 и 58%; НТ-29 (средний уровень ТОРК) на 21, 31 и 36%; WiDr клеток на 6, 14 и 16% соответственно (Фиг. 3А, Б, В). Таким образом, ингибирующее действие FeF зависело от уровня экспрессии протеинкиназы ТОРК в исследуемых клеточных линиях.
Применение фукоидана из бурой водоросли Fucus evanescens в качестве ингибитора протеинкиназы ТОРК с направленным хемопревентивным действием in vitro.