Замещенные 4-(ариламино) селенофенопиримидиновые соединения и способы их применения
Иллюстрации
Показать всеИзобретение относится к селенофеновому соединению формулы (I)
или его фармацевтически приемлемой соли. X представляет собой селен, Y и Z представляют собой атомы углерода; или Y представляет собой селен, X и Z представляют собой атомы углерода; или Z представляет собой селен, X и Y представляют собой атомы углерода; А представляет собой N; В представляет собой NR5, где R5 выбирается из водорода, или алкила; Ar представляет собой арильное или гетероарильное кольцо; арил представляет собой бензольное или нафталиновое кольцо, а гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы; при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол; необязательно замещенное одним, двумя или несколькими группами, независимо выбранными из водорода, галогена, тиола, сульфонамида, C1-6алкила, вторичного С1-6алкила, третичного С1-6алкила, С2-6алкинила, С1-4алкоксикарбонила и фенила; R1, R2 и R3 независимо выбираются из водорода, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, С1-6алкила, вторичного С1-6алкила, третичного С1-6алкила, С1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(С1-6алкил)аминокарбонила, и фенила; или R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное карбоциклическое или пергидрогетероциклическое кольцо, указанное в формуле изобретения; или R1 и R2 соединены, и вместе с атомами, к которым они присоединены, образуют необязательно замещенное арильное или незамещенное гетероарильное кольцо, слитое с селенофеном; при этом арил представляет собой бензольное кольцо, и гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один атом азота. Также предложены способы получения селенофенового соединения (варианты), фармацевтическая композиция, способы лечения или ингибирования, или контролирования клеточного пролиферативного нарушения. Изобретение позволяет получить селенофеновое соединение, обладающее противораковой активностью. 8 н. и 21 з.п. ф-лы, 2 табл., 35 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, способам их получения, способам лечения или ингибирования, или контролирования рака, и способам получения фармацевтических композиций для лечения или ингибирования, или контролирования рака.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Рак представляет собой болезнь, которая является результатом аномального роста ткани. Некоторые виды рака обладают возможностью поражать локальные ткани, а также метастазировать отдаленные органы. Это заболевание может развиться во многих различных органах, тканях и клеточных типах. Таким образом, термин "рак" относится к совокупности более чем из тысячи различных заболеваний. Более 4,4 млн. человек во всем мире были диагностированы с раком груди, толстой кишки, яичников, легких или раком предстательной железы, и более 2,5 млн. человек умерли от этих тяжелых заболеваний. Только в одних Соединенных Штатах Америки в 2005 году имели место более 1,25 млн. новых случаев заболевания, а также имело место более 500000 случаев смерти от рака. Большинство новых случаев относятся к раку толстой кишки (~100000), раку легких (~170000), раку молочной железы (~210000) и раку предстательной железы (~230000). По прогнозам, в течение следующих десяти лет заболеваемость и распространенность рака увеличится примерно на 15%, что отражает средний темп роста 1,4%.
Лечение рака бывает двух основных типов: лечебное или паллиативное. Основными лечебными терапиями рака являются хирургическое вмешательство и радиационное лечение. Эти варианты лечения, как правило, являются успешными только в случае, если рак обнаружен на ранней стадии локализации. Как только заболевание развилась до локально-распространенной или метастатической формы рака, эти методы лечения менее эффективны и цель терапии направлена на временное облегчение симптомов и поддержания хорошего качества жизни. Наиболее распространенные протоколы для любого режима лечения включают комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.
Цитотоксические лекарственные средства (также известные как циторедуктивные средства) используются при лечении рака в рамках лекарственной терапии или с целью продления жизни или паллиативного лечения симптомов. Цитотоксические лекарственные средства могут быть объединены с лучевой терапией и/или с хирургическим вмешательством, представляя, в частности, нео-адъювантную терапию (химиотерапия первой линии, направленная на сокращение опухоли, делая, тем самым, местную терапию, такую как хирургическая операция и лучевая терапия, более эффективной) или адъювантную химиотерапию (используемую в комбинации вместе с хирургической операцией и/или местной терапией, или после них). Комбинации различных препаратов являются зачастую более эффективными, чем отдельные препараты: они могут обеспечить преимущество при определенных опухолях в виде усиления реакции, снижения развития устойчивости к лекарственным средствам, и/или они могут обеспечить повышенную выживаемость. По этим причинам использование комбинированных цитотоксических препаратов при лечении многих видов рака является весьма распространенным явлением. Применяемые в настоящее время цитотоксические лекарственные средства реализуют различные механизмы, чтобы блокировать пролиферацию и индуцировать гибель клеток. В целом, в зависимости от механизма действия, они могут быть разделены на следующие группы: модуляторы микротрубочки, которые мешают полимеризации или деполимеризации микротрубочек (например, доцетаксел, паклитаксел, винбластин, винорелбин), антиметаболиты, в том числе нуклеозидные аналоги и другие ингибиторы ключевых метаболических путей клеток (например, капецитабин, гемцитабин, метотрексат); агенты, которые взаимодействуют непосредственно с ДНК (например, карбоплатин, циклофосфамид), антрациклиновые ДНК интеркаляторы, которые влияют на ДНК-полимеразы и топо-изомеразы II (например, доксорубицин, эпирубицин) и неантрациклиновые ингибиторы топоизомеразной активности (например, топотекан, иринотекан и этопозид). Хотя различные цитостатические препараты действуют через различные механизмы действия, каждый из них, как правило, приводит, по меньшей мере, к транзиентному сокращению опухолей. Цитотоксические лекарственные средства продолжают представлять собой важный компонент в арсенале средств, применяемых онкологами, для борьбы с раком. В настоящее время большинство лекарственных средств, проходящих клинические испытания на заключительной фазе II и фазе III, ориентированы на известные механизмы действия (средства, связывающие тубулин, антиметаболиты, средства, воздействующие на ДНК), и на постепенные улучшения препаратов известных классов (например таксаны или камптотецины). В последнее время появилось небольшое количество цитотоксических лекарственных средств на основе новых механизмов. Механизмы действия этих цитотоксических лекарственных средств включают ингибирование ферментов, участвующих в модификации ДНК (например, гистондеацетилазы (HDAC)), ингибирование белков, участвующих в движении микротрубочек и развитии клеточного цикла (например, кинезины, киназа Аврора), и новые индукторы апоптоза (например, ингибиторы Bcl-2).
Несмотря на то, что цитостатики остаются в авангарде приемов в лечении пациентов с солидными опухолями, их ограниченная эффективность и узкий терапевтический индекс приводит к значительным побочным эффектам. Кроме того, фундаментальные исследования в области рака привели к исследованию менее токсичных терапий на основе конкретных механизмов, центральных для прогрессии опухолей. Такие исследования могут привести к эффективной терапии с улучшением качества жизни больных раком. Таким образом, возник новый класс терапевтических агентов, называемый цитостатическими лекарственными средствами (цитостатиками). Цитостатики направляют свое действие на стабилизацию опухолей и, как правило, они ассоциированы с более ограниченным и менее тяжелым профилем побочных эффектов. Развитие цитостатических лекарственных средств стало результатом идентификации специфических генетических изменений, которые происходят в ходе развития рака, и понимания роли активации белков, таких как тирозинкиназы и серин/треонин-киназы, при развитии рака.
В эпителиальных злокачественных новообразованиях человека часто встречается экспрессированный EGFR, и его активация играет значительную роль в развитии и прогрессировании рака у человека, так как сигнальные пути EGFR связаны с клеточной пролиферацией, промотированием выживания клеток и ингибированием апоптоза. Таким образом, EGFR представляет собой весьма привлекательную молекулярную мишень для терапии рака. За последние 20 лет были успешно разработаны многочисленные низкомолекулярные ингибиторы и моноклональные антитела, нацеленные на EGFR.
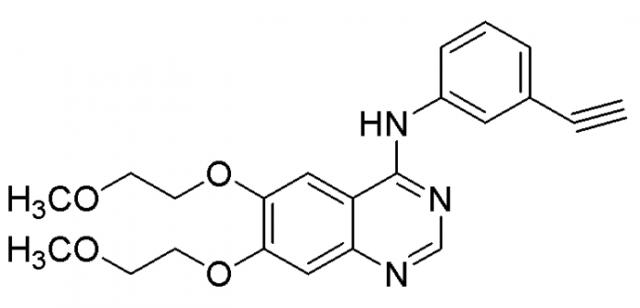
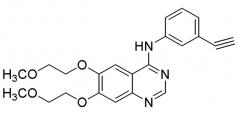
Два селективных ингибитора EGFR, иресса (гефитиниб) и тарцева (эрлотиниб (Фиг.1), представляющие собой производные 4-анилинохиназолина, были соответственно утверждены FDA в 2003 и 2004 годах для терапии локально-распространенной или метастатической формы немелкоклеточного рака легкого (НМРЛ). Клинические данные показывают, что 10-20% всех больных с НМРЛ частично реагируют на эти два ингибитора EGFR, но только эрлотиниб увеличивает выживаемость пациентов с рецидивирующим НМРЛ. Более того, у большинства пациентов, которые ответили на начальное лечение, в конечном счете развивалась устойчивость к ингибиторам EGFR. Таким образом, существует настоятельная неудовлетворенная медицинская необходимость в разработке и создании новых более мощных противоопухолевых активных соединений с широким терапевтическим индексом.
Химическая структура препаратов иресса и тарцева является следующей.
| Иресса | Тарцева |
Таким образом, техническая проблема, которая должна быть решена в соответствии с настоящим изобретением, может быть представлена как предоставление альтернативного соединения, которое обладает хорошей противораковой активностью или ингибирующей активностью в отношении EGFR тирозинкиназ или других киназ, предлагая, таким образом, новые терапевтические варианты для лечения заболеваний, в частности рака и других пролиферативных заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям формулы (I) и их фармацевтически приемлемым солям.
В другом аспекте данное изобретение относится к геометрическим изомерам/оптическим изомерам/диастереомерам, гидратам и сольватам соединений формулы (I).
В другом своем аспекте, настоящее изобретение относится к способу получения соединений формулы (I).
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно 4-(ариламино)селенофенопиримидиновое соединение, выбранное из соединений вышеуказанной формулы (I) и их производных, в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентом/носителем/разбавителем.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно 4-(ариламино)селенофенопиримидиновое соединение, выбранное из соединений вышеуказанной формулы (I) и их производных, в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентом/носителем/разбавителем, и, необязательно, с по меньшей мере одним противоопухолевым агентом.
В другом своем аспекте, настоящее изобретение относится к способу лечения или ингибирования, или контролирования клеточного пролиферативного нарушения, в частности рака, у пациента, нуждающегося в таком лечении, где способ включает введение пациенту эффективного количества соединения формулы (I) или композиции на его основе, как определено выше.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее изобретение будет подробно описано в связи с определенными предпочтительными и частными вариантами осуществления, так чтобы различные аспекты его были более ясны и понятны.
Настоящее изобретение использует селенофен вместо бензольного кольца в 4-(фениламино)хиназолине в качестве основы для значительного увеличения его активности для возможного лечения в случае ранней диагностики рака, и для значительного увеличения эффективности лечения на поздних стадиях рака. Причина, по которой система селенофенового кольца была выбрана вместо ароматической системы фенильного кольца, состоит в том, что это кольцо может напоминать фенильное кольцо по форме, размеру и в пространстве, и оно соответствует структуре фенильного кольца, поскольку селен является большим атомом в пятичленном кольце. Рецепторы, участвующие в распознании 4-(фениламино)хиназолина, например в гефитинибе, также могут распознавать 4-(ариламино)селенофенопиримидин для биологического ответа. Кроме того, селен, как металлоорганическое соединение, обладает противораковыми свойствами. Селен является хорошо известным из незаменимых микроэлементов для человека, который необходим для поддержания здоровой диеты у людей в дозах 55-90 мкг (Aumann, K.M.; Scammells, P. J.; White, J. M.; Schiesser, C. H. Org. Biomol. Chem., 2007, 5, 1276-1281). Следовательно, селен может быть включен как металлоорганическое соединение через ароматическую систему селенофенового кольца, заменяющего ароматическую систему фенильного кольца, со значительно более высокой эффективностью.
Предлагаемые новые аналоги будут иметь конформацию, которая подходит к рецепторам на мембране опухолевой клетки в специфическом конформационном состоянии (SCP), обеспечивая получение физиологического ответа. С помощью этой новой конструкции все молекулы, находящиеся в заранее подготовленной специфической конформации, будут связываться во времени с рецепторами на сто процентов, в то время как препарат иресса, представленный на рынке, может, из-за его неспецифического конформационного состояния (NSCP), иметь относительно низкую вероятность связывания на сто процентов во времени, тем самым не приводя к ни к какому физиологическому ответу, и, следовательно, он будет иметь сниженную активность.
Это, в свою очередь, обеспечит высокую специфичность с большим окном терапевтического индекса (TI). В целом, больший терапевтический индекс является предпочтительным для лечения онкологических больных. Это связано с тем, что было бы желательным начинать терапевтический режим с очень высокой максимально переносимой дозы (МПД), так, чтобы раковые клетки сильно пострадали при первом курсе химиотерапии. В противном случае, выжившие раковые клетки будут восстанавливать повреждения в ДНК, а затем метастазировать в другие органы. Кроме того, раковые клетки, которые выжили после первого курса, станут устойчивыми ко второму курсу химиотерапии, если он будет необходим. И, кроме того, из-за ослабленности иммунной системы от первого курса химиотерапии, во втором курсе, из-за проблем с токсичностью, будет назначена субоптимальная доза.
Как часть разработки новых противораковых соединений, были получены и испытаны, в части их эффективности по отношению различных линий раковых клеток, несколько 4-(ариламино)селенофенопиримидиновых соединений общей формулы (I). Было обнаружено, что эти 4-(ариламино)селенофенопиримидиновые соединения общей формулы (I) показали in vitro хорошее ингибирование пролиферации клеток карциномы человека, таких как клеток А549 карциномы легкого, клеток НТ29 колоректальной карциномы, клеток DU145 карциномы предстательной железы, клеток MDA-MB-231 карциномы молочной железы (отрицательной по эстрогеновым рецепторам), клеток HepG2 гепатоцеллюлярной карциномы и клеток HeLa карциномы шейки матки. Авторы неожиданно обнаружили, что в сравнении с гефитинибом (ирессой), аналог 4-(ариламино)селенофенопиримидина (соединение 33) общей формулы (I) показал лучшую эффективность в ингибировании пролиферации различных опухолевых клеток человека in vitro (см. Таблицу 1 и Таблицу 2). Величины IC50 соединения 33 равны 28,38, 29,47, 13,11, 20,45, 10,41 и 23,09 мкΜ для клеток А549, DU145, НТ29, MDA-MB-231, HepG2 и HeLa, соответственно. В отличие от этого, значения IC50 гефитиниба (ирессы) составили 57,1, 31,47, 46,9, 45,40, 35,53 и 50,12 мкМ для клеток А549, DU145, НТ29, MDA-MB-231, HepG2 и HeLa, соответственно. Наблюдения показывают, что соединение 33 является более мощным ингибитором (на 101%, 6,8%, 257,8%, 122%, 241% и 117%), чем гефитиниб (иресса) при ингибировании пролиферации in vitro опухолевых клеток А549, DU145, НТ29, MDA-MB-231, HepG2 и HeLa, соответственно. Таким образом, новый аналог (соединение 33) является значительно лучшим, чем представленный на рынке препарат гефитиниб (иресса), принимая во внимание его эффективность in vitro и результаты, обобщенные в Таблицах 1 и 2.
Несмотря на то что для демонстрации настоящего изобретения были использованы отдельные соединения, настоящее изобретение охватывает все соединения формулы (I) и их производные.
Соответственно, изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным следующей формулой (I), и к их фармацевтически приемлемым солям;
Формула (I)
где
Х представляет собой селен, Y и Z представляют собой атомы углерода;
или
Y представляет собой селен, Х и Z представляют собой атомы углерода;
или
Z представляет собой селен, X и Y представляют собой атомы углерода;
A представляет собой N или C-R4, где R4 выбирается из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила и C1-6алкилсульфонила;
В выбирается из S, S(O), S(О2) или NR5, где R5 выбирается из водорода, алкила, алкокси или галоалкила;
Ar представляет собой арильное или гетероарильное кольцо; арил представляет собой бензольное или нафталиновое кольцо, а гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы; при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол;
Ar представляет собой кольцо, необязательно замещенное одним, двумя или несколькими группами, независимо выбранными из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила, и представляет собой арильное, гетероарильное и гетероциклоалкильное кольцо; при этом арильное, гетероарильное и гетероциклоалкильное кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом;
R1, R2 и R3 независимо выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила, и арильного, гетероарильного и гетероциклоалкильного кольца; при этом арильное, гетероарильное или гетероциклоалкильное кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом; или
R1 и R2 независимо выбираются из соединений следующей формулы:
где n представляет собой целое число, выбранное из 0 и из чисел от 1 до 5, при этом n предпочтительно равно 2; * обозначает место присоединения к селенофеновому кольцу в формуле I; W выбирается из CH2, O, S или NH;
R6 и R7 независимо выбираются из водорода, амино, тригалометила, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила;
или
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное карбоциклическое или пергидрогетероциклическое кольцо, выбранное из соединений формулы:
где n представляет собой целое число, выбранное из чисел от 0 до 4; m представляет собой целое число, выбранное из чисел от 0 до 4; * обозначает место присоединения к R1 и R2 в формуле I; L выбирается из CH2, O, S и NR8, где R8 выбирается из водорода, амино, тригалометила, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила;
или
R8 выбирается из соединений следующей формулы:
* обозначает место присоединения к N в NR8; где D выбирается из C1-6алкила, -C(=O), -S(=O), -S(=O)2; R9 и R10 выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6лкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила; или
R6 и R7 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное циклоалкильное или циклогетероалкильное кольцо; или
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют необязательно замещенное арильное или необязательно замещенное гетероарильное кольцо, слитое с селенофеном; при этом арил представляет собой бензольное кольцо, и гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы, при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол.
В предпочтительном варианте выполнения, настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным следующей формулой (I),
Формула (I)
где
X представляет собой селен, когда Y и Z являются атомами углерода; или
Y представляет собой селен, когда Х и Z являются атомами углерода; или
Z представляет собой селен, когда X и Y являются атомами углерода;
и соединение выбирается из следующих соединений:
.
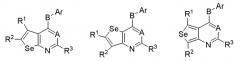
В другом варианте выполнения, настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным формулой (I), где А представляет собой N; В представляет собой NR5; и Ar представляет собой арильное или гетероарильное кольцо; при этом арильное кольцо представляет собой замещенный или незамещенный бензол, как показано ниже:
где
* обозначает место присоединения к B в формуле (I);
и соединение выбирается из следующих соединений:
R11, R12, R13, R14 и R15 независимо выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила, и фенильного, бензильного, 5-членного гетероароматического кольца, содержащего один или несколько гетероатомов, выбранных из серы, кислорода, азота и селена, при условии, что присутствует не более чем один атом кислорода, серы или селена; при этом фенильное или 5-членное гетероароматическое кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом.
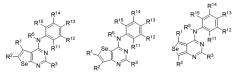
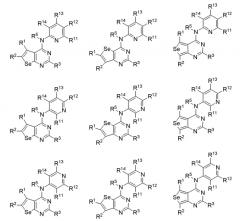
В предпочтительном варианте выполнения, настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным формулой (I), где А представляет собой N; В представляет NR5; и Ar представляет собой гетероарильное кольцо; при этом гетероарил представляет собой 6-членное или 5-членное гетероароматическое кольцо; 6-членное гетероароматическое кольцо включает пиридин, пиридазин, пиримидин и пиразин. 6-членное гетероароматическое кольцо выбирается из:
(а) необязательно замещенного пиридина:
или или
где
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12, R13 и R14 независимо выбираются из групп, указанных выше;
(b) необязательно замещенного пиридазина:
или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(c) необязательно замещенного пиримидина:
или или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(d) необязательно замещенного пиразина:
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше.
В другом варианте осуществления, настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным формулой (I), где Ar представляет собой 5-членное гетероароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота; при этом такие кольца включают тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол. 5-членное ароматическое кольцо выбирается из:
(а) необязательно замещенного тиофена:
или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(b) необязательно замещенного фурана:
или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(с) необязательно замещенного пиррола:
или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(d) необязательно замещенного пиразола:
или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(е) необязательно замещенного имидазола:
или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(f) необязательно замещенного оксазола:
или или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(g) необязательно замещенного изоксазола:
или или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(h) необязательно замещенного тиазола:
или или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(i) необязательно замещенного изотиазола:
или или
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше.
В другом предпочтительном варианте осуществления, изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным следующей формулой (I),
Формула (I)
где:
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, образуют необязательно замещенное арильное или необязательно замещенное гетероарильное кольцо, слитое с селенофеном, выбранное из соединений:
(а) необязательно замещенного слитого арила:
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:
R16, R17, R18 и R19 независимо выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламино