Штамм burkholderia cepacia b-7518, используемый для получения антигена для определения антител к burkholderia cepacia в биологических средах
Иллюстрации
Показать всеИзобретение относится к области биохимии. Заявлен штамм Burkholderia cepacia В-7518, обладающий типичными и стабильными культуральными, тинкториальными, биохимическими свойствами. Данный штамм можно использовать для получения антигена для определения антител к Burkholderia cepacia в биологических средах. 4 табл., 6 пр.
Реферат
Изобретение относится к медицинской микробиологии и биотехнологии и касается штамма Burkholderia cepacia B-7518, который может быть использован для получения антигена для определения антител к Burkholderia cepacia в биологических средах.
Известно, что бактерии В. cepacia способны вызывать патологические изменения у человека. Наиболее остро проблема инфекции В. cepacia стоит у больных муковисцидозом, а также в связи с высокой частотой распространения среди населения иммунодефицитов приобретенного характера. Проблемы лечения больных с В. cepacia инфекциями осложняются высокой устойчивостью этого микроорганизма ко многим антибиотикам и появлением полирезистентных клонов. Актуальными являются поиск и разработка экологически чистых, безвредных биопрепаратов для лечения и профилактики данной инфекции.
Для получения антигена для определения антител к В. cepacia в биологических средах в производственных масштабах необходим стандартный по своим ростовым, биохимическим и антигенным характеристикам штамм В. cepacia, который обеспечит наращивание биомассы при сохранении свойств.
Целью предлагаемого изобретения является подбор штамма В. cepacia, стандартного по своим ростовым, биохимическим и антигенным характеристикам, обеспечивающего стабильно высокий рост при культивировании на плотных и жидких питательных средах и сохраняющего при этом свои свойства.
Предлагаемый штамм B. cepacia В-7518 обладает типичными для вида В. cepacia морфологическими, тинкториальными, биохимическими и культуральными признаками. Клетки представляют собой подвижные, грамотрицательные, не образующие спор палочки. Штамм хорошо растет на обычных питательных средах (микробиологический агар, агар Хоттингера). При +42°C рост культуры сохраняется. При +4°C рост отсутствует. Через 24-48 ч культивирования штамма на плотных питательных средах (микробиологический агар НПО “Микроген”, г. Махачкала) образуются гладкие круглые полупрозрачные колонии кремового цвета в S-форме. По биохимическим свойствам штамм - оксидазоположительный, каталазоположительный, образует желатиназу, лизиндекарбоксилазу и орнитиндекарбоксилазу. Не окисляет глюкозу, окисляет фруктозу, ксилозу, лактозу и мальтозу. Аргининдегидролаза отсутствует. Восстанавливает нитраты до нитритов. Чувствительность к антибактериальным препаратам низкая: штамм высокочувствителен к фторхинолонам II поколения (ципрофлоксацин); аминогликозидам (амикацин). Штамм депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» на базе ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора (ФБУН ГНЦ ПМБ) по адресу: Российская Федерация, 142279, Московская обл., Серпуховский р-н, пос. Оболенск, под номером № В-7518 (Свидетельство о депонировании №208 от 24.12.2013).
Штамм B. cepacia В-7518 дает стабильно высокий рост при культивировании на плотных и жидких питательных средах, сохраняя при этом все свойства и предлагается для получения соматического антигена, используемого в разных диагностических системах по определению антител к B. cepacia.
Пример 1. Ростовые характеристики штамма B. cepacia В-7518 при культивировании на жидких питательных средах
Проводили культивирование 3 штаммов: B. cepacia В-7518 (г. Волгоград), B. cepacia №421 (г. Москва) и B. cepacia №315 (г. Ростов-на-Дону), полученных от больных детей в стационарах Российской Федерации. Для культивирования использовали питательные среды: микробиологический бульон (НПО «Микроген», г. Махачкала) и питательный бульон для культивирования микроорганизмов (ФБУН ГНЦ ПМБ, г. Оболенск) с применением медицинского шейкера С-3,02М. Условия культивирования: инкубация при 37°C при перемешивании со скоростью 20 об/мин в течение 4 ч. Стандартную посевную дозу для всех проб - 3 млрд м.т./мл (0,4 ед. оптической плотности по Мак-Фарланду), инокулировали в питательную среду в соотношении 1:10. Культивирование для каждого варианта проводили в трех повторностях. Контроль культивирования осуществляли путем дозированного высева жидкой культуры на плотную питательную среду (микробиологический агар НПО «Микроген», г. Махачкала) с подсчетом lg колониеобразующих единиц в 1 мл (КОЕ/мл) и определением оптической плотности по Мак-Фарланду. Результаты представлены в Таблице 1.
Полученные данные свидетельствуют, что наиболее стабильны по наращиванию массы на разных питательных средах штаммы B. cepacia В-7518 и B. cepacia №375. При этом B. cepacia В-7518 дает прирост культуры на 3 порядка выше.
B. cepacia В-7518 в процессе культивирования на жидких питательных средах не диссоциирует, сохраняет типичные биохимические свойства, что, в совокупности с хорошим приростом культуры в жидких питательных средах, делает его наиболее перспективным для получения соматического антигена.
Пример 2. Приготовление антигена
Культуру B. cepacia В-7518 выращивали на микробиологическом агаре (НПО “Микроген”, г. Махачкала) 24 ч при +37°C. Смыв культуры производили изотоническим раствором натрия хлорида (0,85%) рН 7,1±0,1. Взвесь микроорганизмов доводили до концентрации 1 млрд м.т./мл в соответствии со стандартом мутности (по Мак-Фарланду соответственно 0,3 ед. опт. плотности). Взвесь микроорганизмов инактивировали прогреванием на водяной бане (+100°C) в течение 15 мин.
Полученный комплексный соматический антиген B. cepacia В-7518 (инактивированный) хранили при +6-8°C в течение месяца. Использовали для постановки агглютинации в пробирках, метода ИФА и иммунизации кроликов с целью получения антисыворотки (положительный контроль в диагностических системах).
Пример 3. Иммунизация кроликов для получения антисыворотки.
Кролики породы «Шиншилла» иммунизировали комплексным соматическим антигеном B. cepacia В-7518 в заднее правое бедро в количестве 1,0 мл на 1 животное на 1 инъекцию двукратно с интервалом 7 дней. Затем забирали кровь и получали антисыворотку, которая давала реакцию агглютинации с исходным антигеном в титре 1:8-1:32. Полученную антисыворотку фасовали по 0,5 мл в пробирки «Эппендорф» и хранили при -20°C в течение 6 мес.
Полученную антисыворотку использовали в качестве положительного контроля при постановке реакции агглютинации в пробирках и метода ИФА с целью выявления антител к буркхольдериям в биологических средах.
Антитела к буркхольдериям с использованием полученного антигена и антисыворотки определяли в медицинском иммунобиологическом препарате для лечения и профилактики острых кишечных инфекций «Лактоглобулин против условно-патогенных бактерий и сальмонелл коровий для перорального применения» (рег. удостоверение № ЛСР-002636/08).
Пример 4. Постановка реакции агглютинации для определения антител к буркхольдериям.
Подготовка проб препарата «Лактоглобулин против условно-патогенных бактерий и сальмонелл коровий для перорального применения».
Флаконы с лактоглобулином развальцовывали от металлических колпачков, подготавливали рабочие разведения двухмерным титрованием от 1:2 до 1:64, используя в качестве растворителя изотонический раствор натрия хлорида (рН 7,1±0,1). В подготовленные агглютинационные пробирки вносили по 2 мл разведений препарата.
Постановка реакции агглютинации:
1. В пробирки с разведенными образцами лактоглобулина вносили по 2 мл комплексного соматического антигена B. cepacia В-7518 (инактивированного). В качестве контроля использовали положительную антисыворотку в разведении 1:8 (положительный контроль сыворотки) и изотонический раствор натрия хлорида (отрицательный контроль антигена).
2. Перемешивали содержимое пробирок. Инкубацию смеси антигена и лактоглобулина проводили при 37°C в течение 30 мин.
3. Учет результатов реакции агглютинации проводили с использованием агглютиноскопа по обнаружению осадка агглютината в виде «зонтика» или «скопления гранул» по плюсовой системе. Последнее разведение препарата с выраженной агглютинацией (не менее +++) учитывали как диагностически значимое.
Результаты исследования наличия антител к буркхольдериям в 6 сериях препарата «Лактоглобулин против условно-патогенных бактерий и сальмонелл коровий для перорального применения» в реакции агглютинации с использованием комплексного соматического антигена B. cepacia В-7518 представлены в таблице 2.
Пример 5. Постановка ИФА для определения антител к буркхольдериям.
1. Подготовка проб препарата «Лактоглобулин против условно-патогенных бактерий и сальмонелл коровий для перорального применения».
Флаконы с лактоглобулином развальцовывали от металлических колпачков, исходный жидкий препарат разводили 1:50. Подготавливали двухмерным титрованием рабочие разведения от 1:100 до 1:3200, используя в качестве растворителя изотонический раствор натрия хлорида (pH 7,1±0,1).
2. Сенсибилизация планшета антигеном.
В работе использовали 96-луночный полистироловый плоскодонный планшет для постановки иммунологических реакций “Linbro” USA.
Во все лунки (в соответствии с количеством анализируемых образцов) вносили комплексный соматический антиген B. cepacia В-7518 (инактивированный) по 100 мкл в лунку в двух повторностях. Планшет с антигеном выдерживали при +4°C 18-24 ч. Производили 3-кратно отмывку несвязавшихся компонентов фосфатно-солевым буферным раствором (ФСБР 7,2±0,2).
Контроли:
1) контроль антигена (отрицательный контроль)
Антиген вносили в лунку, помеченную как контроль антигена. При добавлении исследуемых образцов в лунку с антигеном вносили ФСБР.
2) контроль наличия антител (положительный контроль)
Из положительной кроличьей антисыворотки приготавливали разведения: 1:50; 1:100; 1:200; 1:400; 1:800; 1:1600. Полученные разведения антисыворотки вносили в отмеченные лунки с антигеном. После проведения исследования по показателям оптической плотности положительной контрольной антисыворотки выстраивали калибровочную кривую, которую использовали для определения титров антител в испытуемых образцах.
3) контроль отсутствия антител (отрицательный контроль)
В качестве отрицательного контроля по отсутствию антител использовали кроличью сыворотку от неиммунизированного животного, которую разводили ФСБР в соотношении 1:50 и вносили по 100 мкл в соответствующую лунку.
4) контроль конъюгата (положительный контроль)
В соответствующую лунку вносили 100 мкл рабочего раствора конъюгата, который проявляли субстратной смесью в процессе постановки ИФА.
3. Проведение ИФА
Внесение подготовленных исследуемых проб производили при +37°C в течение 1 ч. Отмывали несвязавшиеся компоненты реакции 3-кратно фосфатно-солевым буферным раствором (ФСБР 7,2±0,2).
В качестве конъюгата использовали коммерческий препарат «Белок А, меченный пероксидазой хрена, сухой» (НИИЭМ им. Пастера, г. Санкт-Петербург), который подготавливали с добавлением бычьего сывороточного альбумина (БСА) в соответствии с инструкцией, прилагаемой производителями. Раствор конъюгата с БСА вносили в лунки с пробами и антигеном по 100 мкл и инкубировали 1 ч при +37°C. Отмывали несвязавшиеся компоненты реакции 3-кратно фосфатно-солевым буферным раствором (ФСБР 7,2±0,2).
Вносили субстратную смесь ОФД (ортофенилендиамин)+перекись водорода по 100 мкл и выдерживали 10-15 мин при 20°C. Останавливали реакцию Стоп-реагентом (0,1 М раствор серной кислоты) и фотометрировали результат с использованием микросканирующего устройства Organon Teknika Reader 530 Version 1.21 (λ=492).
4. Учет реакции ИФА
Титр антител устанавливали по усредненному результату оптической плотности образца препарата, превышающему показатели оптической плотности в отрицательных контролях не менее чем в 2 раза, и сопоставляли результат с калибровочными данными.
Результаты исследования наличия антител к буркхольдериям в 6 сериях препарата «Лактоглобулин против условно-патогенных бактерий и сальмонелл коровий для перорального применения» с использованием комплексного соматического антигена B. cepacia В-7518 методом ИФА представлены в Таблице 3.
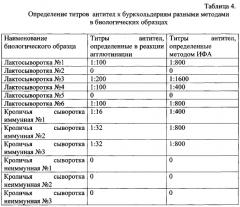
Пример 6. Использование диагностических систем для титрования антител к буркхольдериям в разных биологических средах.
Реакцию агглютинации (пример №4) и метод ИФА (пример №5) использовали для определения титров антител в разных биологических образцах: лактосыворотках (основное сырье для получения лактоглобулина) - 6 образцов, кроличьих сыворотках - 6 образцов, в том числе 3 образца - от иммунизированных B. cepacia В-7518 и 3 образца - от неиммунизированных кроликов. Результаты приведены в Таблице 4.
Проведенные исследования показали, что реакция агглютинации и метод ИФА с использованием соматического антигена B. cepacia В-7518 дают сопоставимые результаты по определению титров антител в разных биологических средах - в сыворотках кроликов, иммунизированных и неиммунизированных B. cepacia В-7518, а также коровьих лактосыворотках.
Таким образом, предлагаемый штамм B. cepacia В-7518 обеспечивает стабильно высокий рост при культивировании на твердых питательных средах при сохранении всех свойств, что позволяет использовать его для получения соматического антигена для определения антител к B. cepacia в биологических средах.
Штамм Burkholderia cepacia B-7518, депонированный в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора под номером B-7518, используемый для получения антигена для определения антител к Burkholderia cepacia в биологических средах.