Средство для лечения и профилактики нарушений сна
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и медицины и касается средства для лечения и профилактики нарушений сна, представляющего собой конъюгат глицина, иммобилизованного на частицах детонационного наноалмаза размером 2-10 нм, с содержанием глицина до 21±3% мас. Описываемое средство позволяет повысить результативность медикаментозного лечения и профилактики нарушений сна, в том числе инсомнии, и расширить ассортимент эффективных и безопасных снотворных препаратов. 2 ил., 4 табл.., 1 пр.
Реферат
Изобретение относится к медицине, в частности к психофармакологии, и касается применения известного седативного средства, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм [1] (далее алмацин), для лечения и профилактики нарушения сна независимо от причины, вызывающей вышеупомянутые нарушения.
Сон представляет собой особое физиологическое состояние организма, прежде всего мозга, которое является жизненно необходимым для высших животных и человека, и поэтому наблюдаемое в последние годы резкое увеличение популяции лиц с нарушениями сна составляет существенную медицинскую и социальную проблему. В настоящее время нарушение сна является одним из наиболее часто наблюдаемых расстройств центральной нервной системы. От различных расстройств сна страдает более четверти населения в мире [2].
Нарушения сна наблюдаются как у здоровых лиц всех возрастов при различных ситуационных трудностях, так и сопровождают широкий спектр заболеваний. Нарушения сна выявляются при психических (хронические стрессы, нервозы, депрессия, шизофрения и др.) и неврологических (инсульты головного мозга, болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, мигрень, рассеянный склероз, вертебробазилярная недостаточность и др.) заболеваниях, при различных болевых синдромах (артрит, артроз, остеохондроз, травмы, раковые заболевания и др.), при гормональных изменениях в организме (беременность, климактерический период, старение организма, гипертиреоз и др.), почечной недостаточности, бронхиальной астме, хронической и острой недостаточности сердечно-сосудистой системы, гипертонии и ряде других заболеваний.
Согласно различным классификациям выделяют более 70 синдромов нарушений сна, которые характеризуются изменением количества сна, его качества, временного распорядка, нарушением поведения, различных физиологических состояний, связанных со сном. Наиболее частым симптомом является инсомния (бессонница), которая характеризуется субъективным ощущением неудовлетворенности сном, отсутствием отдыха после сна и при которой наблюдается снижение общей продолжительности сна, затрудненное засыпание, частое пробуждение. При инсомнии резко изменяется структура сна, что может выражаться в уменьшении продолжительности как фазы медленноволнового, так и фазы быстроволнового сна, а также может сократиться число их эпизодов [2].
В лечении нарушений сна выделяют два подхода [2]. Первый является неспецифическим и использует методы поведенческой коррекции и психотерапии. Второй подход направлен на лечение конкретной нозологической формы инсомнии. Он включает влияние на причинные факторы нарушения сна и/или непосредственное воздействие на его структуру и использует различные фармакологические средства. Первым этапом современной фармакотерапии инсомний можно считать 1903 год, когда стали применять барбитураты. Второй этап начинается с 1950-ых годов, когда в качестве снотворных стали применяться нейролептики (в основном фенотиазиновые производные) и антигистаминные препараты. Третий этап - эра бензодиазепиновых снотворных - начинается с появлением в 1960 году препарата хлордиазепоксида, в 1963 - диазепама и в 1965 - оксазепама. Четвертый этап начинается с 1980-ых годов, когда были разработаны и внедрены циклопирролоны и имидазопиридины, позже - пиразолопиримидины.
В России наиболее часто при наличии нарушений сна применяют безодиазепины с выраженным снотворным действием (феназепам, нитразепам, диазепам и др.). Они представляют собой препараты рецепторного действия, характеризуются широким терапевтическим интервалом и относительно низкой токсичностью. Вместе с тем препараты этой группы создают пациентам существенные проблемы (возрастающие с увеличением дозы): привыкание, зависимость, синдром отмены, ухудшение синдрома ночного апноэ, снижение памяти, антероградная амнезия, снижение внимания и времени реакции, дневная сонливость. Ни один из бензодиазепиновых снотворных не рекомендован для лечения хронической инсомнии в связи с опасностью развития привыкания и зависимости.
Большинство снотворных средств воздействуют на постсинаптический ГАМК-эргический комплекс. Это барбитураты, бензодиазепины, циклопирролоны, имидазопиридины и пиразолопиримидины. Также в качестве снотворных применяют нейролептики с седативным эффектом, антидепрессанты с седативным и хронобиотическим эффектом, а также антигистаминные средства. Препараты всех этих фармакологических групп обладают как неспецифическим, так и специфическим воздействием на структуру сна. Неспецифичность их воздействия на структуру сна заключается в увеличении его времени, снижении длительности засыпания, уменьшении поверхностных стадий и увеличении длительности глубоких стадий фаз медленного сна (ФМС), времени бодрствования и двигательной активности во сне. Специфические свойства препаратов зависят от воздействия на определенные нейромедиаторные системы. Так, при использовании большинства неселективных ГАМК-эргических препаратов происходит увеличение представленности 2-й стадии медленного сна и сокращение фаз быстрого сна (ФБС). Применение трициклических антидепрессантов сопровождается подавлением быстрого сна.
Снотворное действие препаратов небензодиазепинового ряда связывают с воздействием на неГАМК-эргические системы мозга. В настоящее время из этих средств для лечения и профилактики нарушений сна наиболее применяются антигистаминные препараты - блокаторы центральных H1-гистаминовых рецепторов. Широкое распространение получил снотворный препарат этой группы донормил (доксиламин), который увеличивает длительность и качество сна, не изменяя при этом фазы сна. У него не отмечены признаки развития зависимости или синдрома отмены. Препарат может применяться у беременных на протяжении всего периода беременности под наблюдением врача. На фоне его применения отмечено улучшение таких характеристик, как длительность засыпания, продолжительность сна, качество сна, количество ночных пробуждений и качество утреннего пробуждения, причем суммарный показатель по анкете сна почти достиг уровня здоровых людей. По результатам полисомнографического исследования было отмечено снижение длительности засыпания, увеличение продолжительности сна, времени ФБС, улучшение индекса качества сна [2].
Тем не менее, имеющиеся в настоящее время снотворные средства не удовлетворяют в полной мере запросам клиники, поскольку эти симптоматические средства имеют недостаточную эффективность и вызывают существенные побочные эффекты: развитие толерантности и необходимость увеличивать дозу, а также лекарственную зависимость (в первую очередь, это относится к бензодиазепинам) [2].
В связи с этим поиск новых снотворных лекарственных средств является чрезвычайно актуальной социально значимой проблемой мирового уровня.
Известно, что заменимая аминокислота глицин (NH2CH2COOH), являясь центральным нейромедиатором тормозного типа действия, проявляет седативное действие и улучшает метаболические процессы в тканях мозга [3, 4]. В современной терапевтической практике глицин применяют как средство, ослабляющее влечение к алкоголю, уменьшающее явления абстиненции, депрессивные нарушения, повышенную раздражительность, нормализующее сон, а также в комплексном лечении нарушений мозгового кровообращения [3, 4]. Однако из-за слабого снотворного действия глицин как снотворный препарат в медицинской практике не применяется.
В основе фармакологического действия глицина лежит эффект амплификации метаболических и нейротрансмиттерных процессов, возникающих за счет усиления его эндогенного синтеза. Увеличить внутриклеточный синтез глицина можно, только используя пути передачи сигнала, обусловленные взаимодействием с рецепторными системами. Его взаимодействие с глициновыми рецепторами приводит к открытию хлорных каналов, гиперполяризации мембраны и распространению торможения. Наряду с этим глицин способен выступать в роли аллостерического коагониста глутаматных рецепторов. Связываясь в специфическом сайте, он усиливает способность глутамата и N-метил-D-аспарата (NMDA) открывать катионный канал [4, 5].
Установлено, что глицинергическая система наряду с системой ГАМК играет существенную роль в регуляции сна. Показано, что глицинергические нейроны тормозят соматические моторные нейроны в течение быстроволнового (REM) сна, а глицин уменьшает периоды бодрствования и общую продолжительность бодрствования [6]. Механизм снотворного действия глицина связывают с его способностью уменьшать активность орексиновых нейронов, на которые оказывают влияние эндогенные гипоталамические пептиды орексины, участвующие в регуляции циклов сон-бодрствование (фаза пробуждения и быстроволнового сна) [7].
Известен конъюгат глицина, иммобилизованного на частицах детонационного наноалмаза размером 2-10 нм (далее алмацин), обладающий седативным, антидепрессантным, антипсихотическим и анксиолитическим действиями, существенно превосходящими соответствующие виды специфической активности фармакопейного глицина, и способ его получения [1, 8, 9, 10]. По антидепрессивному действию алмацин не уступает по глубине эффекта эталонным антидепрессантам амитриптилину и флуоксетину. При этом в дозе, превышающей более чем в 20 раз терапевтическую дозу глицина, у него отсутствовали побочные эффекты и токсическое действие.
Проявление у конъюгата глицина, иммобилизованного на частицах детонационного наноалмаза (алмацина), выраженного снотворного эффекта и применение алмацина в качестве средства для лечения и профилактики нарушений сна в научной и патентной литературе не описано.
В соответствии с изобретением описывается средство для лечения и профилактики нарушений сна, представляющее собой конъюгат глицина, иммобилизованного на частицах детонационного наноалмаза размером 2-10 нм, с содержанием глицина до 21±3% масс.
Для определения возможности медицинского применения конъюгата глицина, иммобилизованного на частицах детонационного наноалмаза размером 2-10 нм (алмацина), в качестве средства для лечения и профилактики нарушений сна было изучено его снотворное действие в сравнении с фармакопейным глицином и известным снотворным лекарственным средством донормилом (препарат сравнения).
Исследование снотворного действия алмацина и сравниваемых с ним лекарственных веществ было проведено на 35 белых беспородных половозрелых крысах-самцах массой 230-250 г. Работа выполнялась согласно «Методическим указаниям по изучению снотворной активности фармакологических веществ», изложенным в «Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ» [11].
Осуществлялся анализ нейрофизиологических (электрофизиологических) критериев различных фаз цикла сон-бодрствование. Операции по вживлению электродов в сенсомоторную область коры, дорзальный гиппокамп и мышцы шеи проводились в стереотаксической установке в соответствии с атласом мозга у анестезированных нембуталом (50 мг/кг, внутримышечно) крыс за 5-7 дней до проведения экспериментов по регистрации сна. Запись биоэлектрической активности мозга (электроэнцефалография, ЭЭГ) осуществлялась в утренние-дневные часы в течение не менее 5 часов при свободном поведении животных. Фазы сна в эксперименте определяли по электрической активности коры больших полушарий и дорзального гиппокампа и по электромиограмме. С использованием программного обеспечения при анализе циклов сон-бодрствование регистрировались следующие показатели: латентное время от начала регистрации до появления первого эпизода медленноволнового сна и быстроволнового (парадоксального, REM) сна; общее число эпизодов медленноволнового и быстроволнового сна и эпизодов бодрствования; длительность всех эпизодов медленноволнового и быстроволнового и всех эпизодов бодрствования; процентные содержания всех эпизодов медленноволнового и быстроволнового сна и всех эпизодов бодрствования, вычисляемые по соотношению продолжительности этих показателей к продолжительности всей записи ЭЭГ.
Обнаружено, что описываемое средство алмацин вызывает усиление синхронизации тета-ритма и его модулированности в электрограммах сенсомоторной коры и дорзального гиппокампа в фазу быстроволнового (парадоксального) сна, что свидетельствует о нормализирующем влиянии вещества на корково-диэнцефальные взаимосвязи, участвующие в регуляции электрофизиологического и нейрохимического баланса в центральной нервной системе во время сна. Применение алмацина демонстрирует отчетливое снотворное действие, которое выражается в статистически достоверном уменьшении латентного времени наступления сна: первых эпизодов медленноволнового и быстроволнового (парадоксального, REM) сна, увеличении продолжительности и процентной представленности быстроволнового сна и в уменьшении общего числа эпизодов, продолжительности и процентной представленности стадий бодрствования.
В результате проведенного фармакологического исследования установлено наличие у описываемого средства для лечения и профилактики нарушения сна выраженного специфического снотворного эффекта, превосходящего снотворное действие фармакопейных препаратов глицина и донормила. Это позволяет расширить ассортимент эффективных и безопасных снотворных лекарственных средств.
Краткое описание графических материалов
Фиг. 1. Электроэнцефалограммы контрольной крысы №5, демонстрирующие разные стадии (фазы) цикла сон-бодрствование. Сверху вниз на рисунке представлены электроэнцефалограммы дорзального гиппокампа (ГПК) и коры (кора) и электромиограммы (ЭМГ) фаз бодрствования, медленноволнового сна и быстроволнового сна. В нижнем правом углу обозначена калибровочная шкала (калибровочный сигнал): по горизонтали отмеченный отрезок обозначает 1 сек, а по вертикали - 50 мкВ.
Фиг. 2. Влияние описываемого средства, фармакопейного глицина и донормила на качественные характеристики быстроволнового (парадоксального) сна у крыс. Сверху вниз на рисунке представлены электроэнцефалограммы дорзального гиппокампа (ГПК), коры (Кора) и электромиограммы (ЭМГ) контроля и крыс, получавших описываемое средство (Глицин А), фармакопейный глицин (Глицин) и донормил (донормил). В нижнем левом углу обозначена калибровочная шкала (калибровочный сигнал): по горизонтали отмеченный отрезок обозначает 1 сек, а по вертикали - 50 мкВ
Изобретение иллюстрируется следующим примером.
Пример. Изучение специфической снотворной активности описываемого средства в сравнении с фармакопейными препаратами глицином и донормилом.
Исследование выполнено на 35 белых беспородных половозрелых крысах самцах массой 230-250 г. Животных получали из Центрального питомника лабораторных животных «Столбовая», Московская область. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ. Животные содержались в виварии при температурном режиме 20-22°C, при световом цикле - 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках Т/4А размером 580×375×200 мм с верхней крышкой из нержавеющей стали с подстилкой обеспыленной из деревянной стружки по 8 крыс в каждой клетке. Животные содержались на постоянном доступе к корму и воде при использовании полного рациона экструдированного брикетированного корма и питьевой воды. Опыты проводили в первую половину дня.
Исследование снотворного действия описываемого средства было проведено согласно «Методическим указаниям по изучению снотворной активности фармакологических веществ», изложенных в «Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ» [11]. Осуществлялся анализ нейрофизиологических (электрофизиологических) критериев различных фаз цикла сон-бодрствование
Операции по вживлению электродов проводились у крыс, анестезированных нембуталом (50 мг/кг, внутримышечно), за 5-7 дней до проведения экспериментов по регистрации сна. Долгосрочные электроды для регистрации электрической активности вживлялись в стереотаксической установке в сенсомоторную область коры, дорзальный гиппокамп и мышцы шеи. Координаты дорзального гиппокампа рассчитывались по стеретоксическому атласу мозга крыс [12]. Для регистрации электрической активности мозга и электромиограмм шейных мышц использовали электроды, изготовленные из нихромовой проволоки в лаковой изоляции, диаметром 90 мкм для вживления в гиппокамп и 120 мкм - для вживления в сенсомоторную зону коры и в мышцы шеи. Концы электродов припаивали к посеребренным штырькам диаметром 0,8-1 мм, которые закреплялись на кости черепа зубным висват-цементом. Во время эксперимента к штырькам подключали отводящие провода, идущие на коммутатор электроэнцефалографа. Соединение отводящих проводов с коммутатором осуществлялось специальным образом (гибким и подвижным), чтобы обеспечить безартефактную запись электроэнцефалограмм у свободно передвигающихся животных на протяжении длительного времени. Запись биоэлектрической активности мозга (электроэнцефалография, ЭЭГ) осуществлялась в утренние-дневные часы в течение не менее 5 часов с использованием компьютерной электроэнцефалографической установки, включающей программное обеспечение анализа и оценки нейрофизиологических критериев различных фаз цикла сон-бодрствование и статистической обработки данных.
Эксперимент проводили по следующей схеме: 1 день - адаптация животных к экспериментальной обстановке, 1-2 часа; 2-день - регистрация фоновой активности (5 часов), 3-й день - регистрация ЭЭГ в течение 5 часов через 30 минут после введения веществ. Фазы сна в эксперименте определяли по электрической активности коры больших полушарий и дорзального гиппокампа и по электромиограмме. С использованием программного обеспечения при анализе циклов сон-бодрствование регистрировались следующие показатели: латентное время от начала регистрации до появления первого эпизода медленноволнового сна (S), мин [ЛПМС]; латентное время от начала регистрации до появления первого эпизода быстроволнового (парадоксального, REM) сна (F), мин [ЛП F]; общее число эпизодов медленноволнового сна (S), [N(S)]; общее число эпизодов быстроволнового (парадоксального, REM) сна, (F), [N(F)]; общее число эпизодов бодрствования (W), [N(W)]; длительность всей записи в мин (общее время записи ЭЭГ, не менее 5-ти часов), [Т]; длительность всех эпизодов медленноволнового сна (S), мин, [T(S)]; длительность всех эпизодов быстроволнового (парадоксального, REM) сна (F), мин [T(F)]; длительность всех эпизодов бодрствования (W), мин [T(W)]; процентное содержание всех эпизодов медленноволнового сна, вычисляемое по соотношению продолжительности медленноволнового сна к продолжительности всей записи ЭЭГ, (S) [T(S)/T*100], [S%]; процентное содержание всех эпизодов быстроволнового (парадоксального) сна, вычисляемое по соотношению продолжительности быстроволнового сна к продолжительности всей записи ЭЭГ, [T(F)/T*100], [F%]; процентное содержание всех эпизодов бодрствования, вычисляемое по соотношению продолжительности бодрствования к продолжительности всей записи ЭЭГ, [T(W)/T*100], [W%]. Принимались во внимание и рассчитывались лишь те фазы цикла сон-бодрствование, которые были продолжительностью не менее 15 секунд.
Статистическая обработка ЭЭГ результатов была проведена с использованием специальной программы "Brainsys Sleep". Статистическая обработка цифровых данных проводилась с использованием программы «Statistica V. 6.0.» с использованием однофакторного дисперсионного анализа и непараметрического анализа для независимых переменных (U-тест Манна-Уитни).
Установлено, что сон у контрольной крысы так же, как и у человека, состоит из четко чередующихся фаз: 1 - медленноволновый сон, 2 - быстроволновый (быстрый, парадоксальный, REM) сон и 3 - бодрствование и в течение сна происходит смена нескольких таких циклов сон-бодрствование.
В качестве примера на Фиг. 1 представлены электроэнцефалограммы контрольной крысы №5, зарегистрированные в разные фазы цикла сон-бодрствования.
Показано, что в период бодрствования у крысы в электрограммах сенсомоторной коры и дорзального гиппокампа (ГПК) регистрируется дизритмичная биоэлектрическая активность, а в электромиограмме (ЭМГ) - интенсивная мышечная активность. В фазу глубокого медленноволнового сна у крысы в электрограммах сенсомоторной коры и дорзального гиппокампа (ГПК) регистрируются высокоамплитудные медленные волны, а в электромиограмме (ЭМГ) - снижение мышечной активности. Фазе быстроволнового сна предшествует переходная подстадия медленноволнового сна. На фиг 1 видно, что эта подстадия характеризуется интенсивной веретенообразной активностью. В фазу быстроволнового сна у крысы в электрограмме сенсомоторной коры регистрируется выраженная десинхронизация биоэлектрической активности, а в дорзальном гиппокампе (ГПК) регистрируется четко выраженный гиппокампальный тета-ритм в электрограммах сенсомоторной коры, характеризуется почти полным отсутствием мышечной активности, о чем свидетельствует резкое снижение амплитуд электромиограммы шейных мышц.
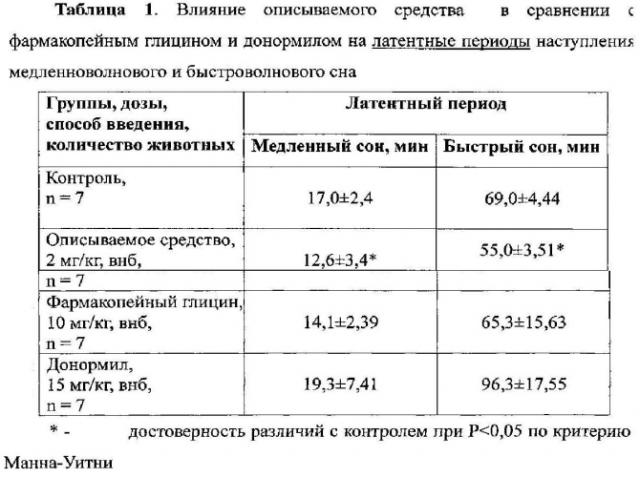
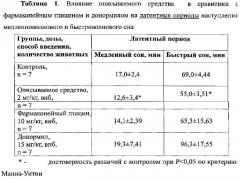
При изучении влияния веществ на латентные периоды наступления быстроволнового и медленноволнового сна установлено, что в контрольной группе животных первый эпизод медленноволнового сна наступил в среднем через 17 мин после начала регистрации ЭЭГ, а первый эпизод быстроволнового сна наступил через 69 минут после начала регистрации ЭЭГ.
Описываемое средство алмацин в дозе 2 мг/кг статистически достоверно по сравнению с контролем уменьшало латентный период наступления как медленноволнового сна (на 26%), так и быстроволнового сна (на 21%) (Таблица 1).
Фармакопейный глицин в дозе 10 мг/кг статистически достоверно не уменьшал латентный период наступления медленноволнового и быстроволнового сна по сравнению с контролем. Донормил в дозе 15 мг/кг несколько увеличивал на уровне тенденции латентный период быстроволнового сна и не влиял на латентный период наступления медленноволнового сна (Таблица 1).
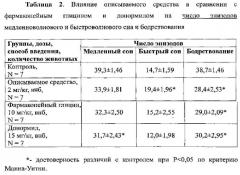
При изучении влияния исследуемых веществ на число эпизодов медленноволнового и быстроволнового сна и бодрствования показано, что описываемое средство в дозе 2 мг/кг статистически достоверно по сравнению с контролем увеличивало (на 31%) число эпизодов быстроволнового сна и уменьшало (на 27%) число эпизодов бодрствования за 5-ти часовой период регистрации (Таблица 2).
Фармакопейный глицин в дозе 10 мг/кг статистически достоверно уменьшал (на 26%) по сравнению с контролем число эпизодов бодрствования, на уровне тенденции уменьшал число эпизодов медленноволнового сна, но не влиял на число эпизодов быстроволнового сна. Донормил в дозе 15 мг/кг статистически достоверно по сравнению с контролем уменьшал (на 19%) число эпизодов медленноволнового сна, уменьшал (на 22%) число эпизодов бодрствования и не влиял на число эпизодов быстроволнового сна за 5-ти часовой период регистрации (Таблица 2).
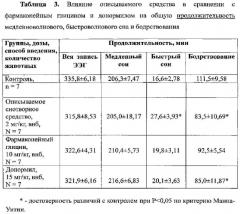
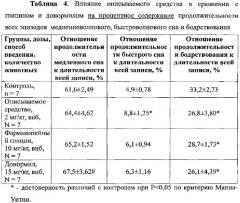
При изучении влияния сравниваемых веществ на общую продолжительность медленноволнового и быстроволнового сна и бодрствования установлено, что описываемое средство в дозе 2 мг/кг за 5-ти часовой период регистрации статистически достоверно по сравнению с контролем увеличивало (на 66%) общую продолжительность быстроволнового сна и уменьшало (на 26%) продолжительность бодрствования (Таблица 3).
Фармакопейный глицин в дозе 10 мг/кг на уровне тенденции по сравнению с контролем увеличивал продолжительность быстроволнового сна и уменьшал продолжительность бодрствования. За 5-ти часовой период регистрации донормил в дозе 15 мг/кг статистически достоверно по сравнению с контролем уменьшал (на 24%) продолжительность бодрствования и на уровне тенденции увеличивал продолжительность медленноволнового и быстроволнового сна (Таблица 3).
Процентное содержание продолжительности эпизодов медленноволнового и быстроволнового сна и бодрствования рассчитывали по соотношению продолжительности фазы сна к длительности всей записи ЭЭГ по формуле:
Описываемое средство в дозе 2 мг/кг за 5-ти часовой период регистрации статистически достоверно по сравнению с контролем увеличивало процентное содержание быстроволнового сна и уменьшало процентное содержание бодрствования (Таблица 4).
Фармакопейный глицин в дозе 10 мг/кг статистически достоверно уменьшал процентное содержание продолжительности бодрствования и на уровне тенденции по сравнению с контролем увеличивал продолжительность быстроволнового сна. Донормил в дозе 15 мг/кг за 5-ти часовой период регистрации статистически достоверно по сравнению с контролем уменьшал процентное содержание бодрствования и на уровне тенденции увеличивал процентное содержание медленноволнового и быстроволнового сна (Таблица 4).
Описываемое средство оказывает существенное влияние и на качественные характеристики быстроволнового (парадоксального, REM) сна. Установлено, что под влиянием этого средства наблюдается усиление синхронизации тета-ритма, его модулированности в электрограммах сенсомоторной коры и дорзального гиппокампа в фазу быстроволнового (парадоксального) сна. Эти качественные изменения электроэнцефалограмм демонстрируются на Фиг. 2.
Способность описываемого средства вызывать усиление синхронизации тета-ритма и его модулированности в электрограммах сенсомоторной коры и дорзального гиппокампа в фазу быстроволнового (парадоксального) сна свидетельствует о нормализирующем влиянии вещества на корково-диэнцефальные взаимосвязи, участвующие в регуляции электрофизиологического и нейрохимического баланса в центральной нервной системе во время сна.
Фармакопейный глицин и донормил в противоположность заявляемому средству не вызывали усиления синхронизации тета-ритма и его модулированности в электрограммах сенсомоторной коры и дорзального гиппокампа в фазу быстроволнового (парадоксального) сна (Фиг. 2).
Полученные в примере результаты исследования свидетельствуют о наличии у описываемого средства (в дозе 2 мг/кг) выраженного снотворного действия, превосходящего снотворное действие фармакопейного глицина (в дозе 10 мг/кг) и препарата сравнения донормила (в дозе 15 мг/кг).
ЛИТЕРАТУРА
1. Н.Б. Леонидов, Р.Ю. Яковлев, Г.В. Лисичкин. Седативное средство и способ его получения. Пат. РФ 2506075, 2013.
2. Сомнология и медицина сна. Избранные лекции / Под ред. Я.И. Левина, М.Г. Полуэктова. М.: Медфорум, 2013. - С. 208-214.
3. М.Д. Машковский. Лекарственные средства. 16-е изд., перераб., испр. и доп. - М.: Новая волна: Издатель Умеренков, 2012. - С. 34-50.
4. Беспалов А.Ю., Звартау Э.Э. Нейропсихофармакология антагонистов NMDA-рецепторов. СПб.: Невский Диалект, 2000. 297 с.
5. Комисарова И.А., Нарциссов Я.Р. Молекулярные механизмы действия лекарственного препарата «Глицин» // Terra medica. 2001. №1. С. 23-25.
6. Brooks PL, Peever JH. Impaired GABA and glycine transmission triggers cardinal features of rapid eye movement sleep behavior disorder in mice // J Neurosci. 2011. V.31. №19. P. 7111-21).
7. Hondo M, Furutani N, Yamasaki M, Watanabe M, Sakurai T. Orexin neurons receive glycinergic innervations // PLoS One. 2011. V. 6. №9, e25076.
8. Н.Б. Леонидов, Р.Ю. Яковлев, А.С. Соломатин, Г.В. Лисичкин. Антидепрессант и способ его получения. Пат. РФ 2519759, 2013.
9. Н.Б. Леонидов, Р.Ю. Яковлев, Г.В. Лисичкин. Антипсихотическое средство и способ его получения. Пат. РФ 2519761, 2013.
10. Н.Б. Леонидов, Р.Ю. Яковлев, И.И. Кулакова, Г.В. Лисичкин. Анксиолитик и способ его получения. Пат. РФ 2519755, 2013.
11. Воронина Т.А., Неробкова Л.Н. Методические указания по изучению снотворной активности фармакологических веществ // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ /Под ред. Р.У. Хабриев (Федеральная служба по надзору в сфере здравоохранения и социального развития, ФГУ Научный центр экспертизы средств медицинского применения) М.: Медицина, 2005. С. 263-276.
12. Буреш Я., Бурешова О., Хьюстон П. Методики и основные эксперименты по изучению мозга и поведения. М.: Высшая школа. 1991, 399 с.
Средство для лечения и профилактики нарушений сна, представляющее собой конъюгат глицина, иммобилизованного на частицах детонационного наноалмаза размером 2-10 нм, с содержанием глицина до 21±3% мас.