Способ прогнозирования отслойки хориона в первом триместре беременности
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к акушерству и гинекологии, и предназначено для прогнозирования отслойки хориона на ранних сроках беременности. Осуществляют выделение ДНК с последующей амплификацией полиморфных вариантов Arg353Gln (G10976A) гена коагуляционного фактора VII и Ile22Met (A66G) гена метионинсинтазы редуктазы (MTRR) при помощи метода ПЦР. При выявлении сочетания гетерозиготы GA полиморфного варианта Arg353Gln (G10976A) гена коагуляционного фактора VII с гомозиготой GG полиморфного варианта Ile22Met (A66G) гена MTRR прогнозируют риск развития отслойки хориона в первом триместре беременности. Изобретение обеспечивает эффективное прогнозирование отслойки хориона в первом триместре беременности на основании определения сочетания генотипов генов тромбофилии и фолатного цикла. 4 табл., 3 пр.
Реферат
Настоящее изобретение относится к медицине, а именно к акушерству и гинекологии, и может быть использовано для прогнозирования риска развития отслойки хориона в I триместре. Способ позволяет прогнозировать развитие отслойки хориона на основании молекулярно-генетического исследования полиморфного варианта Arg353Gln (G10976A) коагуляционного фактора VII и полиморфного варианта Ile22Met (A66G) гена MTRR (метионинсинтаза - редуктаза).
Отслойка хориона, зачастую приводящая к потере плода на ранних сроках беременности, является частым осложнением гестационного процесса и по данным различных авторов встречается от 3 до 18% от числа всех беременностей (Nagy S, Bush М, Stone J, Lapinski R, Gardo S.Clinical Significance of Subchorionic and Retroplacental Hematomas Detected in the First Trimester of Pregnancy// Obstet Gynecol 2003; 102: 94-100; Nagy S, Bush M, Stone J, Lapinski R, Gardo S. Clinical significance of subchorionic and retroplacental hematomas detected in the first trimester of pregnancy//Orv Hetil 2005 Oct 16; 146(42):2157-61; Tuuli M.G., Norman S.M, Odibo A.O. Perinatal outcomes in women with subchorionic hematoma: a systematic review and metaanalysis.// Obstet Gynecol. 2011. - Vol. 117, N. 5. - P. 1205-12. - - URN: https: //www.clinicalkey.com/#!/ContentPlayerCtrl/doPlayContent/2-s2.0-21508763/{"scope":"all","query":"Perinatal outcomes in women with subchorionic hematoma: a systematic review and meta-analysis").
Потеря беременности в сроки до 16 недель происходит в 22% случаях, из них более половины в сроки до 12 недель (Андреева Е.С., Степанькова Е.А. Особенности морфологических изменений плаценты у пациенток с угрозой прерывания беременности и отслойкой хориона с образованием внутриматочной гематомы // Вестник Российского университета дружбы народов, серия «Медицина». - М., 2012. - №5. - С. 36-39).
В случае же пролонгирования беременности пациентки с ретрохориальной гематомой (РХГ) имеют выше риск развития материнских и неонатальных осложнений: гипертензии беременных (ОР: 2,1; ДИ: 1.5-2.9); преэклампсии (ОР 4,0; ДИ: 2.4-6.7), отслойки плаценты (ОР: 5,6; ДИ: 2.8-11.1); задержки роста плода (ОР: 2,4; ДИ: 1.4-4.1), дистресса плода (ОР: 2,6; ДИ: 1.9-3.5), мекониального окрашивания околоплодных вод (ОР: 2,2; ДИ: 1.7-2.9) и выше риск рождения детей, нуждающихся в проведении интенсивной терапии (ОР: 5,6; ДИ: 4.1-7.6) (Nagy S, Bush М, Stone J, Lapinski R, Gardo S.Clinical Significance of Subchorionic and Retroplacental Hematomas Detected in the First Trimester of Pregnancy// Obstet Gynecol 2003; 102: 94-100;
Nagy S, Bush M, Stone J, Lapinski R, Gardo S. Clinical significance of subchorionic and retroplacental hematomas detected in the first trimester of pregnancy//Orv Hetil 2005 Oct 16; 146(42):2157-61).
В настоящее время подход к профилактике и терапии вышеперечисленных гестационных осложнений носит симптоматический характер, что обусловлено недостаточными знаниями природы патогенеза данных состояний, но развивающиеся быстрыми темпами новые направления медицинской генетики, в частности геномика, занимающаяся исследованиями структуры генома, идентификацией генов, исследованиями мутаций и полиморфизмов, открывают возможности для первичной, досимптоматической диагностики наследственной предрасположенности к болезни и, соответственно, для ее ранней (первичной) профилактики.
На сегодняшний день известно, что полиморфизм характерен практически для всех генов человека. Полиморфизм, затрагивающий смысловые части генов, нередко приводит к замене аминокислот и к появлению белков с новыми функциональными свойствами. Наследуемые полиморфные изменения генов играют решающую роль в определении уникального биохимического профиля каждого человека, в оценке его наследственной предрасположенности к различным мультифакториальным заболеваниям. Изучение медицинских аспектов генетического полиморфизма составляет концептуальную и методическую основу предиктивной (предсказательной) медицины (Баранов B.C. Генетический паспорт - основа индивидуальной и предиктивной медицины/ Под ред. B.C. Баранова - СПб.: Изд-во Н-Л, 2009. - 528 с).
Ряд полиморфизмов генов системы гемостаза относят к тромбофилии, термин которой был введен в клиническую практику для определения состояний, при которых увеличен риск тромбозов и тромбоэмболий (Сидельникова В.М., Сухих Г.Т. Невынашивание беременности: Руководство для практикующих врачей. - М.: ООО «Медицинское информационное агентство», 2010. - 536 с: С. 65).
Интерес исследователей к изучению связи полиморфизмов генов, участвующих в процессах коагуляции и фибринолиза, с такими осложнениями беременности, как отслойка хориона и плаценты, понятен, потому что баланс между коагуляцией и фибринолизом рассматривается в качестве одного из условий, обеспечивающих процессы имплантации на ранних сроках беременности.
Известен способ прогнозирования возникновения ретрохориальных гематом у беременных, страдающих недифференцированной дисплазией соединительной ткани (см. патент РФ №2461833, опубликован 20.09.2012) с угрожающим выкидышем без клинической картины отслойки плодного яйца, включающий определение магния в эритроцитах, где при полученных значениях магния в эритроцитах ниже 1,65 ммоль/л у данного контингента беременных прогнозируют возникновение ретрохориальной гематомы. Недостатком известного способа является ограниченность его использования, так как он предназначен только для пациенток с недифференцированной дисплазией соединительной ткани с угрожающим выкидышем без клинической картины отслойки плодного яйца.
Известен также способ прогнозирования по результатам ДНК-диагностики на носительство определенных полиморфных вариантов генов метилентетрагидрофолатредуктазы (MTHFR) и фактора VII свертывания крови, привычного невынашивания (см. патент РФ №2330071, опубликован 27.07.2008), предусматривающий одновременное тестирование ДНК на наличие полиморфного варианта R353Q (Arg353Gln) гена FVII свертывания крови и полиморфного варианта С677Т гена метилентетрагидрофолатредуктазы (MTHFR), определение генотипа пациентки с учетом данных по двум исследуемым генам и составление заключения, где генотип RRTT квалифицируется как крайне неблагоприятный, генотипы RRCC, RRCC и RQTT - как неблагоприятные, генотипы RQCC и RQCT - как благоприятные прогностические признаки. Недостатком известного способа является то, что формирование отслойки хориона в I триместре беременности возможно при отсутствии сочетания данных генных полиморфизмов, и по всей вероятности имеет дополнительный генез.
Наиболее близким к заявленному изобретению является способ прогнозирования отслойки хориона и плаценты на ранних сроках беременности (см. патент РФ №2494400, опубликован 27.09.2013), позволяющий с высокой точностью прогнозировать вероятность отслойки хориона и плаценты на ранних сроках на основании выделения ДНК с последующей амплификацией полиморфизма -675 5G>4G гена ингибитора активатора плазминогена I типа (PAI-1) при помощи метода ПЦР. Вероятность развития отслойки хориона и плаценты у женщин с высоким риском самопроизвольных репродуктивных потерь при генотипе 4G/4G прогнозируют как 50,0%, при генотипе 4G/5G - как 35,3%. Изобретение позволяет с довольно высокой точностью прогнозировать вероятность отслойки хориона и плаценты на ранних сроках, что способствует более рациональному ведению беременности и улучшению ее исходов.
Недостатком способа является ограничение контингента для возможности применения, так как изобретением определена возможность прогнозирования развития отслойки хориона и плаценты только у женщин с высоким риском самопроизвольных репродуктивных потерь.
Задачей заявляемого изобретения является повышение результативности прогнозирования отслойки хориона в I триместре беременности на основании определения сочетания гетерозиготы полиморфного варианта Arg353Gln (G10976A) коагуляционного фактора VII с гомозиготой полиморфного варианта Ile22Met (A66G) гена MTRR.
Поставленная задача решается тем, что у беременных в I триместре проводят анализ полиморфного варианта Arg353Gln (G10976A) коагуляционного фактора VII и полиморфного варианта Ile22Met (A66G) гена MTRR (метионинсинтаза - редуктаза). При выявлении сочетания гетерозиготы полиморфного варианта Arg353Gln (G10976A) коагуляционного фактора VII с гомозиготой полиморфного варианта Ile22Met (A66G) гена MTRR прогнозируют риск развития отслойки хориона. Доказано, что вероятность развития указанной патологии у пациенток с сочетанием данных полиморфных вариантов выше по сравнению с вероятностью развития отслойки хориона у пациенток с отсутствием данного сочетания.
Заявляемый способ прогнозирования отслойки хориона на ранних сроках беременности осуществляют следующим образом.
В исследовании участвовало 58 пациенток с верифицированной по данным ультразвукового исследования ретрохориальной гематомой. В группу контроля вошли 63 беременные, не имеющие ретрохориальной гематомы. Критериями исключения из исследования были женщины, беременность у которых наступила в результате вспомогательных репродуктивных технологий.
Использован комплект реагентов «Генетика Метаболизма Фолатов», предназначенный для определения генетических полиморфизмов, ассоциированных с нарушениями фолатного цикла, и комплект реагентов «КардиоГенетика Тромбофилия» для определения генетических полиморфизмов, ассоциированных с риском развития тромбофилии из комплекта «КардиоГенетика» (ООО «НПО ДНК-Технология», Россия), методом ПЦР в режиме реального времени.
Метод: Полимеразная цепная реакция с детекцией результатов в режиме реального времени, анализ кривых плавления, качественный анализ. Материал для исследования: периферическая кровь.
Выделение ДНК: рекомендуются комплекты реагентов для выделения ДНК ПРОБА-ГС-ГЕНЕТИКА и ПРОБА-РАПИД-ГЕНЕТИКА (ООО «НПО ДНК-Технология», Россия).
Комплект реагентов для определения генетических полиморфизмов методом полимеразной цепной реакции в режиме реального времени включает смесь для амплификации, ПЦР-буфер, Taq-AT-полимеразу и минеральное масло.
С целью проведения амплификации применяются реагенты.
С целью выявления генетических маркеров, определяющих развитие отслойки хориона, у пациенток в I триместре проводят генотипирование 4-х полиморфизмов генов фолатного цикла (MTHFR (5,10 - метилентетра-гидрофолат-редуктаза) С677Т), MTHFR (5,10 - метилентетра-гидрофолат-редуктаза) А1298С, MTR (витамин В12-зависимая метионин-синтаза) A2756G, MTRR (метионинсинтаза-редуктаза) А66G и 8-и полиморфизмов генов системы гемостаза (F 2 (протромбин КФ II) G20210A, F5 (проакселерин, лабильный фактор, КФ V) G1691A (Лейденовская мутация), F VII (проконвертин, КФ VII) G10976A, F 13 (Фибриназа, КФ XIII) G>T, FGB (β-цепь фибриногена) G455A, ITGA2 (α-2-интегрин) С807Т, ITGB3 (тромбоцитарный гликопротеин IIIA) Т1565С, PAI-1 (ингибитор активатора плазминогена 1) -675 5G/4G).
Подготовка и проведение полимеразной цепной реакции
1. Маркируют необходимое количество пробирок для амплификации объемом 0,2 мл (отдельная для каждого исследуемого образца и отрицательного контрольного образца «К-»).
2. Затем, предварительно встряхнув пробирки со смесью для амплификации, в течение 3-5 секунд, центрифугируют в течение 1-3 сек на микроцентрифуге/вортексе.
3. Вносят в заранее промаркированные пробирки по 20 мкл смеси для амплификации.
4. Пробирки с ПЦР-буфером и Taq-AT-полимеразой встряхивают
в течение 3-5 сек и центрифугируют в течение 1-3 сек на микроцентрифуге/вортексе.
5. Приготавливают смесь ПЦР-буфера с Taq-AT-полимеразой, встряхивают пробирку в течение 3-5 сек и центрифугируют в течение 1-3 сек на микроцентрифуге/вортексе.
6. В каждую пробирку со смесью для амплификации добавляют по 10 мкл смеси ПЦР-буфера с Taq-AT-полимеразой и по 1 капле (около 20 мкл) минерального масла. Закрывают крышки пробирок.
8. Вносят препараты ДНК наконечником с аэрозольным барьером в пробирки для исследуемых образцов по 5,0 мкл и в пробирки, маркированные «К-», по 5,0 мкл отрицательного контрольного образца, который прошел этап выделения ДНК.
9. Вновь центрифугируют пробирки на микроцентрифуге/вортексе в течение 1-3 секунд и устанавливают все пробирки в блок детектирующего амплификатора.
10. Завершающим этапом запускают программное обеспечение RealTime_PCR, выбирают оператора. Регистрация и учет результатов детектирующим амплифекатором проводится автоматически.
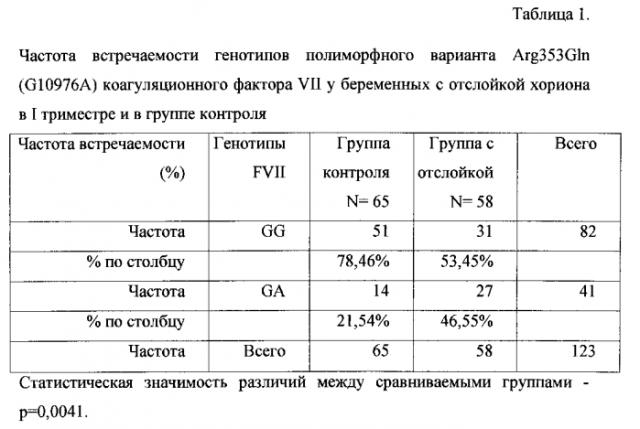
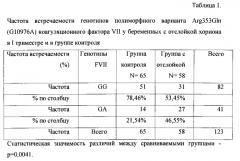
Статистическая обработка результатов осуществлялась с использованием непараметрических критериев: критерий χ2, χ2 с поправкой Йетса, точного двустороннего критерия Фишера. Из представленного набора полиморфизмов генов-кандидатов на основании статистического анализа выделен вариант полиморфизма гена, носительство которого может с высокой точностью прогнозировать развитие отслойки хориона в I триместре, это гетерозигота полиморфного варианта Arg353Gln (G10976A) коагуляционного фактора VII (табл. 1).
Генотип GA полиморфного варианта Arg353Gln (G10976A) гена FVII является гетерозиготой, в то время как генотип GG нормальной гомозиготой. Исследуя их соотношение относительно представленных групп пациенток из общего количества исследуемых беременных - 123 человека, процент встречаемости нормальной гомозиготы в контрольной группе составил 78,46% (51 пациентка), а в группе с отслойкой хориона в первом триместре беременности 53,45% (31) пациентка.
При рассмотрении частоты встречаемости гетерозиготного полиморфного варианта Arg353Gln (G10976A) гена FVII отмечено, что в группе контроля встречаемость данного гетерозиготного варианта составила 21,54% (14 пациенток), в то время как в группе с отслойкой - 46,55% (27 женщин). У пациенток с отслойкой хориона частота встречаемости генотипа GA полиморфного варианта Arg353Gln (G10976A) гена FVII была статистически значимо выше (р=0,0041) по сравнению с пациентками в группе контроля (без отслойки хориона). Данный факт объясняется следующим образом: полиморфизм гена FVII приводит к снижению его экспрессии и понижению уровня коагуляционного фактора VII по данным литературы на 30%. Проконвертин (коагуляционный фактор FVII) принимает участие во внешнем механизме свертывания крови, в случае гипопроконвертинемии замедляется образование тромбина, который катализирует превращение фибриногена в фибрин и образование сгустка с остановкой кровотечения, этим объясняется развитие геморрагического осложнения. Распространенность AG полиморфного варианта Arg353Gln (G10976A) гена FVII в европейских популяциях составляет 10-20%. Однако до настоящего времени влияние полиморфного варианта Arg353Gln (G10976A) гена FVII на прогноз развития отслойки хориона не было определено.
Следующим этапом был проведен анализ ген-генных взаимодействий 12 полиморфизмов 11 генов-кандидатов. Применен статистический анализ с оценкой по критериям Пирсона Хи-квадрат, М-П Хи-квадрат, Йетса хи-квад., точного критерия Фишера, одностор., двустор., хи-квад. Макнемара (A/D). Проведен статистический анализ ген-генных взаимодействий всех 11 генов. Таким образом, при выявлении в первом триместре беременности сочетания гетерозиготы GA полиморфного варианта Arg353Gln (G10976A) гена FVII с мутантной гомозиготой GG полиморфного варианта Ile22Met (A66G) гена MTRR в первом триместре беременности возможность прогнозирования отслойки хориона будет выше по сравнению с пациентками, у которых не было выявлено данное сочетание генов.
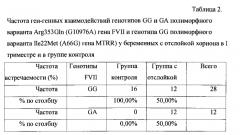
В табл. 2 наглядно отражена предрасположенность к отслойке хориона в I триместре беременности у пациенток, имеющих сочетание гетерозиготы GA полиморфного варианта Arg353Gln (G10976A) гена FVII с мутантной гомозиготой GG полиморфного варианта Ile22Met (A66G) гена MTRR.
Частота встречаемости сочетания гетерозиготы GA полиморфного варианта Arg353Gln (G10976A) гена FVII с мутантной гомозиготой GG полиморфного варианта Ile22Met (A66G) гена MTRR была достоверно выше у пациенток с отслойкой по сравнению с пациентками в группе контроля (табл. 2).
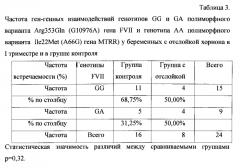
Генотип GG гена FVII является нормой гомозиготой, генотип GA гетерозиготой того же гена, АА гена MTRR представляет собой нормальную гомозиготу. Частота встречаемости сочетания генотипов GG и GA полиморфного варианта Arg353Gln (G10976A) гена FVII и генотипа АА полиморфного варианта Ile22Met (A66G) гена MTRR) не различалась у пациенток, имеющих отслойку хориона в I триместре и без нее (табл. 3).
Генотип AG является гетерозиготной формой полиморфизма Ile22Met (A66G) гена MTRR. Частота встречаемости сочетаний генотипов GG и GA полиморфного варианта Arg353Gln (G10976A) гена FVII и генотипа AG полиморфизма Ile22Met (A66G) гена MTRR не различалась у пациенток, имеющих отслойку хориона в I триместре, и в контрольной группе (табл. 4).
Таким образом, как показали результаты нашего исследования, частота встречаемости сочетания гетерозиготы полиморфного варианта Arg353Gln (G10976A) гена FVII с гомозиготой GG и гетерозиготой AG полиморфного варианта Ile22Met (A66G) гена MTRR не различалась у пациенток с отслойкой и пациенток в группе контроля (табл. 3, 4).
На основании полученных результатов показано, что ген-генные взаимодействия: гетерозиготы полиморфного варианта Arg353Gln (G10976A) гена FVII с гомозиготой полиморфного варианта Ile22Met (A66G) гена MTRR, являются крайне неблагоприятным сочетанием, при котором риск развития отслойки хориона является высоким.
Роль гена MTRR в реализации механизма отслойки хориона заключается в кодировании аминокислотной последовательности фермента метионин синтазы редуктазы, одной из функций которого является обратное превращение гомоцистеина в метионин. В результате замены аминокислотного остатка изолейцина на метионин в позиции 66 функциональная активность фермента снижается, нарушаются процессы метилирования ДНК. Метилирование ДНК играет ведущую роль в формировании и поддержании эпигенетической изменчивости - наследственного динамического процесса, определяющего степень активности генов.
Выявленный факт позволил предложить гипотезу, заключающуюся в том, что дефицит фермента метиленсинтаза редуктаза сопровождается недостатком метальных групп, что, в свою очередь, оказывает влияние на эпигенетический статус, и реализацию эффекта гипоконвертинемии, обусловленного мутацией коагуляционного фактора FVII, в результате - манифестация такого клинического проявления, как отслойка хориона.
Таким образом, предложенная гипотеза о том, что нарушение метилирования ДНК способствует проявлению мутации полиморфного варианта Arg353Gln (G10976A) гена FVII была подтверждена статистической обработкой данных.
Сущность предложенного способа поясняется примерами его осуществления.
Пример №1
Пациентка Т., 30 лет, первобеременная, поступила в гинекологическое отделение с жалобами на тянущие боли внизу живота в течение 2-х недель. При поступлении в стационар было выполнено УЗИ (в полости матки визуализируется один плод, копчико-теменной размер плода 34 мм; срок беременности - 10 нед. 2 дн.; частота сердечных сокращений плода 154 уд. в мин.; средний внутренний диаметр желточного мешка - 5 мм; в нижнем полюсе плодного яйца выявлен участок отслойки размерами 35×20 мм в стадии организации). Показатели коагулограммы: фибриноген 3,9 г/л, HAVR 4.5 мг/100 мл, Д-димер 1284 мг/мл. Беременность 1-я. Наследственность по риску невынашивания, сердечно-сосудистым заболеваниям, генетической патологии не отягощена. В детстве перенесла ОРВИ, ветряную оспу.
Гинекологические заболевания: эрозия шейки матки, миома матки.
Экстрагенитальная патология: дискинезия желчевыводящих путей по гипотоническому типу. Аллергологический анамнез: поллиноз.
Проведено молекулярно-генетическое тестирование 8 полиморфных вариантов генов системы гемостаза и 4-х полиморфных вариантов генов фолатного цикла: обнаружены гетерозигота полиморфного варианта FVII: 10976 G>A (GA) и мутантная гомозигота GG по полиморфизму MTRR: 66 A>G. Таким образом, выявление сочетания гетерозиготы GA полиморфного варианта Arg353Gln (G10976A) гена FVII с мутантной гомозиготой GG полиморфного варианта Ile22Met (A66G) гена MTRR подтверждает вероятность диагноза отслойки хориона, верифицированной по результатам УЗИ.
Пациентка находилась в стационаре 10 дней, при выписке отмечено отсутствие отслойки по данным УЗИ после полученного лечения.
Пример №2
Пациентка Ф., 29 лет, первобеременная, поступила в гинекологическое отделение с жалобами на тянущие боли внизу живота в течение одной недели, кровянистые выделения из половых путей в течение 2-х дней. При поступлении в стационар выполнено УЗИ (срок беременности по дню последней менструации - 7 нед. 6 дней, в полости матки визуализируется 1-плодное яйцо, копчико-теменной размер 14 мм, соответствует менструальному сроку беременности 7 нед. 4 дн.; частота сердечных сокращений 161 уд. в минуту, средний внутренний диаметр желточного мешка 4,7 мм, преимущественная локализация хориона - задняя стенка матки, слева, перекрывает область внутреннего зева нижним краем; в области
внутреннего зева эхо (-) щелевидная тень 15×3 мм - участок отслойки хориона.
Показатели коагулограммы - фибриноген 3,7 г/л, HAVR 4.2 мг/100 мл, Д-димер 789 мг/мл. Наследственность по риску невынашивания, сердечно-сосудистым заболеваниям, генетической патологии - не отягощена.
В детстве перенесла ОРВИ, ветряную оспу, краснуху.
Гинекологические заболевания: первичное бесплодие (1,5 года).
Экстрагенитальная патология: остеохондроз поясничного отдела позвоночника, правосторонний коксартроз, остеома правой тазобедренной кости. Аллергологический анамнез: не отягощен. Проведено молекулярно-генетическое тестирование 8 полиморфных вариантов генов системы гемостаза и 4-х полиморфных вариантов генов фолатного цикла: обнаружены гетерозигота полиморфного варианта FVII: 10976 G>A (GA) и мутантная гомозигота GG по полиморфизму MTRR: 66 A>G. Таким образом, выявление сочетания гетерозиготы GA полиморфного варианта Arg353Gln (G10976A) гена FVII с мутантной гомозиготой GG полиморфного варианта Ile22Met (A66G) гена MTRR подтверждает вероятность диагноза отслойки хориона, верифицированной по результатам УЗИ.
Пациентка находилась в стационаре 10 дней, выписана в удовлетворительном состоянии с организацией отслойки хориона по данным УЗИ после проведенного лечения.
Пример №3
Пациентка С., 26 лет, первобеременная, поступила в отделение гинекологии с жалобами на тянущие боли внизу живота, иррадиирующие в поясницу, в течение 3-х дней, тошноту, периодически рвоту. При поступлении в стационар выполнено УЗИ (срок беременности по дню последней менструации - 9 нед. 2 дн., в полости матки визуализируется 1-плодное яйцо, копчико-теменной размер 20 мм, соответствует менструальному сроку беременности 9 нед. 0 дн.; частота сердечных сокращений 162 уд. в минуту, средний внутренний диаметр желточного мешка 6 мм, преимущественная локализация хориона - задняя стенка матки, на 10 мм выше области внутреннего зева, в нижнем полюсе участок отслойки хориона 7×3 мм с признаками организации). Показатели коагулограммы: фибриноген - 4,2 г/л, Д-димер - 1182 мг/мл, РФМК - 5,0 мг/100 мл.
Наследственность по риску невынашивания, сердечно-сосудистым заболеваниям, генетической патологии - не отягощена.
В детстве перенесла ОРВИ, ветряную оспу, скарлатину, корь.
Гинекологические заболевания: первичное бесплодие (2 года).
Экстрагенитальная патология: отрицает.
Аллергологический анамнез отягощен, в анамнезе отек Квинке на введение новокаина. Проведено молекулярно-генетическое тестирование 8 полиморфных вариантов генов системы гемостаза и 4-х полиморфных вариантов генов фолатного цикла. Обнаружены гетерозигота полиморфного варианта FVII: 10976 G>A (GA) и мутантная гомозигота GG по полиморфизму MTRR: 66 A>G. Таким образом, выявление сочетания гетерозиготы GA полиморфного варианта Arg353Gln (G10976A) гена FVII с мутантной гомозиготой GG полиморфного варианта Ile22Met (A66G) гена MTRR подтверждает вероятность диагноза отслойки хориона, подтвержденной по результатам УЗИ.
Пациентка находилась в стационаре 10 дней, выписана в удовлетворительном состоянии с отсутствием отслойки хориона по данным УЗИ после проведенного лечения.
Способ прогнозирования отслойки хориона на ранних сроках беременности, включающий выделение ДНК с последующей амплификацией полиморфизмов генов тромбофилии и фолатного цикла при помощи метода ПЦР, отличающийся тем, что у беременных в I триместре проводят анализ полиморфного варианта Arg353Gln (G10976A) коагуляционного фактора VII и полиморфного варианта Ile22Met (A66G) гена MTRR (метионинсинтаза редуктаза) и при выявлении сочетания гетерозиготы GA полиморфного варианта Arg353Gln (G10976A) коагуляционного фактора VII с гомозиготой GG полиморфного варианта Ile22Met (A66G) гена MTRR прогнозируют риск развития отслойки хориона в первом триместре беременности.