Модулятор nmda-рецептора со стабилизированной вторичной структурой и его применение
Иллюстрации
Показать всеИзобретение относится к соединениям, обладающим повышенной активностью, направленной на модуляцию активности NMDA-рецептора, и их применению для лечения заболеваний и расстройств, таких как нарушение способности к обучению, когнитивные расстройства и аналгезия, а в частности, для ослабления и/или устранения невропатической боли. 7 н. и 2 з.п. ф-лы, 13 ил., 2 табл., 11 пр.
Реферат
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет предварительной заявки на патент США 61/303472, поданной 11 февраля 2010, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Предшествующий уровень техники
N-метил-D-аспартатный (NMDA) рецептор представляет собой постсинаптический ионотропный рецептор, восприимчивый, inter alia, к возбуждению аминокислотами глутаматом и глицином и к синтезированному соединению NMDA. NMDA-рецептор регулирует поток двухвалентных и моновалентных ионов в постсинаптический нейрон посредством канала, ассоциированного с рецептором (Foster et al, Nature 1987, 329:395-396; Mayer et al, Trends in Pharmacol. Sci. 1990, 11:254-260). NMDA-рецептор участвует в развитии нейронов, в процессе формирования архитектуры нейронов и в синаптической передаче сигнала, и может участвовать в эксперимент-зависимых синаптических модуляциях. Кроме того, очевидно, что NMDA-рецепторы также участвуют в долговременном потенцировании и в расстройствах центральной нервной системы.
NMDA-рецептор играет главную роль в сообщении синаптической системе пластичности, которая лежит в основе многих более сложных когнитивных функций, таких как приобретение информации, способность ее сохранения в памяти и способность к обучению, а также в некоторых когнитивных процессах и в восприятии боли (Collingridge et al., The NMDA Receptor, Oxford University Press, 1994). Кроме того, было высказано предположение, что некоторые свойства NMDA-рецепторов могут играть определенную роль в обработке информации в головном мозге, который сам по себе ответственен за формирование сознания.
NMDA-рецептор представляет особый интерес, поскольку этот рецептор, как очевидно, участвует в индуцировании расстройств ЦНР широкого спектра. Так, например, при ишемии головного мозга, вызываемой инсультом или травмами, избыточное количество возбуждающей аминокислоты, а именно, глутамата, высвобождается из пораженных нейронов или из нейронов, обедненных кислородом. Такой избыток глутамата связывается с рецепторами NMDA, которые открывают дискриминационное окно для лиганда в ионных каналах, в результате чего происходит приток кальция, который продуцирует высокий уровень внутриклеточного кальция, активирующего каскад биохимических реакций, что приводит к разложению белка и к гибели клеток. Также считается, что этот феномен, известный как экситотоксичность, ответственен за различные расстройства, начиная от остановки сердца и до эпилепсии. Кроме того, уже появились сообщения, указывающие на то, что этот феномен ответственен за аналогичные хронические нейродегенеративные расстройства, такие как болезнь Гентингтона, болезнь Паркинсона и болезнь Альцгеймера. Было показано, что NMDA-рецептор ответственен за постишемические судороги, и было также показано, что в некоторых моделях эпилепсии, активация NMDA-рецептора необходима для индуцирования эпилептических припадков. Также известно, что NMDA-рецептор участвует в нейропсихических процессах, поскольку блокада Ca++-канала NMDA-рецептором под действием анестетика PCP (фенилциклидина), взятого у животного, индуцирует у человека психотическое состояние, подобное шизофрении (см. Johnson, K. and Jones, S., 1990). Кроме того, NMDA-рецепторы также участвуют в формировании способности ориентироваться в пространстве.
Очевидно, что NMDA-рецептор состоит из нескольких белковых цепей, находящихся в постсинаптической мембране. Открытые в настоящее время субъединицы первых двух типов образуют крупную внеклеточную область, которая, вероятно, содержит большинство аллостерических сайтов связывания; несколько трансмембранных областей, представляющих собой петлю и имеющих такую укладку, при которой они образуют поры или каналы, являющиеся проницаемыми для Ca++, и карбоксильную концевую область. Открытие и закрытие канала регулируется посредством связывания различных лигандов с доменами (аллостерическими сайтами) белка, локализованного на внеклеточной поверхности. При этом считается, что связывание лигандов влияет на конформационные изменения общей структуры белка, что, в конечном счете, приводит к открытию, частичному открытию, частичному закрытию или к полному закрытию канала.
Соединения, воздействующие на NMDA-рецептор, могут оказывать двойное действие (как агонист/антагонист) на NMDA-рецептор посредством аллостерических сайтов. Такие соединения обычно называются «частичными агонистами». В присутствии главного сайта лиганда, частичный агонист будет вытеснять некоторые лиганды, и тем самым снижать поток Ca++ через рецептор. В отсутствии главного сайта лиганда или при низком уровне этого сайта лиганда, частичный агонист будет увеличивать поток Ca++ через канал рецептора.
В настоящее время существует необходимость в разработке новых и более специфических/активных соединений, которые обладали бы способностью связываться с глицин-связывающим сайтом NMDA-рецепторов или модулировать такой сайт NMDA-рецепторов, например, коровую область, связывающуюся с лигандом NR1 NMDA-рецептора, и обладали бы, например, значительной специфичностью и/или активностью, а в частности, активностью in vivo, способствующей продуцированию фармацевтического эффекта. Кроме того, также необходимо получить фармацевтические формы таких соединений, которые были бы пригодны для пероральной доставки.
Описание сущности изобретения
Настоящее изобретение, по меньшей мере частично, относится к соединениям, которые представляют собой модуляторы NMDA, например, частичные агонисты NMDA. Так, например, настоящее изобретение относится к соединениям, которые могут имитировать бета-складчатую структуру, способную селективно взаимодействовать с глицин-связывающей областью NR1 NMDA-рецептора, например, SEQ ID NO: 1. Описанные пептидомиметики, например, если они связываются с SEQ ID NO: 1, имеют бета-складчатый мотив. В некоторых вариантах изобретения, описанные пептидомиметики, в основном, сохраняют бета-складчатый мотив in vivo или в водном растворе.
В некоторых своих вариантах, настоящее изобретение относится к пептидомиметику, способному связываться или взаимодействовать с коровой областью SEQ ID NO: 1, связывающейся с лигандом NMDA, где указанный пептидомиметик имеет по меньшей мере два альфа-углерода на расстоянии примерно от 6 до 14 Å, например, примерно от 6 до 8 Å. Так, например, описанные миметики могут включать циклическую амидную коровую область, например, спиро-бета-лактам.
В другом варианте изобретения, описанным пептидомиметиком может быть пептид, в котором две или три аминокислоты заменены молекулой, имеющей карбоксильную группу и аминогруппу. В одном из своих вариантов, настоящее изобретение относится к описанному здесь пептидомиметику по любому из пунктов 1-6, где указанный пептидомиметик обладает способностью образовывать водородную связь по меньшей мере в одном, в двух, трех или четырех положениях нижеследующих аминокислот в SEQ ID NO: l: PRO124, THR126, GLU178 и SER180, либо он может обладать способностью образовывать водородную связь со всеми четырьмя аминокислотами.
Так, например, настоящее изобретение относится к пептидомиметику, обладающему способностью связываться с коровой областью SEQ ID NO:1, связывающейся с лигандом NMDA, где указанный пептидомиметик имеет два альфа-углерода на расстоянии примерно от 6 до 14 Å (например, примерно от 6 до 10 Å) и бета-складчатый мотив, содержащий бициклическую амидную коровую область (например, спиро-бета-лактам), расположенную так, что при связывании пептидомиметика с указанной последовательностью SEQ ID NO: 1, такая бициклическая амидная коровая область будет, в основном, сохранять свою конфигурацию. Такой пептидомиметик может включать коровую область, представленную формулой:
. Репрезентативные пептидомиметики могут, в основном, сохранять бета-складчатый мотив in vivo или в водном растворе, и могут обладать способностью образовывать водородную связь с нижеследующими аминокислотами SEQ ID NO:1: PRO124, THR126, GLU178 и SER180. В некоторых вариантах изобретения, бета-складчатая коровая область может быть конъюгирована с одной или с двумя аминокислотами.
Настоящее изобретение также относится к способам лечения или предупреждения расстройств у пациента, опосредуемых NMDA-рецептором, где указанные способы включают введение пациенту, нуждающемуся в этом, подходящего количества глицин-имитирующего бета-складчатого циклического соединения-пептидомиметика, имеющего циклическую амидную группу, например, бета-лактамовую группу, где указанное соединение является агонистом или антагонистом лиганд-связыващей коровой области NMDA-рецептора.
Настоящее изобретение также относится к способу модуляции активности SEQ ID NO: 1, где такая модуляция обусловлена благоприятной конформацией, сообщаемой данным соединением, и где указанная модуляция происходит в результате взаимодействия водородных связей между указанным соединением и одной, двумя, тремя или четырьмя нижеследующими аминокислотами SEQ ID NO: 1: PRO124, THR126, GLU178 и SER180.
В другом своем варианте, настоящее изобретение относится к способу идентификации соединения, обладающего способностью связываться с SEQ ID NO: 1, где указанный способ включает: a) создание молекулярной модели, содержащей одну или несколько областей-мишеней SEQ ID NO: 1, происходящих по меньшей мере от части SEQ ID NO: 1, и имеющей атомные координаты, полученные путем молекулярного моделирования SEQ ID NO: 1, или атомные координаты модели, депонированной в банке данных о белках под регистрационным номером 1PBQ; b) применение данной молекулярной модели для идентификации соединения, которое может связываться с одной или несколькими областями-мишенями в данной молекулярной модели; и c) продуцирование данного соединения. В некоторых вариантах изобретения, такой способ может также включать дополнительную стадию определения наличия модуляции последовательности SEQ ID NO: 1 с использованием указанного соединения.
Настоящее изобретение также относится к фармацевтически приемлемым композициям, содержащим описанное соединение и фармацевтически приемлемый наполнитель. Так, например, такие композиции могут быть использованы для их перорального введения пациенту.
Способ лечения когнитивного расстройства, такого как расстройство, ассоциированное с потерей памяти или с нарушением способности к обучению, включает введение пациенту, нуждающемуся в этом, эффективного количества описанного соединения. Так, например, настоящее изобретение относится к способам лечения потери памяти или снижения степени потери памяти, или лечения нарушения способности к обучению у пациента, нуждающегося в этом.
В одном из своих вариантов, настоящее изобретение относится к способам устранения боли при невропатии у пациента, нуждающегося в этом, где указанный способ включает введение указанному пациенту эффективного количества описанного соединения.
В настоящей заявке также описаны способы лечения депрессии, синдрома навязчивых состояний или шизофрении у пациента, нуждающегося в этом, где указанные способы включают введение указанному пациенту эффективного количества описанного соединения. В другом своем варианте, настоящее изобретение относится к способам лечения посттравматического стресса, алкогольной зависимости или наркомании у пациента, нуждающегося в этом, где указанные способы включают введение указанному пациенту эффективного количества описанных соединений.
Описание графического материала
На Фиг. 1A-1D показано, что описанное соединение (AK52) осуществляет двухфазную модуляцию возбуждающих постсинаптических токов (e.p.s.c.s), опосредуемых NMDA-рецептором в синапсах коллатералей Шаффера поля CA1 гиппокампа, и селективно усиливает индукцию LTP. 1A: Время продолжительности детектируемого снижения под действием AK52 (1 мкМ; сплошной столбик) NMDA-компонента e.p.s.c.s, индуцированных коллатералями Шаффера в пирамидных нейронах поля CA1. (Каждая точка означает среднее ± ср.ст.ош. амплитуды e.p.s.c. peNRXe для 5 клеток) 1B: Время продолжительности усиления при 10-кратном снижении концентрации AK52 (100 нМ; серый столбик) NMDA-компонента e.p.s.c.s, индуцированных коллатералями Шаффера в пирамидных нейронах поля CA1. (Каждая точка означает среднее ± ср.ст.ош. амплитуды e.p.s.c. peNRXe для 5 клеток). 1C: Время LTD, индуцированного серией низкочастотных стимулов (2 Гц/10 мин; начиная с импульса, указанного стрелкой) в синапсах коллатералей Шаффера поля CA1 в срезах, предварительно обработанных 1 мкМ (заштрихованные кружки; n=10) и 100 нМ (заштрихованные ромбы; n=6) NRX-10,052, по сравнению с контрольными необработанными срезами (незаштрихованные кружки; n=8). (Каждая точка означает среднее ± ср.ст.ош. нормализованного наклона кривой EPSP внеклеточного поля для n срезов). 1D: Время проведения экспериментов, в которых осуществляют сравнение LTP, индуцированного серией высокочастотных импульсов (3×100 Гц/500 мс; стрелка) в синапсах коллатералей Шаффера поля CA1 в срезах, предварительно обработанных 1 мкМ (заштрихованные кружки; n=10) или 100 нМ (заштрихованные ромбы; n=8) NRX-10,052, по сравнению с контрольными необработанными срезами (незаштрихованные кружки; n=15). (Каждая точка означает среднее ± ср.ст.ош. нормализованного наклона кривой e.p.s.р. поля для n срезов).
На Фиг. 2A-2E показано, что низкая концентрация описанного соединения B детектируемо усиливает возбуждающие постсинаптические токи, опосредуемые фармакологически изолированным постсинаптическим NMDA-рецептором (e.p.s.c.s), в синапсах коллатералей Шаффера поля CA1, и потенцирует LTP, тогда как концентрация, в 20 раз превышающая указанную концентрацию, снижает NMDA-индуцированные e.p.s.c.s. 2A: Время продолжительности детектируемого усиления одного импульса e.p.s.c.s., индуцированного фармакологически изолированным NMDA в коллатералях Шаффера и зарегистрированного в пирамидных нейронах поля CA1, под действием соединения В (50 нМ; сплошной столбик). 2B: Время продолжительности усиления e.p.s.c.s. NMDA, индуцированного импульсами (4 импульса/100 Гц) под действием соединения В (50 нМ; сплошной столбик); 2C: Время продолжительности детектируемого снижения одного импульса e.p.s.c.s., индуцированного NMDA в коллатералях Шаффера и зарегистрированного в пирамидных нейронах поля CA1, под действием соединения В (1 мкМ; сплошной столбик). 2D: Время продолжительности снижения e.p.s.c.s. NMDA, индуцированного импульсами (4 импульса/100 Гц) в коллатералях Шаффера и зарегистрированного в пирамидных нейронах поля CA1 под действием соединения В (1 мкМ; сплошной столбик); 2E: Усиление LTP, индуцированное серией высокочастотных импульсов (100 Гц/500×3 мс; сплошная стрелка) в коллатералях Шаффера в синапсах на пирамидных нейронах поля CA1 под действием 50 нМ соединения B (заштрихованные кружки) по сравнению с контрольными необработанными срезами (незаштрихованные кружки). (Каждая точка означает среднее ± ср.ст.ош. амплитуды e.p.s.c. peNRXe для n клеток).
На Фиг. 3A-3C продемонстрировано, что описанное соединение (AK51) в концентрациях 100 нМ и 1 мкΜ усиливает постсинаптические токи, индуцированные фармакологически изолированным NMDA (e.p.s.c.s.) в синапсах коллатералей Шаффера поля CA1, и потенцирует LTP. 3A: Время продолжительности детектируемого усиления одного импульса e.p.s.c.s., индуцированного фармакологически изолированным NMDA в коллатералях Шаффера и зарегистрированного в пирамидных нейронах поля CA1, под действием NRX-10,051 (100 нМ; сплошной столбик) (n=x). 3B: Время продолжительности детектируемого усиления одного импульса e.p.s.c.s., индуцированного фармакологически изолированным NMDA в коллатералях Шаффера и зарегистрированного в пирамидных нейронах поля CA1, под действием AK51 (1 мкΜ; сплошной столбик) (n=y). 3C: Усиление LTP, индуцированное серией высокочастотных импульсов (100 Гц/500×3 мс; сплошная стрелка) в коллатералях Шаффера в синапсах на пирамидных нейронах поля CA1 под действием AK5151 в концентрациях 100 нМ () и 1 мкМ (заштрихованные кружки) по сравнению с контрольными необработанными срезами (незаштрихованные кружки). 3D: Время LTP, индуцированного серией низкочастотных импульсов (2 Гц/10 мин; начиная с импульса, указанного стрелкой) в синапсах коллатералей Шаффера поля CA1 в срезах, предварительно обработанных 1 мкМ (заштрихованные кружки; n=10) и 100 нМ (заштрихованные ромбы; n=6) NRX-10051, по сравнению с контрольными необработанными срезами (незаштрихованные кружки; n=8). (Каждая точка означает среднее ± ср. ст. ош. амплитуды e.p.s.c. peNRXe для n клеток).
На Фиг.4 показано, что описанное соединение усиливает NMDA-индуцированный ток и LTP. A: Время продолжительности воздействия 20-минутного нахождения в бане 100 нМ AK51 (сплошной столбик) на нормализованный ток, индуцированный открытием каналов, опосредуемым фармакологически изолированным NMDA-рецептором, в пирамидных нейронах поля CA1 при регистрации целых клеток (среднее ± ср.ст.ош., n=5). B: Время продолжительности воздействия 20-минутного нахождения в бане 1 мкМ AK51 (сплошной столбик) на нормализованный ток, индуцированный открытием каналов, опосредуемым фармакологически изолированным NMDA-рецептором, в пирамидных нейронах поля CA1 при регистрации целых клеток (среднее ± ср.ст.ош., n=6). C: Время продолжительности воздействия нахождения в бане 100 нМ AK51 (сплошной столбик, заштрихованные кружки, n=8) по сравнению с необработанными контрольными срезами (незаштрихованные кружки, n=6) на величину долговременного потенцирования (LTP), определяемую по наклону кривой внеклеточного возбуждающего постсинаптического потенциала (среднее ± ср.ст.ош., fEPSP), индуцированного стимуляцией коллатералей Шаффера высокочастотными импульсами (стрелка, 2×100 Гц/500 мсек). D: Время продолжительности воздействия нахождения в бане 1 мкМ AK51 (сплошной столбик, заштрихованные кружки, n=8) по сравнению с необработанными контрольными срезами (незаштрихованные кружки, n=6) на величину наклона кривой LTP fEPSP (среднее ± ср.ст.ош.), индуцированного стимуляцией коллатералей Шаффера высокочастотными импульсами (стрелка, 2×100 Гц/500 мсек). E: Время продолжительности воздействия нахождения в бане 1 мкМ AK51 (сплошной столбик, заштрихованные кружки, n=10) по сравнению с необработанными контрольными срезами (незаштрихованные кружки, n=8) на величину наклона кривой долговременной депрессии fEPSP (среднее ± ср.ст.ош.), индуцированной стимуляцией коллатералей Шаффера низкочастотными импульсами (стрелка, 2×100 Гц/500 мсек).
На Фиг.5 представлены результаты теста на обучения крыс в Т-образном лабиринте с использованием описанного соединения.
На Фиг.6 представлены результаты анализа на невропатическую боль у крыс, проводимого с использованием формалина.
На Фиг.7 показано, что один изомер описанного соединения AK-55-A значительно усиливает NMDA-ток и LTP, тогда как само соединение не обладает такой способностью.
На Фиг.8 проиллюстрирован количественный анализ, проводимый с помощью ГХ/МС, и указана площадь под кривой для AK-51 и [2H7]пролина, используемого в качестве внутреннего стандарта, а также ГХ/МС-анализ, проводимый путем селективного мониторинга ионов после дериватизации TBDMS, осуществляемой методами, адаптированными Wood et al. Journal of Chromatography B, 831, 313-9 (2005). Количественный интервал для этого соединения в данном анализе составлял от 0,312 пмоль до 10 пмоль на колонку. Для селективного мониторинга ионов (SIM) использовали ионы 241,2 (данное соединение) и 350,3 (дейтерированный пролин). R2=0,9998 (Квадратическая нелинейная регрессия).
На Фиг.9 представлена последовательность NMDA-рецептора NR1 и различные соединения, связанные водородной связью c конкретными аминокислотами.
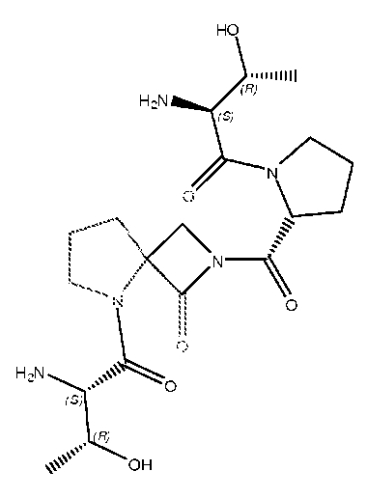
На Фиг.10 представлена кристаллическая структура соединения X (GLYX-13) с NMDA-рецептором NR1.
На Фиг.11 представлена модель пептида (GLYX-13), в которой расстояние между атомами альфа-углерода составляет 12,171 Å.
На Фиг.12 представлены 1Н-ЯМР-спектры описанного здесь соединения.
На Фиг.13 представлены 1Н-ЯМР-спектры описанного здесь соединения.
Подробное описание изобретения
В настоящем изобретении, в основном, описаны соединения, способные модулировать NMDA, например, антагонисты или частичные агонисты NMDA, а также их композиции и/или способы применения описанных соединений.
Ниже приводится определение терминов, используемых в описании настоящей заявки:
Используемый здесь термин «алкенил» означает ненасыщенный углеводород с прямой или разветвленной цепью, имеющий по меньшей мере одну углерод-углеродную двойную связь, такую как прямая или разветвленная группа из 2-12, 2-10 или 2-6 атомов углерода, называемая здесь C2-C12алкенилом, C2-C10aлкенилом и C2-C6алкенилом, соответственно. Репрезентативными алкенильными группами являются, но не ограничиваются ими, винил, аллил, бутенил, пентенил, гексенил, бутадиенил, пентадиенил, гексадиенил, 2-этилгексенил, 2-пропил-2-бутенил, 4-(2-метил-3-бутен)пентенил и т.п.
Используемый здесь термин «алкокси» означает алкильную группу, связанную с кислородом (-О-алкил). Репрезентативными алкоксигруппами являются, но не ограничиваются ими, группы, имеющие алкильную группу из 1-12, 1-8 или 1-6 атомов углерода, называемую здесь C1-C12алкокси, C1-C8алкокси и C1-C6алкокси, соответственно. Репрезентативными алкоксигруппами являются, но не ограничиваются ими, метокси, этокси и т.п. Аналогичным образом, репрезентативными «алкенокси»-группами являются, но не ограничиваются ими, винилокси, аллилокси, бутенокси и т.п.
Используемый здесь термин «алкил» означает насыщенный углеводород с прямой или разветвленной цепью. Репрезентативными алкильными группами являются, но не ограничиваются ими, метил, этил, пропил, изопропил, 2-метил-1-пропил, 2-метил-2-пропил, 2-метил-l-бутил, 3-метил-l-бутил, 2-метил-3-бутил, 2,2-диметил-1-пропил, 2-метил-l-пентил, 3-метил-l-пентил, 4-метил-l-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2,2-диметил-1-бутил, 3,3-диметил-l-бутил, 2-этил-1-бутил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гексил, гептил, октил и т.п.
Алкильная, алкенильная и алкинильная группы могут быть, но необязательно, замещены, если это не оговорено особо, одной или несколькими группами, выбранными из алкокси, алкила, циклоалкила, амино, галогена и -C(О)алкила. В некоторых вариантах изобретения, алкильная, алкенильная и алкинильная группы не замещены, то есть, они являются незамещенными.
Используемый здесь термин «алкинил» означает ненасыщенный углеводород с прямой или разветвленной цепью, имеющий по меньшей мере одну углерод-углеродную тройную связь. Репрезентативными алкинильными группами являются, но не ограничиваются ими, этинил, пропинил и бутинил.
Используемые здесь термины «амид» или «амидо» означают радикал формы -RaC(O)N(Rb)-, -RaC(О)N(Rb)Rc или -C(О)NRbRc-, где каждый из Ra, Rb и Rc независимо выбран из алкокси, алкила, алкенила, алкинила, амида, амино, арила, арилалкила, карбамата, циклоалкила, сложного эфира, простого эфира, формила, галогена, галогеналкила, гетероарила, гетероциклила, водорода, гидроксила, кетона и нитро. Амид может быть связан с другой группой посредством углерода, азота, Rb, Rc или Ra. Амид может быть также циклическим, например, Rb и Rc, Ra и Rb или Ra и Rc, взятые вместе, могут образовывать 3-12-членное кольцо, такие как 3-10-членное кольцо или 5-6-членное кольцо. Термин «карбоксамидо» означает структуру -C(О)NRbRc.
Используемый здесь термин «амин» или «амино» означает радикал формулы -NRdRe, где Rd и Re независимо выбраны из водорода, алкила, алкенила, алкинила, арила, арилалкила, циклоалкила, галогеналкила, гетероарила и гетероциклила. Амино может быть также циклическим, например, Rd и Re, связанные вместе с N, образуют 3-12-членное кольцо, например, морфолино или пиперидинил. Термин «амино» также включает соответствующую соль четвертичного аммония, состоящую из любой аминогруппы, например, -[N(Rd)(Re)(Rf)]+. Репрезентативными аминогруппами являются аминоалкильные группы, где по меньшей мере один из Rd, Re или Rf представляет собой алкильную группу. В некоторых вариантах изобретения, Rd и Re представляют собой водород или алкил.
Используемые здесь термины «галогеногруппа», «галоген» или «Hal» означают F, Cl, Br или I. Используемый термин «галогеналкил» означают алкильную группу, замещенную одним или несколькими атомами галогена.
Термины «гетероциклил» или «гетероциклическая группа» известны специалистам и означают насыщенные или частично ненасыщенные 3-10-членные циклические структуры, и альтернативно, 3-7-членные циклы, которые включают от одного до четырех гетероатомов, таких как азот, кислород и сера. Гетероциклы могут также представлять собой моноциклические, бициклические или другие полициклические системы. Гетероцикл может быть конденсирован с одним или несколькими арильными, частично ненасыщенными или насыщенными циклами. Гетероциклильными группами являются, например, биотинил, хроменил, дигидрофурил, дигидроиндолил, дигидропиранил, дигидротиенил, дитиазолил, гомопиперидинил, имидазолидинил, изохинолил, изотиазолидинил, изоксазолидинил, морфолинил, оксоланил, оксазолидинил, феноксантенил, пиперазинил, пиперидинил, пиранил, пиразолидинил, пиразолинил, пиридил, пиримидинил, пирролидинил, пирролидин-2-онил, пирролинил, тетрагидрофурил, тетрагидроизохинолил, тетрагидропиранил, тетрагидрохинолил, тиазолидинил, тиоланил, тиоморфолинил, тиопиранил, ксантенил, лактоны, лактамы, такие как азетидиноны и пирролидиноны, сультамы, сульфоны и т.п. Гетероциклическое кольцо может быть замещено в одном или нескольких положениях такими заместителями, как алканоил, алкокси, алкил, алкенил, алкинил, амидо, амидино, амино, арил, арилалкил, азидо, карбамат, карбонат, карбокси, циано, циклоалкил, сложный эфир, простой эфир, формил, галоген, галогеналкил, гетероарил, гетероциклил, гидроксил, имино, кетон, нитро, фосфат, фосфонато, фосфинато, сульфат, сульфид, сульфонамидо, сульфонил и тиокарбонил. В некоторых вариантах изобретения, гетероциклическая группа не замещена, то есть, гетероциклическая группа является незамещенной.
Термин «гетероциклоалкил» известен специалистам и означает насыщенную гетероциклильную группу, определенную выше. Используемый здесь термин «гетероциклилалкокси» означает гетероциклил, связанный с алкоксигруппой. Термин «гетероциклилоксиалкил» означает гетероциклил, связанный с кислородом (-О-), который связан с алкильной группой.
Используемые термины «гидрокси» и «гидроксил» означают радикал -OH.
Термины «фармацевтически или фармакологически приемлемый» относятся к молекулам и композициям, которые не вызывают негативных, аллергических или других нежелательных реакций при их введении животному или человеку, нуждающимся в таком введении. Препараты, вводимые человеку, должны удовлетворять требованиям стерильности, апирогенности, общей безопасности и чистоты в соответствии со стандартами, предъявляемыми Комиссией по биологическим стандартам при Управлении по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA).
Используемый в настоящем описании термин «частичный агонист NMDA-рецептора» определен как соединение, способное связываться с глицин-связывающим сайтом NMDA-рецептора; причем, при низких концентрациях, агонист NMDA-рецептора действует, в основном, как агонист, а при высоких концентрациях, он действует, в основном, как антагонист. Эти концентрации были экспериментально определены для всех без исключения «частичных» агонистов.
Используемый термин «фармацевтически приемлемый носитель» или «наполнитель» включает все без исключения растворители, дисперсионные среды, материалы для покрытий, антибактериальные и противогрибковые средства, изотонические агенты и агенты, замедляющие всасывание, и т.п., которые являются физиологически совместимыми. В одном из вариантов изобретения, носитель может быть использован для парентерального введения. Альтернативно, носитель может быть использован для внутривенного, внутрибрюшинного, внутримышечного, подъязычного или перорального введения. Фармацевтически приемлемыми носителями являются стерильные водные растворы или дисперсии и стерильные порошки для немедленного приготовления стерильных растворов или дисперсий для инъекции. Применение таких сред и агентов, содержащих фармацевтически активные вещества, хорошо известно специалистам. В настоящем изобретении рассматривается применение всех фармацевтических композиций согласно изобретению, если только они не содержат стандартные среды или стандартные агенты, которые являются несовместимыми с активным соединением. В указанные композиции могут быть также включены дополнительные активные соединения.
Используемый термин «фармацевтически приемлемая(ые) соль(и)» означает соли, содержащие кислотные или основные группы, которые могут присутствовать в соединениях, используемых в композициях согласно изобретению. Соединения, которые входят в состав композиции согласно изобретению, и которые являются основными по своей природе, обладают способностью образовывать соли широкого ряда с различными неорганическими и органическими кислотами. Кислотами, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений, являются кислоты, образующие нетоксичные кислотно-аддитивные соли, то есть, соли, содержащие фармакологически приемлемые анионы, включая, но не ограничиваясь ими, малат, оксалат, хлорид, бромид, иодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глютамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (то есть, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Соединения, входящие в состав композиций согласно изобретению и включающие аминогруппу, могут образовывать фармацевтически приемлемые соли не только с вышеуказанными кислотами, но и с различными другими аминокислотами. Соединения, которые входят в состав композиций согласно изобретению, и которые являются кислотными по своей природе, могут образовывать соли оснований с различными фармакологически приемлемыми катионами. Примерами таких солей являются соли щелочных или щелочноземельных металлов, а в частности, соли кальция, магния, натрия, лития, цинка, калия и железа.
Соединения согласно изобретению могут содержать один или несколько хиральных центров и/или двойных связей, а поэтому, они могут существовать в природе в виде стереоизомеров, таких как геометрические изомеры, энантиомеры или диастереомеры. Используемый здесь термин «стереоизомеры» включает все геометрические изомеры, энантиомеры или диастереомеры. Эти соединения могут обозначаться символами «R» или «S», в зависимости от конфигурации заместителей, расположенных вокруг стереогенного атома углерода. Настоящее изобретение относится к различным стереоизомерам этих соединений и их смесей. Стереоизомеры включают энантиомеры и диастереомеры. Смеси энантиомеров или диастереомеров могут обозначаться в соответствии с номенклатурой «±», но каждому специалисту известно, что такая структура может обозначаться с указанием хирального центра.
Отдельные стереоизомеры соединений согласно изобретению могут быть получены путем синтеза из коммерчески доступных исходных соединений, имеющих асимметрические или стереогенные центры, или путем приготовления рацемических смесей с последующим применением методов разрешения, хорошо известных среднему специалисту в данной области. Такие методы разрешения включают (1) присоединение смеси энантиомеров к хиральному вспомогательному соединению, разделение полученной смеси диастереомеров путем перекристаллизации или хроматографии, и отделение оптически чистого продукта от вспомогательного соединения, (2) образование соли с использованием оптически активного разделяющего агента, или (3) непосредственное разделение смеси оптических энантиомеров на хиральных хроматографических колонках. Стереоизомерные смеси могут быть также разделены на их стереоизомерные компоненты хорошо известными методами, такими как газовая хроматография с хиральной фазой, высокоэффективная жидкостная хроматография с хиральной фазой, кристаллизация соединения в виде комплекса хиральной соли или кристаллизация соединения в хиральном растворителе. Стереоизомеры могут быть также получены из стереомерно чистых промежуточных соединений с использованием реагентов и катализаторов хорошо известными методами асимметрического синтеза.
Соединения согласно изобретению могут также присутствовать в виде геометрических изомеров. Символ ══ означает связь, которая, как описано здесь, может быть простой, двойной или тройной связью. Настоящее изобретение включает различные геометрические изомеры и их смеси, образующиеся в зависимости от расположения заместителей вокруг углерод-углеродной двойной связи или расположения заместителей вокруг карбоциклического кольца. Заместители вокруг углерод-углеродной двойной связи называются «Z»- или «E»-конфигурациями, где обозначения «Z» и «E» используются в соответствии со стандартами, принятыми ИЮПАК. Если это не оговорено особо, то структуры с двойными связями включают оба «E»- и «Z»-изомера.
Альтернативно, заместители вокруг углерод-углеродной двойной связи могут называться «цис» или «транс», где «цис» означает заместители, расположенные на одной и той же стороне двойной связи, а «транс» означает заместители, расположенные на противоположных сторонах двойной связи. Расположение заместителей вокруг карбоциклического кольца обозначается «цис» или «транс». Термин «цис» относится к заместителям, расположенным на одной и той же стороне плоскости кольца, а термин «транс» относится к заместителям, расположенным на противоположных сторонах плоскости кольца. Смеси соединений, в которых заместители расположены на одной и той же стороне и на противоположных сторонах плоскости кольца, называются «цис/«транс».
Описанные соединения могут присутствовать в сольватированной, а также в несольватированных формах вместе с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п., при этом подразумевается, что настоящее изобретение охватывает как сольватированную, так и несольватированную формы. В одном из вариантов изобретения, указанное соединение является аморфным. В одном из вариантов изобретения, указанное соединение является полиморфным. В другом варианте изобретения, указанное соединение имеет кристаллическую форму.
Настоящее изобретение также охватывает меченные изотопы соединения согласно изобретению, которые идентичны описанным здесь соединениям, за исключением того, что в этих соединениях, один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа атомов, обычно встречающихся в природе. Примерами изотопов, которые могут быть введены в соединения согласно изобретению, являются изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18О, 17О, 31P, 32P, 35S, 18F и 36Cl, соответственно.
Некоторые описанные меченные изотопами соединения (например, меченные 3H и 14C) могут быть использованы в анализах на распределение соединения и/или субстратов в ткани. Изотопы, меченные тритием (то есть, 3H) и углеродом-14 (то есть, 14C) являются особенно предпочтительными с точки зрения простоты их получения и детектирования. Кроме того, замещение тяжелыми изотопами, такими как дейтерий (то есть, 2H), может давать некоторые терапевтические преимущества, обусловленные более высокой метаболической стабильностью (например, более длительным временем полужизни in vivo или пониженными требованиями к дозам), а поэтому, в некоторых случаях, такое замещение может оказаться предпочтительным. Меченные изотопами соединения согласно изобретению могут быть, в основном, получены с применением нижеописанных методов, аналогичных методам, описанным, например, в имеющемся здесь разделе «Примеры», путем замены реагента, меченного не-изотопами