Пиколинамидные и пиримидин-4-карбоксамидные соединения, способ их получения и фармацевтическая композиция, включающая их
Иллюстрации
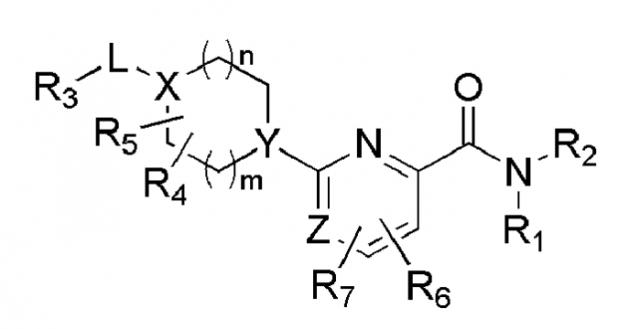
Показать всеИзобретение относится к амидным соединениям структурной формулы 1, которые обладают ингибирующей активностью в отношении 11β-HSD1 фермента. В формуле 1 X представляет N или CR, и Y представляет N или СН при условии, что X и Y не являются в одно и то же время углеродом; Z представляет N или СН; R1 и R2 представляют независимо водород, (С3-С10)циклоалкил, норборнил, адамантил или норадамантил, или R1 и R2 могут быть связаны друг с другом вместе с атомами азота, к которым они присоединены, образуя (С5-С10) насыщенный или ненасыщенный гетероцикл или сконденсированный гетероцикл, при условии, что R1 и R2 не являются в одно и то же время водородом; L представляет одинарную связь, -СО-, -SO2-, -(CR21R22)-(СН2)c- (с представляет целое число 0-5), , -СО(CR21R22)d- (d представляет целое число 1-6), (С3-С10)циклоалкилен, (С6-С20)арилен или 5-6-членный гетероарилен, включающий один или два гетероатома, выбранных из N; R21 и R22 представляют независимо водород или (C1-С10)алкил, R представляет водород или гидроксил; R4 и R5 независимо представляют водород или (С1-С10)алкил, или R4 и R5, связанные вместе, образуют 6-членный ненасыщенный карбоцикл; R6 и R7 представляют независимо водород, (С1-С10)алкил или галоген; R31-R38, R41-R43 и R46 представляют независимо водород или (С1-С10)алкил; и m и n независимо представляют целое число 0-3 при условии, что m+n представляют целое число 2 или более. Значения радикала R3 и дополнительных заместителей циклических групп R1-R3, L приведены в формуле изобретения. Изобретение также относится к фармацевтической композиции, содержащей указанные соединения, и к 11β-HSD1 ингибитору. 5 н. и 4 з.п. ф-лы, 24 табл., 296 пр.
Реферат
Область техники
[1] Настоящее изобретение относится к новым амидным соединениям, т.е. пиколинамидным и пиримидин-4-карбоксамидным соединениям, способу их получения, фармацевтической композиции, включающей их, и к медицинскому применению с использованием соединения в качестве агента для предотвращения, регулирования и лечения заболеваний, связанных с регулированием глюкокортикоидов путем использования селективной ингибирующей активности соединения в отношении 11β-HSD1 фермента.
Предшествующий уровень техники
[2] Глюкокортикоиды (кортизол человека) выполняет важную роль в поддержании гомеостаза глюкозы и метаболизме липидов и белка в организме. В частности, избыточные глюкокортикоиды в печени и адипозных тканях вызывают метаболические синдромы, такие как резистентность к инсулину, висцеральное ожирение, гипертензию и дислипидемию.
[3] Известно, что 11β-гидроксистероидная дегидрогеназа (11β-HSD) имеет два вида изозимов, типа 1 и типа 2. Первый, (11β-HSD1) является NADPH-зависимой редуктазой, и важным ферментом для превращения неактивного глюкокортикоида, кортизона, в активный глюкокортикоид, кортизол, в тканях печени, адипозной и головного мозга. 11β-HSD2 выполняет действие противоположное 11β-HSD1 NAD-зависимым образом, и экспрессируется главным образом в почках.
[4] Сообщалось, что 11β-HSD1-сверхэкспрессированные трансгенные мыши имеют в крови нормальный уровень кортизола, но имеют повышенный уровень кортизола в адипозной или жировой ткани, что вызывает инсулиновую устойчивость, висцеральное ожирение, гиперлипидемию и гипертензию, и что они показывают гораздо большее увеличение веса тела и гораздо большую скорость увеличения веса тела, чем не-трансгенная группа мышей [Masuzaki H. Science 2001, 294, 2166-2170; Masuzaki H. J. Clin. Invest. 2003, 112, 83-90]. Дополнительно сообщалось, что 11β-HSD1 нокаутированные мыши показывают улучшение переносимости глюкозы, ухудшение триглицеридов в крови и увеличение HDL-холестерина [Morton N. M. J. Biol. Chem. 2001, 276, 41293-41300].
[5] Карбеноксолон (CBX), который является неселективным ингибитором 11β-HSD1, улучшает восприимчивость к инсулину у здоровых представителей и пациентов с диабетом типа 2, но нетучных [Andrew, R. C. J. Clin. Endocrinol. Metab. 2003, 88, 285-291]. Однако, сообщалось, что СВХ вызывает гипокалиемию и гипертензию вследствие неселективного ингибирования 11β-HSD1 и 11β-HSD2, и таким образом развитие их ограничивается терапевтическими агентами [Kotelevtsev, Y. J, Clin. Invest. 1999, 103, 683-689].
[6] Следовательно, эффективные и селективные ингибиторы 11β-HSD1 ферментов ингибируют превращение глюкокортикоидов в активный тип, подавляя действие глюкокортикоидов в тканях, и в результате они могут использоваться в качестве терапевтических агентов в отношении метаболических синдромов, вызываемых глюкокортикоидами, таких как не-инсулин зависимый диабет типа 2, ожирение, гиперлипидемия, гипертензия, переносимость глюкозы и аналогичные.
[7] По этой причине настоящие изобретатели исследовали соединения, обладающие эффективной и селективной ингибиторной активностью в отношении 11β-HSD1 ферментов с целью регулирования или лечения метаболических синдромов, таких как ожирение, диабет и пр. В результате, они смогли синтезировать новые пиколинамидные и пиримидин-4-карбоксамидные соединения, и удостоверились, что новые соединения проявляют эффективную и селективную ингибиторную активность в отношении 11β-HSD1 ферментов.
Раскрытие изобретения
Техническая проблема
[8] Целью настоящего изобретения является создание нового амидного соединения, т.е. пиколинамидных и пиримидин-4-карбоксамидных соединений, или их фармацевтически активной соли, сольвата, гидрата, пролекарства, рацемата или стереоизомера.
[9] Еще одной целью настоящего изобретения является создание фармацевтической композиции для ингибирования 11β-HSD1 ферментов человеческого происхождения, включающей новое амидное соединение или его фармацевтически активную соль, сольват, гидрат, пролекарство, рацемат или стереоизомер в качестве активного ингредиента.
[10] Еще одной целью настоящего изобретения является создание агента для предотвращения, регулирования и лечения заболеваний, связанных с регулированием глюкокортикоидов, в которые вовлечены 11β-HSD1 ферменты человеческого происхождения, например, метаболических синдромов, таких как диабет типа 1 и типа 2, осложнения после диабета, латентный аутоиммунный диабет (LADA), синдромы инсулинорезистентности, ожирение, нарушеная толерантность к глюкозе (IGT), нарушение гликемии натощак (IFG), поврежденная толерантности к глюкозе, дислипидемия, атеросклероз, гипертензия и др.
Решение проблемы
[11] Согласно одному общему аспекту настоящее изобретение предоставляет новые амидные соединения, представленные ниже формулой 1, т.е. пиколинамидные и пиримидин-4-карбоксамидные соединения, или их фармацевтически активную соль, сольват, гидрат, пролекарство, рацемат или стереоизомер.
[12] [Формула 1]
[13]
[14] [В формуле 1,
[15] Х представляет N или CR, и Y представляет N или CH, при условии, что X и Y не являются в одно и то же время углеродом;
[16] Z представляет N или CH;
[17] R1 и R2 представляют независимо водород, (С1-10)алкил, (С3-С10)циклоалкил, норборнил, адамантил, норадамантил, (С6-20)арил, (С6-С20)ар(С1-С10)алкил или (С3-С20)гетероарил, или R1 и R2 могут быть связаны друг с другом вместе с атомом азота, к которому они присоединены, образуя (С1-С10)насыщенный или ненасыщенный гетероцикл, бигетероцикл или сконденсированный гетероцикл, при условии, что R1 и R2 не являются в одно и то же время водородом;
[18] L представляет одинарную связь, -O-, -NR11-, -CO-, -SO2-, -(CR21R22)-(CH2)c- (с представляет целое число от 0 до 5), -CO(CR21R22)d- (d представляет целое число 1-6), (С3-С10)циклоалкилен, (С6-С20)арилен или (С3-С20)гетероарилен;
[19] R21 и R22 представляют независимо водород или (С1-С10)алкил, или R21 и R22 могут быть связаны через алкилен или алкенилен с образованием циклоалифатического кольца или ароматического кольца;
[20] R и R3 представляют независимо водород, (С1-С10)алкил, (С3-С10)циклоалкил, (С1-С10)алкокси, галоген, гидрокси, циано, -NR31R32, нитро, -CONH2, -CO2R33, -SO3H, -SO2NR34R35, -SO2R36, -O(CH2)aCO2H (а представляет целое число 1-3), O(CH2)bCONH2 (b представляет целое число 1-3), -NH(CO)R37, -NH(SO2)R38, 5- - 7-членный гетероцикл, (С6-С20)арил или (С3-С20)гетероарил;
[21] R4 и R5 независимо представляют водород, (С1-С10)алкил, (С3-С10)циклоалкил, (С1-С10)алкокси, галоген, гидрокси, циано, амино, нитро, -CONH2 или -CO2R12, и включают все изомеры и рацемические соединения их всех, или R4 и R5 могут быть замещены соседними атомами углерода, образуя (С1-С10) насыщенный или ненасыщенный карбоцикл, гетероцикл, бикарбоцикл, бигетероцикл, сконденсированный карбоцикл, или сконденсированный гетероцикл, или могут быть связаны с R3, образуя насыщенный или ненасыщенный карбоцикл;
[22] R6 и R7 представляют независимо водород, (С1-С10)алкил, (С3-С10)циклоалкил, (С1-С10)алкокси, галоген, гидрокси, циано, амино, нитро, -CONH2 или -CO2R12;
[23] циклоалкилен, арилен или гетероарилен группы L; алкил, циклоалкил, норборнил, адамантил, норадамантил, арил, аралкил или гетероарил групп R1 и R2; насыщенный или ненасыщенный гетероцикл, бигетероцикл или сконденсированный гетероцикл, образуемый связью R1 и R2; алкил, циклоалкил, алкокси, гетероцикл, арил или гетероарил групп R и R3; алкил, циклоалкил или алкокси групп R4 и R5; насыщенный или ненасыщенный карбоцикл, гетероцикл, бикарбоцикл, бигетероцикл, сконденсированный карбоцикл или сконденсированный гетероцикл, образуемый замещением R4 и R5 соседними атомами углерода; и алкил, циклоалкил или алкокси групп R6 и R7 могут быть дополнительно замещены одним или более заместителями, выбранными из группы, состоящей из (С1-С10)алкила, (С3-С10)циклоалкила, (С1-С10)алкокси, галоген(С1-С10)алкила, галоген(С1-С10)алкокси, галогена, гидрокси, циано, -NR41R42, нитро, -CO2R43, -CONH2, -SO3H, -SO2NR44R45, -SO2(CH2)cNR44R45 (c представляет целое число 1-3), -SO2R46,-O(CH2)cCO2H (с представляет целое число 1-3), -O(CH2)dCONH2 (d представляет целое число 1-3), -NH(CO)R47, -NH(SO2)R48, (С6-С20)арил и (С3-С20)гетероарил;
[24] R11, R12, R31, R32, R33, R34, R35, R36, R37, R38, R41, R42, R43, R44, R45, R46, R47 и R48 представляют независимо водород, (С1-С10)алкил, (С3-С10)циклоалкил или (С6-С20)арил; и
[25] m и n независимо представляют целое число 0-3, при условии, что m+n представляют целое число 2 или более.]
[26] В описании R1 и R2 независимо представляют водород, (С3-С10)циклоалкил, норборнил, адамантил, норадамантил или (С6-С20)ар(С1-С10)алкил, или R1 и R2 могут быть связаны друг с другом, образуя гетероцикл, выбранный из следующих:
[27]
;
[28] L представляет одинарную связь, -CO-, -SO2-, -(CR21R22)-(CH2)c- (c представляет целое число 0-5),
,
-CO(CR21R22)d (d представляет целое число 1-6), (С3-С10)циклоалкилен, (С6-С20)арилен или (с3-С20)гетероарилен;
[29] R21 и R22 независимо представляют водород или (С1-С10)алкил;
[30] R3 представляет водород, (С1-С10)алкил, (С3-С10)циклоалкил, (С1-С10)алкокси, галоген, гидрокси, циано, -NR31R32, нитро, -CONH2, -CO2R33, -SO2NR34R35, -SO2R36, -O(CH2)aCO2H (a представляет целое число 1-3), -O(CH2)bCONH2 (b представляет целое число 1-3), -NH(CO)R37, -NH(SO2)R38, 5- - 7-членный гетероцикл, (С6-С20)арил или (С3-С20)гетероарил;
[31] R6 и R7 независимо представляют водород, (С1-С10)алкил или галоген;
[32] циклоалкилен, арилен или гетероарилен группы L; циклоалкил, норборнил, адамантил, норадамантил или аралкил групп R1 и R2; алкил, циклоалкил, алкокси, гетероцикл, арил или гетероарил группы R3; и алкил групп R6 и R7 могут быть дополнительно замещены одним или более заместителями, выбранными из группы, состоящей из (С1-С10)алкила, (С3-С10)циклоалкила, (С1-С10)алкокси, галоген(С1-С10)алкила, галоген(С1-С10)алкокси, галогена, гидрокси, циано, -NR41R42, нитро, -CO2R43, -CONH2, -SO3H, -SO2NR44R45, -SO2(CH2)cNR44R45 (c представляет целое число 1-3), -SO2R46, -O(CH2)cCO2H (с представляет целое число 1-3), -O(CH2)dCONH2 (d представляет целое число 1-3), -NH(CO)R47, -NH(SO2)R48, (С6-С20)арил и (С3-С20)гетероарил; и
[33] R11, R12, R31, R32, R33, R34, R35, R36, R37, R38, R41, R42, R43, R44, R45, R46, R47 и R48 представляют независимо водород, (С1-С10)алкил, (С3-С10)циклоалкил или (С6-С20)арил.
[34] Соединения настоящего изобретения могут быть получены с помощью использования известного метода органического синтеза, включая методы, описанные подробно в примерах.
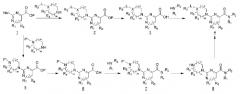
[35] Пиколинамидное соединение настоящего изобретения можно получить согласно схеме 1 ниже
[36] [Схема 1]
[37]
[38] (В схеме 1 Р представляет собой защитную группу.)
[39] Пиколиновую кислоту (1), замещенную в 6-положении галогеном или трифлатом, подвергали реакции с соответствующим амином и реагентами сочетания при комнатной температуре с получением промежуточного соединения 2. Далее вводили соответственно замещенный гетероцикл, содержащий атом азота, с последующей микроволновой реакцией, высокотемпературной реакцией или реакцией, катализируемой металлом, или аналогичным с получением конечного соединения 3.
[40] Дополнительно, промежуточное соединение 2 подвергали реакции с гетероциклом, включающим в себя один атом N, защищенный соответствующей защитной группой, и еще один атом N, с помощью микроволновой реакции, высокотемпературной реакции или катализируемой металлом реакции, с последующим снятием защиты с получением промежуточного соединения 8. Различные заместители (-L-R3) вводили в него с помощью метода алкилирования, карбонилирования, сульфонилирования, восстановительного аминирования, сочетания с использованием металлических катализаторов, или аналогичных, обеспечивая возможность эффективного синтеза различных производных.
[41] С другой стороны, чтобы получить соединение 6, в котором гетероцикл связан с 6-положением пиколинамида С-С связью, промежуточное соединение 2 подвергали реакции с гетероциклом, включающим 4,4,5,5-тетраметил-2-винил-1,3,2-диоксаборолан с N атомом, защищенным соответствующей защитной группой, с помощью катализируемой металлом реакции, с последующей реакцией гидрирования и снятия защиты, с получением промежуточного соединения 5. Различные заместители (-L-R3) могут вводиться туда с помощью метода алкилирования, карбонилирования, сульфонилирования, восстановительного аминирования, сочетания с использованием металлических катализаторов, или аналогичных.
[42] В случае, когда каждое из конечных соединений 3, 6 и 9 имеет функциональную группу из NO2, CN, CO2R, CO2H, NH2, OH или аналогичную, дальнейшее конечное соединение может быть получено с помощью реакции восстановления, гидролиза, аминирования, алкилирования, карбонилирования, сульфонилирования или аналогичных.
[43] Между тем, пиримидин-4-карбоксамидное соединение настоящего изобретения можно получить согласно схеме 2 ниже.
[44] [Схема 2]
[45]
[46] (На схеме 2 Р и Р' являются защитными группами.)
[47] Пиримидин-4-карбоновую кислоту, замещенную в 2-положении галогеном или трифлатом защищали соответствующей защитной группой (1), а затем подвергали реакции с соответственно замещенным гетероциклом, включающим N атом с помощью микроволновой реакции или высокотемпературной реакции с последующим снятием защиты, обеспечивая возможность синтеза промежуточного соединения 3. Данное соединение вводили в реакцию с соответствующим амином и реагентами сочетания при комнатной температуре с получением конечного соединения 4.
[48] В дополнение, соединение 1 подвергали реакции с гетероциклом, включающим один N атом, защищенным соответствующей защитной группой, и другой N атом, с помощью микроволновой или высокотемпературной реакции с последующим снятием защиты защищяющей карбоновую кислоту группы с получением промежуточного соединения 6. Данное соединение подвергали реакции с соответствующим амином и реагентами сочетания при комнатной температуре с последующим снятием защиты защищающей амин группы, обеспечивая возможность синтеза промежуточного соединения 8. Различные заместители (-L-R3) вводили в него с помощью метода алкилирования, карбонилирования, сульфонилирования, восстановительного аминирования, сочетания с использованием металлических катализаторов, или аналогичных, обеспечивая возможность эффективного синтеза различных производных.
[49] В случае, когда конечные соединения 4 имеют функциональную группу, такую как NO2, CN, CO2R, CO2H, NH2, OH или аналогичную, дальнейшее конечное соединение может быть получено с помощью реакции восстановления, гидролиза, аминирования, алкилирования, карбонилирования, сульфонилирования или аналогичных.
[50] Согласно еще одному общему аспекту настоящее изобретение предоставляет фармацевтическую композицию, включающую амидное соединение формулы 1, или его фармацевтически приемлемую соль, сольват, гидрат, пролекарство, рацемат или стереоизомер и фармацевтически приемлемый носитель.
[51] Согласно одному общему аспекту настоящее изобретение предоставляет 11β-HSD1 ингибитор, включающий амидное соединение формулы 1, или его фармацевтически активную соль, сольват, гидрат, пролекарство, рацемат или стереоизомер. Более того, настоящее изобретение предоставляет фармацевтическую композицию для лечения и/или предотвращения заболеваний, вызываемых, опосредуемых и/или развивающихся под действием высокого уровня кортизола, фармацевтическую композицию, включающую амидное соединение формулы 1, или его фармацевтически приемлемую соль, сольват, гидрат, пролекарство, рацемат или стереоизомер и фармацевтически приемлемый носитель.
[52] Согласно еще одному общему аспекту настоящее изобретение предоставляет фармацевтическую композицию для лечения и/или предотвращения метаболических синдромов, диабета, особенно не-инсулин зависимого диабета, преддиабета, инсулиновой толерантности, низкой толерантности к глюкозе, гипергликемии, ожирения и связанных с весом расстройств, дислипидемии, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, липидных расстройств, таких как низкие уровни HDL или высокие уровни LDL, глаукомы, остеопороза, познавательных расстройств, глюкокортикоид-опосредуемых действий на функции нейронов, таких как беспокойство или депрессия, нейродегенеративных расстройств, иммунных расстройств, таких как туберкулез, лепра или псориаз, гипертензии, атеросклероза и их осложнений, рестеноза сосудов, сердечно-сосудистого заболевания, панкреатита, ретинита, нейропатии или нефропатии, фармацевтическую композицию, включающую амидное соединение формулы 1, или его фармацевтически приемлемую соль, сольват, гидрат, пролекарство, рацемат или стереоизомер и фармацевтически приемлемый носитель.
[53] Амидное соединение настоящего изобретения может обычно использоваться в виде свободной кислоты или свободного основания. В отличие от этого амидное соединение настоящего изобретения может использоваться в виде аддитивной соли кислоты или основания. Кислотно-аддитивная соль свободного аминового соединения настоящего изобретения может быть получена с помощью хорошо известного в технике метода, и образуется из органической кислоты и неорганической кислоты. Подходящие примеры органической кислоты включают малеиновую, фумаровую, бензойную, аскорбиновую, янтарную, метан-сульфоновую, уксусную, трифторуксусную, щавелевую, пропионовую, винную, салициловую, лимонную, глюконовую, молочную, миндальную, коричную, аспарагиновую, стеариновую, пальмитиновую, гликолевую, глютаминовую и бензолсульфоновую кислоту. Подходящие примеры неорганической кислоты включают соляную, бромистоводородную, серную, фосфорную и азотную кислоту. Примеры аддитивных солей основания включают соли, образуемые вместе с карбоксилатными анионами, и включают соли, образуемые с органическими и неорганическими катионами, например, катионами, выбранными из щелочных и щелочно-земельных металлов (например, лития, натрия, калия, магния, бария и кальция), и аммониевыми ионами и их замещенными производными (например, дибензиламмонием, бензиламмонием, 2-гидроксиэтиламмонием или аналогичными). Следовательно, имеется в виду, что термин “фармацевтически приемлемая соль” соединения формулы 1 включает любые приемлемые типы солей.
[54] Далее, в объем настоящего изобретения может быть включено пролекарство. Пролекарство, когда вводится пациенту, представляет собой ковалентно связанный носитель, в котором соединение формул 1 высвобождается in vivo. Пролекарство обычно получают модификацией функциональной группы, и данная модификация прерывается с помощью общепринятых операций или в организме, генерируя исходное соединение. Пролекарство, когда оно вводится пациенту, прерывается с образованием гидрокси, аминовой или сульфгидрильной группы, и таким образом пролекарство включает соединение настоящего изобретения, связанное с группой, образующей гидрокси, аминовую или сульфгидрильную группу. Следовательно, характерные представители примеров пролекарства включают, но не ограничиваются ими, ацетатные, формиатные и бензоатные производные спиртовых и аминовых функциональных групп соединений формулы 1. Кроме того, что касается карбоновокислотной группы (-СООН), могут использоваться группы сложных эфиров, таких как метилового эфира, этилового эфира или аналогичных.
[55] Что касается стереоизомера, соединение формулы 1 может иметь хиральный центр, и может существовать в виде рацемата, рацемической смеси и индивидуального энантиомера или диастереомера. Данные изомеры могут разделяться или расщепляться общепринятым методом, и любой конкретный изомер может быть получен с помощью общепринятого метода синтеза или стереоспецифического или асимметрического синтетического метода. В объем настоящего изобретения включены все данные изомерные типы и их смеси.
[56] Некоторые из кристаллических форм соединения формулы 1 могут существовать в полиморфной форме, и данная форма включена в настоящее изобретение. Кроме того, некоторые из соединений формулы 1 могут образовывать гидраты или сольваты вместе с водой или другими органическими растворителями. Данные гидраты или сольваты также включены в объем настоящего изобретения.
[57] Фармацевтическая композиция настоящего изобретения может включать в качестве активного ингредиента амидное соединение, представленное формулой 1, его фармацевтически приемлемую соль, сольват, гидрат, пролекарство, рацемат или стереоизомер, и к ним могут добавляться обычные нетоксичные фармацевтически приемлемые носители, адьюванты, наполнители или аналогичные для формулирования в области фармацевтики обычной рецептурной формы, такой как таблетки, капсулы, пастилки, жидкости, суспензии или аналогичные, или парентеральной рецептурной формы.
[58] Наполнители, используемые в фармацевтической композиции настоящего изобретения, могут включать подсластитель, связующее, растворитель, агент, способствующий растворению, смачивающий агент, эмульгатор, агент, придающий внешний вид, адсорбент, дезинтегрирующий агент, антиоксидант, консерваторы, агент скольжения, наполнитель, ароматизирующий агент и аналогичные. Например, в состав композиции могут включаться лактоза, декстроза, сахароза, манит, сорбит, целлюлоза, глицин, двуокись кремния, тальк, стеариновая кислота, стерин, стеарат магния, алюминийсиликат магния, крахмал, желатин, камедь трагаканта, альгиновая кислота, альгинат натрия, метилцеллюлоза, натриевая карбоксиметилцеллюлоза, агар-агар, вода, этанол, полиэтиленгликоль, поливинилпирролидон. Хлорид натрия, хлорид кальция, апельсиновая эссенция, земляничная эссенция, ванильный ароматизатор и аналогичные.
Преимущественные эффекты изобретения
[59] Новые пиколинамидные и пиримидин-4-карбоксамидные соединения настоящего изобретения, их фармацевтически приемлемая соль, сольват, гидрат, пролекарство, рацемат или стереоизомер обладает селективной ингибиторной активностью в отношении 11β-HSD1 ферментов человеческого происхождения. Поэтому, соединения настоящего изобретения оказывают полезные действия как агенты для предотвращения, регулирования и лечения заболеваний, связанных с регулированием глюкокортикоидов, которые вызываются активностью 11β-HSD1 ферментов, например, метаболических синдромов, таких как диабет 1 и 2 типа, диабет после осложнений, латентный аутоиммунный диабет взрослых (LADA), синдромы инсулинорезистентности, ожирение, нарушенная толерантность к глюкозе (IGT), нарушенная гликемия натощак (IFG), поврежденная толерантность к глюкозе, дислипидемия, атеросклероз, гипертензия и проч.
Способ изобретения
[60] Описываемое выше настоящее изобретения будет описано подробно ниже на основе примеров, экспериментальных примеров и примеров получения. Однако, данные примеры, экспериментальные примеры и примеры получения являются только иллюстративными примерами и не предназначены для ограничения объема настоящего изобретения.
[61] [Примеры]
[62] Пример 1: Синтез N-циклогексил-6-(пиперидин-1-ил)пиколинамида
[63]
[64] Стадия 1: Синтез 6-бром-N-циклогексилпиколинамида (Промежуточное соединение 1)
[65] После того, как 6-бромпиколиновую кислоту (500 мг, 2,48 ммоль) суспендировали в ацетонитриле (25 мл), к ней последовательно добавляли циклогексиламин (0,34 мл, 2,97 ммоль), N,N-диизопропилэтиламин (0,65 мл, 3,72 ммоль) и HBTU (1,13 г, 2,97 ммоль), а затем получающуюся в результате смесь перемешивали при комнатной температуре в токе азота в течение 3 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (EtOAc/гексаны), получая 624 мг бесцветного масла (94%).
[66] Стадия 2: Синтез N-циклогексил-6-(пиперидин-1-ил)пиколинамида
[67] 6-Бром-N-циклогексилпиколинамид (55 мг, 0,194 ммоль), пиперидин (18 мг, 0,213 ммоль), Pd2(dba)3 (3,5 мг, 0,00388 ммоль), ксантфос (6,7 мг, 0,0116 ммоль) и трет-бутоксид натрия (27,4 мг, 0,285 ммоль) суспендировали в толуоле (3 мл), и затем перемешивали при 100°С в токе азота в течение 3 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (30% EtOAc/гексаны), получая 51 мг бледно желтого масла (83%). MS (ESI): 288[M+H]+
[68]
[69] Соединения следующих примеров синтезировали тем же самым способом, что и в примере 1 выше, с использованием промежуточного соединения 1 и соответствующего аминового исходного материала.
[70] Таблица 1
[71]
[72] Пример 6: Синтез (4-метилпиперидин-1-ил)(6-(пиперидин-1-ил)пиридин-2-ил)метанон
[73]
[74] Стадия 1: Синтез (6-бромпиридин-2-ил)(4-метилпиперидин-1-ил)метанона (промежуточное соединение 2)
[75] После того, как 6-бромпиколиновую кислоту (500 мг, 2,48 ммол) суспендировали в ацетонитриле (25 мл), к ней последовательно добавляли 4-метилпиперидинин (0,44 мл, 3,72 ммоль), N,N-диизопропилэтиламин (0,65 мл, 3,72 ммоль) и HBTU (1,13 г, 2,97 ммоль), а затем получающуюся в результате смесь перемешивали при комнатной температуре в токе азота в течение 4 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (EtOAc/гексаны), получая 677 мг белого твердого вещества (97%).
[76] Стадия 2: Синтез (4-метилпиперидин-1-ил)(6-пиперидин-1-ил)пиридлин-2-ил)метанона
[77] (6-бромпиридин-2-ил)(4-метилпиперидин-1-ил)метанон (40 мг, 0,142 ммоль), пиперидин (13 мг, 0,156 ммоль), Pd2(dba)3 (2,6 мг, 0,00284 ммоль), ксантфос (5,0 мг, 0,00864 ммоль) и трет-бутоксид натрия (20,4 мг, 0,208 ммоль) суспендировали в толуоле (2 мл), и затем перемешивали при 100°С в токе азота в течение 3 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (30% EtOAc/гексаны), получая 31 мг бледно желтого масла (80%). MS (ESI): 288[M+H]+
[78]
[79] Соединения следующих примеров синтезировали тем же самым способом, что и в примере 6 выше, с использованием промежуточного соединения 2 и соответствующего аминового исходного материала.
[80] Таблица 2
[81]
[82] Пример 11: Синтез (3,3-диметилпиперидин-1-ил)(6-(4-(4-метоксифенил)пиперазин-1-ил)пиридин-2-ил)метанона
[83]
[84] Стадия 1: Синтез (6-бромпиридин-2-ил)(3,3-диметилпиперидин-1-ил)метанона (промежуточное соединение 3)
[85] После того, как 6-бромпиколиновую кислоту (200 мг, 0,99 ммол) суспендировали в ацетонитриле (8 мл), к ней последовательно добавляли 3,3-диметилпиперидинин (0,17 мл, 1,19 ммоль), N,N-диизопропилэтиламин (0,26 мл, 1,49 ммоль) и HBTU (0,45 г, 1,19 ммоль), а затем получающуюся в результате смесь перемешивали при комнатной температуре в токе азота в течение 3 часов.
[86] К получающейся в результате реакционной жидкости добавляли дистиллированную воду (15 мл) с последующей экстракцией МС (50 мл × 2). Органический слой сушили над безводным сульфатом магния с последующим фильтрованием и концентрированием, а затем полученный таким образом остаток подвергали MPLC (20% EtOAc/гексаны), получая 292 мг бесцветного масла (99%).
[87] Стадия 2: Синтез (3,3-диметилпиперидин-1-ил)(6-(4-(4-метоксифенил)ппперазин-1-ил)пиридин-2-ил)метанона
[88] (6-бромпиридин-2-ил)(3,3-диметилпиперидин-1-ил)метанон (40 мг, 0,135 ммоль), 1-(4-метоксифенил)пиперазин (29 мг, 0,149 ммоль), Pd2(dba)3 (2,5 мг, 0,00273 ммоль), ксантфос (4,7 мг, 0,00812 ммоль) и трет-бутоксид натрия (19,0 мг, 0,198 ммоль) суспендировали в толуоле (2 мл), и затем перемешивали при 100°С в токе азота в течение 2 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (50% EtOAc/гексаны), получая 47 мг бледно желтого твердого вещества (85%). MS (ESI): 409[M+H]+
[90] Соединения следующих примеров синтезировали тем же самым способом, что и в примере 11 выше, с использованием промежуточного соединения 3 и соответствующего аминового исходного материала.
[91] Таблица 3
[92]
[93] Пример 16: Синтез N(адамантан-2-ил)-6-(4-(4-метоксифенил)пиперазин-1-ил)пиколинамид
[94]
[95] Стадия 1: Синтез N(адамантан-2-ил)-6-бромопиколинамид (Промежуточное соединение 4)
[96] После того, как 6-бромпиколиновую кислоту (500 мг, 2,48 ммоль) суспендировали в ацетонитриле (25 мл), к ней последовательно добавляли 2-гидрохлорид адамантиламина (558 мг, 2,97 ммоль), N,N-диизопропилэтиламин (1,30 мл, 7,44 ммоль) и HBTU (1,13 г, 2,97 ммоль), а затем получающуюся в результате смесь перемешивали при комнатной температуре в токе азота в течение 3 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (30%Teac/гексаны), получая 602 мг белого твердого вещества (73%).
[97] Стадия 2: Синтез N(адамантан-2-ил)-6-(4-(4-метоксифенил)пиперазин-1-ил)пиколинамид
[98] N(адамантан-2-ил)-6-бромопиколинамид (55 мг, 0,194 ммоль), 1-(4-метоксифенил)пиперазин (41 мг, 0213 ммоль), PD2(dba)3 (3,5 мг 0,00388 ммоль), ксантфос (6,7 мг, 0,0116 ммоль) и трет бутоксид натрия (27,4 мг, 0,285 ммоль) суспендировали в толуоле (3 мл), и затем перемешивали при 100°С в токе азота в течение 3 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (30% EtOAc/гексаны), получая 64 мг бледно-желтого твердого вещества (84%). MS (ESI): 447[M+H]+
[99]
[100] Соединения следующих примеров синтезировали тем же самым способом, что и в примере 16 выше, с использованием промежуточного соединения 4 и соответствующего аминового исходного материала.
[101] Талица 4
[102]
[103] Пример 23: Синтез N-(адамантан-2-ил)-6-(пиперазин-1-ил)пиколинамид
[104]
[105] Стадия 1: Синтез трет-бутил 4-(6-(адамантан-2-илкарбамоил)пиридин-2-ил)пиперазин-1-карбоксилат
[106] N(адамантан-2-ил)-6-бромопиколинамид (80 мг, 0,239 ммоль), трет-бутил пиперазин-1-карбоксилат (49 мг, 0,263 ммоль), PD2(dba)3 (4,4 мг 0,005 ммоль), ксантфос (8,3 мг, 0,014 ммоль) и трет бутоксид натрия (34 мг, 0,359 ммоль) суспендировали в толуоле (3 мл), и затем перемешивали при 100°С в токе азота в течение 3 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (40% EtOAc/гексаны), получая 86,8 мг бледно желтого масла (83%)
[107] Стадия 2: Синтез N-(адамантан-2-ил)-6-(пиперазин-1-ил)пиколинамид
[108] После того как трет-бутил 4-(6-(адамантан-2-илкарбамоил)пиридин-2-ил)пиперазин-1-карбоксилат (86 мг, 0,195 ммоль) растворяли в МС (2 мл), с последующим последовательным добавлением трифторуксусной кислоты (2 мл), а затем получающуюся в результате жидкость перемешивали в потоке азота при комнатной температуре в течение 4 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении с последующим добавлением насыщенного водного раствора NaHCO3 (10 мл), а затем экстрагировали МС (15 мл × 2). Органический слой сушили над безводным сульфатом магния с последующим фильтрованием и концентрированием, а затем полученный таким образом остаток подвергали MPLC (10% MeOH/MC), получая 65 мг бесцветного масла (98%). MS (ESI): 341[M+H]+
[109]
[110] Пример 24:Синтез N-(адамантан-2-ил)-6-(4-(2-гидроксиэтил)пиперазин-1-ил)пиколинамид
[111]
[112] После того как N-(адамантан-2-ил)-6-(пиперазин-1-ил)пиколинамид (34 мг, 0,100 ммоль) растворяли в DMF (2 мг), с последующим последовательным добавлением 2-бромоэтанола (19 мг, 0,150 ммоль) и карбоната калия (41 мг, 0,300 ммоль), а затем получающуюся в результате смесь перемешивали при 100°С в токе азота в течение 18 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (10% МеОН/МС), получая 37 мг бесцветного масла (96%). MS (ESI): 385[M+H]+.
[113]
[114] Пример 25: Синтез метил 3-(4-(6(адамантан-2-илкарбамоил)пиридин-2-ил)пиперазин-1-ил)пропанат
[115]
[116] После того как N-(адамантан-2-ил)-6-(пиперазин-1-ил)пиколинамид (34 мг, 0,100 ммоль) растворяли в ДМФ (2 мл), туда добавляли метиловый эфир 3-бромпропановой кислоты (25 мг, 0,150 ммоль)и карбонат калия (41 мг, 0,300 ммоль), а затем получающуюся в результате смесь перемешивали при 100°С в токе азота в течение 24 часов. Получающуюся в результате реакционную жидкость фильтровали и концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (60% EtOAc/гексаны), получая 41 мг белого твердого вещества (96%). MS (ESI): 427[M+H]+.
[117]
[118] Пример 26: Синтез (3-(4-(6-(адамантан-2-илкарбамоил)пиридин-2-ил)пиперазин-1-ил)пропановая кислота
[119]
[120] Метил (3-(4-(6-(адамантан-2-илкарбамоил)пиридин-2-ил)пиперазин-1-ил)пропаноат (43 мг, 0,101 ммоль) добавляли 4н водного раствора HCI (2 мл), а затем нагревали с обратным холодильником в течение 2 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем нейтрализовали медленным добавлением насыщенного водного раствора NaHCO3, с последующей экстракцией раствором смеси (10 мл × 2) тетрагидрофуран:MC=4:1. Органический слой сушили над безводным сульфатом магния с последующим фильтрованием и концентрированием, а затем полученный таким образом остаток подвергали MPLC (10% MeOH/MC), получая 27 мг бледно желтого масла (65%). MS (ESI):413[M+H]+
[121]
[122] Пример 27: Синтез N-(адамантан-2-ил)-6-4-(3-амино-3-оксопропил)пиперазин-1-ил)пиколинамид
[123]
[124] 7N аммония в метаноле (2мл) добавляли в метил 3-(4-(6-(адамантан-2-илкарбамоил)пиридин-2-ил)пиперазин-1-ил)пропаноат (94 мг,0,22 ммоль), а затем получающуюся смесь перемешивали при комнатной температуре в течение 48 часов. Получающуюся реакционную жидкость концентрировали при пониженном давлении, а полученный таким образом остаток подвергали MPLC (10% МеОН/МС), получая 54 мг бесцветного масла (60%). MS (ESI): 412[M+Н]+.
[125]
[126] Пример 28: Синтез (S)-(6-(пиперидин-1-ил)пиридин-2-ил)(3-(2-трифторметил)фенил)пирролидин-1-ил)метанона
[127]
[128] Стадия 1: Синтез (S)-(6-бромпиридин-2-ил)(3-(2-трифторметил)фенил)пирролидин-1-ил)метанона (промежуточное соединение 5)
[129] После того, как 6-бромпиколиновую кислоту (430 мг, 2,13 ммоль) суспендировали в ацетонитриле (25 мл), к ней последовательно добавляли (S)-3-(2-трифторметил)фенил)пирролидин (503 мг, 2,34 ммоль), N,N-диизопропилэтиламин (0,56 мл, 3,20 ммоль) и HBTU (969 мг, 2,56 ммоль), а затем получающуюся в результате смесь перемешивали при комнатной температуре в токе азота в течение 3 часов. Получающуюся в результате реакционную жидкость концентрировали при пониженном давлении, а затем полученный таким образом остаток подвергали MPLC (40% EtOAc/гексаны), получая 765 мг белого твердого вещества (90%).
[130] Стадия 2: Синтез (S)-(6-(пиперидин-1-ил)пиридин-2-ил)(3-(2-трифторметил)фенил)пирролидин-1-ил)метанона
[131] (S)-(6-бромпиридин-2-ил)(3-(2-трифторметил)фенил)пирролидин-1-ил)метанон (60 мг, 0,150 ммоль), пиперидин (15 мг, 0,180 ммоль), Pd2(dba)3 (3 мг, 0,003 ммоль), ксантфос (5 мг, 0,009 ммоль) и трет-бутокс