Тест-система mycobacterium smegmatis aphviii+ для скрининга ингибиторов серин-треониновых протеинкиназ эукариотического типа
Иллюстрации
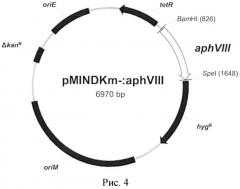
Показать всеИзобретение относится к молекулярной биологии, фармацевтике и медицинской химии, в частности к разработке и созданию тест-систем. Тест-система М. smegmatis aphVIII+ создана для тестирования различных химических соединений на их способность специфически ингибировать серин-треониновые протеинкиназы М. smegmatis и представляет собой генетическую конструкцию, представленную на рис. 4, сконструированную на основе модифицированного челночного вектора pMIND с делетированным геном устойчивости к канамицину (pMINDKm-), включающую ген аминогликозидфосфотрансферазы aphVIII из штамма Streptomyces rimosus АТСС 10970, клонированный по сайтам эндонуклеаз рестрикции BamHI и SpeI, и внедренную методом трансформации в штамм М. smegmatis mc2 155. Изобретение позволяет расширить ассортимент тест-систем. 4 ил., 2 табл., 3 пр.
Реферат
Изобретение относится к молекулярной биологии, фармацевтике и медицинской химии, в частности к разработке, созданию и валидации новых биомишеней и тест-систем с целью поиска химических соединений-лидеров, которые могут являться потенциальными кандидатами в противотуберкулезные лекарства.
Уровень техники
По оценкам всемирной организации здравоохранения (ВОЗ) 8,6 миллионов человек заболели туберкулезом и 1,3 миллиона умерли от туберкулеза (включая 320000 ВИЧ-положительных больных) в 2012 году [World Health Organization. Global tuberculosis report 2013. World Health Organization, 2013]. Одной из причин трудности лечения туберкулеза в настоящее время является массовое возникновение множественной лекарственной устойчивости (МЛУ) у возбудителя туберкулеза. К появлению МЛУ-штаммов часто приводит несвоевременно прерванное лечение или неудачно подобранный курс химиотерапии. Среди штаммов МЛУ особенно опасны штаммы с широкой лекарственной устойчивостью (ШЛУ), устойчивые к 4-9 препаратам [Matteelli A., Roggi A., Carvalho А.С. Extensively drug-resistant tuberculosis: epidemiology and management. // Clin Epidemiol. 2014. Vol. 6. Pp. 111-1188 pp.; Sotgiu G., Ferrara G., Matteelli A., Richardson M.D., Centis R., Ruesch-Gerdes S., Toungoussova O., Zellweger J.P., Spanevello A., Cirillo D., Lange C., Migliori G.B. Epidemiology and clinical management of XDR-TB: a systematic review by TBNET. // Eur. Respir. J. 2009. Vol. 33, №4. Pp. 871-88111 рр]. Улучшение результатов лечения туберкулеза зависит от развития современной фармацевтики, главным в котором является разработка новых технологических подходов к созданию новых лекарственных средств путем воздействия на мишени, важные для жизнедеятельности возбудителя туберкулеза - Mycobacterium tuberculosis. Важнейшими среди таковых мишеней являются протеинкиназы - белки, осуществляющие передачу внутриклеточных сигналов в клетках. Серин-треониновые протеинкиназы (СТПК) - одни из наиболее универсальных регуляторов жизнеспособности про- и эукариотических клеток. Этим ферментам принадлежит ключевая роль в контроле таких процессов, как вирулентность, персистенция, толерантность к антибиотикам, образование биопленок и др. [Прозоров А.А., Федорова И.А., Беккер О.Б., Даниленко В.Н. Факторы вирулентности Mycobacterium tuberculosis: генетический контроль, новые концепции // Генетика. 2014. Т. 50. №8. С.885-908; Forrellad М.А., Klepp L.I., Gioffré A., Sabio у Garcia J., Morbidoni H.R., de la Paz Santangelo M., Cataldi A.A., Bigi F. Virulence factors of the Mycobacterium tuberculosis complex. // Virulence. 2013. Vol. 4, №1. Pp. 3-6664 pp.; Danilenko V.N., Osolodkin D.I., Lakatosh S.A., Preobrazhenskaya M.N., Shtil A.A. Bacterial Eukaryotic Type Serine- Threonine Protein Kinases: Tools for Targeted Anti-Infective Drug Design // Current Topics in Medicinal Chemistry, 2011, 11, 1352-1369]. До недавнего времени тестирование библиотек потенциальных противотуберкулезных средств производилось микробиологическим путем [Shmalenyuk E.R., Chernousova L.N., Karpenko I.L., Kochetkov S.N., Smirnova T.G., Andreevskaya S.N., Chizhov A.O., Efremenkova O.V., Alexandrova L.A. Inhibition of Mycobacterium tuberculosis strains H37Rv and MDR MS-115 by a new set of C5 modified pyrimidine nucleosides. // Bioorg Med Chem. 2013 Sep 1;21(17):4874-84. doi: 10.1016/j.bmc.2013.07.003. Epub 2013 Jul 11; Siddiqi S.H., Rusch-Gerdes S. Руководство по работе с системой Bactec MGIT 960, 2006] или непосредственным воздействием вещества на биомишень in vitro. Эти методы тестирования не достаточно эффективны при первичном тестировании химических библиотек по скорости и стоимости.
Ранее разработана тест-система на основе штамма Streptomyces lividans ТК24(66) для прескрининга ингибиторов СТПК [Danilenko V.N., Simonov A.Y., Lakatosh S.A., Kubbutat M.H., Totzke F., SchAchtele C., Elizarov S.M., Bekker O.B., Printsevskaya S.S., Luzikov Y.N., Reznikova M.I., Shtil A.A., Preobrazhenskaya M.N. Search for inhibitors of bacterial and human protein kinases among derivatives of diazepines [1,4] annelated with maleimide and indole cycles. // J Med Chem. 2008 Dec 25;51(24):7731-6]. Ключевым элементом разработанной тест-системы является фермент аминогликозид-3′-фосфотрансфераза тип VIII (AphVIII) штамма Streptomyces rimosus АТСС 10970, обеспечивающий устойчивость актинобактерий к аминогликозидным антибиотикам. Ранее нами был изолирован и секвенирован ген aphVIII и проведено клонирование его в штамм Е. coli BL21(DE3) в составе экспрессионного вектора pET16b под контроль транскрипционного и трансляционного сигналов бактериофага Т7 в рамке считывания с ATG экспрессионного участка [Сизова И.А., Хегеманн П., Фурманн М., Даниленко В.Н. Аминогликозид-3′-фосфотрансфераза VIII из Streptomyces rimosus АТСС 10970: сравнение с аминогликозид-3′-фосфотрансферазами из штаммов-продуцентов аминогликозидов и с эукариотическими протеинкиназами //Молекулярная биология, 2002, т. 36, №1, с. 27-36]. Важной особенностью APHVIII S. rimosus АТСС 10970 является зависимость активности фермента от уровня его фосфорилирования серин-треониновыми протеинкиназами (СТПК) [Елизаров С.М., Сергиенко О.В., Сизова И.А., Даниленко В.Н. Зависимость активности аминогликозид-3′-фосфотрансферазы типа VIII от серин-треонин-протеинкиназ у Streptomyces rimosus // Молекулярная биология, 2005, т. 39, №2, с. 1-19]. Установлена кристаллическая 3D структура белка APHVIII, депонированная в банк данных www.rcsb.org с кодом 4Н05. Методами направленного мутагенеза установлено, что ключевым для модуляции активности APHVIII является фосфорилирование по остатку Ser-146 в активационной петле фермента. Сравнительный анализ канамицинкиназной активности нефосфорилированной и фосфорилированной форм исходного и мутантных вариантов белка APHVIII показал, что фосфорилированная форма APHVIII в 6-7 активнее нефосфорилированной [Елизаров С.М., Алексеева М.Г., Новиков Ф.Н., Чилов Г.Г., Маслов Д.А., Даниленко В.Н. Идентификация сайтов фосфорилирования аминогликозидфосфотрансферазы VIII Streptomyces rimosus // Биохимия, 2012, т. 77, вып. 11, с. 1504-1512].
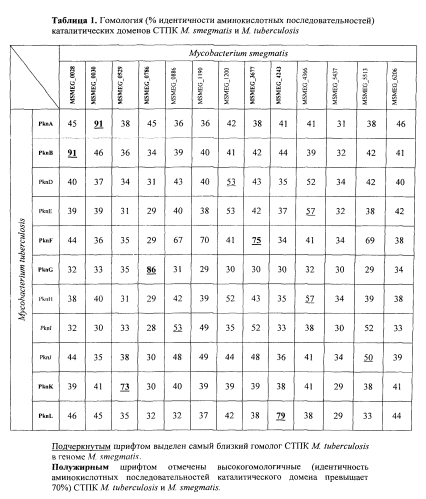
Геном штамма М. smegmalis mc2 155 содержит 13 генов серин-треониновых протеинкиназ (СТПК) эукариотического типа, 6 из которых (PknA, PknB, PknF, PknK, PknG, PknL) являются высокогомологичными СТПК М. tuberculosis (процент идентичности аминокислотной последовательности каталитического домена больше 70%) (табл. 1). PknA и PknB необходимы для синтеза клеточной стенки и клеточного деления [Thakur М., Chakraborti Р.К. Ability of PknA, a mycobacterial eukaryotic-type serine/threonine kinase, to transphosphorylate MurD, a ligase involved in the process of peptidoglycan biosynthesis // Biochem J 2008; 415:27-33; Fernandez P., Saint-Joanis В., Barilone N., Jackson M., Gicquel В., Cole ST, et al. The Ser/Thr protein kinase PknB is essential for sustaining mycobacterial growth // J Bacteriol 2006; 188:7778-84; Gee C.L., Papavinasasundaram K.G., Blair S.R., Baer C.E., Falick A.M., King D.S., Griffin J.E., Venghatakrishnan H., Zukauskas A., Wei J.R., Dhiman R.K., Crick D.C., Rubin E.J., Sassetti С.М., Alber T. A phosphorylated pseudokinase complex controls cell wall synthesis in mycobacteria. // Sci Signal. 2012. Vol. 5, №208. P. ra71 p.], PknF также вовлечена в синтез клеточной стенки и формирование септы и транспорте глюкозы [Deol P., Vohra R., Saini А.К., Singh A., Chandra Н., Chopra P., Das Т.К., Tyagi А.К., Singh Y. Role of Mycobacterium tuberculosis Ser/Thr kinase PknF: implications in glucose transport and cell division // J Bacteriol 2005; 187:3415-20], PknK регулирует скорость роста микобактерий, сдерживая ее [Malhotra V., Arteaga-Cortés L.T., Clay G., Clark-Curtiss I.E. Mycobacterium tuberculosis protein kinase К confers survival advantage during early infection in mice and regulates growth in culture and during persistent infection: implications for immune modulation // Microbiology 2010; 156:2829-41], неэкспрессирующаяся в M. smegmatis PknG способствует выживанию M. tuberculosis в макрофагах [Walburger A., Koul A., Ferrari G., Nguyen L., Prescianotto-Baschong C., Huygen K., Klebl В., Thompson C., Bacher G., Pieters J. Protein kinase G from pathogenic mycobacteria promotes survival within macrophages. // Science. 2004. Vol. 304, №5678. Pp. 1800-18045 pp.], а субстратом для PknL в M. tuberculosis является ДНК-связывающий белок, кодируемый геном Rv2l75c [Cohen-Gonsaud М., Barthe P., Canova M.J., Stagier-Simon C., Kremer L., Roumestand C., Molle V. The Mycobacterium tuberculosis Ser/Thr kinase substrate Rv2175c is a DNA-binding protein regulated by phosphorylation // J Biol Chem 2009; 284:19290-300].
Наиболее близкой к предлагаемой тест-системе является система Streptomyces lividans aphVIII+ [Беккер О.Б., Елизаров С.М., Алексеева М.Т., Любимова И.К., Даниленко В.Н. Ca2+ - зависимая модуляция устойчивости к антибиотикам у Streptomyces lividans 66 и Streptomyces coelicolor А3(2) // Микробиология, 2008, т. 77, №5, с. 630-638; Danilenko V.N., Simonov A.Y., Lakatosh S.A., Kubbutat M.H., Totzke F., SchAchtele C., Elizarov S.M., Bekker O.B., Printsevskaya S.S., Luzikov Y.N., Reznikova M.I., Shtil A.A., Preobrazhenskaya M.N. Search for inhibitors of bacterial and human protein kinases among derivatives of diazepines [1,4] annelated with maleimide and indole cycles. // J Med Chem. 2008 Dec 25;51(24):7731-6]. Сконструированная и описанная ранее тест-система предназначается для отбора ингибиторов СТПК стрептомицетов, в то время как предлагаемая - для скрининга ингибиторов микобактериальных СТПК, потенциальных противотуберкулезных препаратов, действующих в том числе на штаммы с фенотипом множественной и широкой лекарственной устойчивости.
Раскрытие изобретения
Задачей изобретения является создание новой тест-системы М. smegmatis aphVIII+ для скрининга ингибиторов микобактериальных серин-треониновых протеинкиназ.
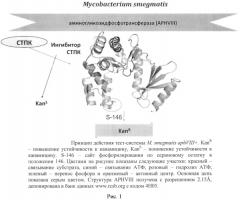
Принцип действия тест-системы: фосфорилирование APHVIII по сайту Serl46 посредством серин-треониновых протеинкиназ приводит к устойчивости штамма М. smegmatis aphVIII+ к канамицину; добавление ингибитора препятствует фосфорилированию APHVIII и снижает устойчивость к канамицину (рис. 1).
Практической применимостью новой тест-системы М. smegmatis aphVIII+ является селективный скрининг ингибиторов микобактериальных протеинкиназ, в результате которого могут быть отобраны вещества, являющиеся потенциальными противотуберкулезными лекарственными препаратами.
Конструирование тест-системы М. smegmatis aphVIII+.
Для конструирования тест-системы проведено клонирование гена аминогликозидфосфотрансферезы aphVIII в составе челночного экспрессионного вектора для гетерологической экспрессии в клетках штамма М. smegmatis mc2 155, спонтанного мутанта дикого М. smegmatis АТСС 607 с повышенной частотой трансформации.
В качестве вектора для гетерологической экспрессии генов в клетках М. smegmatis mc2 155 использовали челночный вектор pMIND [Blokpoel М.С., Murphy H.N., O′Toole R., Wiles S., Runn E.S., Stewart G.R., Young D.B., Robertson B.D. Tetracycline-inducible gene regulation in mycobacteria // Nucleic Acids Research. 2005. Vol. 33, №2. Pp. e22-e221 pp.], содержащий точки начала репликации как в Е. cali, так и в М. smegmatis. Ввиду того, что вектор pMIND содержал последовательности генов устойчивости и к гигромицину, и к канамицину, он был модифицирован с целью делетирования по сайтам эндонуклеаз рестрикции BstBI и Tth111I гена устойчивости к канамицину. Полученная плазмида обозначена pMINDKm-.
Ген aphVIII из штамма S. rimosus АТСС 10970 был ранее клонирован в экспрессионный вектор pET16b по сайтам эндонуклеаз рестрикции XhoI и BamHI. Полученная плазмида обозначена pET16b:aphVIII. Последовательность гена aphVIII депонирована в банке генов NCBI/GenBank (код доступа AAG11411) [Сизова И.А., Хегеманн П., Фурманн М., Даниленко В.Н. Аминогликозид-3′-фосфотрансфераза VIII из Streptomyces rimosus: сравнение с аминогликозид-3′-фосфотрансферазами из штаммов-продуцентов аминогликозидов и с эукариотическими протеинкиназами // Молекулярная биология, 2002, т. 36, №1, с. 27-36].
С целью получения экспрессионной конструкции ген aphVIII был клонирован в плазмиду pMINDKm- под индуцируемым тетрациклиновым промотором по сайтам эндонуклеаз рестрикции BatHI и SpeI. Последовательность сайта посадки рибосомы (RBS) была внесена в конструкцию праймера для амплификации. Полученная плазмида обозначена pMINDKm-:aphVIII. Схема получения целевой конструкции представлена на рис. 2.
Таким образом:
1) Сконструированная бактериальная тест-система М. smegmatis aphVIII+ включает штамм М. smegmatis mc2 155, содержащий плазмиду pMINDKm-:aphVIII с экспрессируемым геном aphVIII, продуктом которого является белок аминогликозидфосфотрансфераза, фосфорилирование которой одной или несколькими серин-треониновыми протеинкиназами микобактерии М. smegmatis приводит к повышенной устойчивости к антибиотику канамицину (рис. 1).
2) Назначением разработанной тест-системы М. smegmatis aphVIII+ является селективный скрининг ингибиторов микобактериальных серин-треониновых протеинкиназ - потенциальных противотуберкулезных лекарственных препаратов.
3) Преимуществом данной тест-системы является возможность одновременного тестирования различных химических соединений как на антимикобактериальную активность, так и на их способность специфически ингибировать серин-треониновые протеинкиназы.
Краткое описание чертежей
Рис. 1. Принцип действия тест-системы М. smegmatis aphVIII+. KanR - повышение устойчивости к канамицину, KanS - понижение устойчивости к канамицину. S-146 - сайт фосфорилирования по сериновому остатку в положении 146. Структура APHVIII получена с разрешением 2.15 Å, депонирована в банк данных www.rcsb.org с кодом 4Н05.
Рис. 2. Схема конструирования целевой генетической конструкции. Отмечены точки начала репликации в Е. coli (OriE) и в М. smegmatis (OriM), ген устойчивости к канамицину (KanR) и его делетированный вариант (dKanR), ген устойчивости к гигромицину (HgR), ген тетрациклинового репрессора (tetR), содержащий промотор и оператор для клонируемого гена, сайты рестрикции для клонирования BamHI и SpeI, а также сайты рестрикции, по которым осуществлялась делеция гена устойчивости к канамицину BstBI и Tth111I.
Рис. 3. Валидация тест-системы М. smegmatis aphVIII+ со стандартным ингибитором серин-треониновых протеинкиназ BisI и его неактивным производным BisV.
Рис. 4. Схема конечной генетической конструкции. Конструкция содержит ген aphVIII из S. rimosus АТСС 10970, клонированный по сайтам эндонуклеаз рестрикции BatHI и SpeI. На схеме представлены точки начала репликации (oriE и oriM), ген устойчивости к гигромицину (hygR), делетированный ген устойчивости к канамицину (ΔkanR), и ген тетрациклинового репрессора (tetR).
Осуществление изобретения
Для делеции гена устойчивости к канамицину KanR из плазмиды pMIND 1 мкг плазмидной ДНК инкубировали с 5 ед. Bsp 1191 (BstBI) и 20 ед. PsyI (Tth111I) в 1×Tango™ буфере фирмы «Fermentas» (Литва) в течение 2 ч при 37°C, затем инактивировали ферменты нагреванием до 80°C в течение 20 мин. После этого проводили электрофорез смеси в 1% агарозном геле, после чего вырезали полосу длиной 6200 п.н. и очищали ДНК набором GeneJET Gel Extraction Kit фирмы «Fermentas» (Литва). Очищенный фрагмент обрабатывали 5 ед. фрагмента Кленова фирмы «Fermentas» (Литва) в соответствии с протоколом производителя для получения «тупых» концов. После этого ДНК очищали набором GeneJET PCR Purification Kit фирмы «Fermentas» (Литва), обрабатывали ДНК-лигазой фага Т4 (30 ед. /мкл) фирмы «Fermentas» (Литва) из расчета 30 ед. фермента на 1 мкг ДНК в 1×лигазном буфере с добавлением 5% полиэтиленгликоля (PEG) в течение 1 ч при 22°C, после чего инактивировали нагреванием до 65°C в течение 10 мин. Полученной лигазной смесью трансформировали компетентные клетки штамма Е. coli DH5a, полученные хлоркальциевым методом. Трансформированные клетки подращивали в течение 1,5 ч и высевали на агаризованную среду LB, содержащую гигромицин (250 мкг/мл). Выросшие через 18 ч при 37°C колонии скалывали в 10 мл жидкой среды LB, содержащей гигромицин (250 мкг/мл), выращивали в течение ночи, выделяли плазмиду набором GeneJET Plasmid miniprep Kit фирмы «Fermentas» (Литва) и секвенировали по Сэнгеру с использованием праймеров Seq-Km-for и Seq-Km-rev (все праймеры приведены в таблице 2) для подтверждения делеции.
Ген aphVIII амплифицировали с плазмиды pET16b:aphVIII с использованием праймеров APH-pMIND-for (содержит сайт рестрикции BamHI, сайт посадки рибосомы и участок отжига на ген aphVIII) и APH-pMIND-rev (содержит участок отжига на ген aphVIII и сайт рестрикции SpeI). Состав ПЦР-смеси рассчитывали, исходя из рекомендаций производителя к набору High Fidelity PCR Enzyme Mix фирмы «Fermentas» (Литва). Параметры реакции ПЦР: первичная денатурация ДНК при 95°C в течение 5 мин; затем 30 циклов амплификации: 95°C в течение 30 с (денатурация), при 67°C в течение 30 с (отжиг олигонуклеотидов), 72°C в течение 1 мин (достройка (элонгация) цепи); финальная элонгация фрагментов при 72°C в течение 10 мин. Полученные в результате амплификации фрагменты ДНК препаративно выделяли из агарозного геля набором GeneJET Gel Extraction Kit фирмы «Fermentas» (Литва).
Для клонирования гена aphVIII 1 мкг плазмидной ДНК pMINDKm-инкубировали с 1 мкл FastDigest®BamHI и 1 мкл FastDigest®SpeI ферментов в 1×FastDigest Green буфере фирмы «Fermentas» (Литва) в течение 15 мин при 37°C. Параллельно 500 нг амплифицированного гена aphVIII инкубировали с 1,5 мкл FastDigest®BamHI и 1,5 мкл FastDigest®SpeI ферментов в тех же условиях. Рестрицированные фрагменты препаративно выделяли из агарозного геля набором GeneJET Gel Extraction Kit фирмы «Fermentas» (Литва).
Полученные фрагменты в молярном соотношении 1:5 (вектор:вставка) обрабатывали ДНК-лигазой фага Т4 (30 ед. /мкл) фирмы «Fermentas» (Литва) из расчета 30 ед. фермента на 1 мкг ДНК в 1×лигазном буфере. Инкубацию проводили в течение 1 ч при 22°C. Полученной лигазной смесью трансформировали компетентные клетки штамма E.coli DH5a, полученные хлоркальциевым методом. Трансформированные клетки подращивали в течение 1,5 ч и высевали на агаризованную среду LB, содержащую гигромицин (250 мкг/мл).
Скрининг колоний, выросших через 18 ч при 37°C, проводился методом ПЦР-скрининга с использованием набора «Амплификация» фирмы «Dialat Ltd» (Россия) на приборе «Терцик» («ДНК-технология»). Для этого выросшие колонии скалывают и ресуспендируют в 30 мкл стерильной воды. Готовят смесь для ПЦР (на 100 мкл): 10 мкл 10×ПЦР буфера; 10 мкл смеси 2,5 мМ EdNTPs; 5 мкл DMSO; 4 мкл 50 мМ MgCl2. олигонуклеотиды на ген aphVIII - APH-pMIND-for и APH-pMIND-rev в количестве 20 пмоль; 0,8 мкл фермента Taq - полимеразы. Смесь разливают аликвотами 22 мкл в микропробирки для ПЦР и добавляют по 3 мкл полученной суспензии клеток. Параметры реакции ПЦР соответствуют параметрам для амплификации гена aphVIII. Результаты амплификации учитывают путем анализа исследуемых образцов с помощью электрофореза в 1% агарозном геле. Размер амплифицированных фрагментов определяют с использованием маркера λ DNA/EcoRI + HindIII («Fermentas»). Положительными являются клоны, дающие в результате ПЦР фрагмент длиной 820 п.н. (длина клонируемого гена). Из отобранных клонов выделяют плазмидные ДНК, которые секвенируют для проверки на возможные ошибки при амплификации с использованием праймеров Seq-pMIND-for и Seq-pMIND-rev. В результате проведенного клонирования получена плазмида pMINDKm-:aphVIII.
Плазмидой pMINDKm-:aphVIII, а также контрольной плазмидой pMINDKm- трансформируют методом электропорации электрокомпетентные клетки М. smegmatis mc2 155 [Goude R., Parish Т. Electroporation of Mycobacteria // Mycobacteria Protocols: Second Edition. Totowa, NJ: Humana Press, 2010. Vol. 465, Chapter 13. Pp. 203-21513 pp.], после чего клетки высевают на триптон-соевый агар фирмы «Himedia» (Индия), содержащий гигромицин (50 мкг/мл) и инкубируют при 37°C до появления одиночных колоний (3-5 суток).
Для определения активности ингибиторов используют метод бумажных дисков. Методика заключается в определении величины зоны подавления роста штамма М. smegmatis aphVIII+, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих антибиотик (канамицин) или антибиотик в сочетании с ингибиторами протеинкиназ. Тестирование исследуемых веществ осуществляют в субингибирующих концентрациях. Концентрацию канамицина подбирают экспериментально.
Бактерии, выращенные на триптон-соевом агаре с гигромицином, засевают в жидкую среду Lemco-Tw (5 г/л бакто-пептона (Becton Dickinson, США), 5 г/л порошка Lab-Lemco (Oxoid, Великобритания), 5 г/л NaCl, 0,05% Tween-80), содержащую 50 мкг/мл гигромицина и 20 нг/мл тетрациклина (индуктор транскрипции) и выращивают в термостатируемом в шейкере при 37°C при 100 об/мин до оптической плотности OD600=0,3-0,45 (~108 клеток в 1 мл). Затем бактериальную суспензию смешивают с расплавленным триптон-соевым агаром и водой в соотношении 1:5:4 (v/v) и заливают полученной смесью чашки Петри с триптон-соевым агаром. После застывания на поверхность агара накладывают бумажные диски, содержащие антибиотик канамицин или канамицин и ингибитор протеинкиназ. Культуру инкубируют в течение 40 ч при - 37°C.
Примеры валидации и использования тест-системы М. smegmatis aphVIII+ по настоящему изобретению.
Пример 1. Валидация тест-системы М. smegmatis aphVIII+.
Штамм М. smegmatis aphVIII+ был проверен на устойчивость к аминогликозидному антибиотику канамицину. Для этого колонии М. smegmatis aphVIII+ высевались репликатором на питательную среду, содержащую гигромицин в концентрации 50 мкг/мл, тетрациклин 20 нг/мл и различные концентрации канамицина. Штамм М. smegmatis aphVIII+ был устойчив к канамицину в максимальной концентрации 200 мкг/мл, что свидетельствовало об экспрессии гена aphVIII и ферментативном действии белка AphVIII.
Для валидации тест-системы были использованы ингибитор серин-треониновых протеинкиназ BisI (bisindolylmaleimide-I) (Sigma) [Martiny-Baron G., Kazanietz M.G., Mischak H., Blumberg P.M., Kochs G., Hug H., Marmé D., Schächtele C. Selective inhibition of protein kinase С isozymes by the indolocarbazole GO 6976 // J Biol Chem. 1993 May 5;268(13):9194-7.], его неактивный гомолог BisV, селективный ингибитор Pk25 (PknA) S. coelicolor LCTA-1276 [Патент №2388759 РФ от 10.05.2010. Даниленко В.Н., Лакатош С.А., Преображенская М.Н., Штиль А.А. Лекарственное средство на основе производных 4-замещенных-3-(3-диалкиламинометил-индол-1-ил)малеимидов.], селективный ингибитор PknB М. tuberculosis (MSMEG_0028 у М. smegmatis) - митоксантрон [Wehenkel A., Fernandez P., Bellinzoni М., Catherinot V., Barilone N., Labesse G., Jackson M., Alzari P.M. The structure of PknB in complex with mitoxantrone, an ATP-competitive inhibitor, suggests a mode of protein kinase regulation in mycobacteria. // FEES Lett. 2006. Vol. 580, №13. Pp. 3018-30225 pp.]. Вещества вносили в субингибирующих концентрациях, которые были следующими: BisI - 500 нмоль/диск, BisV - 10 нмоль/диск, LCTA-1276-200 нмоль/диск, митоксантрон 5 нмоль/диск, канамицин 200 мкг/диск.
Добавление ингибиторов BisI и LCTA-1276 приводило к увеличению зоны подавления роста вокруг диска с канамицином, в то время, как BisV и митоксантрон такого эффекта не проявляли (рис. 3, табл. 3). Активность BisI и ее отсутствие у BisV свидетельствуют о том, что сконструированная система избирательно отбирает именно активные ингибиторы протеинкиназ. Действие LCTA-1276 доказывает, что тест-система отбирает ингибиторы киназ MSMEG_0030 (PknA М. tuberculosis) и MSMEG_5513, имеющие сигнатуры аминокислот АТФ-связывающих карманов, относящиеся к одной группе с протеинкиназой Pk25 S. coelicolor, согласно классификации [Zakharevich N.V., Osolodkin D.I., Artamonova I.I., Palyulin V.A., Zefirov N.S., Danilenko V.N. Signatures of the ATP-binding pocket as a basis for structural classification of the serine/threonine protein kinases of gram-positive bacteria. // Proteins. 2012. Vol. 80, №5. Pp. 1363-137614 pp.], а следовательно подверженные действию ингибиторов, активных в отношении Pk25. Отсутствие активности митоксантрона в тест-системе свидетельствует о том, что ингибиторы киназы MSMEG_0028 (PknB М. tuberculosis) в тест-системе не отбираются, что также свидетельствует о селективности тест-системы.
Полученные данные свидетельствуют о том, что сконструированная тест-система М. smegmatis aph VIII+ функционирует и может быть использована для селективного отбора ингибиторов микобактериальных протеинкиназ, в частности протеинкиназы PknA М. tuberculosis.
Пример 2. Скрининг ингибиторов микобактериальных СТПК среди соединений класса индолилмалеимидов в системе М. smegmatis aphVIII+.
В валидированной тест-системе М. smegmatis aphVIII+ проводился скрининг низкомолекулярных веществ класса индолилмалеимидов, синтезированных в НИИНА им. Г.Ф. Гаузе РАМН, г. Москва [Симонов А.Ю., Лакатош С.А., Лузиков Ю.Н., Резникова М.И., Сусова О.Ю., Штиль А.А., Елизаров С.М., Даниленко В.Н., Преображенская М.Н. Синтез 4-замещенных 3-[3-(диалкиламинометил)индол-1-ил]малеинимидов и изучение их способности ингибировать протеинкиназу C-α, предотвращать развитие множественной лекарственной устойчивости опухолевых клеток и цитотоксичности // Известия Академии наук. Серия химическая, 2008, №9, с. 1977-1985], и показавших активность в качестве ингибиторов СТПК в других тест-системах, созданных в лаборатории [Беккер О.Б., Алексеева М.Г., Осолодкин Д.П., Палюлин В.А., Елизаров С.М., Зефиров Н.С., Даниленко В.Н. Новая тест-система для скрининга ингибиторов серин-треониновых протеинкиназ: конструкт Escherichia coli aphVIII/pk25 // Acta Naturae (русскоязычная версия), 2010, т. 2, №3, с. 126-139]. Исследования проводили в 3-5 независимых повторах. Для выявления наиболее активного из исследуемых веществ, проводился анализ действия отобранных соединений LCTA-1389 и LCTA-1552. Вещества тестировались в субингибирующих концентрациях, составляющих 200 нмоль/диск. В качестве контроля для сравнения использовалось соединение LCTA-1276.
Все вещества при совместном действии с канамицином показывали увеличение зоны ингибирования, при этом вещества показали примерно равный уровень активности (табл. 4).
Таким образом, отобраны соединения класса индолилмалеимидов, являющиеся активными ингибиторами микобактериальных СТПК на уровне стандартного ингибитора LCTA-1276.
Пример 3. Скрининг ингибиторов микобактериальных СТПК среди триазолотетразинов в системе М. smegmatis aphVIII+.
В валидированной тест-системе М. smegmatis aphVIII+ проводился скрининг низкомолекулярных веществ класса триазолотетразинов, синтезированных в ИОС УрО РАН, г.Екатеринбург, и показавших высокую антимикобактериальную активность [Патент №2462466 РФ от 27.09.2012. Беккер О.Б., Даниленко В.Н., Ишметова Р.И., Маслов Д.А., Русинов Г.Л., Толщина С.Г., Чарушин В.Н. Замещенные азоло[1,2,4,5]тетразины - ингибиторы актинобактериальных серин-треониновых протеинкиназ]. Соединения тестировали в 3-5 независимых повторах. Для выявления наиболее активного из исследуемых веществ проводился анализ действия соединений TSV-395, TSV-402, TSV-409 и TSVal30. Вещества тестировались в субингибирующих концентрациях.
Все вещества при совместном действии с канамицином показывали увеличение зоны ингибирования, при этом максимально активным в наименьшей концентрации показало себя соединение TSV-402 (табл. 5).
Таким образом, из веществ класса триазолотетразинов отобраны активные ингибиторы микобактериальных СТПК, а также вещество TSV-402, проявляющее антимикобактериальную активность в низкой концентрации и потенциально являющееся «хит» соединением для дальнейшего продвижения.
| Таблица 3 | |||||
| Зависимость уровня устойчивости к канамицину М. smegmatis aphVIII+ от действия стандартных ингибиторов серин-треониновых протеинкиназ | |||||
| Обозначение | Молекулярная формула | Молекулярная масса | Количество | Зона ингибирования, мм | |
| Km, 200 мкг/диск | Km+ исследуемое вещество | ||||
| BisI | C25H24N4O2 | 412,48 | 500 нмоль/диск | 7,5±0,75 | 10,0±0,5 |
| BisV | C21H15N3O2 | 341,36 | 10 нмоль/диск | 7,5±0,75 | 7,5±0,5 |
| LCTA-1276 | C26H30N4O2 | 430 | 200 нмоль/диск | 7,5±0,75 | 11,0±0,7 |
| Mitoxantrone | C22H28N4O6 | 444,48 | 5 нмоль/диск | 7,5±0,75 | 7,5±0,5 |
| Таблица 4 | |||||
| Зависимость уровня устойчивости к канамицину М. smegmatis aphVIII+ от действия соединений класса индолилмалеимидов | |||||
| Обозначение | Молекулярная формула | Молекулярная масса | Количество | Зона ингибирования, мм | |
| Km, 200 мкг/диск | Km+ исследуемое вещество | ||||
| LCTA-1389 | C23H19N5SO2 | 429,00 | 200 нмоль/диск | 7,5±0,75 | 10,8±0,7 |
| LCTA-1552 | C25H25CIN4O2 | 448,94 | 200 нмоль/диск | 7,5±0,75 | 10,8±0,3 |
| LCTA-1276 | C26H30N4O2 | 430,00 | 200 нмоль/диск | 7,5±0,75 | 11,0±0,7 |
| Таблица 5 | |||||
| Зависимость уровня устойчивости к канамицину М. smegmatis aph VIII+ от действия соединений класса триазолотетразинов | |||||
| Обозначение | Молекулярная формула ингибитора | Молекулярная масса | Количество | Зона ингибирования, мм | |
| Km, 200 м кг/диск | Km+ исследуемое вещество | ||||
| TSVal30 | C10H11N7S | 261,00 | 75 нмоль/диск | 7,5±0,75 | 13,5±1,0 |
| TSV-409 | C7H5N7 | 187,16 | 100 нмоль/диск | 7,5±0,75 | 11,5±0,5 |
| TSV-395 | C12H15N7S | 289.36 | 100 нмоль/диск | 7,5±0,75 | 11,8±1,3 |
| TSV-402 | C15H13N7S | 323.38 | 15 нмоль/диск | 7,5±0,75 | 10,0±1,5 |
Тест-система М. smegmatis aphVIII+ для тестирования различных химических соединений на их способность специфически ингибировать серин-треониновые протеинкиназы М. smegmatis, представляющая собой генетическую конструкцию, представленную на рис. 4, сконструированную на основе модифицированного челночного вектора pMIND с делетированным геном устойчивости к канамицину (pMINDKm-), включающую ген аминогликозидфосфотрансферазы aphVIII из штамма Streptomyces rimosus АТСС 10970, клонированный по сайтам эндонуклеаз рестрикции BamHI и SpeI, и внедренную методом трансформации в штамм М. smegmatis mc2 155.