Способ выделения фибробластов, способ создания биотрансплантата на их основе (варианты) и способ регенерации тканей человека (варианты)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть применено для регенерации тканей мезодермального происхождения с использованием фибробластов взрослого организма. Производят забор тканей кожи, полученный биоптат промывают в физрастворе с альбумином человека, далее обрабатывают раствором диспазы в культуральной среде ДМЕМ-LG с содержанием глюкозы 1 г/л до отделения эпидермиса от дермы. Полученную дерму промывают ДМЕМ-LG и механически измельчают, фрагменты дермы распределяют по чашке Петри и заливают ДМЕМ-LG с эмбриональной телячьей сывороткой (ЭТС), раствором заменимых аминокислот (MEM NEAA) и антибиотиками. Далее культивируют клетки до заполнения фибробластами всей поверхности дна чашки, после снимают их ферментом, отмывают, фильтруют и осаждают центрифугированием. Клеточный осадок суспендируют в ростовой среде и культивируют во флаконах в CO2-инкубаторе до достижения конфлуэнтного монослоя, после клетки снимают ферментом, осаждают и пассируют до необходимого терапевтического количества. Полученные фибробласты используют для изготовления трансплантатов для регенерации тканей человека. Изобретение позволяет уменьшить объем биоптата и получить гомогенную культуру фибробластов с высокой степенью адаптации и активности. 5 н. и 24 з.п. ф-лы, 8 ил., 1 табл., 7 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области биомедицины, в частности к способам выделения и культивирования аутологичных/аллогенных фибробластов или фибробластоподобных клеток, способам получения биотрансплантатов и их применению для регенерации тканей человека. Способы могут найти применение в регенеративной медицине, косметологии, пластической хирургии, медицине катастроф, комбустиологии и других областях медицины.
Уровень техники
В последние годы активно развиваются новые перспективные направления биомедицины - клеточная терапия и тканевая инженерия, которые с успехом применяются в репарационной, или регенеративной, медицине. Известно, что в организме восстановление поврежденных тканей происходит за счет региональных стволовых/прогениторных клеток. Однако с возрастом или из-за воздействия неблагоприятных факторов количество этих клеток уменьшается, а также нарушаются механизмы регуляции их активности (Rao M.S., Mattson М.Р. Stem cell and aging: expanding the possibilities // Mech. Ageing Dev. 2001. Vol. 122. P. 713-734).
Благодаря активным разработкам и внедрению новых клеточных технологий становится возможным восстановление/замена поврежденных тканей и органов с помощью выделенных и выращенных до терапевтического количества клеток. В последние годы выделены и охарактеризованы практически все типы клеток человеческого организма. Разработаны технологии, позволяющие использовать выделенные и размноженные в условиях in vitro клетки в медицине для восстановления поврежденных тканей и органов.
В этой связи применение региональных стволовых/прогениторных клеток взрослого организма представляется очень актуальным направлением биомедицины. На сегодняшний день наиболее изученными и перспективными для применения во многих областях медицины, в том числе регенеративной медицине, являются фибробласты и мезенхимные мультипотентные стромальные клетки (ММСК).
Впервые мезенхимные мультипотентные стромальные клетки были получены из костного мозга по их способности прикрепляться к поверхности культуральной посуды (Fridenshtein A.J., Deriglazova U.F., Kulagina N.N. et al. Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method // Exp. Hematol. 1974. Vol. 2. P. 83-92). Мультипотентные мезенхимные стволовые клетки отличаются относительной простотой выделения и культивирования, способностью пролиферировать в течение длительного времени in vitro и широким спектром дифференцировки не только в клетки тканей мезенхимного происхождения, но и в клетки тканей других зародышевых листков.
Со временем были отработаны методики выделения ММСК из других тканей организма (тимус, дерма, жировая ткань, плацента, фетальные ткани и др.), наиболее легкодоступным источником из них является жировая ткань. Доказано, что введенные внутривенно ММСК мигрируют в проблемную зону, где в дальнейшем принимают активное участие в репарации поврежденной ткани.
Состояние кожи, прежде всего, определяется состоянием дермы. Фибробласты - основные клеточные элементы дермы, главной функцией которых является участие в метаболизме межклеточного вещества. В процессе жизнедеятельности фибробласты кожи синтезируют и выделяют большое количество биологически активных веществ: различные факторы роста, белки (коллаген, эластин), протеогликаны (преимущественно гиалуроновую кислоту), гликопротеины и т.д., которые обеспечивают коже упругость, эластичность, поддерживают водно-солевой баланс, способствуют активным обменным процессам.
С возрастом количество фибробластов в дерме уменьшается, а также снижается их активность, в результате чего кожа теряет упругость и эластичность, появляются морщины.
Старение кожи - сложный процесс, многие аспекты которого до конца не изучены. Существует мнение, что одной из основных причин старения кожи является нарушение способности фибробластов кожи к делению и снижение уровня их синтетической активности. Следовательно, воздействуя на эти процессы, можно улучшить состояние кожи.
Для коррекции возрастных изменений кожи в настоящее время используются самые разнообразные подходы - пилинг, шлифовка, лифтинг, введение в проблемные зоны токсина ботулизма. Широко используются мезопрепараты (мезотерапия), которые в своем составе содержат компоненты внеклеточного матрикса и соединительной ткани, синтезируемые фибробластами [Hruza GJ. Arch. Facial Plast. Surg. Vol 6, Nov/Dec 2004]. Как правило, действие мезопрепаратов направлено на стимуляцию собственных клеток кожи.
Однако можно решить проблему и более кардинальным путем - увеличить количество фибробластов в коже с помощью их пересадки в проблемные зоны.
На сегодняшний день фибробласты человека полностью охарактеризованы, подтверждена их биобезопасность и клиническая эффективность применения для коррекции возрастных изменений кожи. Показано, что клетки, выращенные in vitro, способны при культивировании в соответствующих условиях сохранять свои физиологические способности и при введении в проблемную зону восстанавливают поврежденные ткани.
Путем гистологических исследований биоптатов кожи показано, что введенные в кожу аутофибробласты сохраняются в течение не менее 12 месяцев и синтезируют все компоненты межклеточного матрикса [Зорин В.П. и др. КТТИ. Том YII, №2, 2012].
На данный момент предлагаются различные способы регенерации тканей человека с использованием фибробластов или фибробластоподобных клеток, выделенных из различных источников взрослого организма. Основными задачами исследователей при разработке биотехнологических способов восстановления дефектных тканей являются выбор оптимального способа выделения и размножения клеток и адекватного носителя с целью их доставки в область повреждения и адаптации в дефектной области.
Известен способ выделения и культивирования аутологичных дермальных фибробластов, в котором клетки выделяют из биоптатов без ферментативной и механической обработки исходного материала, где биоптат помещается под покровное стекло и инкубируется на чашке Петри, покрытой синтетическим аналогом внеклеточного матрикса поли-D-лизином (RU 2382077, МПК C12N 5/071). Недостаток этого метода в том, что в результате получается гетерогенная популяция клеток, состоящая из фибробластов и эпителиоподобных клеток.
Предложен способ получения биотрансплантата для лечения косметических дефектов кожи, который заключаются в том, что кожу или липоаспират ферментативно дезагрегируют в 0,25% растворе трипсина (Патент РФ 2271818, А61К 35/36, C12N 5/08, А61Р 17/02; Патент РФ 2271819, А61К 35/36, C12N5/08, А61Р 17/14). Этот метод обеспечивает низкую эффективность дезагрегации ткани, что снижает количество первичного клеточного материала.
Существует способ выделения клеток, при котором биоптат кожи обрабатывается диспазой с целью отделения дермы от эпидермиса, а затем дерма механически измельчается и обрабатывается 0,01% раствором коллагеназы (Патент РФ 2335538, C12N 5/06, C12N 5/08). Известен способ получения биотрансплантата для коррекции дефектов мягких тканей, характеризующийся тем, что биоптат аутокожи обрабатывается 0,25%-ным раствором трипсина с целью отделения дермы от эпидермиса, а затем дерма механически измельчается и обрабатывается 0,1-0,5% раствором коллагеназы (Патент РФ 2281776, А61К 35/36). Данные методы позволяют получить более гомогенную популяцию клеток, но биологический материал подвергается дополнительной ферментативной обработке, что неизбежно сказывается на качестве и количестве получаемых клеток.
Известен способ получения биотрансплантата для коррекции дефектов мягких тканей, характеризующийся тем, что для получения фибробластов биоптат обрабатывают раствором коллагеназы II типа (Патент РФ 2428996, А61К 35/36, A61Q 19/08, C12N 5/073). Недостаток предложенного метода состоит в том, что биологический материал подвергается длительной (в течение 16-17 часов) ферментативной обработке.
Предлагаются различные носители, которые могут использоваться как самостоятельно, так и в составе биотрансплантата для введения в место дефекта.
Известен способ введения гиалуроновой кислоты внутрикожно (Патент РФ 2194512, 2001). Недостаток метода заключается в узкой направленности действия, т.к. используется только один из многих компонентов межклеточного матрикса, синтезируемых фибробластами.
Известен способ инъекционного введения в место дефекта биотрансплантанта в виде суспензии аутологичных или аллогенных фибробластов в соответствующем количестве с использованием в качестве носителя коллагена (Патентный документ США 2002048563; Патентный документ США 2002197241). Недостаток метода в том, что в качестве носителя используется только один компонент межклеточного матрикса.
Известны способы восстановления дефектов мягких тканей путем трансплантации аутологичных дермальных фибробластов в суспензии физиологического раствора (Патент РФ 2281776, МПК А61К 35/36 и Патент США 5660850, НКИ 424/426, МПК A61F 2/02). Недостатком метода считают низкую эффективность приживляемости клеток в месте инъекций.
Существует способ, где в качестве микроносителей для доставки клеток в область дефекта используют коллагеновые и/или желатиновые микросферы диаметром от 50 до 400 мкм, а предпочтительно от 100 до 300 мкм (Патент РФ 2004118437, А61К 35/36, C12N 5/08, А61Р 17/02). Недостаток метода в высокой стоимости и сложности воспроизведения.
Наиболее близкими к заявленным являются способы, в которых для выделения фибробластов из биоптата кожи дерму предварительно отделяют от эпидермиса с целью получения гомогенной культуры клеток (Патент РФ 2335538, C12N 5/06, C12N 5/08; Патент РФ 2281776, А61К 35/36), а в качестве носителя используются компоненты межклеточного матрикса, синтезируемые фибробластами (Патент РФ 2428996, А61К 35/36, A61Q 19/08, C12N 5/073).
Раскрытие изобретения
Поскольку фибробласты обладают выраженными потенциями к синтезу компонентов межклеточного матрикса: белков (коллаген, эластин), различных факторов роста, протеогликанов (преимущественно гиалуроновая кислота), гликопротеинов и др., при введении фибробластов с носителем в дерму кожи происходит активизация обменных процессов: восстанавливаются водно-солевой баланс и кровообращение, кожа приобретает упругость, эластичность, здоровый вид.
В связи с чем заявленное решение направлено на создание способа регенерации органов и тканей человека с использованием фибробластов или фибробластоподобных клеток, выделенных из различных тканей взрослого организма.
Общими техническими результатами заявленных изобретений являются: быстрая, эффективная и стабильная коррекция возрастных изменений кожи, которая достигается благодаря созданию биотрансплантата, основанного на использовании аутологичного или аллогенного клеточного материала, уменьшение количества первичного биоматериала за счет максимального сокращения ферментативной обработки ткани при выделении клеток и оптимизации способа его доставки в дефектную область, снижение себестоимости процедур, обеспечение легковоспроизводимости способа коррекции патологических, в том числе возрастных, изменений кожи, а также устранение вышеупомянутых недостатков, имеющихся у аналогов заявленных изобретений.
Технические результаты достигаются тем, что для выделения клеток фибробластов осуществляют следующие последовательные действия.
Производят забор тканей кожи. Полученный биоптат промывают в физиологическом растворе, дополненном человеческим альбумином. Промытый биоптат подвергают обработке раствором диспазы в культуральной среде Игла в модификации Дюльбеко с содержанием глюкозы 1 г/л (ДМЕМ-LG) до отделения пленки эпидермиса от дермы, полученную дерму промывают ДМЕМ-LG и механически измельчают. Полученные фрагменты дермы распределяют по чашке Петри и заливают ДМЕМ-LG, дополненной эмбриональной телячьей сывороткой (ЭТС), раствором заменимых аминокислот (MEM NEAA) и антибиотиками. Затем культивируют клетки, периодически сменяя культуральную среду. После того как фибробласты мигрируют из фрагментов и заполнят всю поверхность дна чашки, их снимают ферментом и отмывают культуральной средой от фермента, пропускают через фильтр и осаждают центрифугированием. Клеточный осадок суспендируют в ростовой среде и высевают на культуральные флаконы, помещают в CO2-инкубатор и после достижения конфлуэнтного монослоя клетки снимают ферментом, осаждают и пассируют до необходимого терапевтического количества.
Рекомендуемыми являются следующие параметры осуществления способа.
Производят забор (т.н. биопсия) небольшого количества тканей кожи (вполне достаточно объема не более 2 мм/1 мм/1 мм).
Полученный материал - биоптат промывают в физиологическом растворе (0,9% раствор NaCl) с добавлением человеческого альбумина, преимущественно в концентрации последнего 1%.
Промытый биоптат подвергают обработке раствором диспазы (преимущественно в концентрации 0,1%) в культуральной среде Игла в модификации Дюльбеко с содержанием глюкозы 1 г/л (далее - ДМЕМ-LG) до отделения пленки эпидермиса от дермы (пояснение: после обработки биоптата диспазой получаем 2 компонента: эпидермис и дерму. Далее работа происходит только с дермой). Для получения лучших результатов рекомендуется проводить данную обработку в течение 3 часов на орбитальном шейкере при постоянном покачивании при температуре 37°C.
Полученную после названной обработки дерму промывают ДМЕМ-LG и механически измельчают.
Далее, фрагменты дермы распределяют по чашке Петри, например, с диаметром 6 см и заливают ДМЕМ-LG, дополненной эмбриональной телячьей сывороткой (далее - ЭТС), простым раствором заменимых аминокислот (далее - MEM-NEAA) и антибиотиками (например, пенициллин, стрептомицин или амфотерицин).
Затем культивируют клетки, периодически сменяя культуральную среду. При этом оптимальными параметрами для культивирования являются: температура 37°C, 5%-ная концентрация CO2 в воздухе и регулярная (через каждые трое суток) смена среды.
После того как фибробласты мигрируют из фрагментов и заполнят всю поверхность дна чашки, их снимают ферментом (например, ЭДТА с добавлением трипсина в концентрации 0,05%), после чего отмывают от фермента культуральной средой, пропускают через фильтр (подойдет фильтр с размером фильтрующей ячейки 80-100 мкм) для удаления волокон и осаждают центрифугированием.
Затем клеточный осадок суспендируют в ростовой среде (Среда роста - питательная среда, содержащая все компоненты, обеспечивающие активное деление клеток, культивируемых вне организма. 1. Малая медицинская энциклопедия. - М.: Медицинская энциклопедия. 1991-96 гг. 2. Первая медицинская помощь. - М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. - М.: Советская энциклопедия. - 1982-1984 гг.) и высевают на культуральные флаконы, преимущественно из расчета 1×106 клеток/см2, после чего помещают в CO2-инкубатор и после достижения конфлуэнтного монослоя клетки снимают ферментом, осаждают центрифугированием, клеточный осадок суспендируют в ростовой среде и высевают на культуральные флаконы, помещают в CO2-инкубатор и после достижения конфлуэнтного монослоя клетки снимают ферментом, осаждают и пассируют до необходимого терапевтического количества и рассевают далее до получения необходимого терапевтического количества фибробластов.
Для применения и транспортировки выделенные и культивированные фибробласты или ММСК необходимо соединять со специализированным носителем-протектором для получения биотрансплантата.
Биотрансплантаты с клетками, выделенные вышеописанным методом, получают следующим образом.
После финального пассирования выделенные клетки переводят на культивирование в среде с собственной сывороткой крови пациента (ССКП) или в терапевтической среде AIM-V (Gibco) (тканевая питательная среда. В частности, производится BRL, Grand Island, NY). Фибробласты собирают с помощью фермента, дважды промывают ДМЕМ-LG путем центрифугирования ресуспендирования, а затем физиологическим раствором, содержащим человеческий альбумин, суспендируют в физрастворе и смешивают с экстрактом икры осетровых рыб.
При этом собирают фибробласты, например, с помощью ЭДТА с добавлением трипсина в концентрации 0,05%, а физиологический раствор содержит человеческий альбумин, предпочтительно в концентрации 1%.
Фибробласты суспендируют в физрастворе предпочтительно из расчета 1,2-1,3×106 клеток на 1 мл биотрансплантата.
Рекомендуется суспензию клеток смешивать с экстрактом икры осетровых рыб в соотношении 4:1, а именно: 4 части физраствора, содержащего 1,2-1,3×106 фибробластов, и 1 часть экстракта икры осетровых рыб, а в качестве экстракта применять препарат «Кавиар» (производится, в частности, ООО «Лаборатория ТОСКАНИ», Россия, ОГРН 1027720000131, в ампулах по 2 мл) в объеме 200 мкл на 1 мл трансплантата.
Информация о препарате «Кавиар» представлена, в частности, в следующих общедоступных источниках в сети Интернет:
http: //www.martinex.ru/products/mesotherapy/skinasil/caviar.html;
http: //www.info-beauty.ru/inekciornnaya-kosmetologiya/38-mezoterapiya/183-kaviar.html;
profi.fo.ru/shop/5098_%D0%BC%D0%B5%D0%B7%D0%BE%D1%82%D0%B5%D1%80%D0%B0%D0%BF%D0%B8%D1%8F%2C%D0%BA%D0%BE%D0%BD%D1%82%D1%83%D1%80%D0%BD%D0%B0%D1%8F_%D0%BF%D0%BB%D0%B0%D1%81%D1%82%D0%B8%D0%BA%D0%B0/17902_%D0%9A%D0%B0%D0%B2%D0%B8%D0%B0%D1%80._%D0%AD%D0%BA%D1%81%D1%82%D1%80%D0%B0%D0%BA%D1%82_%D0%B8%D0%BA%D1%80%D1%8B_%D0%BE%D1%81%D0%B5%D1%82%D1%80%D0%BE%D0%B2%D1%8B%D1%85_%D1%80%D1%8B%D0%B1_5%25.
Другой вид биотрансплантата получается при смешении суспензии клеток с препаратом на основе смеси органического кремния, экстракта плаценты, гидролизата эластина и гидролизата коллагена, например с препаратом «Antiestrias» (коктейль «Антистрии» в ампулах по 2 мл) производства компании «Dietbel» (Испания) в объеме 200 мкл на 1 мл трансплантата.
Информация о препарате раскрыта, в частности, в следующих общедоступных источниках в сети Интернет:
http: //martinex.ru/products/mesotherapy/ditbel/dietbel-injection/antiestrias.html;
http: //lantana43.ru/index.php?page=shop.product_details&flypage=&product_id=35&category_id=0&option=com_virtuemart&Itemid=2
http: //jeternel-sales.ra/catalog/items/antiestrias_regenerador_2_ml;
http: //xn--elaanijscib.xn--plai/index.php?route=product/category&path=107_240;
http: //www.charm-center.ru/cosmetic/brand/dietbel.
Состав предлагаемого к использованию препарата «Antiestrias» следующий: органический кремний, экстракт плаценты, гидролизат эластина, гидролизат коллагена.
Используют полученные биотрансплантаты путем введения их в дефектные ткани папульным (простое подкожное введение препарата), тоннельным (формирование линейного канала в дерме и равномерное его заполнение на обратном ходе иглы) или комбинированными методами.
Предложенное выше использование в качестве носителей коммерческих препаратов «Кавиар» и «Antiestrias» при создании биотрансплантатов для коррекции дефектов кожи обусловлено несколькими факторами. Мезопрепараты «Кавиар» и «Antiestrias» содержат компоненты межклеточного матрикса, синтезируемые фибробластами, такие как факторы роста кератиноцитов, фибробластов, лимфоцитов, макрофагов, витамины, микроэлементы, экстракт плаценты, гидролизат эластина, гидролизат коллагена и др., и применяются в косметологии для коррекции патологических изменений состояния кожи, в том числе возрастных. Препараты имеют удобную инъекционную форму, и, в отличие от мономерных носителей (физиологического раствора, коллагена, гиалуроновой кислоты), содержат несколько компонентов, которые комплексно усваиваются тканями, не вызывая общетоксического, аллергизирующего, местно-раздражающего действия, а их автономное введение благотворно влияет на состояние кожи. В экспериментах in vitro показано, что данные препараты способствуют поддержанию жизнеспособности и пролиферативной активности фибробластов, что позволяет использовать их в качестве благоприятного окружения для введенных клеток на время их адаптации и приживления в дефектной области.
Биотрансплантат также может быть введен внутривенно, для чего готовят специальный раствор путем соединения ММСК с 1% раствором человеческого альбумина в 0,9% растворе хлорида натрия (физраствора). В экспериментах in vitro подтверждено, что данный носитель-протектор, содержащий компоненты кровяного русла, способствует адаптации клеток в условиях in vivo.
Осуществление изобретения
Оценка эффективности способа регенерации тканей мезенхимного происхождения с использованием фибробластов или фибробластоподобных клеток, выделенных из различных тканей взрослого организма, проводилась поэтапно и включала стадии выделения фибробластов из кожи, выделения мультипотентных мезенхимных стволовых клеток (ММСК) из жировой ткани, их культивирования in vitro до получения необходимой клеточной массы; подготовку различных комбинаций трансплантата; исследование in vivo подготовленных трансплантатов; анализ полученных результатов.
Заявленное изобретение иллюстрируется следующими примерами.
Пример 1. Выделение и культивирование фибробластов из кожи человека
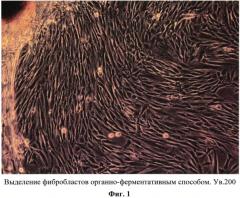
Фибробласты выделяли по оригинальной методике из минимального объема биоптата кожи (2 мм/1 мм/1 мм), забор которого осуществляли амбулаторно. Основной задачей при разработке метода выделения фибробластов было максимальное уменьшение объема забираемого биологического материала с одновременным увеличением выхода первичного клеточного материала. Результат достигался благодаря применению органно-ферментативного способа обработки биоптата, обеспечивающего максимальный выход фибробластов из ткани и получение гомогенной популяции (Фиг. 1). Разработанный метод позволяет из маленького объема биоматериала за короткий промежуток времени получить качественную гомогенную культуру фибробластов.
Биоптат тщательно промывали в физиологическом растворе с 1% человеческого альбумина, после чего подвергали обработке в 1 мл 0,1% раствора диспазы в ДМЕМ-LG в течение 3 часов на орбитальном шейкере при постоянном покачивании (30-40 об/мин) при температуре 37°C с целью отделения пленки эпидермиса от дермы. Эпидермис удаляли, а дерму промывали средой ДМЕМ-LG, механически измельчали ножницами на 8-10 фрагментов и полученные фрагменты распределяли по чашке Петри ⌀6 см. Через 2-3 минуты, когда фрагменты прикреплялись к поверхности чашки, их заливали средой Игла в модификации Дюльбекко с низким содержанием глюкозы (ДМЕМ-LG), содержащей 15% по объему добавляемой эмбриональной телячьей сыворотки (ЭТС), раствор антибиотика/антимикотика (100 МЕ/мл пенициллин/100 мкг/мл стрептомицин/0,25 мкг/мл амфотерицин) и однократный (1% по объему добавляемых аминокислот) раствор заменимых аминокислот (MEM-NEAA) и помещали в CO2-инкубатор. После того как фибробласты мигрировали из фрагментов и заполняли всю поверхность дна чашки, их снимали ферментом 0,05% трипсин-ЭДТА (ЭДТА с добавлением трипсина в концентрации 0,05%), переносили в пробирку, разбавляли средой, чтобы отмыть от фермента, пропускали через фильтр 80-100 мкм для удаления волокон и осаждали центрифугированием. Полученный осадок клеток пипетировали в ростовой среде, переносили в культуральный флакон S=150 см2 и помещали в инкубатор. По достижении конфлуэнтного монослоя клетки снимали ферментом, осаждали и пассировали далее до необходимого терапевтического количества. После финального пассирования фибробласты переводили на культивирование в среде с собственной сывороткой крови пациента (ССКП) или в терапевтической среде AIM-V (Gibco), предназначенной для культивирования клеток и тканей человека ex vivo. Среда не содержит животных эмбриональных добавок, что исключает проявление иммунного ответа при введении клеток пациентам.
Необходимое для биотрансплантата количество фибробластов собирали с помощью 0,05% трипсин - ЭДТА, дважды отмывали ДМЕМ-LG путем центрифугирования - ресуспендирования, а затем физиологическим раствором с 1% человеческого альбумина и суспендировали в 0,9% растворе хлорида натрия из расчета 1,2-1,3×106 клеток в 1 мл биотрансплантата.
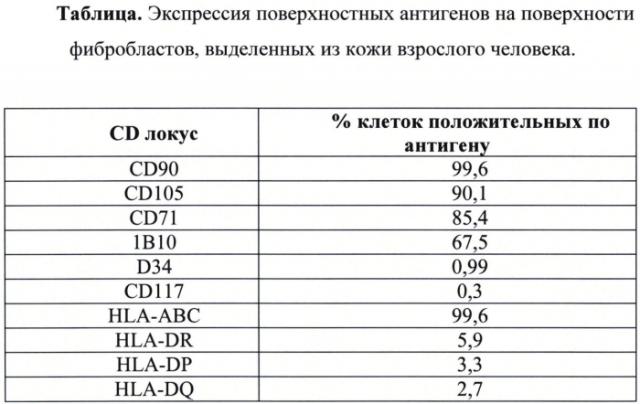
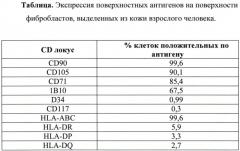
Полученную популяцию клеток оценивали по ряду показателей. Визуальный анализ прикрепленных клеток с помощью фазово-контрастной микроскопии показал, что клетки имели фибробластоподобную форму, популяция клеток однородна. По результатам иммунофенотипирования (по экспрессии поверхностных антигенов) популяция полученных клеток соответствовала фибробластам (см. Таблицу ниже). Митотический индекс и время цитогенерации составляли 31‰ и 34-44 час соответственно, что согласуется со стандартными показателями. Для подтверждения стабильности хромосомного набора полученной популяции проводили кариологический анализ клеток на 5 пассаже методом GTG-окрашивания (предобработка 0.25% раствором трипсина с последующим окрашиванием красителем Гимза на фосфатном буфере pH 6.8). Показано, что линия имеет нормальный диплоидный кариотип 46, XX (Фиг. 8). Отсутствие туморогенных потенций клеток доказывали путем внутрибрюшинного введения клеток бестимусным мышам. Клетки не оказывали токсического действия и онкологически безопасны.
Данная технология гарантирует получение гомогенной высококачественной популяции фибробластов человека и имеет высокую степень воспроизводимости.
Длительное хранение фибробластов осуществляется в криохранилище в жидком азоте при температуре -196°C, среда для замораживания состояла из 50% ДМЕМ-LG, 40% ЭТС и 10% ДМSO.
Пример 2. Выделение и культивирование мультипотентных мезенхимных стромальных клеток (ММСК) из жировой ткани человека
ММСК выделяли из жировой ткани человека, полученной во время проведения липосакции или плановой операции с информированного согласия пациента по стандартной методике [Zak Р.А., Tissue Engineering, vol. 7, №2, 2001] с модификациями.
Жировую ткань тщательно промывали в физиологическом растворе с 1% человеческого альбумина, измельчали механически и подвергали ферментативной обработке 0,075%-ным раствором смеси коллагеназы тип I и тип II в среде Игла в модификации Дюльбеко с содержанием глюкозы 1 г/л (ДМЕМ-LG) при 37°C в течение 40 минут. Коллагеназу отмывали эквивалентным объемом питательной среды (ДМЕМ-LG, дополненной 10% эмбриональной сыворотки теленка) и центрифугировали при 300 g в течение 5-7 минут. Полученный осадок ресуспендировали и пропускали через фильтры с диаметром пор 80-100 мкм для удаления неразлизированных фрагментов ткани. Полученную клеточную суспензию высевали во флаконы площадью 75 см2 из расчета 106 клеток/см2.
Культивировали ММСК в среде ДМЕМ с низким содержанием глюкозы, дополненной 15% эмбриональной сывороткой теленка, однократным раствором заменимых аминокислот (MEM-NEAA) и антибиотиками (100 ед/мл пенициллина, 100 мкг/мл стрептомицина) при 37°C и 5% CO2 в воздухе. Среду меняли каждые 3-4 суток и по достижении конфлуэнтного монослоя осуществляли субкультивирование: клетки снимали с субстрата раствором 0,05% трипсин-ЭДТА и высевали на культуральные флаконы из расчета 5×106 клеток/см2 в ростовой среде. После финального пассирования фибробласты переводили на культивирование в среде с собственной сывороткой крови пациента (ССКП) или в терапевтической среде AIM-V (Gibco), предназначенной для культивирования клеток и тканей человека ex vivo. Среда не содержит животных эмбриональных добавок, что исключает проявление иммунного ответа при введении клеток пациентам.
Необходимое для биотрансплантата количество ММСК собирали с помощью 0,05% трипсин-ЭДТА, отмывали путем центрифугирования - ресуспендирования дважды ДМЕМ-LG, а затем физиологическим раствором с 1% человеческого альбумина и суспендировали в 0,9% растворе хлорида натрия в концентрации 0,9-1,0×106 на 1 кг веса пациента.
Результаты иммунофенотипирования показали, что популяция полученных клеток соответствует по экспрессии поверхностных антигенов мезенхимным стволовым клеткам. Митотический индекс и время цитогенерации составили 34‰ и 54-62 час соответственно.
Пример 3. Влияние носителей-биопротекторов на поддержание жизнеспособности и пролиферативной активности фибробластов
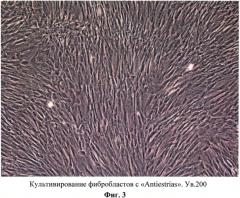
Для выбора оптимального носителя-биопротектора при создании биотрансплантата тестировали 5 мезопрепаратов: №1 - «Кавиар», №2 - «Antiestrias», №3 - «Колэласт комплекс», №4 «Facial А-36», №5 - «Дмаэ комплекс».
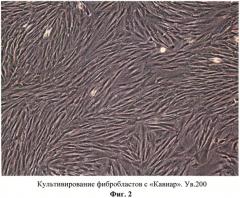
Выбор именно этих препаратов обусловлен их мультисоставом и наибольшей популярностью применения в косметологии при коррекции различных изменений кожи. Выращенные фибробласты в количестве 0,2×105 для тестирования каждого препарата осаждали путем центрифугирования, суспендировали в 200 мкл мезопрепарата и выдерживали в течение 2 часов при комнатной температуре. Затем клетки переносили в чашки, добавляли 800 мкл стандартной рабочей среды и переносили в инкубатор для культивирования (соотношение среда:мезопрепарат 4:1). В качестве контроля выращивали клетки в стандартных условиях, без добавления мезопрепарата. В результате было продемонстрировано, что препараты №1 и №2 способствуют поддержанию жизнеспособности и пролиферативной активности фибробластов (Фиг. 2, 3), препараты 3, 4 (Фиг. 4, 5) несколько отстают в росте по сравнению с контролем (Фиг. 7), а под воздействием препарата 5 клетки испытывают шок и начинают некротировать (Фиг. 6).
Таким образом, наиболее эффективными в качестве носителя-протектора при создании биотрансплантантов оказались препараты «Кавиар» (№1) и «Antiestrias» (№2).
Пример 4. Получение биотрансплантата 1
Аутологичные или аллогенные фибробласты, выделенные из дермы кожи человека, суспендируют в 0,9% растворе хлорида натрия из расчета 1,2-1,3×106 клеток на 1 мл биотрансплантата для инъекционного введения. Для приготовления биотрансплантата суспензию культуры аутологичных или аллогеных фибробластов соединяют с препаратом «Кавиар» в качестве носителя-биопротектора в соотношении 4:1 (т.е. 1 мл биотрансплантата содержит 1,2-1,3×106 фибробластов, 4 части 0,9% раствора хлорида натрия и 1 часть препарата «Кавиар»).
Пример 5. Получение биотрансплантата 2
Аутологичные или аллогенные фибробласты, выделенные из дермы кожи человека, суспендируют в 0,9% растворе хлорида натрия из расчета 1,2-1,3×106 клеток на 1 мл биотрансплантата для инъекционного введения. Для приготовления биотрансплантата суспензию культуры аутологичных или аллогеных фибробластов соединяют с препаратом «Antiestrias» в качестве носителя-биопротектора в соотношении 4:1 (т.е. 1 мл биотрансплантата содержит 1,2-1,3×106 фибробластов, 4 части 0,9% раствора хлорида натрия и 1 часть препарата «Antiestrias»).
Апробация полученных биотрансплантатов проводилась на пяти добровольцах в возрасте от 37 до 62 лет. При интрадермальном введении биотрансплантатов с целью коррекции возрастных изменений разработанным способом наблюдался выраженный положительный эффект - прогрессирующее улучшение текстуры кожи, восстановление тургора, увеличение толщины дермы, уменьшение глубины морщин и др., которые стабильно сохранялись в течение 1,5-2 лет. Для более стойкого эффекта процедуру рекомендуется проводить дважды с интервалом 3 месяца.
Пример 6. Получение биотрансплантата 3
Биотрансплантат для внутривенного введения содержит суспензию культуры аутологичных фибробластоподобных клеток, выделенных из жировой ткани в количестве 0,9-1,0×106 на 1 кг веса в 0,9% растворе хлорида натрия с 1% раствором альбумина в качестве носителя-биопротектора.
Пример 7. Способ доставки биотрансплантата в область дефекта
Биотрансплантат, представляющий собой суспензию культуры аутологичных или аллогенных фибробластов (1,2-1,3×106/мл), вводят в область дефекта в количестве 0,8-0,9×10 клеток на 1 см (6-7 мкл биотрансплантата) методом интрадермальных инъекций с образованием папул диаметром 0,1-0,2 мм двукратно с интервалом 12 недель. На 1 зону (около 150 см2) используют 12-13×106 клеток.
В другом варианте биотрансплантат, представляющий собой суспензию культуры аутологичных или аллогенных фибробластов в количестве 1,2-1,3×106 в 1 мл, вводят в область дефекта тоннельным способом вдоль линии морщин. Единовременно водят 9-10 мл биотрансплантата.
В другом варианте биотрансплантат, представляющий собой суспензию культуры аутологичных или аллогенных фибробластов в количестве 1,2-1,3×106 в 1 мл, вводят в область дефекта по параллельным, а затем по перпендикулярным линиями по всей длине иглы, формируя «сетку». Единовременно водят 9-10 мл биотрансплантата.
В другом варианте биотрансплантат, представляющий собой суспензию культуры аутологичных или аллогенных фибробластов в количестве 1,2-1,3×106 в 1 мл, вводят в область дефекта комбинированным способом. Единовременно водят 9-10 мл биотрансплантата.
В другом варианте биотрансплантат, содержащий суспензию культуры аутологичных фибробластоподобных клеток, выделенных из жировой ткани, в количестве 0,9-1,0×106 на 1 кг веса, вводят внутривенно.
1. Способ выделения клеток фибробластов, заключающийся в том, что производят забор тканей кожи, полученный биоптат промывают в физиологическом растворе, дополненном человеческим альбумином, промытый биоптат подвергают обработке раствором диспазы в культуральной среде Игла в модификации Дюльбеко с содержанием глюкозы 1 г/л (ДМЕМ-LG) до отделения пленки эпидермиса от дермы, полученную дерму промывают ДМЕМ-LG и механически измельчают, фрагменты дермы распределяют по чашке Петри и заливают ДМЕМ-LG, дополненной эмбриональной телячьей сывороткой (ЭТС), раствором заменимых аминокислот (MEM NEAA) и антибиотиками, культивируют клетки, периодически сменяя культуральную среду, после того как фибробласты мигрируют из фрагментов и заполнят всю поверхность дна чашки, их снимают ферментом и отмывают культуральной средой от фермента, пропускают через фильтр и осаждают центрифугированием, клеточный осадок суспендируют в ростовой среде и высевают на культуральные флаконы, помещают в CO2-инкубатор и после достижения конфлуэнтного монослоя клетки снимают ферментом, осаждают и пассируют до необходимого терапевтического количества.
2. Способ по п. 1, отличающийся тем, что забор тканей кожи осуществляют в объеме не более 2 мм/1 мм/1 мм.
3. Способ по п. 1, отличающийся тем, что полученный забором биоптат промывают в физиологическом растворе с человеческим альбумином в концентрации последнего 1%.
4. Способ по п. 1, отличающийся тем, что применяемый для обработки раствор диспазы имеет концентрацию 0,1%.
5. Способ по п. 1, отличающийся тем, что обработку биоптата раствором диспазы в ДМЕМ-LG проводят в течение 3 часов на орбитальном шейкере при постоянном покачивании при температуре 37°C.
6. Способ по п. 1, отличающийся тем, что используют чашку Петри, имеющую диаметр 6 см.
7. Способ по п. 1, отличающийся тем, что применяют эмбриональную сыворотку теленка (ЭСТ) с концентрацией 15% по объему добавляемой сыворотки.
8. Способ по п. 1, отличающийся тем, что культивирование клеток проводят при температуре 37°C и при 5% концентрации CO2 в воздухе.
9. Способ по п. 1, отличающийся тем, что при культивировании клеток культуральную среду сменяют каждые трое суток.
10. Способ по п. 1, отличающийся тем, что в качестве фермента используют ЭДТА с добавлением трипсина в концентрации 0,05%.
11. Способ по п. 1, отличающийся тем, что для культивирования клеток в качестве антибиотика применяется пенициллин, или стрептомицин, или амфотерицин.
12. Способ по п. 1, отличающийся тем, что для удаления волокон после культивирования производят фильтрацию через фильтр, имеющий размер фильтрующей ячейки 80-100 мкм.
13. Способ по п. 1, отличающийся тем, что клеточный осадок высевают на культуральные флаконы из расчета 1×10 клеток/см.
14. Способ создания биотрансплантата, заключающийся в том, что после финального пассирования клетки, выделенные способом по п. 1 формулы, переводят на культивирование в среде с собственной сывороткой крови пациента (ССКП) или в терапевтической среде AIM-V (Gibco), фибробласты собирают с помощью фермента, дважды промывают ДМЕМ-LG путем центрифугирования - ресуспендирования, а затем физиологическим раствором, содержащим человеческий альбумин, суспендируют в физрастворе и смешивают с экстрактом икры осетровых рыб.
15. Способ по п. 14, отличающийся тем, что в качестве фермента используют ЭДТА с добавлением трипсина в концентрации 0,05%.
16. Способ по п. 14, отличающийся тем, что для промывки используют физиологический раствор с человеческим альбумином в концентрации последнего 1%.
17. Способ по п. 14, отличающийся тем, что суспендирование проводят в физрастворе из расчета 1,2-1,3×106 клеток на 1 мл биотрансплантата.
18. Способ по п. 14, отличающийся тем, что суспензию клеток смешивают с экстрактом икры осетровых