Новый вариант альфа-1-антитрипсина, способ его получения и применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению варианта альфа-1-антитрипсина, и может быть использовано в медицине для предотвращения или лечения дефицита альфа-1-антитрипсина. Получают вариант альфа-1-антитрипсина путем замены аминокислоты в 4, 9 или 12 положении N-конца альфа-1-антитрипсина на аспарагин с целью добавления сайта гликозилирования. Изобретение позволяет увеличить период полужизни альфа-1-антитрипсина в организме. 7 н. и 1 з.п.ф-лы, 10 ил., 3 табл., 5 пр.
Реферат
Область техники
Настоящее изобретение имеет отношение к новому варианту альфа-1-антитрипсина, способу его получения и его применению.
Предшествующий уровень техники
Альфа-1-антитрипсин представляет собой белок, состоящий из 394 аминокислотных остатков, имеющий молекулярную массу приблизительно 50,000 дальтон (Da) и присутствующий в крови млекопитающих. Альфа-1-антитрипсин является одним из основных белков крови, концентрация которого в крови составляет приблизительно 2 мг/мл (Robin W.C. et. al., Nature, 298, 329-334, 1982), при этом он также известен под названием альфа-1-ингибитор протеаз. Альфа-1-антитрипсин имеет, по меньшей мере, около 100 природных аллелей, и его фенотипы классифицируются по категориям от A до Z в соответствии с профилями изоэлектрического фокусирования (IEF). Известно, что наиболее распространенный аллель M-типа присутствует в крови большинства людей, имеет, по меньшей мере, приблизительно 75 различных изоформ (Brantley, M. et. al., Am. J. Med., 84 (suppl. 6A), 13-31, 1988) и сохраняет основную функцию ингибитора протеаз.
В общем, известно, что приблизительно 90% изоформ альфа-1-антитрипсина присутствуют в виде пяти PiM подтипов, таких как M1, M2, M3, M4 и M5. Из их числа M1, M2 и M3 составляют приблизительно 67%, 16% и 11%, соответственно (Jan-Olof Jeppson and Carl-Bertil Laurell, FEBS Lett., 231, 327-330, 1986). Известно, что M2 и M3 подтипы имеют гистидин (His) и аргинин (Arg) в 101ом положении от N-конца, соответственно, а также известно, что отличие по этой аминокислоте не оказывает влияния на природную активность альфа-1-антитрипсина.
Альфа-1-антитрипсин представляет собой гликопротеин, который гликозилируется по 3 сайтам (Mega, Т. et. al., J. Biol. Chem., 255, 4057-4061, 1980). Рентгеновская кристаллическая структура показывает, что он состоит из 3-х бета листов и 8-ми альфа-спиралей подобно другим ингибиторам протеазы (серпинам), присутствующим в крови (Elliot P.R., et. al., JMB, 275, 419-425, 1998). Функция альфа-1-антитрипсина заключается в ингибировании различных видов протеаз в организме, а его главной функцией in vivo, связанной с известными в настоящее время болезнями, является ингибирование активности эластазы нейтрофилов (Beatty et. al., J. Biol. Chem., 255, 3931~3934, 1980). Недостаток альфа-1-антитрипсина вызывает такие тяжелые болезни, как эмфизема легких, при которых функция легких нарушается вследствие разрушения эластина. Кроме того, имеются клинические отчеты, показывающие, что модифицированные белки альфа-1-антитрипсина в норме не секретируются печенью, но накапливаются в печени, что приводит к началу цирроза печени.
В последние годы некоторые продукты, полученные из крови человека, были одобрены Управлением США по контролю за продуктами питания и медицинскими изделиями (FDA) и имеются в продаже в качестве терапевтических средств для лечения дефицита альфа-1-антитрипсина. Характерные примеры таких продуктов включают Prolastin (коммерчески доступный от Talecris Plasma Resources Inc), Aralast (коммерчески доступный от Baxter Inc) и Zemaira (коммерчески доступную от CSL Behring Inc), которые в большинстве случаев вводятся в организм человека в дозе 60 мг/кг с помощью внутривенной инъекции с интервалами в одну неделю. Следовательно, белок должен вводиться взрослому пациенту в большой дозе от 4 до 5 г в течение длительного периода времени.
Согласно анализу мониторинга данных (DMHC2364) в США и Европе насчитывается около 200,000 пациентов, имеющих генетические проблемы, связанные с альфа-1-антитрипсином, однако только часть этих пациентов получает лечение, в силу того, что остальным не поставлен правильный диагноз. Все созданные до настоящего времени продукты медицинского назначения представляют собой альфа-1-антитрипсин, полученный из крови человека. Извлеченный из крови человека альфа-1-антитрипсин может содержать вирусы из организма человека, которые могут вызывать фатальные для людей болезни, такие как вирус иммунодефицита человека (HIV), вирус гепатита B или вирус гепатита C, даже если он полностью исключен в ходе процесса изготовления. Даже в том случае, когда при получении альфа-1-антитрипсина проводятся скрининговый анализ крови с целью обнаружения некоторых патогенов и процедура инактивации вирусов, невозможно устранить редкие патогены, которые до сих пор неизвестны. Следовательно, всегда существует риск инфицирования организма человека неизвестными патогенами при использовании выделенного из крови альфа-1-антитрипсина. Кроме того, стабильная поставка незараженной крови, используемой для производства коммерчески необходимого количества альфа-1-антитрипсина, является проблематичной.
В качестве альтернативы для решения упомянутых выше проблем может быть использован метод рекомбинантных ДНК для создания альфа-1-антитрипсина, в качестве терапевтического средства. Поэтому метод рекомбинантных ДНК постоянно разрабатывается, однако до сих пор отсутствует коммерчески доступный рекомбинантный альфа-1-антитрипсин вследствие различных ограничивающих факторов.
Известно, что человеческий альфа-1-антитрипсин имеет 3 N-гликановых фрагмента, так как он гликозилируется по 3 сайтам (аспарагин в 46ом положении, аспарагин в 83ем положении и аспарагин в 247ом положении). Поскольку альфа-1-антитрипсин, полученный методом рекомбинантных ДНК с использованием микроорганизмов, таких как Е. coli, не гликозилируется, известно, что при введении в организм он имеет короткий период полужизни in vivo (Karnaukhova et. al., Amino Acids, 30, 317-332, 2006, Garver Jr. et. al., Proc. Natl. Acad. Sci. USA., 84, 1050-1054, 1987). Для решения этой проблемы, а также эффективного производства большого количества альфа-1-антитрипсина, было проведено исследование экспрессии альфа-1-антитрипсина у растений. Однако было обнаружено, что хотя у рекомбинантного альфа-1-антитрипсин, экспрессированного в растениях, наблюдалось характерное для растений гликозилирование, он имел еще более короткий период полужизни в организме, чем человеческий альфа-1-антитрипсин (Huang et. al., Biotechnol. Prog., 17, 126-133, 2001).
С целью увеличения периода полужизни альфа-1-антитрипсина в организме Cantin et. al. предложили гибридный белок, полученный путем конъюгации полиэтиленгликоля с остатком цистеина альфа-1-антитрипсина, экспрессированного в микроорганизмах (Cantin et. al., Am. J. Respir. Cell. Mol. Biol., 27, 659-665, 2002). В статье сообщается, что в том случае, когда полиэтиленгликоль, имеющий молекулярную массу от 20 до 40 кДа, был соединен с остатком цистеина альфа-1-антитрипсина, экспрессированного в микроорганизме, конъюгированный альфа-1-антитрипсин имел увеличенный период полужизни в организме по сравнению с альфа-1-антитрипсином, экспрессированным в микроорганизме, что приводит по существу к такому же периоду полужизни, как у человеческого альфа-1-антитрипсина. Однако при соединении полиэтиленгликоля с белком могут образовываться различные гетерогенные продукты реакции из-за побочных химических реакций. В связи с этим, требуются дополнительные стадии для удаления гетерогенных продуктов реакции. Кроме того, поскольку не существует N-гликановых фрагментов в альфа-1-антитрипсине, конъюгированном с PEG, это может быть причиной возникновения проблем с иммуногенностью при лечении людей, вызванных экспонированными аминокислотными последовательностями.
Известно, что альфа-1-антитрипсин, полученный из клеток животных, имеет в основном тот же самый период полужизни в организме как человеческий альфа-1-антитрипсин (Garver Jr. et. al., Proc. Natl. Acad. Sci. USA., 84, 1050-1054, 1987). Поэтому для получения альфа-1-антитрипсина имеющего структуру, сходную с человеческим альфа-1-антитрипсином, может быть предпочтительным получение в животных клетках. Несмотря на преимущество альфа-1-антитрипсина, происходящего из животных клеток, производство альфа-1-антитрипсина с использованием животных клеток связано с проблемой, поскольку этот способ является в целом более дорогим, чем способ получения альфа-1-антитрипсина в микроорганизмах.
В то же время, была предложена технология добавления сайта гликозилирования в участок петли альфа-1-антитрипсина с целью увеличения периода полужизни in vivo альфа-1-антитрипсина. В общем, можно предположить, что когда белок, экспрессируемый в животных клетках, является гликозилированным, можно считать, что белок имеет увеличенный период полужизни в организме вследствие увеличенного гидродинамического объема гликозилированного белка при введении в организм человека по сравнению с негликозилированными белками. Однако, как можно видеть на примере эритропоэтинов, изменение или добавление сайта гликозилирования к физиологически активному белку оказывает большое влияние на период полужизни белка in vivo в зависимости от положений сайтов гликозилирования (Eliott et. al., Nat. Biotechnol., 21, 414-421, 2003). Следовательно, когда сайт гликозилирования добавляется к альфа-1-антитрипсину с целью увеличения периода полужизни in vivo и физиологической стабильности, необходимо тщательно контролировать к какому положению(ям) альфа-1-антитрипсина добавляется сайт гликозилирования.
В заключение, предпринималось множество попыток создать методику, получения альфа-1-антитрипсина с использованием методов рекомбинантных ДНК, который бы имел увеличенную устойчивость in vivo. Однако такие существующие методы не пригодны для получения альфа-1-антитрипсина в качестве медикамента вследствие различных проблем, описанных выше. Следовательно, существует острая необходимость в новом способе получения рекомбинантного альфа-1-антитрипсина, обладающего хорошей устойчивостью в организме.
Техническая проблема
С целью получения рекомбинантного альфа-1-антитрипсина, обладающего практической ценностью для клиники, настоящие изобретатели получили варианты альфа-1-антитрипсина путем добавления сайтов гликозилирования к альфа-1-антитрипсину в различных конкретных положениях и обнаружили, что вариант альфа-1-антитрипсина обладает превосходной устойчивостью в организме и сохраняет ингибирующее действие на эластазу, причем значительно увеличивается период полужизни в крови (t1/2) и площадь под кривой зависимости концентрации лекарственного средства в крови от времени (AUC). Следовательно, настоящее изобретение выполнено с учетом этих фактов.
Техническое решение
Согласно одному аспекту настоящего изобретения предоставляется вариант альфа-1-антитрипсина, полученный путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования.
Согласно одному типичному варианту осуществления настоящего изобретения вариант альфа-1-антитрипсина может иметь от 1 до 3 дополнительных центров гликозилирования.
Согласно другому типичному варианту осуществления настоящего изобретения определенный сайт может находиться между 3им и 13ым положениями N-конца.
Согласно другому типичному варианту осуществления настоящего изобретения определенный сайт может находиться в 9ом или 12ом положении N-конца.
Согласно еще одному типичному варианту осуществления настоящего изобретения определенный сайт может находиться в 4ом или 9ом положениях, 4ом или 12ом положениях или 9ом и 12ом положениях.
Согласно другому аспекту настоящего изобретения предоставляется способ получения варианта альфа-1-антитрипсина, включающий замену аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования, культивирование клеток трансформированных вектором экспрессии альфа-1-антитрипсина, обладающим добавленным к нему сайтом гликозилирования, в культуральной среде, экспрессирование варианта белка альфа-1-антитрипсина из клеток и очистку и извлечение экспрессированного варианта белка альфа-1-антитрипсина.
Согласно еще одному аспекту настоящего изобретения предоставляется композиция, предназначенная для предотвращения или лечения дефицита альфа-1-антитрипсина, включающая вариант альфа-1-антитрипсина в качестве активного ингредиента, при этом вариант альфа-1-антитрипсина получают путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования.
Согласно одному типичному варианту осуществления настоящего изобретения дефицит альфа-1-антитрипсина может являться хронической обструктивной болезнью легких или циррозом печени.
Согласно следующему аспекту настоящего изобретения предоставляется способ предотвращения или лечения дефицита альфа-1-антитрипсина, включающий введение терапевтически эффективного количества варианта альфа-1-антитрипсина пациенту, при этом вариант альфа-1-антитрипсина получают путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования.
Согласно еще одному аспекту настоящего изобретения предоставляется вариант гибридного белка альфа-1-антитрипсина, обладающий увеличенным периодом полужизни в организме, при этом гибридный белок получают путем связывания двух вариантов альфа-1-антитрипсина, каждый из которых получают путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования.
Согласно следующему аспекту настоящего изобретения предоставляется вариант гибридного белка альфа-1-антитрипсина, включающий гетерогенный белок, обладающий повышенным периодом полужизни в организме, при этом гибридный белок получают путем связывания варианта альфа-1-антитрипсина с гетерогенным белком, а вариант альфа-1-антитрипсина получают путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью добавления сайта гликозилирования.
Согласно одному типичному варианту осуществления настоящего изобретения вариант альфа-1-антитрипсина может иметь дополнительную замену аминокислоты пролина в 357ом положении, которое является Р2 положением, на аспарагин.
Полезные эффекты
Вариант альфа-1-антитрипсина согласно настоящему изобретению обладает превосходной устойчивостью в организме и сохраняет ингибирующее действие на активность эластазы, в силу того, что период полужизни в крови (t1/2) и площадь под кривой зависимости концентрации лекарственного средства в крови от времени (AUC) значительно увеличиваются при добавлении сайта N-гликозилирования в результате мутации аминокислоты между 1ым и 25ым положениями N-конца альфа-1-антитрипсина. Следовательно, вариант альфа-1-антитрипсина согласно настоящему изобретению можно использовать при предотвращении или лечении дефицита альфа-1-антитрипсина. Кроме того, вариант альфа-1-антитрипсина согласно настоящему изобретению можно использовать при лечении дефицита альфа-1-антитрипсина и можно использовать для увеличения периода полужизни гетерогенного белка в организме, когда гетерогенный белок связан с вариантом альфа-1-антитрипсина.
Описание чертежей
Эти и другие признаки, аспекты и преимущества предпочтительных вариантов осуществления настоящего изобретения будут более подробно описаны в последующем описании изобретения и прилагаемых чертежах.
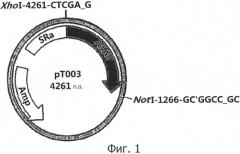
Фиг. 1 - схематическое изображение вектора альфа-1-антитрипсина (рТ003) согласно настоящему изобретению;
Фиг. 2 - диаграмма, показывающая последовательности и положения вариантов альфа-1-антитрипсина согласно настоящему изобретению;
Фиг. 3 - диаграмма, показывающая результаты SDS-PAGE очищенного альфа-1-антитрипсин и его вариантов согласно настоящему изобретению;
Фиг. 4 - фармакокинетическая кривая выделенного из плазмы альфа-1-антитрипсина и рекомбинантного альфа-1-антитрипсина, экспрессированного в животных клетках, после подкожного введения согласно настоящему изобретению;
Фиг. 5 - фармакокинетическая кривая альфа-1-антитрипсина и его вариантов после подкожного введения согласно настоящему изобретению;
Фиг. 6 - фармакокинетическая кривая полученного из плазмы альфа-1-антитрипсин и рекомбинантных вариантов альфа-1-антитрипсина после подкожного введения согласно настоящему изобретению;
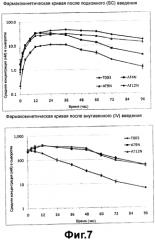
Фиг. 7 - фармакокинетическая кривая вариантов альфа-1-антитрипсина после подкожного и внутривенного введения согласно настоящему изобретению;
Фиг. 8 - фармакокинетическая кривая альфа-1-антитрипсина и его димера после внутривенного введения согласно настоящему изобретению;
Фиг. 9 - фармакокинетическая кривая человеческого гормона роста/варианта гибридного альфа-1-антитрипсина после подкожного введения согласно настоящему изобретению; и
Фиг. 10 - фармакокинетическая кривая гранулоцитарного колониестимулирующего фактора/варианта гибридного альфа-1-антитрипсина после подкожного введения согласно настоящему изобретению.
Способы осуществления изобретения
Настоящее изобретение относится к варианту альфа-1-антитрипсина, полученному путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью добавления сайта гликозилирования.
Вариант альфа-1-антитрипсина согласно настоящему изобретению отличается тем, что в дополнение к трем сайтам гликозилирования (аспарагин в 46ом положении, аспарагин в 83ем положении и аспарагин в 247ом положении) альфа-1-антитрипсина, аминокислота в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина заменяется с целью добавления сайта N-гликозилирования. Количество добавляемых сайтов гликозилирования не ограничивается. Например, количество сайтов гликозилирования может находиться в пределах от 1 до 3.
Добавление сайта N-гликозилирования к определенному сайту на N-конце человеческого альфа-1-антитрипсина может осуществляться с целью образования последовательности Asn-X-Thr/Ser, являющейся последовательностью, кодирующей сайт присоединения N-гликана между 1ым и 25ым положениями N-конца. Предпочтительно, глутамин, аминокислота, присутствующая между 3ьим и 13ым положениями N-конца человеческого альфа-1-антитрипсина и предпочтительно присутствующая в 9ом или 12ом положении N-конца, заменяется аспарагином для добавления сайта гликозилирования. Варианты, образованные добавлением сайта гликозилирования, могут иметь структуру, в которой сахара добавляются в 4ом и 90 ом положениях, 4ом и 12ом положениях или 9ом и 12ом положениях. В дополнение к описанным здесь специфическим сайтам варианты альфа-1-антитрипсина могут гликозилироваться в другом сайте в 25ом положении N-конца.
Кроме того, настоящее изобретение имеет отношение к способу получения варианта альфа-1-антитрипсина, включающему замену аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью добавления сайта гликозилирования, культивирование клеток, трансформированных вектором экспрессии альфа-1-антитрипсина, имеющим добавленный к нему сайт гликозилирования, в культуральной среде, выделение варианта альфа-1-антитрипсина из культуральной среды, очистку и восстановление экспрессированного варианта белка альфа-1-антитрипсина.
В качестве упомянутой выше технологии добавления сайта N-гликозилирования может использоваться метод рекомбинантных ДНК, причем аминокислота может быть замещена, вставлена и удалена с помощью генной инженерии с целью добавления сайта N-гликозилирования. Приблизительно 20 аминокислот N-конца человеческого альфа-1-антитрипсина составляют участок, который был с трудом обнаружен в рентгеновской кристаллической структуре альфа-1-антитрипсина (PDB код: 1QLP, 2QUG, 3CWL, 1PSI, 7API, 1KCT (www.pdb.org)). В этом случае N-концевой участок альфа-1-антитрипсина имел трехмерную структуру, которая была очень гибкой и неорганизованной.
Вариант альфа-1-антитрипсина согласно настоящему изобретению может быть получен путем мутации, по меньшей мере, одной аминокислоты с использованием метода сайт-направленного мутагенеза. Например, когда глутамин в 9ом положении человеческого альфа-1-антитрипсина заменяется аспарагином, или глицин в 148ом положении заменяется аспарагином, при этом модифицированный человеческий альфа-1-антитрипсин экспрессируется в животных клетках, сайт гликозилирования образуется на остатке аспарагина используемого вместо глутамина (9ое) или глицина (148ое). Так же, когда глицин в 148ом положении заменяется треонином, новый сайт гликозилирования формируется на аспарагине в 146ом положении. В этом случае сайт гликозилирования может быть добавлен в различных положениях альфа-1-антитрипсина.
В настоящем изобретении вариант альфа-1-антитрипсина получают путем добавления сайта N-гликозилирования в результате замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца человеческого альфа-1-антитрипсина, который был неорганизованным в рентгеновской кристаллической структуре альфа-1-антитрипсина (А1АТ), в дополнение к трем сайтам гликозилирования (аспарагин в 46ом положении, аспарагин в 83ем положении и аспарагин в 247ом положении) человеческого альфа-1-антитрипсина. Затем вариант альфа-1-антитрипсина экспрессируется в клетках яичника китайского хомячка и очищается до высокой степени очистки с использованием хроматографии.
Очищенный вариант альфа-1-антитрипсина, имеющий добавленный к нему сайт N-гликозилирования, при окрашивании наблюдается в виде полосы, которая располагается в относительно более высоком положении, чем альфа-1-антитрипсин дикого типа в SDS-PAGE-анализе. Это показывает, что молекулярная масса варианта альфа-1-антитрипсина увеличивается при гликозилировании.
Кроме того, очищенный вариант альфа-1-антитрипсина обладает превосходной устойчивостью в организме, что видно по заметному увеличению площади под кривой зависимости концентрации лекарственного средства от времени (AUC) и периода полужизни in vivo (t1/2). Однако в случае варианта (I26T), в котором аминокислота в 26ом положении альфа-1-антитрипсина заменяется треонином, устойчивость in vivo не улучшалась даже при добавлении сайта N-гликозилирования. Кроме того, добавление сайта гликозилирования к участку петли (петля A, петля B, петля C, петля D, или петля E), как описано в WO 2008/151845, или поблизости от участка петли не оказывает существенного влияния на улучшение устойчивости in vivo вариантов альфа-1-антитрипсина. Кроме того, поскольку гликозилирование участка петли может оказывать влияние на активность альфа-1-антитрипсина, который в основном функционирует как ингибитор протеаз, очень важно выбрать положение гликозилирования, не оказывающее влияния на активность альфа-1-антитрипсина.
Также было подтверждено, что очищенный вариант альфа-1-антитрипсина сохранял ингибирующее действие на эластазу. Кроме того, известно, что константа скорости ассоциации человеческого альфа-1-антитрипсина находилась в основном в пределах от 1.0±0.2×105 (Boudier С., 1994) до 1.67×106 M-1сек-1 (Terashima M, et. al., Appl. Microbiol. Biotechnol., 52(4), 516-523, 1999). Человеческий альфа-1-антитрипсин дикого типа и его варианты согласно настоящему изобретению имеют константы скорости ассоциации и константы равновесия, сходные с константами человеческого альфа-1-антитрипсина. Следовательно, можно видеть, что гликозилирование N-конца альфа-1-антитрипсина не влияло на ингибирование активности эластазы.
Кроме того, настоящее изобретение имеет отношение к варианту гибридного белка альфа-1-антитрипсина, имеющему увеличенное время полужизни в организме. При этом гибридный белок получают путем соединения двух вариантов альфа-1-антитрипсина друг с другом.
Настоящие изобретатели получили двойной вариант альфа-1-антитрипсина, в котором аминокислота пролин в 357ом положении, которое было P2 положением варианта альфа-1-антитрипсина, была дополнительно заменена аспарагином; получили гибридный белок, в котором гранулоцитарный колониестимулирующий фактор был связан с двойным вариантом альфа-1-антитрипсина; провели фармакокинетическое исследование и подтвердили, что гибридный белок обладал повышенной устойчивостью в организме (смотри Экспериментальный Пример 5). Из этих результатов видно, что период полужизни in vivo гетерогенного белка, например физиологически активного белка, увеличивалось, когда физиологически активный белок был связан с двойным вариантом альфа-1-антитрипсина.
Следовательно, настоящее изобретение имеет отношение к варианту гибридного белка альфа-1-антитрипсина, при этом время полужизни in vivo другого гетерогенного белка увеличивается путем связывания гетерогенного белка с вариантом альфа-1-антитрипсина. Тип гетерогенного белка не ограничивается, тем не менее, он может быть физиологически активным пептидом или физиологически активным белком.
Вариант гибридного белка альфа-1-антитрипсина, имеющий увеличенный период полужизни, можно получить путем связывания двух или более очищенных вариантов альфа-1-антитрипсина. В результате предыдущих исследований Sytkowski, A.J. et. al. было сделано сообщение, что когда эритропоэтин (ЕРО) был связан с использованием подходящего линкера с целью получения гибридного белка ЕРО-ЕРО, гибридный белок обладал значительно повышенной активностью и более длительным периодом полужизни в организме, чем мономер ЕРО (Sytkowski, A.J., et. al., J. Biol. Chem., 274, 24773-24778, 1999). Следовательно, когда два или более вариантов альфа-1-антитрипсина настоящего изобретения связаны друг с другом, ожидается, что период полужизни гибридного белка будет увеличен по сравнению с мономером варианта альфа-1-антитрипсина. Кроме того, когда физиологически активный пептид или иммунорегуляторный фактор или цитокин или тому подобное с коротким периодом полужизни в организме связывается с вариантом альфа-1-антитрипсина согласно настоящему изобретению, ожидается, что период полужизни in vivo будет существенно увеличиваться, тем самым демонстрируя достаточно устойчивое действие.
Кроме того, настоящее изобретение имеет отношение к композиции, предназначенной для предотвращения или лечения дефицита альфа-1-антитрипсина, включающей вариант альфа-1-антитрипсина в качестве активного ингредиента.
В дополнение к этому, настоящее изобретение имеет отношение к способу предотвращения или лечения дефицита альфа-1-антитрипсина, который включает введение терапевтически эффективного количества варианта альфа-1-антитрипсина пациенту.
Как описано выше, вариант альфа-1-антитрипсина согласно настоящему изобретению обладает превосходной устойчивостью в организме и сохраняет ингибирующее действие в отношении эластазы, в силу того, что период полужизни в крови (t1/2) и площадь под кривой зависимости концентрации лекарственного средства от времени (AUC) существенно увеличиваются при добавлении сайта N-гликозилирования в результате мутации аминокислоты между 1ым и 25ым положениями N-конца альфа-1-антитрипсина. Следовательно, вариант альфа-1-антитрипсина согласно настоящему изобретению может использоваться для предотвращения или лечения дефицита альфа-1-антитрипсина. Дефицит альфа-1-антитрипсина включает хроническую обструктивную болезнь легких (COPD) или цирроз печени, предпочтительно эмфизему легких, однако настоящее изобретение не ограничивается этим.
В дополнение к варианту альфа-1-антитрипсина композиция согласно настоящему изобретению может включать, по меньшей мере, один известный активный ингредиент, способный предотвращать или лечить дефицит альфа-1-антитрипсина.
Композиция согласно настоящему изобретению дополнительно может включать, по меньшей мере, один фармацевтически приемлемый носитель в дополнение к активному ингредиенту, как описано выше, для целей введения. Фармацевтически пригодный носитель может использоваться в комбинации, по меньшей мере, с одним средством, выбранным из группы, состоящей из физиологического раствора, стерильной воды, раствора Рингера, забуференного солевого раствора, раствора декстрозы, раствора мальтодекстрина, глицерина, этанола и их смеси. При необходимости может быть добавлена другая типичная добавка, такая как антиоксидант, буфер и бактериостатическое средство. Кроме того, разбавитель, диспергирующее вещество, поверхностно-активное вещество, связующее вещество и смазывающее вещество дополнительно добавляют в композицию, которая затем может быть заключена в состав для инъекции или в состав пилюли, капсулы, гранулы или таблетки. Кроме того, композиция может быть создана в соответствии с болезнями или ингредиентами с использованием надлежащего способа, известного в соответствующем уровне техники, или метода, раскрытого в последней редакции Фармации Ремингтона (Remington′s Pharmaceutical Science, Mack Publishing Company, Easton PA).
Композиция согласно настоящему изобретению может быть введена перорально или парентерально (например, с помощью внутривенной, подкожной или внутрибрюшинной инъекции, ингаляции или местного применения) в соответствии с желательным методом, и может использоваться для генной терапии с использованием варианта альфа-1-антитрипсина согласно настоящему изобретению. Доза композиции может варьировать в зависимости от веса, возраста, пола и состояния здоровья пациента, диеты, времени введения, способа введения, скорости высвобождения медикамента и тяжести болезни. Доза варианта альфа-1-антитрипсина, которая вводится один раз в неделю, - это доза менее чем 60 мг/кг (это доза альфа-1-антитрипсина), однако композиция в этой дозе показывает фактически такую же клиническую эффективность. Кроме того, когда вариант альфа-1-антитрипсина вводится в той же самой дозе как альфа-1-антитрипсин дикого типа, ожидается, что композиция будет демонстрировать ту же самую клиническую эффективность, даже когда продолжительность введения увеличивается.
Композиция настоящего изобретения может использоваться отдельно или в комбинации с хирургическим лечением, гормональной терапией, лекарственной терапией и с методами, использующими модификатор биологического ответа.
Далее для лучшего понимания настоящего изобретения предоставляются предпочтительные Примеры и Экспериментальные Примеры. Однако следует понимать, что предоставленное здесь подробное описание предназначается только для лучшего понимания настоящего изобретения и не предназначается для ограничения объема настоящего изобретения.
Пример 1: Получение альфа-1-антитрипсина, его варианта и димера
1-1. Создание вектора экспрессии pAV1
Вектор pAV1, созданный с помощью соответствующей модификации исходного вектора pSGHVO (GenBank, учетный № AF 285183) с целью производственного применения, использовали в качестве вектора экспрессии для клонирования в настоящем изобретении. Исходным вектором был лабораторный вектор, созданный для того, чтобы легко очищать белок, обладающий физиологической активностью, в том случае, когда белок человеческого происхождения сверхэкспрессировался в высокой концентрации и высвобождался из животных клеток, но не проявлял активность, когда белок экспрессировался в бактерии, такой как Е. coli. Однако, так как исходный вектор имел различные ограничения по использованию в производстве, исходный вектор был модифицирован, чтобы использоваться в производстве с высоким уровнем экспрессии белка, что является самым большим преимуществом вектора pSGHV0.
1-2. Создание вектора альфа-1-антитрипсина (подтип M3) (рТ003)
Вектор альфа-1-антитрипсина (рТ003) был сконструирован клонированием гена альфа-1-антитрипсина (M3) в вектор pAV1, с использованием hMU001448 (KRIBB) в качестве матрицы. Подробнее, hMU001448 (KRIBB) матрица была амплифицирована с помощью полимеразной цепной реакции (ПЦР) с использованием двух праймеров: XhoAT прямой праймер (5′-CCCTCCTCGAGAATGCCGTCTTCTGTCTCG-3′, SEQ ID NO: 1) и ATNot обратный праймер (5′-GGGCCCGCGGCCGCAGTTATTTTTGGGTGG G-3′, SEQ ID NO: 2). Оба конца амплифицированного нуклеотида были расщеплялены двумя рестрикционными ферментами XhoI и NotI и соединены с вектором экспрессии pAV1, имеющим сайт рестрикции XhoI/NotI, давая в результате конструкцию вектора альфа-1-антитрипсина (рТ003, SEQ ID NO: 39). Этот вектор альфа-антитрипсина (рТ003) схематически показан на ФИГ. 1.
1-3. Получение варианта альфа-1-антитрипсина (M3)
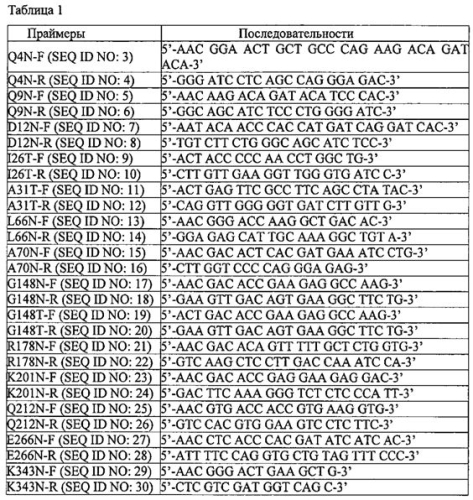
Для получения множества вариантов альфа-1-антитрипсина, имеющих дополнительный сайт гликозилирования, вектор альфа-1-антитрипсина (рТ003), полученный в Примере 1-2, использовали в качестве матрицы. Для получения вариантов альфа-1-антитрипсина использовали пары прямых и обратных праймеров, перечисленные в следующей Таблице 1, и набор для мутагенеза (Enzynomix, EZchangeTM Site-Directed Mutagenesis Kit). Последовательности и положения вариантов альфа-1-антитрипсина показаны на ФИГ. 2.
Так как целью мутаций всех вариантов альфа-1-антитрипсина было добавление сайта N-гликозилирования, первоначальная аминокислота заменялась, как правило, аспарагином с образованием последовательности Asn-X-Thr, которая, как известно, является сайтом N-гликозилирования в животных клетках. В некоторых случаях, однако, соседняя с остатком аспарагина аминокислота была заменена треонином, для того чтобы использовать остаток аспарагина, присутствующий в первоначальной последовательности ДНК.
1-4. Создание вектора альфа-1-антитрипсина (подтип M2) (рТ006)
Вектор альфа-1-антитрипсина (рТ006) был сконструирован клонированием гена альфа-1-антитрипсина в pAV1 вектор, с использованием рЕАТ8 (кодирующий a1-AT (M2) cDNA) в качестве матрицы. Подробнее, рЕАТ8 (кодирующий a1-AT(M2) cDNA) матрица была амплифицирована с помощью ПЦР с использованием двух праймеров: XhoAT прямой праймер (5′-CCCTCCTCGAGAATGCCGTCTTCTGTCTCG-3′, SEQ ID NO: 1) и ATNot обратный праймер (5′-GGGCCCGCGGCCGCAGTTATTTTTGGGTGGG-3′, SEQ ID NO: 2). Оба конца амплифицированного нуклеотида были расщеплены двумя рестрикционными ферментами XhoI и NotI и соединены с вектором экспрессии pAV1, имеющим сайт рестрикции XhoI/NotI, давая в результате конструкцию вектора альфа-1-антитрипсина (рТ006, SEQ ID NO: 40).
1-5. Получение варианта альфа-1-антитрипсина (M2)
Для получения варианта альфа-1-антитрипсина (M2) с дополнительным сайтом гликозилирования вектор альфа-1-антитрипсина (рТ006), полученный в Примерах 1-4, использовали в качестве матрицы. Для получения вектора варианта (M2) альфа-1-антитрипсина (AT9N (M2)) использовали пару из двух праймеров (т.е., прямой праймер (SEQ ID NO: 5) и обратный праймер (SEQ ID NO: 6)) и набор для мутагенеза (Enzynomix, EZchangeTM Site-Directed Mutagenesis Kit). Аминокислотная последовательность полученного в результате варианта альфа-1-антитрипсина приведена в SEQ ID NO: 42.
1-6. Получение димеров альфа-1-антитрипсинов и их вариантов
Для получения димера варианта альфа-1-антитрипсина был использован pAT9N (подтип M2) в качестве варианта альфа-1-антитрипсина. Для создания вектора димера использованный в качестве матрицы pAT9N (M2) был амплифицирован с помощью ПЦР с использованием двух праймеров: XhoAT прямой праймер 2 (5′-GGGCCCCTCGAGGCCACCATGCCGTCTTCTGTCTCGTGGGGCATCCTCCTGCTGGCAGGCC
TGTGCTGCCTGGTCCCTGTCTCCCTGGCTGAAGATCCCCAGGGA-3′, SEQ ID NO: 31) и ATBam обратный праймер 2 (5′-GGGGGGATCCTCTTTTTGGGTGGGATTCAC-3′, SEQ ID NO: 32). Оба конца амплифицированного нуклеотида были расщеплены двумя рестрикционными ферментами XhoI и BamHI и соединены с вектором экспрессии pAT9N (M2), имеющим сайт рестрикции XhoI/BamHI, давая в результате конструкцию вектора димера альфа-1-антитрипсина (pAT9N (M2)-AT9N (M2)).
1-7. Экспрессия димеров альфа-1-антитрипсинов и их вариантов
Для экспрессии белков альфа-1-антитрипсина (Т003, Т006), его вариантов и димера, полученных в Примерах 1-2, 3, 4, 5 и 6, использовали клетки яичника китайского хомячка (СНО-K1). СНО-K1 инкубировали в среде Игла, модифицированной по Дульбекко (DMEM), с добавлением 10% эмбриональной телячьей сыворотки (FBS) и антибиотика, в условиях 5% СО2 и 37°C. За день до введения векторов экспрессии, содержащих альфа-1-антитрипсин и его вариант, клетки высевали при плотности 5×106 клеток в 100 мм чашку для культивирования и культивировали. Затем смешивали 800 мкл DMEM без FBS, антибиотик и 10 мкг каждого из векторов экспрессии, содержащих альфа-1-антитрипсин, его вариант и димер, и выдержали при комнатной температуре в течение одной минуты. Затем полученную смесь смешивали с 20 мкг полиэтиленимина (PEI, linear, Polysciences Inc. (кат. номер 23966, MB: около 25,000)) и выдержали при комнатной температуре приблизительно в течение от 10 до 15 минут. В этом случае культивированные клетки днем