Способ оценки подавляющего действия цитомегаловирусной инфекции на третьем триместре гестации на активность цитохромоксидазы в синцитиотрофобласте ворсинок плаценты, приводящей к нарастанию числа ядер в состоянии апоптоза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к способу оценки угрозы гибели ворсинок плаценты и неполноценного развития плода при обострении цитомегаловирусной инфекции в третьем триместре гестации. Для этого измеряют титр антител к цитомегаловирусу, и при его значении 1:1600, снижении активности цитохрооксидазы в синцитиотрофобласте до 2,50±0,015 усл.ед. и увеличении числа ядер в состоянии апоптоза до 3,0±0,03% создается угроза гибели ворсинок плаценты и неполноценного развития плода. Способ позволяет оценить угрозу гибели ворсинок плаценты и неполноценного развития плода за счет подавления цепи окислительных процессов. 2 ил.
Реферат
1. Цель исследования - выявить, что обострение цитомегаловирусной инфекции в период гестации подавляет в синцитиотрофобласте активность цитохромоксидазы, вызывая увеличение числа ядер в состоянии апоптоза.
2. Изобретение относится к медицине, а именно к прогнозу состояния ядер в синцитиотрофобласте ворсинок плаценты при обострении во время гестации цитомегаловирусной инфекции, под влиянием которой подавляется активность цитохромоксидазы.
3. Раскрытие изобретения
Цитохромы - гемопротеиды, основная функция которых заключается в переносе электронов, выполняя одну из важнейших ролей в тканевом дыхании. В зависимости от конфигурации простетической группы цитохромы можно подразделить на четыре типа: a, b с, d. Основная функция цитохромов - это их участие в цепи переносчиков электронов: b-c1-(с-а)-а3-O2 [4]. Окислительный цитохром С восстанавливается химическими реагентами, такими как цитохромредуктазы. Цитохром аз (цитохромоксидаза; цитохром - C; О2-оксидоредуктаза) - основной фермент, переносящий электроны от цитохрома C на О2 в процессе окислительного фосфорилирования [5]. Окисление цитохрома С сопровождается появлением мембранного протонного потенциала, который используется клеткой для обеспечения метаболических процессов, особенно для синтеза АТФ. Фермент располагается на внутренней мембране митохондрий [4]. Таким образом, цитохром С-оксидаза кодируется в митохондриальном геноме и синтезируется на митохондриальных рибосомах [8]. Перенос электрона сопровождается трансмембранным переносом двух протонов из матрикса в цитозольное пространство и сопровождается формированием протонного потенциала [7]. Цитохромоксидаза в клетках человека крайне необходима для обеспечения их жизнедеятельности. Нарушение биосинтеза цитохрома С оксидазы приводит к гибели клеток.
4. Новая техническая задача
Цитомегаловирусные белки, внедряясь в синцитиотрофобласт ворсинок плаценты, становятся ксенобиотиками на борьбу, с которыми вступают ферменты группы цитохромоксидазы. В случае высокой агрессивности возбудителя ферментативное противоборство против ксенобиотика не справляется и происходит снижение активности цитохромоксидазы, что при увеличении процента ядер переходящих в состояние апоптоза ставит под угрозу гибель ворсинок плаценты.
5. В доступной литературе анналов по данному вопросу не отмечено.
6. Осуществление изобретения
6.1. Исследования проводились на базе акушерского отделения ФГБУ «Дальневосточный научный центр физиологии и патологии дыхания» СО РАМН. Обследовано 15 беременных на третьем триместре гестации с обострением цитомегаловирусной инфекции с титром 1:1600. Контролем служили 15 беременных, не болевших цитомегаловирусной инфекцией в период гестации. У беременных симптоматически цитомегаповирусная инфекция проявлялась в виде острого респираторного заболевания, сопровождающегося ринофарингитом. Клинический диагноз - обострение цитомегаловирусной инфекции устанавливался при комплексном исследовании периферической крови на наличие IgM или четырехкратного и более нарастания титра антител IgG в парных сыворотках в динамике через 10 дней, индекса авидности более 65%, а также ДНК цитомегаловируса. Исследования проводились с учетом требований Хельсинской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных исследований с участием человека» с поправками 2008 г. и правилами клинической практики в Российской Федерации, утвержденными приказом Министерства РФ №266 от 19.06.2003 г. Верификация цитомегаловируса, определение типоспецифических антител класса IgM и IgG, индекса авидности осуществлялись методами иммуноферментного анализа на микропланшетном ридере «Stst-Fax-2100» с использованием тест-систем ЗАО «Вектор-Бест» (Новосибирск), выявление ДНК цитомегаловируса методами ПЦР на аппарате ДТ-96 с использованием наборов НПО «ДНК-технология» (Москва).
6.2. Определение цитохромоксидазы в плаценте выполнялось по методу Муг [1, 2]. Срезы изготовляли на замораживающем микротоме толщиной 7-10 микрон, помещая первоначально в физиологический раствор при pH 7,2, а затем переносили их в инкубационный раствор, который приготовляли при температуре 37°C следующего состава: смешивали в равном количестве 0,01 М (0,17%) диметил-p-фенилендиамин-HCl, растворенный в 0,066 М фосфатном буфере pH 5,8, содержащем 1% NaCl и 0,14% раствор α-нафтола. Контрольные срезы промывали в растворе азида натрия, изготовленного на физиологическом растворе поваренной соли в концентрации 0,005 М (0,019%). После инкубации в течение 10 мин споласкивали в физиологическом растворе. Срез покрывали 5% раствором ацетата калия, накрывали покровным стеклом, окантовывая расплавленным парафином. Препараты изучали под цифровым микроскопом МТ (Япония), связанным с компьютером по программе «Scion Corporation» (USA) с целью проведения цитофотометрической обработки продуктов реакции. Морфологическая классификация апоптоза на парафиновых срезах проводилась по метке концов фрагментов ДНК (in situ end labeling metod, ISEL) с инкубацией в смеси 4 нуклеотидов dATF, dGTF, dCTF biotin II dUTP, ДНК полимераза - E. Coli («Sigma», USA) [3].
7. В процессе исследования были получены следующие результаты
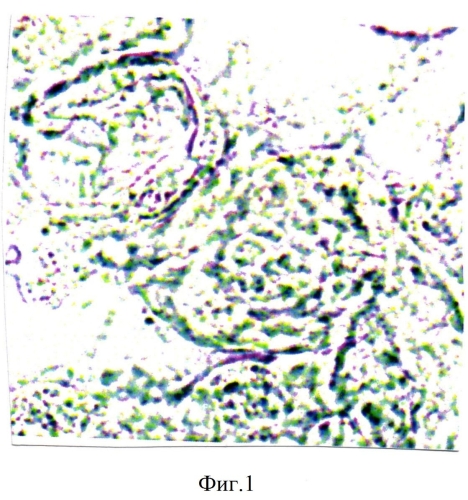
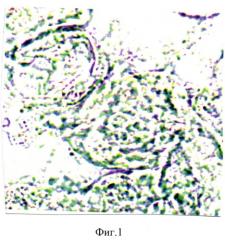
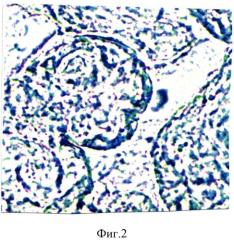
При обострении цитомегаловирусной инфекции в третьем триместре беременности отмечались функциональные нарушения в плаценте. У рожениц анализировалась активность цитохромоксидазы в синцитиотрофобласте ворсинок плаценты. В синцитиотрофобласте ворсинок плаценты рожениц, перенесших в третьем триместре обострение цитомегаловирусной инфекции с титром антител 1:1600, отмечалось снижение активности цитохромоксидазы до 2,50±0,015 усл. ед. (контроль - 7,50±0,03 усл. ед.) (фиг.1, 2). Анализируя содержание количества ядер в синцитиотрофобласте, находящихся в состоянии апоптоза отмечали, что при снижении активности цитохромоксидазы в синцитиотрофобласте число ядер, находящихся в состоянии апоптоза резко увеличивалось: при титре антител к цитомегаловирусу 1:1600 - до 3,0±0,03% (контроль - 0,50±0,015%). Таким образом, белки цитомегаловирусной инфекции, проникая в синцитиотрофобласт, в качестве ксенобиотиков, вступают в противоборство с ферментными системами. Наиболее эффективным элементом, обеспечивающим детоксикацию ксенобиотиков, в частности в синцитиотрофобласте должна быть цитохромоксидаза. В этом случае происходит внедрение атома кислорода в органическое вещество (в данном случае в цитомегаловирусный белок - как ксенобиотик). При этом цитохром окисляется, чтобы затем быть восстановленным дыхательной цепью. Цепь эта сопряжена с генерацией протонного потенциала. Оксигенированный продукт затем подвергается либо дальнейшему окислению с участием цитохромоксидазы, либо удаляется из клетки. Цитомегаловирусный антиген при попадании в синцитиотрофобласт оказывает сильное токсическое действие и подавляет цепь окислительных процессов, вследствие чего наблюдается снижение в синцитиотрофобласте активности цитохромоксидазы и как следствие увеличивается число ядер в синцитиотрофобласте в состоянии апоптоза.
На фигуре 1 изображена гистохимическая реакция на активность цитохромоксидазы в синцитиотрофобласте ворсинок плаценты при обострении в третьем триместре цитомегаловирусной инфекции с титром антител к цитомегаловирусу 1:1600. Реакция на цитохромоксидазу снижается до 2,50±0,015 усл. ед. (контроль - 7,50±0,03 усл. ед.). Гистохимическая реакция по Муг. Увеличение - 10×100.
На фигуре 2 изображена гистохимическая реакция на активность цитохромоксидазы в синцитиотрофобласте ворсинок плаценты у роженицы, не болевшей в течение гестации. Интенсивность реакция на цитохромоксидазу- 7,50±0,03 усл. ед. Гистохимическая реакция по Муг. Увеличение - 10×100.
ЛИТЕРАТУРА
1. Кисели Д. Практическая микротехника и гистохимия. Будапешт, 1962; 400.
2. Лилли Р. Патогистологическая техника и практическая гистохимия. М.: «Мир», 1969; 645.
3. Погорелов В.М., Козинец Г.И. Морфология апоптоза при нормальном и злокачественном гемопоэзе // Гематология и трансфузиология. 1995:43(5); 21-24.
4. Скулачев В.П. Энергетика биологических мембран. М.: «Наука», 1989; 564.
5. Скулачев В.П. Кислород в живой клетке: добро и зло // Соросовский образовательный журнал. 1996: №3; 4-16.
6. Скулачев В.П. Законы биоэнергетики // Соросовский образовательный журнал. 1997: №1; 9-14.
7. Филатов И.А. Биоорганическая химия. 1988: 14(6); 725-745.
8. Wilkstrom М., Krab K. Cytochrome oxidase. A. Synthesis. L. 1988.
Способ оценки угрозы гибели ворсинок плаценты и неполноценного развития плода при обострении цитомегаловирусной инфекции в третьем триместре гестации, включающий измерение в периферической крови титра антител к цитомегаловирусу, и при титре антител к цитомегаловирусу 1:1600, снижении активности цитохромоксидазы в синцитиотрофобласте до 2,50±0,015 усл.ед. и увеличении числа ядер в состоянии апоптоза до 3,0±0,03% создается угроза гибели ворсинок плаценты и неполноценного развития плода.