Стабильные и растворимые антитела, ингибирующие tnfα
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к антителу или фрагменту этого антитела, которое специфически связывается с TNFα человека, причем антитело или фрагмент антитела содержит последовательность каркасной области тяжелой цепи человека и последовательности CDR, происходящие из антитела кролика, а также к композиции для лечения заболеваний, опосредованных TNFα, содержащей вышеуказанное антитело или фрагмент. Раскрыты молекула выделенной нуклеиновой кислоты, кодирующая вариабельную область тяжелой цепи и вариабельную область легкой цепи вышеуказанного антитела или его фрагмента, а также вектор экспрессии, ее содержащий, и клетка-хозяин, содержащая данный вектор. Раскрыты применение вышеуказанного антитела или фрагмента антитела для получения лекарственного средства для лечения или профилактики заболевания, опосредованного TNFα человека, а также их использование в способе лечения или профилактики заболевания, опосредованного TNFα. Изобретение позволяет эффективно проводить лечение или профилактику заболевания, опосредованного TNFα человека, антителами, которые оптимизированы в отношении стабильности, растворимости, связывания с TNFα в условиях in vitro и in vivo и низкой иммуногенности. 7 н. и 17 з.п. ф-лы, 12 ил., 6 табл., 6 пр.
Реферат
Релевантные заявки
Настоящая заявка заявляет приоритет заявки на патент США 61/075640, поданной 25 июня 2008 г., и заявки на патент США 61/075956, поданной 26 июня 2008 г.
Уровень техники
Фактор некроза опухолей альфа (TNFα, также известный как кахетин) представляет собой природный цитокин млекопитающих, продуцируемый клетками многочисленных типов, включая моноциты и макрофаги, в ответ на эндотоксин или другие стимулы. TNFα является основным медиатором воспалительных, иммунологических и патофизиологических реакций (Grell M. et al., 1995, Cell, 83:793-802).
Растворимый TNFα образуется при расщеплении трансмембранного белка-предшественника (Kriegler et al., 1988, Cell, 53:45-53), и секретируемые полипептиды массой 17 кДа подвергаются сборке в растворимые гомотримерные комплексы (Smith et al., 1987, J. Biol. Chem., 262:6951-6954; обзоры по TNFα смотри у Butler et al., 1986, Nature, 320:584; Old, 1986, Science, 230:630). Затем данные комплексы связываются с рецепторами, обнаруживаемыми на поверхности различных клеток. В результате подобного связывания генерируется ряд провоспалительных эффектов, которые включают: (i) высвобождение других провоспалительных цитокинов, таких как интерлейкин IL-6, IL-8 и IL-1; (ii) высвобождение матричных металлопротеиназ и (iii) положительную регуляцию экспрессии эндотелиальных адгезивных молекул, которые дополнительно усиливают воспалительный и иммунный каскад привлечением лейкоцитов во внесосудистые ткани.
Большое количество заболеваний ассоциировано с повышенными уровнями TNFα, многие их которых имеют большое значение в клинике. Было показано, что при ряде заболеваний человека имеется положительная регуляция, включая хронические заболевания, такие как ревматоидный артрит (RA), воспалительные заболевания кишечника, в том числе болезнь Крона и язвенный колит, сепсис, застойную сердечную недостаточность, астму, бронхиальную астму и рассеянный склероз. У мышей, трансгенных по человеческому TNFα, конститутивно продуцируется большое количество TNFα, и у этих животных развивается спонтанный деструктивный полиартрит, напоминающий RA (Keffer et al., 1991, EMBO J., 10:4025-4031). Следовательно, TNFα относится к провоспалительным цитокинам.
В настоящее время хорошо установлено, что TNFα является ключевым соединением в патогенезе RA, который, в свою очередь, является хроническим, прогрессирующим и приводящим к истощению заболеванием, характеризующимся воспалением и разрушением многочисленных суставов, и также проявлением системных симптомов, таких как лихорадка, недомогание и хроническая усталость. Также RA приводит к развитию хронического синовиального воспаления с частым прогрессированием вплоть до разрушения хрящевой и костной ткани. Повышенные концентрации TNFα обнаружены в синовиальной жидкости и периферической крови пациентов, страдающих RA. В том случае, когда пациентам с RA вводят блокирующие TNFα лекарственные средства, то у них уменьшается воспаление, купируются симптомы заболевания и замедляется повреждение суставов (McKown et al., 1999, Arthritis Rheum., 42:1204-1208).
В физиологическом отношении TNFα также ассоциирован с защитой от определенных инфекций (Cerami et al., 1988, Immunol. Today, 9:28). TNFα продуцируется макрофагами, которые были активированы липополисахаридами грамотрицательных бактерий. С учетом этого обстоятельства полагают, что TNFα является эндогенным медиатором центрального значения, который принимает участие в развитии и патогенезе эндотоксического шока в результате бактериального сепсиса (Michie et al., 1989, Br. J. Surg., 76:670-671; Debets et al., 1989, Second Vienna Shock Forum, p. 463-466; Simpson et al., 1989, Crit. Care Clin., 5:27-47; Waage et al., 1987, Lancet, 1:355-357; Hammerle et al., 1989, Second Vienna Shock Forum, p. 715-718; Debets et al., 1989, Crit. Care Med., 17:489-497; Calandra et al., 1990, J. Infect. Dis., 161:982-987; Revhaug et al., 1988, Arch. Surg., 123:162-170).
Также было показано, что как и в других системах органов, TNFα играет ключевую роль в центральной нервной системе, в частности, при воспалительных и аутоиммунных заболеваниях нервной системы, включая рассеянный склероз, синдром Гуллиана-Барре и тяжелую миастению, и при дегенеративных расстройствах нервной системы, включая болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона. TNFα также принимает участие в развитии расстройства связанных систем сетчатки и мышц, включая неврит зрительного нерва, макулярную дегенерацию, диабетическую ретинопатию, дерматомиозит, амиотрофический латеральный склероз и мышечную дистрофию, а также травмы нервной системы, в том числе травматическое повреждение головного мозга, острое повреждение спинного мозга и инсульт.
Гепатит представляет собой другое связанное с TNFα воспалительное заболевание, которое среди других причин может быть вызвано вирусными инфекциями, включая вирус Эпштейна-Барра, цитомегаловирус и вирусы гепатита А-Е. Гепатит вызывает острое воспаление печени в портальной и лобулярной области с последующим развитием фиброза и опухолей. Также TNFα может опосредовать кахексию при злокачественном заболевании, которая в большинстве случаев приводит к прогрессированию заболевания и летальному исходу (Tisdale M.J., 2004, Langenbecks Arch. Surg., 389:299-305).
Ключевая роль, которую играет TNFα в развитии воспаления, в клеточных иммунных ответах и патологии многих заболеваний, привела к поиску антагонистов TNFα. Одной группой антагонистов TNFα, разработанных для лечения заболеваний, опосредованных TNFα, являются антитела или фрагменты антител, которые специфически связываются с TNFα и, тем самым, блокируют его функцию. При применении анти-TNFα-антител было показано, что блокада TNFα может изменить направленность эффектов TNFα, включая снижение уровня IL-1, GM-CSF, IL-6, IL-8, адгезивных молекул и разрушение тканей (Feldmann et al., 1997, Adv. Immunol., 1997:283-350). Специфические ингибиторы TNFα, которые недавно стали промышленно доступными, включают моноклональные, химерные мышиные-человеческие антитела против TNFα (инфликсимаб, ремикадТМ; Centocor Corporation/Johnson&Johnson), которые показали клиническую эффективность при лечении RA и болезни Крона. Все имеющиеся на рынке ингибиторы TNFα вводят внутривенно или подкожно с интервалом одну неделю или более в виде болюс-инъекций, что обеспечивает высокие начальные концентрации, которые постепенно снижаются к моменту следующей инъекции. Объем распределения ограничен.
Несмотря на описанные достижения, остается потребность в новых и эффективных формах антител или других иммуносвязывающих соединений для лечения TNFα-ассоциированных заболеваний, таких как RA. В частности, имеется насущная необходимость в иммуносвязывающих соединениях с оптимальными функциональными свойствами для эффективного и продолжительного лечения артрита и других TNFα-ассоциированных заболеваний, которые обеспечат более гибкое введение и формуляцию и которые обладают повышенным проникновением в ткани и, тем самым, обеспечат высокий объем распределения.
Сущность изобретения
Следовательно, основной целью изобретения является обеспечение стабильных и растворимых антител или других иммуносвязывающих соединений, которые специфически связываются с TNFα в условиях in vitro и in vivo. В предпочтительном варианте осуществления указанное иммуносвязывающее соединение представляет собой scFv-антитело или Fab-фрагмент.
Настоящее изобретение относится к стабильным scFv-антителам или Fab-фрагментам, специфическим к TNFα, которые содержат определенные последовательности легкой цепи и тяжелой цепи, оптимизированные в отношении стабильности, растворимости и связывания с TNFα в условиях in vitro и in vivo и низкой иммуногенности. Указанные антитела предназначены для диагностики и/или лечения TNFα-опосредованных заболеваний. Также раскрываются нуклеиновые кислоты, векторы и клетки-хозяева для экспрессии рекомбинантных антител по изобретению, способы их выделения и применение указанных антител в медицине.
Краткое описание фигур
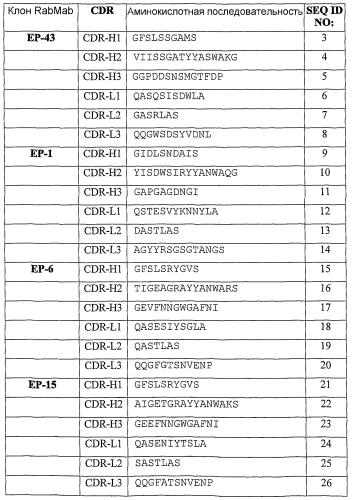
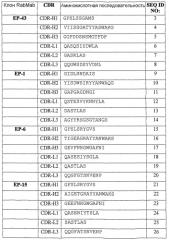
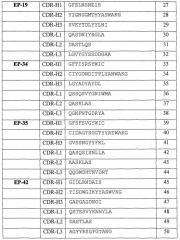
На фигуре 1 показана относительная способность 44 супернатантов гибридом с антителами RabMab против TNFα к связыванию TNFα (тест Biacore) и нейтрализации активности последнего (тест на клетках L929).
На фигуре 2 показана способность 20 одноцепочечных антител RabMab против TNFα и 7 гуманизированных одноцепочечных антител против TNFα к избирательному связыванию с TNFα (тест секреторной ELISA, пожалуйста, обратите внимание, что для данного теста использовали супернатант бактериальной культуры, который не нормализовали по содержанию одноцепочечных антител).
На фигуре 3 показана кинетика связывания антитела EP43max (фигура 3a) и кинетика связывания антитела EP34max (фигура 3b) с человеческим TNFα.
На фигуре 4 показана активность антител EP43max (пустые квадраты) и эффективность антител ESBA105 (закрашенные кружки). EC50 EP43max составляет 1 нг/мл и EC50 ESBA105 составляет 6,5 нг/мл.
На фигуре 5 показана функциональная активность антител EP43max, EP6max и EP19max в тесте термического развертывания молекулы белка (FTIR).
На фигуре 6 приведены кривые тепловой денатурации антитела EP43max и его производных при сравнении FTIR анализом.
На фигуре 7 показано сравнение антитела EP43max (фигура 7a) и его варианта EP43minmax (фигура 7b) в тесте теплового стресса.
На фигуре 8 показано определение CDR H1, использованного в данном документе для трансплантации антигенсвязывающих сайтов из кроличьих моноклональных антител в каркасные области человеческого антитела с высокой растворимостью и стабильностью.
На фигуре 9а показана активность антитела Epi34max и адалимумаба в блокировании цитотоксической активности рекомбинантного человеческого TNFalpha в концентрации 1000 пг/мл (мышиные клетки L929). Было установлено, что IC50 Ep34max и адалимумаба составили соответственно 1,03 нг/мл и 8,46 нг/мл.
На фигуре 9b показана активность адалимумаба и антитела Ep34max в блокировании цитотоксической активности рекомбинантного человеческого TNFalpha в концентрации 10 пг/мл (человеческие клетки Kym-1). Было установлено, что значения IC50 инфликсимаба и Ep34max (791) равнялись соответственно 66,2 нг/мл и 0,69 нг/мл.
На фигуре 10а показана активность антитела Epi34max и инфликсимаба в блокировании цитотоксической активности рекомбинантного человеческого TNFalpha в концентрации 1000 пг/мл (мышиные клетки L929). Было установлено, что IC50 Ep34max и инфликсимаба равнялись соответственно 1,04 нг/мл и 13,9 нг/мл.
На фигуре 10b показана эффективность инфликсимаба и антитела Ep34max (791) в блокировании цитотоксической активности рекомбинантного человеческого TNFalpha в концентрации 10 пг/мл (человеческие клетки Kym-1). Было установлено, что значения IC50 инфликсимаба и Ep34max составили соответственно 14,8 нг/мл и 0,63 нг/мл.
На фигуре 11 показан график тепловой денатурации BioATR FT-IR по данным трансформированного инфракрасного спектра Fourier в области амидной полосы I антитела Ep34max по сравнению с антителом ESBA903. V50 для ESBA903 составляла 71,12 и для Ep34max 71,50; крутизна ESBA903 2,481 и для Ep34max 2,540.
На фигуре 12 приведены кривые термического развертывания DSC scFv-антител Ep34max и ESBA903. Тпл. антитела Ep34max составляет 78,11°С и Тпл. антитела ESBA903 равняется 76,19°С.
Подробное описание изобретения
Основной целью изобретения является обеспечение стабильного и растворимого иммуносвязывающего соединения, которое специфически связывается с TNFα в условиях in vitro и in vivo. В предпочтительном варианте осуществления указанным производным антитела является scFv-антитело или Fab-фрагмент. Иммуносвязывающие соединения по изобретению предпочтительно содержат легкую и/или тяжелую цепь.
Определения
Для облегчения понимания настоящего изобретения приводятся определения некоторых терминов. Дополнительные определения приводятся по тексту подробного описания.
В том смысле, в котором термин «антитело» используется в данном документе, он является синонимом «иммуноглобулина». Антитела по настоящему изобретению могут представлять собой целые иммуноглобулины или их фрагменты, содержащие, по меньшей мере, одну вариабельную область иммуноглобулина, такую как одноцепочечная вариабельная область, Fv (Skerra A. and Pluckthun A., 1988, Science, 240:1038-1041), scFv (Bird R.E. et al., 1988, Science, 242:423-426; Huston J.S. et al., 1988, Proc. Natl. Acad. Sci. USA, 85:5879-5883), Fab, (Fab')2 или другие фрагменты, хорошо известные специалистам в данной области.
Термин «CDR» относится к одному из шести гипервариабельных участков внутри вариабельных областей антитела, которые в основном отвечают за связывание с антигеном. Одно из наиболее часто используемых определений шести CDR приводится Kabat E.A. et al., 1991, Sequences of proteins of immunological interest. NIH Publication 91-3242.
В том смысле, в котором в данном документе используется термин CDR, он относится только к CDR1, CDR2 и CDR3 вариабельной области легкой цепи (CDR L1, CDR L2, CDR L3 или L1, L2, L3), а также к CDR2 и CDR3 вариабельной области тяжелой цепи (CDR Н2, CDR Н3 или Н2, Н3). Однако в том смысле, в котором в данном документе определяется CDR1 вариабельной области тяжелой цепи (CDR Н1 или Н1), то он определяется по следующим остаткам (система нумерация Kabat): начинается с положения 26 и заканчивается перед положением 36. По существу это слитая конструкция CDR Н1, как иначе определяется по Kabat и Chotia (также для иллюстрации смотри фигуру 8).
В том смысле, в котором в данном документе используется термин «каркасная область», он относится к участку вариабельной области, VL или VH, который служит в качестве каркаса для антигенсвязывающих петель (CDR) данной вариабельной области. По существу это вариабельная область без CDR.
Термины «одноцепочечное антитело», «одноцепочечный фрагмент Fv» или «scFv» относятся к молекуле, содержащей вариабельную область тяжелой цепи антитела (или область VH) и вариабельную область легкой цепи антитела (или область VL), соединенные через линкер. Такие молекулы scFv имеют общее строение: NH2-VL-линкер-VH-СООН или NH2-VH-линкер-VL-СООН.
Термин «иммуносвязывающее соединение» относится к молекуле, которая содержит весь или часть антигенсвязывающего участка антитела, например, всю или часть вариабельной области тяжелой и/или легкой цепи, так, что иммуносвязывающее соединение специфически распознает антиген-мишень. Не ограничивающие примеры иммуносвязывающих соединений включают полноразмерные молекулы иммуноглобулинов и scFv, а также фрагменты антител, включая, не ограничиваясь этим, (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком, в шарнирной области; (iii) Fab'-фрагмент, состоящий из доменов VH и CH1; (v) Fv-фрагмент, состоящий из областей VL и VH одного плеча антитела; (vi) однодоменное антитело, такое как Dab-фрагмент, который состоит из доменов VL и VH, антитело Camelid или Shark (например, shark Ig-NAR нанотела®); и (vii) нанотело, область тяжелой цепи, содержащее вариабельную область и две константных области.
Система нумерации, используемая в данном документе для идентификации положений аминокислотных остатков в вариабельных областях тяжелой и легкой цепи антитела, представляет систему, описанную A.Honegger, J. Mol. Biol., 309, 2001, 657-670 (система AHo). Таблицы перевода между таблицами системы AHo и наиболее часто используемой системой, описанной Kabat et al. (Kabat E.A. et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, US Department Health and Human Services, NIH Publication No. 91-3242), приведены A. Honegger, J. Mol. Biol., 309, 2001, 657-670.
Термин «эпитоп» или «антигенная детерминанта» относится к участку на антигене, с которым специфически связывается иммуноглобулин или антитело (например, TNF). Как правило, эпитоп содержит, по меньшей мере, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот в уникальной пространственной конформации. Смотри, например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, G.E. Morris, Ed. (1996).
Термины «специфическое связывание», «избирательное связывание», «избирательно связывается» и «специфически связывается» относятся к антителу, которое связывается с эпитопом на заранее определенном антигене. Как правило, антитело связывается с аффинностью (KD), составляющей менее чем 10-7 М, например, примерно менее чем 10-8 М, 10-9 М или 10-10 М, или даже ниже.
Термин KD относится к константе равновесия диссоциации конкретного взаимодействия антитело-антиген. Как правило, антитела по изобретению связываются с TNF с константой равновесия диссоциации (KD) примерно менее чем 10-7 М, например, примерно менее чем 10-8 М, 10-9 М или 10-10 М, или даже ниже, по данным технологии поверхностного плазмонного резонанса (SPR) на аппарате BIACORE.
В том смысле, в котором в данном документе используется термин «идентичность», он относится к совпадению последовательностей двух полипептидов, молекул или двух нуклеиновых кислот. В том случае, когда положение в обеих из двух сравниваемых последовательностях занято одинаковым основанием или аминокислотным мономером (например, если положение в каждой из двух молекул ДНК занято аденином или положение в каждом из полипептидов занято лизином), то тогда соответствующие молекулы являются идентичными по данному положению. «Процентная идентичность» между двумя последовательностями представляет собой функцию числа совпадающих положений в двух последовательностях, деленное на число сравниваемых положений, ×100. Например, если совпадают 6 из 10 положений в двух последовательностях, то тогда две последовательности обладают 60% идентичностью. В качестве примера: ДНК-последовательности CTGACT и CGGTT обладают 50% идентичностью (в целом совпадают 3 из 6 положений). Как правило, сравнение проводят, когда две последовательности выравнивают с получением максимальной идентичности. Такое выравнивание можно проводить с использованием, например, метода Needleman et al., 1970, J. Mol. Biol., 48:443-453, применяя соответственно такие компьютерные программы, как Align program (DNAstar, Inc.). Также можно определить процентную идентичность для двух аминокислотных последовательностей с использованием алгоритма E. Meyers and Miller (Comput. Appl. Biosci., 4:11-17, 1988), который включен в программу ALIGN (версия 2.0), с помощью таблицы весов остатков PAM120, штрафа за пропуск длиной 12 и штрафа за пропуск длиной 4. Кроме того, можно определить процентную идентичность между двумя аминокислотными последовательностями с использованием алгоритма Needleman и Wunsch (J. Mol. Biol., 48:444-453, 1970), который включен в программу GAP в программном пакете GCG (доступен на сайте www.gcg.com), с матрицей Blossum 62 или с матрицей PAM250 и весом пропуска 16, 14, 12, 10, 8, 6 или 4 и весом длины 1, 2, 3, 4, 5 или 6.
«Сходными» последовательностями являются последовательности, которые при выравнивании имеют идентичные или сходные аминокислотные остатки, где сходные остатки представляют консервативные замены на соответствующие аминокислотные остатки в подвергшейся выравниванию референс-последовательности. В этом отношении «консервативная замена» остатка в референс-последовательности представляет замену на остаток, который в физическом или функциональном отношении аналогичен соответствующему референс-остатку, например, имеет аналогичный размер, форму, электрический заряд, химические свойства, в том числе способность к образованию ковалентных или водородных связей или тому подобное. Таким образом, «модифицированная консервативной заменой» последовательность представляет последовательность, которая отличается от референс-последовательности или последовательности дикого типа по одной или более консервативным заменам. «Процентная сходность» между двумя последовательностями представляет собой функцию числа положений, которые содержат совпадающие остатки или консервативные замены в двух последовательностях, деленное на число сравниваемых положений, ×100. Например, если совпадают 6 из 10 положений в двух последовательностях и 2 из 10 положений содержат консервативные замены, то тогда две последовательности обладают 80% положительной сходностью.
В том смысле, в котором в данном документе используется термин «консервативные модификации последовательности», он относится к аминокислотным модификациям, которые не оказывают отрицательного влияния или не изменяют связывающие характеристики антитела, содержащего аминокислотную последовательность. Такие консервативные модификации последовательности включают нуклеотидные или аминокислотные замены, добавления и делеции. Например, модификации можно вводить стандартными в данной области методами, такими как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативные аминокислотные замены включают замены, в которых аминокислотный остаток замещен аминокислотным остатком с такой же боковой цепью. В данной области известны группы аминокислотных остатков с аналогичными боковыми цепями. Данные группы включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, предполагаемый остаток заменимой аминокислоты в человеческом анти-VEGF-антителе предпочтительно замещен на другой аминокислотный остаток из группы с той же боковой цепью. Способы идентификации нуклеотидных и аминокислотных консервативных замен, которые не приводят к элиминации связывания с антигеном, являются хорошо известными в данной области (смотри, например, Brummell et al., Biochem, 32:1180-1187, 1993; Kobayashi et al., Protein Eng., 12(10):879-884, 1999 и Burks et al., Proc. Natl. Acad. Sci. USA, 94:412-417, 1997).
В том смысле, в котором в данном документе используется термин «аминокислотная консенсусная последовательность», он относится к аминокислотной последовательности, которую можно получить с использованием матрицы, по меньшей мере, из двух и предпочтительно более подвергшихся выравниванию аминокислотных последовательностей, с пропусками при выравнивании, так что становится возможным определить наиболее часто встречаемый аминокислотный остаток в каждом положении. Консенсусная последовательность представляет такую последовательность, которая содержит аминокислоты, которые наиболее часто присутствуют в каждом положении. В том случае, когда две или более аминокислот в равной степени находятся в одном положении, то консенсусная последовательность включает обе или все такие аминокислоты.
Аминокислотную последовательность белка можно анализировать на различных уровнях. Например, консерватизм или вариабельность могут проявляться на уровне одного остатка, на уровне многочисленных остатков, многочисленных остатков с пропусками и т.п. Остатки могут проявлять консерватизм идентичного остатка или они могут быть консервативными на уровне группы. Примеры групп аминокислот включают полярные, но незаряженные R-группы (серин, треонин, аспарагин и глутамин); положительно заряженные R-группы (лизин, аргинин и глутамин); отрицательно заряженные R-группы (глутаминовая кислота и аспарагиновая кислота); гидрофобные R-группы (аланин, изолейцин, лейцин, метионин, фенилаланин, триптофан, валин и тирозин); и особые аминокислоты (цистеин, глицин и пролин). Специалистам в данной области известны другие группы аминокислот, и их можно определить с использованием структурных определений или других данных для оценки замещаемости. В этом смысле заменяемую аминокислоту можно отнести к любой аминокислоте, которую можно заместить и при этом сохранить функциональный консерватизм в этом положении.
Очевидно, понятно аминокислоты одной и той же группы могут различаться по степени проявления их биофизических свойств. Например, известно, что некоторые гидрофобные R-группы (например, аланин, серин или треонин) являются более гидрофильными (т.е. обладают более высокой гидрофильностью или более низкой гидрофобностью) по сравнению с другими гидрофобными R-группами (например, валином или лейцином). Относительную гидрофильность или гидрофобность можно определить с использованием общепринятых в данной области способов (смотри, например, Rose et al., Science, 229:834-838, 1985 и Cornette et al., J. Mol. Biol., 195:659-685, 1987).
В том смысле, в котором в данном документе одну аминокислотную последовательность (например, первую последовательность VH или VL) выравнивают с одной или более дополнительными аминокислотными последовательностями (например, одной или более последовательностями VH или VL, имеющихся в базе данных), то аминокислотное положение в последовательности (например, в первой последовательности VH или VL) можно сравнить с «соответствующим положением» в одной или более дополнительных аминокислотных последовательностях. В том смысле, в котором в данном документе используется термин «соответствующее положение», то он представляет равноценное положение в сравниваемой последовательности(ях), когда последовательности оптимально выровнены, т.е. когда последовательности выравниваются для достижения наиболее высокой процентной идентичности или процентной сходности.
В том смысле, в котором в данном документе используется термин «химерные» иммуносвязывающие соединения, он относится к антителам, которые содержат участок тяжелой и/или легкой цепи, идентичный или гомологичный соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретной группе или подгруппе антител, в то время как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другой группе или подгруппе антител, а также фрагментам таких антител.
В том смысле, в котором в данном документе используется термин «гуманизированные антитела», он относится к иммуносвязывающим соединениям, которые синтезированы с использованием технологии рекомбинантной ДНК, для элиминации иммунного ответа на чужеродные антигены. Получение гуманизированных антител является хорошо известным методом, применяемым для снижения иммуногенности моноклональных антител из чужеродных источников. Гуманизированное антитело состоит из гуманизированной вариабельной области тяжелой цепи, гуманизированной вариабельной области легкой цепи и полностью человеческих константных областей. Гуманизация вариабельной области включает выбор каркасной области-акцептора, как правило, человеческой каркасной области-акцептора, числа CDR из иммуносвязывающего соединения-донора для вставки в каркасную область-акцептор вариабельной области и замену остатков из каркасной области-донора в каркасной области-акцепторе. Общий способ трансплантации CDR в человеческие акцепторные каркасные области раскрыт Winter в патенте США № 5225539, который в полном объеме включен в данный документ для сведения. В патенте США № 6407312 приведены наставления, которые в полном объеме включены в данный документ для сведения, раскрывается ряд аминокислотных положений каркасной области, для которых предпочтительной является замена из донорного иммуносвязывающего соединения.
В том смысле, в котором в данном документе используется термин «функциональное свойство», он представляет свойство полипептида (например, иммуносвязывающего соединения), которое желательно улучшить (например, по сравнению с обычным полипептидом) и/или которое является преимущественным для специалиста в данной области, например, в целях улучшения производственных характеристик или терапевтической эффективности полипептида. В одном варианте осуществления функциональное свойство представляет собой повышенную стабильность (например, стабильность к нагреванию). В другом варианте осуществления функциональное свойство представляет собой повышенную растворимость (например, в условиях клетки). В еще одном варианте осуществления функциональное свойство представляет собой отсутствие агрегации. В еще одном варианте осуществления функциональное свойство представляет собой повышение экспрессии (например, в прокариотической клетке). В еще одном варианте осуществления функциональное свойство представляет повышение выхода белка после рефолдинга при выделении из телец включений. В некоторых вариантах осуществления функциональное свойство не представляет собой повышение аффинности связывания антигена.
Термин «нуклеиновокислотная молекула» относится к молекулам ДНК и молекулам РНК. Нуклеиновокислотная молекула представляет одноцепочечную или двухцепочечную, но предпочтительно двухцепочечную ДНК. Нуклеиновая кислота «операбельно связана», когда она имеет функциональную связь с другой нуклеиновокислотной последовательностью. Например, промотор или энхансер операбельно связан с кодирующей последовательностью, если он оказывает влияние на транскрипцию последовательности.
Термин «вектор» относится к нуклеиновокислотной молекуле, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Одним типом вектора является «плазмида», которая представляет собой циклическую двухцепочечную ДНК-петлю, в которую могут быть лигированы дополнительные сегменты ДНК. Другой тип вектора представляет вирусный вектор, с которым можно лигировать дополнительные сегменты в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, содержащие бактериальный ориджин репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) можно интегрировать в геном клетки-хозяина при введении в клетку-хозяин и обеспечив тем самым репликацию вместе с геномом хозяина.
Термин «клетка-хозяин» относится к клетке, в которую введен экспрессирующий вектор. Клетки-хозяева могут включать бактериальные, микробные, растительные клетки и клетки животных. Бактерии, чувствительные к трансформации, включают члены семейства энтеробактерий, такие как штаммы Escherichia coli или Salmonella; Bacillaceae, такие как Bacillus subtilis; Pneumococcus; Streptococcus и Haemophilus influenzae. Подходящие микроорганизмы включают Saccharomyces cerevisiae и Pichia pastoris. Подходящие клетки-хозяева животных включают клетки CHO (линии клеток яичника китайского хомячка) и клетки NSO.
Термины «лечить», «лечение» и «терапия» относятся к лечебным или профилактическим мероприятиям, описанным в данном документе. В способах «лечения» используется введение субъекту, нуждающемуся в таком лечении, антитела по настоящему изобретению, например, субъекту с уже имеющимся TNFα-опосредованным нарушением или субъекту, у которого имеется риск развития такого нарушения, в целях профилактики, лечения, замедления, снижения тяжести заболевания или ослабления одного или более симптомов заболевания, или предупреждения рецидивирования заболевания для пролонгации выживаемости субъекта по сравнению с отсутствием такого лечения.
Термин «TNFα-опосредованное нарушение» или «TNFα-опосредованное заболевание» относится к заболеванию, для начала развития, прогрессирования или устойчивого проявления симптомов или его болезненных состояний необходимо участие TNF. Приведенные в качестве примера TNFα-опосредованные нарушения включают, не ограничиваясь этим, хронические и/или аутоиммунные воспалительные заболевания в целом, опосредованные иммунной системой воспалительные заболевания в целом, воспалительное заболевание ЦНС, воспалительные заболевания, поражающие глаза, суставы, кожу, слизистые, центральную нервную систему, желудочно-кишечный тракт, мочевые пути или легкие, увеиты в целом, ретинит, HLA-B27+увеит, болезнь Бехчета, синдром сухого глаза, глаукому, синдром Шегрена, сахарный диабет (включая диабетическую нейропатию), резистентность к инсулину, артриты в целом, ревматоидный артрит, остеоартрит, реактивный артрит и синдром Рейтера, юношеский артрит, анкилозирующий спондилит, рассеянный склероз, синдром Гуллиана-Барре, тяжелую миастению, амиотрофический латеральный склероз, саркоидоз, гломерулонефрит, хроническое заболевание почек, цистит, псориаз (включая псориатический артрит), гидраденит гнойный, панникулит, гангренозную пиодермию, синдром SAPHO (синовит, акне, пустулез, гиперстоз и остеит), акне, синдром Свита, пемфигус, болезнь Крона (включая некишечные проявления заболевания), язвенный колит, бронхиальную астму, гиперчувствительность при пневмонии, общие аллергии, аллергический ринит, аллергический синусит, хроническое обструктивное заболевание легких (COPD), фиброз легких, грануломатоз Вегенера, синдром Кавасаки, гигантоклеточный артерит, васкулит Чарга-Стросса, нодозный полиартрит, ожоги, синдром трансплантат против хозяина, реакции хозяин против трансплантата, эпизоды отторжения после трансплантации органа или костного мозга, системные и местные проявления васкулита в целом, системную и дискоидную красную волчанку, полимиозит и дерматомиозит, склеродермию, преэклампсию, острый и хронический панкреатит, вирусный гепатит, гепатит в результате злоупотребления алкоголем, послеоперационное воспаление, такое как воспаление после операции на глазах (например, по поводу катаракты (замена хрусталика) или операции по поводу глаукомы), после операции на суставах (включая артроскопическую операцию), после операции на структурах, связанных с суставами (например, связках), после операции в ротовой полости и/или стоматологических операций, после минимально инвазивных вмешательств на сердце и сосудах (например, PTCA, атерэктомии, размещения стента), после лапароскопических и/или эндоскопических внутрибрюшинных и гинекологических процедур, после эндоскопических урологических вмешательств (например, операции на предстательной железе, уретроскопии, цистоскопии, интерстициальный цистит), или воспаление в периоперативный период (профилактика) в целом, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, паралич Белла, болезнь Крейцфельда-Якоба; связанный со злокачественным заболеванием остеолизис, связанное со злокачественным заболеванием воспаление, связанная со злокачественным заболеванием боль, связанная со злокачественным заболеванием кахексия, метастазы в кости, острые и хронические формы боли, независимо от того, вызваны они центральными или периферическими эффектами TNFα, и независимо от того, классифицируются они как воспалительная, ноцицептивная или нейропатическая формы боли, ишиас, боль в нижней области спины, синдром запястного канала, комплексный регионарный болевой синдром (CRPS), подагру, невралгию после герпеса, фибромиалгию, местные болевые состояния, синдромы хронической боли в результате метастазирующей опухоли, дисменорею; бактериальный, вирусный или грибковый сепсис, туберкулез, СПИД, атеросклероз, заболевание коронарных артерий, гипертензию, дислипидемию, сердечную недостаточность и хроническую сердечную недостаточность. Термин «эффективная доза» или «эффективная дозировка» относится к количеству, достаточному для достижения или, по меньшей мере, для частичного достижения желаемого эффекта. Термин «терапевтически эффективная доза» определяется как количество, достаточное для излечения или, по меньшей мере, для частичного купирования заболевания и его осложнений у пациента, уже страдающего заболеванием. Количества, эффективные для данного применения, будут зависеть от тяжести заболевания, которое подвергается лечению, и общего состояния собственной иммунной системы пациента.
Термин «субъект» относится к человеку или животному, отличному от человека. Например, способы и композиции по настоящему изобретению можно использовать для лечения субъекта с TNF-опосредованным нарушением.
Термин «зайцеобразные» относится к членам таксономического отряда Зайцеобразные, состоящего из семейств Зайцы (например, зайцы и кролики) и Пищуховые (пищухи). В наиболее предпочтительном варианте осуществления представителем зайцеобразных является кролик. В том смысле, в котором в данном документе используется термин «кролик», он относится к животному, принадлежащему к семейству Зайцы.
Различные номенклатуры использовали для полученных иммуносвязывающих соединений. Как правило, их идентифицируют по номеру (например, #34). В тех случаях, когда используют префикс, такой как EP или Epi (например, EP 34, который идентичен Epi 34 или #34), то указывается одно и то же иммуносвязывающее соединение.
Если не указано иначе, то все технические и научные термины, использованные в данном документе, име