Арилированные поликарбоксильные производные фуллерена, способы их получения ковалентные конъюгаты, способ их получения
Иллюстрации
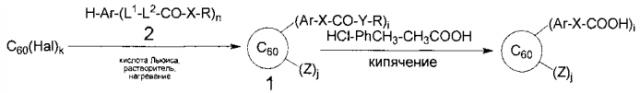
Показать всеИзобретение относится к химической и фармацевтической отраслям промышленности и касается химической функционализации фуллерена C60, в частности метода синтеза органических производных [60] фуллерена, в том числе растворимых в воде и физиологических средах. Проблема получения высокостабильных поликарбоксильных производных фуллерена C60, пригодных для использования в биомедицине или фармакологии, а также для получения конъюгатов производных фуллеренов с другими лекарственными препаратами, решается в рамках настоящего изобретения путем создания нового класса арилированных поликарбоксильных производных фуллерена C60, содержащих присоединенные к фуллереновому каркасу фрагменты ароматических карбоновых кислот (производных карбоновых кислот), а также способа получения таких соединений. В изобретении защищаются структуры и способ получения отдельного класса поликарбоксильных арилированных производных фуллерена C60, имеющих состав и строение, соответствующие общей формуле 1, а именно
Изобретение также относится к способу получения соединений, описываемых общей формулой 1, по реакции галогенпроизводных фуллерена C60 с защищенными производными ароматических карбоновых кислот в присутствии в качестве катализатора кислот Льюиса. Последующее получение поликарбоксильных соединений в форме свободных кислот проводится с помощью кислотного гидролиза.
Изобретение может найти применение в биомедицинских исследованиях и в производстве новых лекарственных препаратов, предназначенных для терапии заболеваний человека и животных. Более конкретно, изобретение относится к новым арилированным поликарбоксильным производным фуллерена С60 и способу их получения. 7 н. и 2 з.п. ф-лы, 4 ил., 2 табл.
Реферат
Изобретение относится к химической и фармацевтической отраслям промышленности и касается химической функционализации фуллерена С60, в частности, метода синтеза органических производных [60] фуллерена, в том числе растворимых в воде и физиологических средах. Изобретение может найти применение в биомедицинских исследованиях и в производстве новых лекарственных препаратов, предназначенных для терапии заболеваний человека и животных. Более конкретно, изобретение относится к новым арилированным поликарбоксильным производным фуллерена С60 и способу их получения.
После открытия фуллеренов в 1985 г. [1 - W. Kroto, J.R. Heath, S.C. O'Brien, R.F. Curl, R.E. Smalley. С60: Buckminsterfullerene, Nature, 318, 162-163 (1985)], разработки метода их получения в макроколичествах путем электродугового испарения графита [2 -W. Kratchmer, L.D. Lamb, К. Fostiropoulos, D.R. Huffman. С60: a new form of carbon. Nature, 347, 354-358 (1990)] или при неполном сгорании углеводородов [3- Н. Murayama, S. Tomonoh, J.M. Alford, M.E. Karpuk. Fullerene production in tons and more: From science to industry. Full. Nanotub. Carbon Nanostruct. 12, 1-9 (2004)]) и эффективных методов разделения фуллеренов [4 - К. Nagata, Е. Dejima, Y. Kikuchi. М. Hashiguchi. Kilogram-scale [60]fullerene separation from a fullerene mixture: Selective complexation of fullerenes with 1,8-diazabicyclo[5.4.0]undec-7-ene (DBU). Chem. Lett., 34, 178-179 (2005)] низший фуллерен C60 высокой чистоты стал доступен в килограммовых количествах по цене менее 15€/г [5 - http://www.neotechproduct.ru/str6.php?lang=rus].
Доступность фуллеренов для исследований позволила найти ряд областей практического использования этих соединений. Наиболее многообещающие результаты получены с использованием химически модифицированных фуллеренов С60 и С70. Например, производные фуллеренов являются незаменимыми компонентами органических солнечных батарей с к.п.д. до 7-8% [6 - Y. Liang, Z. Xu, J. Xia, S.-T. Tsai, Y. Wu, G. Li, C. Ray, L.Yu, For the Bright Future - Bulk Heterojunction Polymer Solar Cells with Power Conversion Efficiency of 7.4%. Adv. Mater. 22, 1-4, (2010)] и полевых транзисторов [7 - T.D. Anthopoulos, С.Tanase et al. Ambipolar Organic Field-Effect Transistors Based on a Solution-Processed Methanofullerene. Adv. Mater., 16, 2174 (2004)]). Некоторые производные фуллеренов интересны как высокотемпературные сверхпроводники [8 - M.J.
Rosseinsky. Recent developments in the chemistry and physics of metal fullerides. Chem. Mater., 10, 2665-2685 (1998)], материалы нелинейной оптики [9 - L.W. Tutt, A. Kost. Optical limiting performance of С60 and C70 solutions. Nature, 356, 225-226 (1992)], протонные проводники [10 - R. Maruyama. Electrochemical mass-flow control of hydrogen using a fullerene-based proton conductor. Electrochemica Acta, 48, 85-89 (2002)] и т.д.
В последние годы активно обсуждается возможность создания лекарственных препаратов на основе водорастворимых производных фуллеренов [11 - Л.Б. Пиотровский, О.И. Киселев. Фуллерены в биологии. СПб, Росток, 2006], в основном содержащих ионогенные группы - аминные [12 - O. Troshina, P. Troshin, A. Peregudov, V. Kozlovski, R. Lyubovskaya. Photoaddition of N-Substituted Piperazines to С60: An Efficient Approach to the Synthesis of Water-Soluble Fullerene Derivatives. Chem. Eur. Journal, 12, 5569-5577 (2006)] и карбоксильные [13 - M. Brettereich, A. Hirsch. A highly water-soluble dendro[60]fullerene. Tetrahedron Letters, 39, 2731-2734 (1998); 14 - O. Troshina, P. Troshin, A. Peregudov, V. Kozlovskiy, J. Balzarini, R. Lyubovskaya. Chlorofullerene C60Cl6: a precursor for straightforward preparation of highly water-soluble polycarboxylic fullerene derivatives active against HIV. Org. Biomol. Chem., 5, 2783-2791 (2007)].
Для водорастворимых производных фуллеренов С60 и С70 обнаружены различные виды биологической активности, которые могут быть использованы при создании новых лекарственных нанопрепаратов. Так, показана высокая противоопухолевая активность соединений фуллеренов в условиях фотодинамической терапии [15 - Y. Tabata, Т. Ishii, Т. Aoyama, R. Oki, Y. Hirano, О. Ogawa, Y. Ikada in ((Perspectives of Fullerene Nanotechnology», E. Osawa (Ed.) 2001, Kluver Academ. Publ., Dordrecht-Boston-London.; 16 - Андреев С.M. Лаптев В.П. Панферова Н.Г. Романова В.С, Петров В.В. Овчинников А.Е., Патент РФ RU 2005140680 А «Фармацевтическая композиция для фотодинамической терапии и способ лечения онкологического заболевания с ее использованием»] и химиотерапии раковых опухолей [17 - К. YASUHIKO, О. KENK, IDEAL STAR INC, патент JP 2005053904 (A) ((Fullerene and anticancer therapeutic agent»; 18 - Заявка на патент №PST/RU 2007/000337. 2007 «Полифункциональные аминокислотные производные фуллерена С60, содержащие биологически активные группировки, пептиды или белки, способы их получения (варианты), применение их в качестве доноров монооксида азота и в качестве вазодилататоров, а также способ ингибирования процесса метастазирования». Котельников А.И., Романова B.C., Богданов Г.Н., Коновалова Н.П., Котельникова Р.А., Файнгольд И.И., Фрог Е.С., Писаренко О.И., Бубнов Ю.Н., Давыдов М.И., Алдошин С.М.]. Мощная антиоксидантная активность производных фуллеренов, обусловленная способностью поглощать и дезактивировать кислородсодержащие свободные радикалы (благодаря этому свойству фуллерены получили название «радикальных губок» [19 - P.J. Krusic, Е. Wasserman, Р.N. Keizer, J.R. Morton, К.F. Preston. Radical reactions of С60, Science, 254, 1183-1185 (1991)]) может быть использована при создании нейрозащитных препаратов [20 - A. Lin, S. Fang, S. Lin, С.Chou, Т. Luh, L. Ho. Local carboxyfullerene protects cortical infarction in rat brain. NeuroScience Research, 43, 317-321 (2002)].
Возможно применение производных фуллеренов в качестве средств доставки других лекарственных препаратов, особенно противоракового действия [21 - P. Chaudhuri, A. Paraskar, S. Soni, R.A. Mashelkar, S. Sengupta. Fullerenol-Cytotoxic Conjugates for Cancer Chemotherapy. ACS Nano, 3(9), 2505-2514 (2009)], а также для трансфекции генов в генной терапии [22 -R. Maeda-Mamiya, Е. Noiri, Н. Isobe, W. Nakanishi, К. Okamoto, К. Doi, Т. Sugaya, Т. Izumi, Т. Homma, Е. Nakamura. In vivo gene delivery by cationic tetraamino fullerene. Proc. Natl. Acad. Sci. USA, 107(12), 5339-5344 (2010)].
Особенно перспективно использование соединений фуллеренов в качестве противовирусных препаратов (в особенности против вируса иммунодефицита человека -ВИЧ) [23 - S. Wilson in ((Perspectives of Fullerene Nanotechnology», E. Osawa Ed. 2001, Kluver Academ; 24 - Патент РФ №RU 2236852 C1 «Средство для ингибирования репродукции оболочечных вирусов, способ его получения, фармацевтическая композиция и способ ингибирования вирусных инфекций», ЗАО "Деско", директор Л.Д. Раснецов]. Приведенные примеры однозначно показывают практическую ценность органических производных фуллеренов.
Отсутствие удобных и экономичных способов синтеза хорошо растворимых в воде производных фуллеренов является существенным препятствием для использования этого класса соединений в биомедицинских исследованиях и в медицине. Многие из получаемых водорастворимых соединений обладают лишь весьма умеренной растворимостью в воде, а также невысокой стабильностью из-за того, что содержат в своей структуре лабильные функциональные группы
Проблема получения высокостабильных поликарбоксильных производных фуллерена С60, пригодных для использования в биомедицине или фармакологии, а также для получения конъюгатов производных фуллеренов с другими лекарственными препаратами, решается в рамках настоящего изобретения путем создания нового класса арилированных поликарбоксильных производных фуллерена С60, содержащих присоединенные к фуллереновому каркасу фрагменты ароматических карбоновых кислот (производных карбоновых кислот), а также способа получения таких соединений.
В заявляемом изобретении защищаются структуры и способ получения отдельного класса поликарбоксильных арилированных производных фуллерена С60, имеющих состав и строение, соответствующие общей формуле 1, а именно:
где Ar представляет собой остаток замещенного или незамещенного ароматического соединения, в том числе:
- остаток замещенного или незамещенного производного ряда бензола, при этом n=1-5;
- остаток замещенного или незамещенного производного ряда нафталина, при этом n=1-7;
- остаток замещенного или незамещенного производного ряда бифенила, при этом n=1-9;
-остаток замещенного или незамещенного производного ряда терфенила, при этом n=1-13;
- остаток замещенного или незамещенного производного ряда тетрафенила, при этом n=1-17;
- остаток замещенного или незамещенного производного ряда пентафенила, при этом n=1-21;
- остаток замещенного или незамещенного производного ряда антрацена, при этом n=1-9;
- остаток замещенного или незамещенного производного ряда флуорена, при этом n=1-9;
- остаток замещенного или незамещенного производного ряда фенантрена, при этом n=1-9;
- остаток замещенного или незамещенного производного ряда пирена, при этом n=1-9;
- остаток замещенного или незамещенного производного ряда тетрацена, при этом n=1-11;
- остаток замещенного или незамещенного производного ряда пентацена, при этом n=1-13;
- остаток замещенного или незамещенного производного ряда перилена, при этом n=1-12;
в случае если Ar представляет собой остаток замещенного или незамещенного производного ряда бензола,
линкер L1 представляет собой атом кислорода, серы или замещенный или незамещенный атом азота, а также метиленовую цепочку (СН2)m (m=2-30);
линкер L2 представляет собой метиленовую цепочку (СН2)m (m=0-30); метиленовую цепочку (CH2)m (m=0-30), содержащую заместители в боковой цепи; метиленовую цепочку (СН2)m (m=0-30), в которой любой из атомов углерода может быть независимо замещен на гетероатом (кислород, серу или азот); метиленовую цепочку (СН2)m (m=0-30), в которой любой из атомов углерода может быть независимо замещен на гетероатом (кислород, серу или азот), содержащую заместители в боковой цепи; замещенный или незамещенный алифатический остаток, содержащий от 1 до 30 атомов углерода; замещенный или незамещенный ароматический остаток, содержащий от 6 до 30 атомов углерода; замещенный или незамещенный гетероциклический остаток, содержащий от 1 до 30 атомов углерода;
в случае если Ar представляет собой остаток замещенного или незамещенного производного ряда бифенила,
линкер L1 представляет собой атом кислорода, серы или замещенный или незамещенный атом азота, а также метиленовую цепочку (СН2)m (m=1-30);
линкер L2 представляет собой метиленовую цепочку (CH2)m (m=0-30); метиленовую цепочку (СН2)m (m=0-30), содержащую заместители в боковой цепи; метиленовую цепочку (СН2)m (m=0-30), в которой любой из атомов углерода может быть независимо замещен на гетероатом (кислород, серу или азот); метиленовую цепочку (СН2)m (m=0-30), в которой любой из атомов углерода может быть независимо замещен на гетероатом (кислород, серу или азот), содержащую заместители в боковой цепи; замещенный или незамещенный алифатический остаток, содержащий от 1 до 30 атомов углерода; замещенный или незамещенный ароматический остаток, содержащий от 6 до 30 атомов углерода; замещенный или незамещенный гетероциклический остаток, содержащий от 1 до 30 атомов углерода;
в случае если Ar представляет собой остаток замещенного или незамещенного ароматического соединения, отличного от остатка замещенного или незамещенного производного ряда бензола или бифенила,
линкер L1 представляет собой атом кислорода, серы или замещенный или незамещенный атом азота, а также метиленовую цепочку (СН2)m (m=0-30);
линкер L2 представляет собой метиленовую цепочку (СН2)m (m=0-30); метиленовую цепочку (СН2)m (m=0-30), содержащую заместители в боковой цепи; метиленовую цепочку (CH2)m (m=0-30), в которой любой из атомов углерода может быть независимо замещен на гетероатом (кислород, серу или азот); метиленовую цепочку (СН2)m (m=0-30), в которой любой из атомов углерода может быть независимо замещен на гетероатом (кислород, серу или азот), содержащую заместители в боковой цепи; замещенный или незамещенный алифатический остаток, содержащий от 1 до 30 атомов углерода; замещенный или незамещенный ароматический остаток, содержащий от 6 до 30 атомов углерода; замещенный или незамещенный гетероциклический остаток, содержащий от 1 до 30 атомов углерода;
Х представляет собой атом кислорода, серы, замещенный или незамещенный атом азота;
R представляет собой независимо атом водорода; замещенный или незамещенный С1-С30 алкильный заместитель нормального или разветвленного строения; атом щелочного (Li, Na, К, Rb, Cs) или щелочноземельного металла (Mg, Са, Sr, Ва); биосовместимый органический катион; остаток биологически активного соединения, содержащего гидроксильную, аминную или тиольную группу, присоединенного посредством образования сложного эфира, амида или тиоэфира;
индекс i принимает значения от 4 до 30;
где Z=H, F, Cl, Br, О, ОН, ONO, NO, NO2, отрицательный заряд на фуллереновой сфере с сопряженным ему внешнесферным неорганическим или органическим катионом;
где индекс j принимает значения от 0 до 30.
Защищается также способ получения соединений, описываемых общей формулой 1, по реакции галогенпроизводных фуллерена С60 с защищенными производными ароматических карбоновых кислот в присутствии в качестве катализатора кислот Льюиса (схема 1). Последующее получение поликарбоксильных соединений в форме свободных кислот проводится с помощью кислотного гидролиза.
В качестве исходных производных ароматических карбоновых кислот могут выступать производные общей формулы 2, в которых обозначения совпадают с использованными в общей формуле 1, а Н обозначает атом водорода.
В качестве исходных галогенидов фуллерена могут использоваться фториды, хлориды и бромиды С60 состава С60(Hal)k, где Hal обозначает атом фтора, хлора или брома, а индекс к принимает значения от 2 до 48, а также смеси указанных соединений. В частности, в качестве исходных могут использоваться следующие соединения: C60F48, C60F36, C60F18; C60Cl6, C60Cl8, C60Cl10, C60Cl12, C60Cl14, C60Cl16, C60Cl24, C60Cl26, C60Cl28, C60Cl30; C60Br6, C60Br8, C60Br14, С60Br24. Наиболее предпочтительным является использование в качестве исходных соединений хлоридов фуллерена, а наиболее предпочтительным хлоридом [60]фуллерена для использования в настоящем изобретении является хлорфуллен C60Cl6.
В качестве катализаторов реакции галогенфуллеренов с защищенными производными карбоновых кислот могут использоваться безводные галогениды (хлориды, бромиды и иодиды) железа, алюминия, титана, олова и бора, а также трифторид бора.
При проведении реакции получения соединений общей формулы 1 необходимо применение инертного растворителя, в качестве которого могут использоваться ароматические соединения, содержащие дезактивирующие электроноакцепторные заместители, а также галогенированные алифатические соединения (например, дихлорметан, трихлорметан или тетрахлорметан). В случае использования в реакции активированных производных общей формулы 2, содержащих донорные кислород-, серу - или азотсодержащие группы, оптимальным является использование в качестве растворителя хлорбензола, 1,2-дихлорбензола, 1,3-дихлорбензола, 1,2,3-трихлорбензола, 1,2,4-трихлорбензола, 1,3,5-трихлорбензола, нитробензола. В случае неактивированных субстратов оптимальным является использование нитробензола в качестве растворителя.
При необходимости получения продуктов, содержащих такое же количество заместителей, как и в исходном галогениде фуллерена, реакцию получения арилированных производных формулы 2 необходимо проводить при минимально возможной температуре (то есть при температуре, при которой в реакционной смеси можно обнаружить начало образования продукта с помощью методов тонкослойной хроматографии или высокоэффективной жидкостной хроматографии). В случае использования в реакции активированных производных общей формулы 2, содержащих донорные кислород-, серу- или азотсодержащие группы, эта температура составляет в зависимости от исходного вещества и используемого катализатора от 30 до 70°C, а при использовании неактивированного реагента - от 70 до 90°C.
Для получения продуктов, содержащих меньшее количество аддендов, чем в исходном галогениде фуллерена, то есть для проведения реакции арилирования, совмещенной с частичным элиминированием атомов галогена с каркаса фуллерена, реакцию необходимо проводить при возможно более высокой температуре, ограниченной термической стабильностью исходных веществ. Приемлемый диапазон температуры в этом случае составляет от 100 до 150°C в случае активированных субстратов, и от 150 до 250°C в случае неактивированных субстратов.
Последующее получение поликарбоксильных арилированных производных в незащищенной форме (то есть с карбоксильными группами в свободной форме) может осуществляться путем проведения кислотного гидролиза в смеси уксусная кислота-толуол-соляная кислота при кипячении. Наиболее оптимально использование смеси состава 2:1:1.
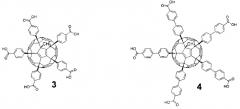
Наиболее близкими структурными аналогами соединений общей формулы 1, заявляемых в настоящем изобретении, являются арилированные производные фуллерена С60 3 и 4, получаемые по реакции медь - катализируемого присоединения металлорганических соединений к немодифицированному фуллерену С60 [25 - Matsuo, Y.; Kanaizuka, К.; Matsuo, К.; Zhong, Y.-W.; Nakae, Т.; Nakamura, E. 34 Photocurrent-Generating Properties of Organometallic Fullerene Molecules on an Electrode. J. Am. Chem. Soc. 2008, 130, 5016]. Данные соединения синтезируют с использованием весьма чувствительных арилмагнийорганических соединений, что сильно осложняет работу с ними. Кроме того, для получения металлорганических соединений необходимо использовать не всегда доступные бромированные производные ароматических углеводородов, что сужает круг получаемых таким образом соединений.
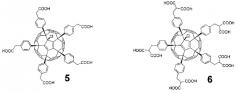
Наиболее близким аналогом способа получения соединений общей формулы 1, заявляемых в данном изобретении, является опубликованный нами ранее способ получения поликарбоксильных производных фуллерена С60 5 и 6 [14 - О. Troshina, Р. Troshin, A. Peregudov, V. Kozlovskiy, J. Balzarini, R. Lyubovskaya. Chlorofullerene C60Cl6: a precursor for straightforward preparation of highly water-soluble polycarboxylic fullerene derivatives active against HIV. Org. Biomol. Chem., 5. 2783-2791 (2007)]. Данный метод основан на реакции арилирования хлорфуллерена C60Cl6 эфирами фенилуксусной и бензилмалоновой кислот при температуре 100°C с использованием в качестве катализатора треххлористого железа и нитробензола в качестве растворителя. Последующее снятие защитных групп в способе-прототипе проводится путем кислотного гидролиза в смеси хлорбензол-трифторуксусная кислота-уксусная кислота-соляная кислота при температуре 60°C в течение 3 дней.
Разработанный и заявляемый нами метод получения соединений общей формулы 1 превосходит способ-прототип по следующим показателям:
1. В случае получения по заявляемому методу соединений 5 и 6 при проведении синтеза при минимально возможной температуре (70°C вместо 100°C в способе-прототипе) достигается существенно более высокий выход целевого продукта в расчете на исходный хлорфуллерен C60Cl6, что особенно важно с учетом высокой стоимости этого реагента (пример 1).
2. Возможно использование других галогенидов фуллерена в качестве исходных веществ (см. пример 6), что существенно расширяет круг получаемых соединений (в частности, позволяет получать продукты с числом присоединенных арильных групп более 5).
3. Возможно использование широкого круга активированных и неактивированных реагентов общей формулы 2 и выбор наиболее подходящих для них катализаторов, что позволяет легко получать разнообразные поликарбоксильные производные фуллерена.
4. Использование для гидролиза системы уксусная кислота-толуол-соляная кислота позволяет обойтись без использования дорогостоящей трифторуксусной кислоты и хлорированных растворителей, что удешевляет процесс, делает его более экологически чистым и облегчает повторное использование кислот. Проведение процесса гидролиза при кипячении реакционной смеси (температура около 115°C) вместо 60°C сокращает продолжительность процесса в 2-3 раза.
Данный метод позволяет получать широкий круг высокостабильных поликарбоксильных производных фуллерена С60, отличающихся высокой химической и метаболической стабильностью, хорошей растворимостью в воде и за счет указанных свойств - высокой биосовместимостью. Поэтому они должны найти применение в фармакологии и биомедицине как лекарственные препараты и средства транспорта других лекарственных средств.
Важнейшим отличием соединений общей формулы 1 от известных ранее соединений, например 5 и 6, является их существенно более низкая токсичность как для клеточных культур, так и для лабораторных животных. В таблице 1 приведены результаты определения цитотоксичности известных ранее и заявляемых соединений по отношению к четырем клеточным линиям: клеткам эпителия почки зеленой мартышки (Vero), диплоидным фибробластам человека (ФЛЭЧ), Т-клеткам человека (СЕМ) и клеткам опухоли шейки матки (HeLa). Видно, что значения цитотоксической концентрации, при которой нарушается рост клеток, для заявляемых соединений в 4-25 раз выше, чем для описанных ранее. Это означает, что заявляемые соединения оказывают существенно меньшее воздействие на клетки, что свидетельствует об их высокой биосовместимости. Более того, острая токсичность для лабораторных животных (гибридные мыши линии BDF1) оказалась вдвое ниже, чем для известных близких по структуре соединений (таблица 2). Таким образом, эксперименты in vitro и in vivo позволяют утверждать, что соединения общей формулы 1 могут быть безопасно использованы в живых системах.
Понижение токсичности и повышение биосовместимости соединений по сравнению с описанными ранее производными фуллеренов достигнуто за счет использования в составе соединений общей формулы 1 объемных ароматических фрагментов и/или удлиненных линкеров, соединяющих каркас фуллерена и солюбилизирующие карбоксильные группы. Такой подход для повышения биосовместимости производных фуллеренов не известен из существующего уровня техники и является новым.
Защищается также использование поликарбоксильных производных общей формулы 1 для синтеза конъюгатов с лекарственными препаратами, содержащими гидроксильные, аминные и тиольные группы, способные к образованию сложных эфиров, амидов или тиоэфиров с поликарбоксильными производными общей формулы 1. Для создания сложноэфирной, амидной или тиоэфирной связи используется карбодиимидный метод, а сам процесс конденсации ведут при комнатной температуре в течение 12-24 часов. Примеры получения таких конъюгатов с различными клиническими лекарственными препаратами приведены ниже (см. примеры 8-10).
Возможность практического применения заявляемых производных фуллеренов в качестве противовирусных препаратов иллюстрируется примером 11.
Данное изобретение иллюстрируется, но никак не ограничивается следующими примерами.
Пример 1.
Улучшенный метод синтеза соединений 5 и 6 из хлорфуллерена C60Cl6. Для получения соединений 5 и 6 по улучшенному методу хлорфуллерен C60Cl6 (3-10 г) прибавляют при перемешивании к сухому нитробензолу (500 мл) в атмосфере аргона. Колбу вакуумируют при легком нагревании (30-40°C) для удаления содержащихся в растворителе газов и следов воды. При этом хлорфуллерен C60Cl6 практически полностью растворяется с образованием прозрачного красного раствора. К раствору прибавляют перегнанные в вакууме метиловые эфиры фенилуксусной или бензилмалоновой кислоты (100-150 мл), после чего еще раз вакуумируют систему до прекращения выделения газов. Затем прибавляют безводный трихлорид железа (100 мг), после чего систему снова вакуумируют, заполняют аргоном и быстро нагревают. Реакция начинается при 70°C, что определяют с помощью тонкослойной хроматографии. Поддерживают ту же температуру в течение 2 часов, после чего охлаждают и проводят выделение продуктов по описанной методике [14 - О. Troshina, P. Troshin, A. Peregudov, V. Kozlovskiy, J. Balzarini, R. Lyubovskaya. Chlorofullerene C60Cl6: a precursor for straightforward preparation of highly water-soluble polycarboxylic fullerene derivatives active against HIV. Org. Biomol. Chem.. 5, 2783-2791 (2007)].
Выход метилового эфира соединения 5 составляет 75% (60% для метода-прототипа), метилового эфира соединения 6 - 85% (50% для метода-прототипа). Спектральные характеристики полученных продуктов идентичны приведенным в цитированной публикации.
Пример 2.
Получение защищенных поликарбоксильных производных [60] фуллерена, содержащих остатки арилкарбоновых кислот, из хлорфуллерена C60Cl6
Для получения соединений 1а и 1б используют арилирование хлорфуллерена C60Cl6 метиловыми эфирами фенилпропионовой и фенилмасляной кислот. Хлорфуллерен C60Cl6 (1 г) прибавляют при перемешивании к сухому нитробензолу (100 мл) в атмосфере аргона. Колбу вакуумируют при легком нагревании (30-40°C) для удаления содержащихся в растворителе газов и следов воды. При этом хлорфуллерен C60Cl6 практически полностью растворяется с образованием прозрачного красного раствора. К раствору прибавляют перегнанные в вакууме метиловые эфиры фенилуксусной или бензилмалоновой кислоты (20-50 мл), после чего еще раз вакуумируют систему до прекращения выделения газов. Затем прибавляют безводный трихлорид железа (100 мг), после чего систему снова вакуумируют, заполняют аргоном и быстро нагревают. Реакция начинается при 80°C, что определяют с помощью тонкослойной хроматографии. Поддерживают ту же температуру в течение 1 часа, после чего охлаждали до комнатной температуры.
После завершения синтеза охлажденную реакционную смесь выливают в делительную воронку, содержащую 1 л разбавленной (2-5%) соляной кислоты, и встряхивают для удаления соединений железа из органической фазы. Органический слой промывают 3-4 раза дистиллированной водой, после чего отделяют и сушат над сульфатом натрия или магния.
Продукты 1а-б выделяют методом колоночной хроматографии. Для этого реакционную смесь разбавляют вдвое петролейным эфиром и наносят на хроматографическую колонку (диаметр 30 мм, высота слоя силикагеля 300 мм). Удаляют нитробензол пропусканием через колонку чистого толуола, а затем медленно элюируют побочные продукты с использованием 0,4-0,5% раствора метанола в толуоле. Целевые продукты вымывают 0,6-0,7% метанолом в толуоле, контролируя их чистоту методом ВЭЖХ. Фракции продукта с чистотой более 95% собирают вместе и упаривают на ротационном испарителе, а недостаточно чистые фракции концентрируют до небольшого объема и повторно хроматографируют в тех же условиях.
После упаривания растворителя в вакууме сухой остаток продукта промывают метиловым или этиловым спиртом и сушат на воздухе. Выход продуктов 1а-б составляет от 50 до 60% в зависимости от качества исходных реагентов и загрузки хлорфуллерена. Чистота полученных производных 1а-б (95-98%) подтверждена с помощью высокоэффективной жидкостной хроматографии.
Строение полученных производных было доказано методами ЯМР на ядрах 1Н и 13С, а также с помощью двумерной корреляционной ЯМР-спектроскопии.
1a. 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 2.53 (т, 2Н), 2.65 (т, 8Н), 2.84 (т, 2Н), 2.98 (т, 8Н), 3.60 (с, 3Н), 3.65 (с, 6Н), 3.68 (с, 6Н), 6.94 (д, 2Н), 7.09-7.18 (м, 10Н), 7.54 (д, 4Н), 7.82 (д, 4Н).
13С ЯМР (150 МГц, CDCl3, δ, м.д): 30.37 (СН2), 30.57 (СН2), 30.61 (СН2), 35.28 (СН2), 35.53 (СН2), 35.62 (СН2), 51.60 (ОСН3), 51.65 (ОСН3), 51.67 (ОСН3), 57.92 (sp3 каркас), 60.53 (sp3 каркас), 63.18 (sp3 каркас), 127.76 (Ar), 128.6-128.8 (Ar), 130.27 (Ar), 135.36, 136.87, 139.63, 140.25, 141.83, 142.91, 143.39, 143.54, 143.74, 143.82, 144.03, 144.19, 144.30, 144.43, 144.57, 145.31, 145.38, 146.78, 147.30, 147.44, 147.89, 148.19, 148.33, 148.51, 148.70, 148.75, 148.83, 150.43, 151.23, 153.77, 156.76, 173.14 (СООСН3), 173.20 (СООСН3), 173.22 (СООСН3).
16. 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 1.85 (м, 2Н), 1.97 (м, 8Н), 2.25 (т, 2Н), 2.33 (м, 8Н), 2.54 (т, 2Н), 2,68 (м, 8Н), 3.59 (с, ЗН), 3.65 (с, 6Н), 3.67 (с, 6Н), 6.92 (д, 2Н), 7.05-7.18 (м, 10Н), 7.55 (д, 4Н), 7.83 (д, 4Н).
13С ЯМР (150 МГц, CDCl3, δ, м.д): 26.13 (СН2), 26.30 (СН2), 26.37 (СН2), 33.23 (СН2), 33.40 (СН2), 33.44 (СН2), 34.67 (СН2), 34.75 (СН2), 51.51 (ОСН3), 51.57 (ОСН3), 57.94 (sp3 каркас), 60.58 (sp3 каркас), 63.22 (sp3 каркас), 76.35 (С-Cl), 127.93 (Ar), 128.62 (Ar). 128.67 (Ar), 128.91 (Ar), 130.20 (Ar), 135.10, 136.63, 140.46, 141.01, 141.04, 141.61, 142.88, 143.45, 143.65, 143.82, 144.09, 144.18, 144.29, 144.41, 144.55, 145.35, 145.43, 146.86, 147.29, 147.42, 147.87, 148.15, 148.30, 148.48, 148.65, 148.68, 148.71, 148.80, 150.52, 151.31, 153.76, 156.83, 173.83 (СООСН3), 173.86 (СООСН3), 173.91 (СООСН3).
Снятие защитных групп в соединениях 1а-б с помощью кислотного гидролиза и получение арилированных производных со свободными карбоксильными группами описано ниже (пример 7).
Пример 3.
Получение защищенных поликарбоксильных производных [60] фуллерена, содержащих остатки бициклических арилкарбоновых кислот, из хлорфуллерена C60Cl6
В условиях, аналогичных описанным в примере 2, проводят обработку хлорфуллерена C60Cl6 метиловыми эфирами бифенилкарбоновой и нафтилуксусной кислот. Реакция с указанными эфирами начинается при 80-90°C, время реакции составляет 30 минут.
После хроматографического выделения были получены соединения 1в-г с выходами 60-65%.
Строение полученных производных было доказано методами ЯМР на ядрах 1Н и 13С, а также с помощью двумерной корреляционной ЯМР-спектроскопии.
1в. 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 3,63-3,77 (м, 25Н), 7,29 (д, 2Н), 7,38-7,41 (м, 12Н), 7,48-7,51 (д, 2Н), 7,56-7,59 (д, 4Н), 7,59-7,62 (д, 4Н), 7,62-7,67 (м, 8Н), 7,81-7,85 (д, 4Н), 8,09-8,12 (д, 4Н).
13С ЯМР (150 МГц, CDCl3, δ, м.д): 40,82 (СН2), 40,85 (СН2), 40,87 (СН2), 52,12 (ОСН3), 52,19 (ОСН3), 58,06 (sp3 каркас), 60,66 (sp3 каркас), 63,31 (sp3 каркас), 76,35 (С-Cl), 126,50, 127,23, 127,34, 127,43, 127,46, 128,26, 129,07, 129,09, 129,62, 129,81, 129,86, 130,58, 133,18, 133,34, 133,37, 136,41, 137,89, 138,91, 139,16, 139,21, 139,61, 140,31, 140,35, 142,76, 143,05, 143,40, 143,55, 143,79, 143,94, 144,07, 144,33, 144,43, 144,56, 144,69, 145,35, 145,44, 146,76, 147,35, 147,47, 147,96, 148,25, 148,40, 148,58, 148,77, 148,82, 148,88, 150,38, 151,27, 153,92, 156,72, 171,96 (СООСН3), 172,01 (СООСН3).
1г. 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 3,00-4,25 (м, 25Н), 6,70-8,60 (м, 30Н).
13С ЯМР (150 МГц, CDCl3, δ, м.д): 38,24-39,41 (СН2), 51,41-52,37 (ОСН3), 58,81 (sp3 каркас), 61,09 (sp3 каркас), 63,59 (sp3 каркас), 123.09-124,06, 125,51-126,57, 126,66-127,15, 127,62-129,25,130,55-132,25, 132,91-134,09, 142,81-149,25, 171,15-172,0 (СООСН3).
Снятие защитных групп в соединениях 1в-г с помощью кислотного гидролиза и получение арилированных производных со свободными карбоксильными группами описано ниже (пример 7).
Пример 4.
Получение защищенных поликарбоксильных производных [60] фуллерена, содержащих остатки арилоксикарбоновых кислот, из хлорфуллерена C60Cl6.
Для получения соединений 1д-1ж используют арилирование хлорфуллерена C60Cl6 метиловыми эфирами феноксиуксусной, феноксипропионовой и феноксимасляной кислот.При использовании в качестве катализатора безводного треххлористого железа процесс ведут следующим образом. Хлорфуллерен C60Cl6 (1-10 г) прибавляют при перемешивании к сухому нитробензолу (500 мл) в атмосфере аргона. Колбу вакуумируют при легком нагревании (30-40°C) для удаления содержащихся в растворителе газов и следов воды. При этом хлорфуллерен C60Cl6 практически полностью растворяется с образованием прозрачного красного раствора. К раствору прибавляют перегнанные в вакууме метиловые эфиры феноксиуксусной, феноксипропионовой и феноксимасляной кислот (20- 100 мл), после чего еще раз вакуумируют систему до прекращения выделения газов. Устанавливают температуру смеси равной 30°C и прибавляют безводный трихлорид железа (10-100 мг), после чего систему снова вакуумируют и снова заполняют аргоном. Реакция начинается сразу после прибавления катализатора. Реакцию проводят при указанной температуре до полного исчезновения исходного хлорфуллерена, что контролируется с помощью тонкослойной или высокоэффективной жидкостной хроматографии.
Реакционную смесь охлаждают и проводят дальнейшую обработку, как указано в примере 2.
Получают продукты 1д, 1е, 1ж с выходом 35, 45 и 41% соответственно.
При проведении указанной реакции с использованием тетрахлорида титана в качестве катализатора заменяют растворитель на 1,2-дихлорбензол, а вместо треххлористого железа используют 1-5 мл TiCl4. Реакцию проводят при 50°C в течение 2 часов. Получают продукты 1д, 1е, 1ж с выходом 45, 40 и 49% соответственно.
При проведении реакции с использованием тетрахлорида олова в качестве катализатора заменяют растворитель на 1,2-дихлорбензол или хлорбензол, а вместо треххлористого железа используют 2-10 мл SnCl4. Реакцию проводят при 70°C в течение 3,5 часов. Получают продукты 1д, 1е, 1ж с выходом 60, 55 и 60% соответственно.
Строение полученных производных было доказано методами ЯМР на ядрах 1Н и 13С, а также с помощью двумерной корреляционной ЯМР-спектроскопии.
1д. 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 3.78 (с, 3Н), 3.85 (с, 6Н), 3.86 (с, 6Н), 4.58 (с, 2Н), 4.69 (с, 4Н), 4.70 (с, 4Н), 6.68 (д, 2Н), 6.86 (д, 4Н), 6.92 (д, 4Н), 7.16 (д, 2Н), 7.55 (д, 4Н), 7.86 (д, 4Н).
13С ЯМР (150 МГц, CDCl3, δ, м.д): 52.30 (ОСН3), 52.37 (ОСН3), 57.45 (sp3 каркас), 60.07 (sp3 каркас), 62.80 (sp3 каркас), 65.16 (ОСН2), 65.23 (ОСН2), 65.36 (ОСН2), 76.63 (С-Cl), 113.94 (Ar), 114.88 (Ar), 114.94 (Ar), 129.86 (Ar), 129.89 (Ar), 130.43 (Ar), 131.34 (Ar), 131.94 (Ar), 137.26, 142.92, 143.34, 143.37, 143.65, 143.85, 144.03, 144.21, 144.30, 144.45, 144.54, 145.21, 145.32, 146.69, 147.27, 147.41, 147.86, 148.19, 148.32, 148.48, 148.69, 148.70, 148.75, 148.79, 150.44, 151.10, 153.48, 156.79, 156.89, 157.34, 157.40, 169.15 (СООСН3), 169.21 (СООСН3).
1e 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 2,76 (т, 2Н), 2,87 (м, 8Н), 3,71-3,79 (м, 15Н), 4,19 (т, 2Н), 4,30 (м, 8Н), 6,69 (д, 2Н), 6,86 (д, 4Н), 6,92 (д, 4Н), 7,16 (д, 2Н), 7,56 (д, 4Н), 7,85 (д, 4Н).
13С ЯМР (150 МГц, CDCl3, δ, м.д): 34,38 (СН2), 34,44 (СН2), 51,89 (ОСН3), 51,96 (ОСН3), 57,52 (sp3 каркас), 60,14 (sp3 каркас), 62,85 (sp3 каркас), 63,25 (ОСН2), 63,45 (ОСН2), 63,55 (ОСН2), 113,83 (Ar), 114,83 (Ar), 114,85 (Ar), 129,09, 129,24, 129,70, 129,73, 129,76, 131,24, 131,31, 136,67, 142,87, 143,40, 143,55, 143,76, 143,84, 144,09, 144,17, 144,25, 144,43, 144,51, 145,28, 145,42, 146,86, 147,26, 147,28, 147,41, 147,85, 148,16, 148,31, 148,47, 148,65, 148,69, 148,71, 148,77, 150,54, 151,33, 153,63, 156,83, 157,57, 158,11, 158,15, 171,42 (СООСН3), 171,49 (СООСН3), 171,53 (СООСН3).
1ж. 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 2.06 (м, 2Н), 2.17 (м, 8Н), 2.49 (т, 2Н), 2.59 (т, 8Н), 3.68 (с, 3Н), 3.73 (с, 6Н), 3.74 (с, 6Н), 3.93 (т, 2Н), 4.06 (м, 8Н), 6.66 (д, 2Н), 6.84 (д, 4Н), 6.89 (д, 4Н), 7.16 (д, 2Н), 7.56 (д, 4Н), 7.84 (д, 4Н).
13С ЯМР (150 МГц, CDCl3, δ, м.д): 24.58 (СН2), 24.64 (СН2), 24.67 (СН2), 30.45 (СН2), 30.58 (СН2), 51.66 (ОСН3), 51.72 (ОСН3), 57.52 (sp3 каркас), 60.14 (sp3 каркас), 62.86 (sp3 каркас), 66.48 (ОСН2), 66.72 (ОСН2), 66.83 (ОСН2), 113.66 (Ar), 114.56 (Ar), 114.67 (Ar), 114.80 (Ar), 127.74, 129.10, 129.25, 129.40, 129.76, 130.56, 131.03, 131.26, 136.45, 142.85, 143.42, 143.54, 143.75, 143.86, 144.09, 144.14, 144.24, 144.43, 144.49, 145.30, 145.42, 146.88, 147.25, 147.27, 147.40, 147.84, 148.14, 148.30, 148.45, 148.63, 148.68, 148.69, 148.76, 150.55, 151.34, 153.64, 156.86, 157.87, 158.38, 158.44, 173.65 (СООСН3), 173.67 (СООСН3), 173.71 (СООСН3).
Снятие защитных групп в соединениях 1д-ж с помощью кислотного гидролиза и получение арилированных производных со свободными карбоксильными группами описано ниже (пример 7).
Пример 5.
Получение защищенных поликарбоксильных производных [60] фуллерена, содержащих остатки арилкарбоновых кислот, из хлорфуллерена C60Cl6
Для получения соединения 1з используют арилирование хлорфуллерена C60Cl6 метиловым эфиром фенилпропионовой кислоты. Хлорфуллерен C60Cl6 (1 г) прибавляют при перемешивании к сухому нитробензолу (150 мл) в атмосфере аргона. Колбу вакуумируют при легком нагревании (40°C) для удаления содержащихся в растворителе газов и следов воды. При этом хлорфуллерен C60Cl6 практически полностью растворяется с образованием прозрачного красного раствора. К раствору прибавляют перегнанный в вакууме метиловый эфир фенилпропионовой кислоты (20 мл), после чего еще раз вакуумируют систему до прекращения выделения газов и наконец заполняют аргоном. Затем нагревают реакционную смесь до 150°C и прибавляют безводный трихлорид железа (10 мг), после чего продолжают нагревание до 200°C. Реакция заканчивается за 15 минут при указанной температуре.
Продукт выделяют, как описано в примере 2. Для элюирования продукта в ходе хроматографии используют 0,4% раствор метанола в толуоле. Продукт 1з получают с выходом 40% в расчете на взятый в реакцию хлорфуллерен.
Чистота полученного продукта (более 95%) подтверждена с помощью метода высокоэффективной жидкостной хроматографии. Электроспрей масс-спектр синтезированного продукта (Фиг. 1), полученный в присутствии цианид-иона, содержит только пик продукта присоединения состава С60(C6H4CH2CH2COOCH3)4CN- (отношение m/z 1399), что подтверждает индивидуальность и высокую чистоту полученного вещества.
Пример 6.
Получение защищенн