Карбоксамидные соединения и их применение в качестве ингибиторов кальпаина
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к новым карбоксамидным соединениям формулы (I) и к их фармацевтически приемлемым солям, где R1 является фенил-С1-С6-алкилом, где фенил может быть незамещенным или замещенным 1 радикалом R1c; где R1c выбирают независимо из галогена, С1-С6-алкила, C1-C6-алкокси, где С1-С6алкильные группы могут быть частично или полностью галогенированы или могут иметь 1, 2 или 3 заместителя R1a, и -(CH2)p-NRc6Rc7, где р=0, 1, где R1a выбирают независимо из NRa6Ra7, Ra6 представляет собой С1-С6-алкил, Ra7 представляет собой С1-С6-алкил, или два радикала Ra6 и Ra7, или Rc6 и Rc7 образуют вместе с атомом N азотсодержащий 6-членный насыщенный гетероцикл, который может необязательно иметь 1 дополнительный гетероатом О в качестве члена кольца, R2 представляет собой фенил, пиридил, где фенил может быть незамещенным или может иметь 1 заместитель R2c; где R2c имеет одно из значений, указанных для R1c; R3 представляет собой С1-С6-алкил, С3-С6-алкенил, С3-С6-циклоалкил, С3-С6-циклоалкил-С1-С2-алкил, где С1-С6алкил, является незамещенным или имеет 1 заместитель Rxa, где Rxa имеет одно из значений, указанных для R1a; R5 представляет собой галоген или С1-С2-алкил, где m является 0 или 1; n является 0. Также изобретение относится к конкретным соединениям, фармацевтической композиции на основе соединения формулы (I). Технический результат: получены новые карбоксамидные соединения, полезные в качестве ингибиторов кальпаина (кальций-зависимых цистеиновых протеаз). 3 н. и 24 з.п. ф-лы, 4 табл., 34 пр.
Реферат
Настоящее изобретение относится к новым карбоксамидным соединениям и их применению для получения лекарственного средства. Карбоксамидные соединения являются ингибиторами кальпаина (кальций-зависимых цистеиновых протеиназ). Соответственно, изобретение также относится к применению этих карбоксамидных соединений для лечения расстройства, связанного с повышенной активностью кальпаина.
Кальпаины являются внутриклеточными протеолитическими ферментами из группы цистеиновых протез, и они присутствуют во многих клетках. Фермент кальпаин активируется при повышенной концентрации кальция, при этом различают кальпаин I или μ-кальпаин, который активируется при микромолярных концентрациях ионов кальция, и кальпаин II или м-кальпаин, который активируется при миллимолярных концентрациях ионов кальция. В настоящее время, также высказываются предположения о существовании дополнительных кальпаиновых изоферментов (M.E. Saez et al; Drug Discovery Today 2006, 11 (19/20), pp. 917-923; K. Suzuki et al, Biol. Chem. Hoppe-Seyler, 1995, 376 (9), pp.523-9).
Кальпаины играют важную роль в различных физиологических процессах. Эти процессы включают расщепление различных регуляторных белков, таких как протеинкиназа C, белков цитоскелета, таких как MAP 2 и спектрин, и мышечных белков, разрушение белка при ревматоидном артрите, белков при активации тромбоцитов, нейропептидном метаболизме, белков при митотическом делении, и другие процессы, которые приведены в публикации M.J.Barrett et al, Life Sci. 1991, 48, pp.1659-69; K. Wang et al, Trends in Pharmacol.Sci. 1994, 15, pp. 412-419.
Повышенные уровни кальпаина обнаружены при различных патофизиологических процессах, например: сердечных ишемиях (например, инфаркте миокарда), ишемиях почек, легких, печени или центральной нервной системы (например, инсульте), воспалениях, мышечных дистрофиях, катарактах глаз, диабете, ВИЧ расстройствах, повреждениях центральной нервной системы (например, травме головного мозга), болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона, рассеянном склерозе и других заболеваниях (см. K.K. Wang, выше) и инфекционных заболеваниях, таких как малярия (IM Medana et al, Neuropath and Appl. Neurobiol. 2007, 33, pp.179-192). Предполагают, что существует связь между этими заболеваниям и обычно или постоянно повышенными внутриклеточными уровнями кальция. Это приводит к тому, что кальций-зависимые процессы становятся сверхактивными и больше не подвергаются нормальному физиологическому контролю. Соответствующая сверхактивация кальпаинов может также запускать патофизиологические процессы.
По этой причине, было сделано предположение, что ингибиторы кальпаина могли бы применяться для лечения этих заболеваний. Это предположение было подтверждено рядом исследований. Так, в публикации Seung-Chyul Hong et al, Stroke 1994, 25 (3), pp. 663-669, and R. T. Bartus et al, Neurological Res. 1995, 17, pp. 249-258, было показано, что ингибиторы кальпаина обладают нейропротективным действием при острых нейродегенеративных повреждениях или ишемиях, таких как возникающие после мозгового инсульта. В публикации K.E. Saatman et al, Proc. Natl. Acad. Sci. USA, 1996, 93, pp. 3428-3433 сообщается, что после экспериментальной травмы головного мозга, ингибиторы кальпаина также улучшают восстановление нарушений характеристик памяти и нейромоторных нарушений. В публикации C.L. Edelstein et al, Proc. Natl. Acad. Sci. USA, 1995, 92, pp. 7662-6, было показано, что ингибиторы кальпаина обладают защитным действием в случае пораженных гипоксией почках. В публикации Yoshida, Ken Ischi et al, Jap. Circ. J. 1995, 59 (1), pp. 40-48 было отмечено, что ингибиторы кальпаина оказывают положительное действие после кардиологического повреждения, вызванного ишемией или реперфузией. Ингибитор кальпаина BDA-410 задерживал развитие заражения малярией на экспериментальной модели патогенеза малярии на мышах, как показано в публикации X. Li et al., Mol. Biochem. Parasitol. 2007, 155 (1), pp 26-32.
Более поздние исследования кальпастатина на генетически измененных животных показали, что экспрессия природного ингибитора кальпаина значительно уменьшает патофизиологическое действие активированного кальпаина при экспериментальном гломерулонефрите (J. Peltier et al., J A, Soc Nephrol. 2006, 17, pp. 3415-3423), при сердечно-сосудистом ремоделировании в случае гипертензии, вызванной ангиотензином II, при нарушенной синаптической передаче в случае врожденного миастенического синдрома медленных каналов (Groshong JS et al, J. Clin. Invest. 2007, 117 (10), pp 2903-2912), при эксайтотоксичной фрагментации ДНК через митохондриальные сигнальные пути (J Takano et al, J. Biol. Chem. 2005, 280 (16) pp. 16175-16184), и при некротических процессах в дистрофичных мышцах (M.J. Spencer et al, Hum Mol Gen, 2002, 11(21), pp 2645-2655).
В последние годы было показано, что как функция, так и метаболизм ряда важных белков, принимающих участие в развитии болезни Альцгеймера, модулируются с помощью кальпаина. Различные внешние воздействия, такие как, например, эксайтотоксины, окислительный стресс или же воздействие амилоидного белка, приводят к сверхактивности кальпаина в нервной клетке, вызывающей, в виде каскада, дисрегуляцию ЦНС-специфической киназы cdk5 и затем гиперфосфорилирование так называемого тау-белка. В то время как основная задача тау-белка заключается в стабилизации микротрубочек и, следовательно, цитоскелета, фосфорилированный тау-белок уже больше не способен выполнять эту функцию; цитоскелет разрушается, аксональный транспорт вещества нарушается, и следовательно, в конечном счете, дегенерируется нервная клетка (G. Patrick et al, Nature 1999, 402, pp. 615-622; E. A. Monaco et al; Curr. Alzheimer Res. 2004, 1 (1), pp. 33-38). Накопление фосфорилированного тау-белка дополнительно приводит к образованию так называемых нейрофибриллярных клубков (NFT), которые вместе с хорошо известными амилоидными бляшками представляют собой патологический признак болезни Альцгеймера. Аналогичные изменения в тау-белке, обычно относимые к важной особенности таупатий, также наблюдаются при других (нейро)дегенеративных расстройствах, таких как, например, последствия инсульта, воспаления мозга, паркинсонизм, при нормотензивной гидроцефалии и болезни Крейтцфельда-Якоба.
Участие кальпаина в нейродегенеративных процессах было показано на трансгенных мышах с помощью кальпастатина, специфического и природного ингибитора кальпаинов (Higuchi et al; J. Biol. Chem. 2005, 280 (15), pp. 15229-15237). С помощью ингибитора кальпаина удавалось значительно снижать клинические признаки острого аутоиммунного энцефаломиелита на экспериментальной модели рассеяного склероза на мышах (F. Mokhtarian et al; J. Neuroimmunology 2006, Vol. 180, pp. 135-146). Кроме того, было показано, что, с одной стороны, ингибиторы кальпаина блокируют Αβ-индуцируемую дегенерацию нейронов (Park et al; J. Neurosci. 2005, 25, pp. 5365-5375), и, помимо этого, уменьшают высвобождение β-амилоидного предшественника белка (β APP) (J. Higaki et al, Neuron, 1995, 14, pp. 651-659). Исходя из этого, ингибиторы кальпаина, обладающие достаточной ЦНС доступностью, представляют собой новый терапевтический подход к лечению нейродегенеративных расстройств в целом, а также, в частности, болезни Альцгеймера.
Ингибиторы кальпаина также ингибируют высвобождение интерлейкина-1α (N. Watanabe et al, Cytokine 1994, 6(6), pp. 597-601). Кроме того, было обнаружено, что ингибиторы кальпаина проявляют цитотоксическое действие в отношении опухолевых клеток (E. Shiba et al. 20th Meeting Int. Ass. Breast Cancer Res., Sendai Jp, 1994, 25.-28.Sept., Int. J. Oncol. S(SuppL), 1994, 381).
Только недавно было показано участие кальпаина в ВИЧ расстройствах. Так, было продемонстрировано, что ВИЧ-индуцированная нейротоксичность опосредуется кальпаином (O'Donnell et al; J. Neurosci. 2006, 26 (3), pp. 981-990). Было также показано участие кальпаина в репликации вируса ВИЧ (Teranishi et al; Biochem. Biophys. Res. Comm. 2003, 303 (3), pp. 940-946).
Последние исследования указывают, что кальпаин играет некоторую роль в так называемой ноцицепции, в восприятии боли. Ингибиторы кальпаина продемонстрировали явный положительный эффект на различных соответствующих доклинических моделях боли, например, при термически индуцируемой гипералгезии у крыс (Kunz et al; Pain 2004, 110, pp.409-418), при индуцируемой таксолом нейропатии (Wang et al; Brain 2004, 127, pp.671-679) и при острых и хронических воспалительных процессах (Cuzzocrea et al; American Journal of Pathololgy 2000, 157 (6), pp. 2065-2079).
Недавно было также показано участие кальпаина в развитии заболеваний почек, таких как хронические заболевания почек, например, диабетическая нейропатия. Так, на экспериментальных моделях на животных было продемонстрировано (Y. Shi et al.), что происходит подавление природного ингибитора кальпаина, кальпастатина, во время ишемии/реперфузии почек (Am. J. Physiol. Renal Physiol. 2000, 279, pp. 509-517). Кроме того, было показано на модели острой почечной недостаточности (A. Dnyanmote et al, Toxicology and Applied Pharmacology 2006, 215, pp.146-157), что ингибирование кальпаина посредством сверхэкспрессии кальпастатина снижает развитие повреждение почек, индуцируемое нефротоксическим веществом DCVC (S-(1,2-дихлорвинил)-L-цистеином). Кроме того, было продемонстрировано (Peltier et al.), что активация и секреция кальпаина способствует гломерулярному повреждению на экспериментальной модели гломерулонефрита (J. Am. Soc. Nephrol. 2006, 17, pp. 3415-3423). Было также показано, что ингибиторы кальпаина снижают почечную дисфункцию и повреждение, вызываемое ишемией/реперфузией почек, и, следовательно, они могут применяться для повышения устойчивости почек к их повреждению, связанному с сосудистым хирургическим вмешательством на аорте или с пересадкой почки (P. Chatterjee et al., Biochem. Pharmacol. 2005, 7, pp. 1121-1131).
Кальпаин был также идентифицирован в качестве центрального медиатора, важного для паразитической активности.
Паразиты, такие как малярийный плазмодий Plasmodium falciparum и возбудитель токсоплазмоза Toxoplasma gondii, используют кальпаины клетки-хозяина для облегчения высвобождения из внутриклеточной паразитофорной вакуоли и/или плазматической мембраны хозяина. Ингибирование кальпаина-1 в гипотонически лизированных и вторично уплотненных эритроцитах предотвращало высвобождение паразитов P. falciparum, которое восстанавливали путем добавления очищенного кальпаина-1. Аналогично, эффективный выход T. gondii из фибробластов млекопитающих блокировали либо путем небольшого вмешательства в РНК-опосредованное подавление, либо путем генетического стирания активности кальпаина, и могли восстанавливать путем генетической комплементации (D. Greenbaum et al, Science 324, 794 (2009). Тот факт, что паразиты, которые не могут высвобождаться из клеток-хозяев, не способны к пролиферации, позволяет предложить стратегию для антипаразитарной терапии. Было показано, что фармакологическое ингибирование кальпаина оказывает противомалярийную активность, и, вследствие этого, представляет собой новой подход в антипаразитарной стратегии при лечении заболеваний, вызываемых такими инфекциями, как малярия или токсоплазмоз (Li et al., Mol Biochem Parasitol. 2007; 155(1): 26-32; Jung et al. Archives of Pharmacal Research (2009), 32(6), 899-906, Chandramohanadas et al. Science (2009), 324, 794).
Кроме того, возможные применения ингибиторов кальпаина подробно рассмотрены в публикациях: M.Pietsch et al. Current Topics in Medicinal Chemistry, 2010, 10, 270-293; M.E. Saez et al; Drug Discovery Today 2006, 11 (19/20), pp. 917-923; N. O. Carragher, Curr. Pharm. Design 2006, 12, pp. 615-638; K. K. Wang et al; Drugs of the Future 1998, 23 (7), pp. 741-749; and Trends in Pharmacol.Sci. 1994, 15, pp. 412-419.
Описанные к настоящему времени ингибиторы кальпаина в целом подразделяют на необратимые и обратимые ингибиторы, и на пептидные и непептидные ингибиторы.
Необратимыми ингибиторами обычно являются алкилирующие вещества. Их недостатком является то, что, во-первых, они реагируют неселективно, и/или они не стабильны в организме. Следовательно, соответствующие ингибиторы часто проявляют нежелательные побочные эффекты, такие как токсичность, и поэтому их применение существенно ограничено. Необратимые ингибиторы включают, например, эпоксиды, такие как E64, α-галогенкетоны и дисульфиды.
К большому числу известных обратимых ингибиторов кальпаина относятся пептидные альдегиды, которые получают, в частности, из ди- или трипептидов, таких как, например, Z-Val-Phe-H (MDL 28170). Также описаны производные и пролекарства, структурно получаемые из альдегидов, в частности, соответствующие ацетали и гемиацетали (например, гидрокситетрагидрофураны, гидроксиоксазолиндины, гидроксиморфолины и другие подобные соединения), а также имины или гидразоны. Однако, при физиологических условиях, пептидные альдегиды и родственные соединения обычно имеют недостаток, заключающийся в том, что вследствие их реакционной способности, они часто являются нестабильными, быстро метаболизируются и склонны к неспецифическим реакциям, которые могут также вызывать токсическое действие (J.A. Fehrentz and B.Castro, Synthesis 1983, pp. 676-78).
В последние годы был описан ряд непептидных карбоксамидов, имеющих β-кетофункцию в аминном фрагменте и ингибирующих кальпаин. Так, в WO 98/16512 описаны производные 3-амино-2-оксокарбоновой кислоты, в которых аминогруппу амидируют с помощью соединения 4-пиперидинкарбоновой кислоты. В WO 99/17775 описаны аналогичные соединения, которые амидируют с помощью хинолинкарбоновой кислоты. В WO 98/25883, WO 98/25899 и WO 99/54294 описаны производные 3-амино-2-оксокарбоновой кислоты, аминогруппу которой амидируют с помощью замещенной бензойной кислоты. В WO 99/61423 описаны производные 3-амино-2-оксокарбоновой кислоты, аминогруппу которой амидируют с помощью ароматической карбоновой кислоты, несущей остаток тетрагидрохинолина/изохинолина и 2,3-дигидроиндола/изоиндола. Аналогичные соединения, в которых остаток ароматической карбоновой кислоты несет гетероциклоалкильный радикал или (гетеро)арильный радикал, который необязательно соединен через мостик, описаны в WO 99/54320, WO 99/54310, WO 99/54304 и WO 99/54305. Или же, в WO 08/080969 описаны никотинамиды производных 3-амино-2-оксокарбоновой кислоты, которые в положении 2 пиридинового кольца связаны с замещенным пиразолом через атом азота. В WO 03/080182 описано применение упомянутых выше амидов для лечения легочных заболеваний. Упоминаемые в описании изобретения непептидные ингибиторы кальпаина также имеют ряд недостатков, в частности низкую селективность или ее отсутствие в отношении родственных цистеиновых протеаз, таких как различные катепсины, что также может приводить к нежелательным побочным эффектам.
В WO 07/016589 и WO 08/106130 описаны производные 2-оксокарбоновой кислоты, несущие N-ацилированную 2-пирролидинкарбоксиламидную группу в 3-положении. Кроме того, раскрыто их применение при лечении вирусных инфекций гепатита C.
Было показано, что карбоксамиды, включающие α-кетоамидный фрагмент в аминном компоненте, в частности карбоксамиды, описанные в WO 08/080969, являются высокоэффективными и селективными ингибиторами кальпаина. Однако, как было обнаружено авторами настоящего изобретения, в ряде случаев они имели ограниченную цитозольную стабильность, в частности, у людей, что может приводить к их преждевременному выведению из цитозоля. Вследствие этого, может быть неудовлетворительной фармакокинетика этих соединений.
Считают, что цитозольное разложение указанных карбоксамидных соединений, имеющих α-кетоамидный фрагмент, вызывается в основном метаболическим восстановлением карбонильной функции в α-положении. Восстановление карбонила является важной стадией в фазе I метаболизма карбонилсодержащих лекарственных средств путем превращения альдегидных, кетоновых хиноновых фрагментов в спирты для облегчения выделения с помощью конъюгации или непосредственного выведения фазы II (M.J.C. Rosemond and J.S. Walsh: "Human carbonyl reduction pathways and a strategy for their study in vitro", Drug Metabolism Reviews, 2004, 36, 335-361). Активность по восстановлению карбонила в организме человека проявляется повсеместно, обнаруживается во многих тканях, включая печень, легкие, головной мозг, сердце, почки, и кровь. Было охарактеризовано множество ферментов человека, восстанавливающих карбонил, включая среднецепочечные (MDR) и короткоцепочечные (SDR) дегидрогеназы/редуктазы, альдокеторедуктазы (AKR) и хинонредуктазы (QR), большинство из которых присутствуют в цитозолях печени, кроме некоторого семейства короткоцепочечных ферментов, присутствующих в микросомах печени и митохондриях, описанных в публикации F. Hoffmann and E. Maser: "Carbonyl reductases and pluripotent гидроксиsteroid dehydrogenases of the shortchain dehydrogenases/reductases superfamily", Drug Metabolism Reviews 2007, 39, 87-144.
Следовательно, задачей настоящего изобретения является разработка соединений, которые ингибируют кальпаин с высокой аффинностью и селективностью. Кроме того, предполагается, что соединения должны проявлять повышенную цитозольную стабильность в клетках человека, таких как гепатоциты, и, вследствие этого, улучшенную фармакокинетику.
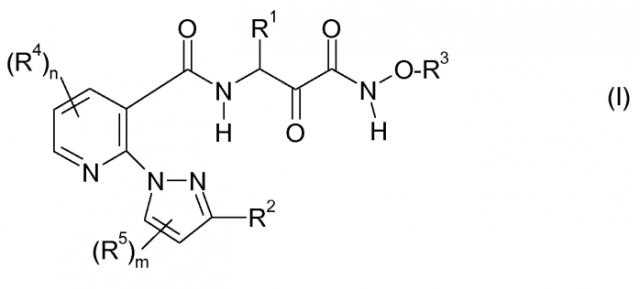
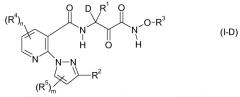
Решение этой задачи и дополнительных задач достигается за счет применения описанных ниже карбоксамидных соединений общей формулы I, их фармацевтически приемлемых солей, пролекарств, гидратов и таутомеров:
где
R1 является C1-C10-алкилом, C2-C10-алкенилом, C2-C10-алкинилом, где последние 3 упомянутые радикалы могут быть частично или полностью галогенированы и/или иметь 1, 2 или 3 заместителя R1a,
C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, где CH2 группа в циклоалкильном фрагменте последних двух упомянутых радикалов может быть заменена на O, NH или S, или два смежных атома С могут образовывать двойную связь, где циклоалкильный фрагмент может дополнительно иметь 1, 2, 3 или 4 радикала R1b,
арилом, гетероарилом, арил-C1-C6-алкилом, арил-C2-C6-алкенилом, гетероарил-C1-C4-алкилом или гетероарил-C2-C6-алкенилом, где арил и гетероарил в последних 6 упомянутых радикалах могут быть незамещенными или иметь 1, 2, 3 или 4 одинаковых или различных радикала R1c; где
R1a выбирают независимо из OH, SH, COOH, CN, OCH2COOH, C1-C6-алкокси, C1-C6-галогеналкокси, C3-C7-циклоалкилокси, C1-C6-алкилтио, C1-C6-галогеналкилтио, COORa1, CONRa2Ra3, SO2NRa2Ra3, -NRa2-SO2-Ra4, NRa2-CO-Ra5, SO2-Ra4 и NRa6Ra7,
R1b выбирают независимо из OH, SH, COOH, CN, OCH2COOH, галогена, фенила, который необязательно имеет 1, 2 или 3 заместителя R1d,
C1-C6-алкила, C1-C6-алкокси, C1-C6-алкилтио, где алкильные фрагменты в 3 последних упомянутых заместителях могут быть частично или полностью галогенированы и/или иметь 1, 2 или 3 заместителя R1a,
COORb1, CONRb2Rb3, SO2NRb2Rb3, NRb2-SO2-Rb4, NRb2-CO-Rb5, SO2-Rb4 и NRb6Rb7,
кроме того, два R1b радикала могут вместе образовывать C1-C4-алкиленовую группу, или 2 R1b радикала, соединенных со смежными атомами С циклоалкила, могут образовывать вместе с углеродными атомами, к которым они присоединены, также бензольное кольцо.
R1c выбирают независимо из OH, SH, галогена, NO2, NH2, CN, COOH, OCH2COOH, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкокси-C1-C4-алкила, C1-C6-алкилтио, где алкильные фрагменты в последних 4 упомянутых заместителях могут быть частично или полностью галогенированы и/или иметь 1, 2 или 3 заместителя R1a,
C3-C7-циклоалкила, C3-C7-циклоалкил-C1-C4-алкила, C3-C7-циклоалкилокси, где циклоалкильный фрагмент последних трех упомянутых радикалов может иметь 1, 2, 3 или 4 радикала R1b,
арила, гетероарила, O-арила, O-CH2-арила, где последние три упомянутых радикала являются незамещенными в арильном фрагменте или могут иметь 1, 2, 3 или 4 радикала R1d, COORc1, CONRc2Rc3, SO2NRc2Rc3, NRc2-SO2-Rc4, NRc2-CO-Rc5, SO2-Rc4,
-(CH2)p-NRc6Rc7 при p=0, 1, 2, 3, 4, 5 или 6, и
O-(CH2)q-NRc6Rc7 при q=2, 3, 4, 5 или 6; где
Ra1, Rb1 и Rc1 являются независимо H, C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d,
Ra2, Rb2 и Rc2 являются независимо H, C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, и
Ra3, Rb3 и Rc3 являются независимо H, C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, или
два радикала Ra2 и Ra3, или Rb2 и Rb3, или Rc2 и Rc3 образуют вместе с атомом N необязательно замещенный азотсодержащий 3-7-членный гетероцикл, который может необязательно иметь 1, 2 или 3 дополнительных различных или одинаковых гетероатома из группы O, N, S в качестве членов кольца,
Ra4, Rb4 и Rc4 являются независимо C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, и
Ra5, Rb5 и Rc5 имеют независимо одно из значений, упомянутых для Ra1, Rb1 и Rc1;
Ra6, Rb6 и Rc6 являются независимо H, C1-C6-алкилом, C1-C6-алкокси, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, CO-C1-C6-алкилом, CO-O-C1-C6-алкилом, SO2-C1-C6-алкилом, арилом, гетероарилом, O-арилом, OCH2-арилом, арил-C1-C4-алкилом, гетероарил-C1-C4-алкилом, CO-арилом, CO-гетероарилом, CO-(арил-C1-C4-алкил), CO-(гетероарил-C1-C4-алкил), CO-O-арилом, CO-O-гетероарилом, CO-O-(арил-C1-C4-алкил), CO-O-(гетероарил-C1-C4-алкил), SO2-арилом, SO2-гетероарилом, SO2-(арил-C1-C4-алкил) или SO2-(гетероарил-C1-C4-алкил), где арил или гетероарил в последних 18 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, и
Ra7, Rb7 и Rc7 являются независимо H, C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкилом, который имеет 1, 2 или 3 заместителя R1a, или C2-C6-алкенилом, C2-C6-алкинилом, C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, C3-C7-гетероциклоалкил-C1-C4-алкилом, C1-C6-алкокси-C1-C4-алкилом, арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя R1d, или
два радикала Ra6 и Ra7, или Rb6 и Rb7, или Rc6 и Rc7 образуют вместе с атомом N необязательно замещенный азотсодержащий 3-7-членный гетероцикл, который может необязательно иметь 1, 2 или 3 дополнительных различных или одинаковых гетероатома из группы O, N, S в качестве членов кольца,
или два радикала R1b, или два радикала R1c, соединенных со смежными атомами С, образуют вместе с атомами С, с которыми они соединены, 4, 5, 6 или 7-членный необязательно замещенный карбоцикл или необязательно замещенный гетероцикл, который имеет 1, 2 или 3 различных или одинаковых гетероатома из группы O, N и S в качестве членов кольца;
R1d выбирают из галогена, OH, SH, NO2, COOH, C(O)NH2, CHO, CN, NH2, OCH2COOH, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-алкокси, C1-C6-галогеналкокси, C1-C6-алкилтио, C1-C6-галогеналкилтио, CO-C1-C6-алкила, CO-O-C1-C6-алкила, NH-C1-C6-алкила, NHCHO, NH-C(O)C1-C6-алкила и SO2-C1-C6-алкила;
R2 является C3-C7-циклоалкилом, C3-C7-циклоалкил-C1-C4-алкилом, где CH2 группа в циклоалкильном фрагменте последних двух упомянутых радикалов может быть заменена на O, NH или S, или два смежных атома С могут образовывать двойную связь, где циклоалкильный фрагмент может дополнительно иметь 1, 2, 3 или 4 радикала R2b;
арилом, O-арилом, O-CH2-арилом, гетероарилом, арил-C1-C6-алкилом, арил-C2-C6-алкенилом, гетероарил-C1-C4-алкилом или гетероарил-C2-C6-алкенилом, где арил или гетероарил в последних 8 упомянутых радикалах могут быть незамещенными или иметь 1, 2, 3 или 4 одинаковых или различных радикала R2c; где
R2b имеет одно из значений, указанных для R1b, и
R2c имеет одно из значений, указанных для R1c;
R3 является C1-C4-галогеналкилом или C1-C6-алкилом, C3-C6-алкенилом, C3-C6-алкинилом, C3-C6-циклоалкилом, C3-C6-циклоалкил-C1-C2-алкилом, C3-C6-гетероциклоалкил-C1-C2-алкилом, C1-C4-алкокси-C1-C2-алкилом, где алкил, алкенил, алкокси, алкинил, циклоалкил, гетероциклоалкил в последних 7 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя Rxa,
арилом, арил-C1-C4-алкилом, гетероарилом или гетероарил-C1-C4-алкилом, где арил или гетероарил в последних 4 упомянутых радикалах являются незамещенными или имеют 1, 2 или 3 заместителя Rxd,
где Rxa имеет одно из значений, указанных для R1a, и Rxd имеет одно из значений, указанных для R1d;
R4 и R5 выбирают независимо из галогена, NH2, CN, CF3, CHF2, CH2F, O-CF3, O-CHF2, O-CH2F, COOH, OCH2COOH, C1-C2-алкила, C1-C2-алкокси, C1-C2-алкокси-C1-C2-алкила, C1-C2-алкилтио, CH2NRR', где
R и R' выбирают независимо из водорода и C1-C4-алкила;
m является 0, 1 или 2; и
n является 0, 1 или 2.
Следовательно, настоящее изобретение, относится к карбоксамидным соединениям общей формулы I, их таутомерам, гидратам, фармацевтически приемлемым солям карбоксамидных соединений общей формулы I, пролекарствам карбоксамидных соединений общей формулы I и фармацевтически приемлемым солям пролекарств, таутомеров или гидратов карбоксамидных соединений общей формулы I.
Карбоксамидные соединения изобретения формулы I, их соли, их пролекарства, их гидраты и их таутомеры эффективно ингибируют кальпаин даже при низких концентрациях. Кроме того, они отличаются высокой селективностью в отношении ингибирования кальпаина по сравнению с другими цистеиновыми протеазами, такими как катепсин B, катепсин K, катепсин L и катепсин S, и их повышенной устойчивостью к цитозольному разложению.
Поэтому, карбоксамидные соединения изобретения формулы I, их соли, их пролекарства, их гидраты и их таутомеры особенно подходят для лечения расстройств и состояний у животных, в частности у людей, которые связаны с повышенной активностью кальпаина.
Следовательно, изобретение также относится к применению карбоксамидных соединений формулы I, их таутомеров, их гидратов и их фармацевтически приемлемых солей для получения лекарственного средства, в частности лекарственного средства, которое применяют для лечения расстройства или состояния, которое связано с повышенной активностью кальпаина.
Кроме того, изобретение относится к лекарственному средству, в частности лекарственному средству, которое применяют для лечения расстройства или состояния, которое связано с повышенной активностью кальпаина. Лекарственное средство включает, по меньшей мере, одно описанное в изобретении карбоксамидное соединение формулы I, таутомер, гидрат или пролекарство соединения формулы I, или фармацевтически приемлемую соль соединения формулы I или таутомера, гидрата или пролекарства соединения формулы I.
Настоящее изобретение также относится к карбоксамидным соединениям, которые выбирают из группы, состоящей из
1-бензил-N-(4-(этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-бензил-N-(4-(этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2S)-1-бензил-N-(4-(этоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров,
1-бензил-N-(4-(изопропоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-бензил-N-(4-(изопропоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2S)-1-бензил-N-(4-(изопропоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров,
1-бензил-N-(4-(циклопропилметоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-бензил-N-(4-(циклопропилметоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2S)-1-бензил-N-(4-(циклопропилметоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров,
1-(2-фторбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-(2-фторбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2-S)-1-(2-фтор-бензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров,
1-(2-хлорбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, его стереоизомеров (2R)-1-(2-хлорбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида и (2S)-1-(2-хлорбензил)-N-(4-(метоксиамино)-3,4-диоксо-1-фенилбутан-2-ил)-5-оксопирролидин-2-карбоксамида, а также смесей этих стереоизомеров, и их таутомеров, их гидратов, их пролекарств и их фармацевтически приемлемых солей.
Эти карбоксамидные соединения, их соли, их пролекарства, их гидраты и их таутомеры, подобные соединениям формулы I, эффективно ингибируют кальпаин даже при низких концентрациях. Кроме того, они отличаются высокой селективностью в отношении ингибирования кальпаина по сравнению с другими цистеиновыми протеазами, такими как катепсин B, катепсин K, катепсин L и катепсин S, и их повышенной устойчивостью к цитозольному разложению. Поэтому, эти карбоксамидные соединения особенно подходят для лечения расстройств и состояний у животных, в частности у людей, которые связаны с повышенной активностью кальпаина. Следовательно, изобретение также относится к применению этих карбоксамидных соединений, их таутомеров, их гидратов и их фармацевтически приемлемых солей для получения лекарственного средства, в частности лекарственного средства, которое применяют для лечения расстройства или состояния, которое связано с повышенной активностью кальпаина, описанных в изобретении для соединений формулы I. Что касается таутомеров, гидратов, фармацевтически приемлемых солей или пролекарств, то они относятся к соединениям формулы I.
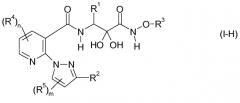
Карбоксамидные соединения формулы I могут присутствовать в форме α-кетоамида, показанного в формуле I. В качестве варианта, они могут также присутствовать в форме гидрата, то есть, кетогруппу в α-положении относительно амидного фрагмента в аминном компоненте трансформируют в две присоединенных к одному и тому же атому гидроксильных группы, как показано в формуле I-H ниже. R1, R2, R3, R4, R5, m и n в формуле I-H имеют упомянутые выше значения.
В присутствии воды, особенно при физиологических условиях, обычно обе и α-кетоамидная форма, и гидратная форма присутствуют в смеси.
Когда в следующих далее формулах и описаниях указывается только α-кетоамидная форма, предполагается, что она включает также гидрат и его смеси с α-кетоамидной формой, если не указано иное. Гидраты и α-кетоамидные формы в равной степени подходят в качестве ингибиторов кальпаина.
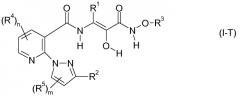
Карбоксамидные соединения изобретения формулы I также способны образовывать таутомеры, которые в равной степени подходят в качестве ингибиторов кальпаина. Конкретными примерами таутомеров, которые могут быть упомянуты, являются соединения формулы I-T:
R1, R2, R3, R4, R5, m и n в формуле I-T имеют упомянутые выше значения.
Карбоксамидные соединения изобретения формулы I могут также образовывать гемиацетали, гемикетали, ацетали или кетали с алканолами. Эти соединения в равной степени подходят в качестве ингибиторов кальпаина, так как они являются пролекарствами соединений формулы I. Соответственно, соединения, в которых одна или обе геминальных гидроксильных группы, показанные в формуле I-H, являются радикалом, полученным из алканола, и, в частности, C1-C6-алкокси, могут также быть использованы согласно изобретению.
Используемый в описании и пунктах формулы изобретения термин "пролекарство" относится к соединению, которое трансформируется в условиях метаболизма в соединение формулы I. Помимо упомянутых выше гемиацеталей, гемикеталей, ацеталей и кеталей, пролекарства соединений формулы I включают соединения формулы I, в которых атом кислорода кетогруппы в α-положении к амидному фрагменту заменяют группой O-Alk-O, S-Alk-O или S-Alk-S, где Alk является линейным C2-C5-алкандиилом, который может быть незамещенным или замещенным с помощью 1, 2, 3 или 4 радикалов, выбранных из C1-C4-алкила или галогена, и примеры таких групп включают O(CH2)2O, O(CH2)5O, O(CH2)4O, S(CH2)2O, S(CH2)5O, S(CH2)4O и другие группы. Кроме того, пролекарства соединений формулы I включают соединения формулы I, в которых кетогруппа в α-положении к амидному фрагменту заменена на группу C=NR6, где R6 выбирают из H, C1-C6-алкила, C1-C6-алкокси, C2-C6-алкенила, C3-C6-циклоалкила, C3-C6-циклоалкил-C1-C4-алкила, C2-C6-алкенилокси, C3-C6-циклоалкилокси, C3-C6-циклоалкил-C1-C4-алкилокси. В условиях метаболизма, упомянутые выше пролекарства трансформируются в соответствующие α-кетоамидные соединения формулы I или в соответствующие гидраты формулы I-H. Следовательно, указанные пролекарства и их фармацевтически приемлемые соли являются также частью изобретения.
В равной степени возможно использование фармацевтически приемлемых солей карбоксамидных соединений формулы I, их таутомеров, их гидратов или их пролекарств, особенно, солей присоединения кислоты с физиологически приемлемыми органическими или неорганическими кислотами. Примерами подходящих физиологически приемлемых органических и неорганических кислот являются хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, азотная кислота, серная кислота, органические сульфоновые кислоты, имеющие от 1 до 12 углеродных атомов, например, C1-C4-алкилсульфоновые кислоты, такие как метансульфоновая ки