Средство для селективной апоптотической элиминации опухолевых клеток
Иллюстрации
Показать всеИзобретение относится к микробиологической промышленности и может быть использовано в биотехнологии, генетической инженерии, медицине и ветеринарии. Предложено применение РНКаза Bacillus sp. ВКПМ В-9862 в качестве средства для селективной апоптотической элиминации опухолевых клеток. Предложенное средство обладает выраженным апоптозиндуцирующим действием в отношении малигнизированных клеток, при этом не оказывает токсического эффекта на нормальные клетки крови, печени, нервной ткани и фибробласты. 4 ил., 5 пр.
Реферат
Изобретение относится к микробиологии и биотехнологии, медицине и ветеринарии и касается использования рибонуклеазы Bacillus sp. ВКПМ В-9862 как средства для селективной апоптической элиминации опухолевых клеток.
Рибонуклеазы (РНКазы) - важнейшие клеточные ферменты метаболизма РНК, функции которых заключаются в расщеплении мРНК, превращении предшественников РНК в зрелые формы, продукции малых регуляторных РНК, деградации определенных типов РНК. В последние годы пристальное внимание уделяется функциям РНКаз, связанным с регуляцией экспрессии генов, роста и дифференцировки клеток, защитой от патогенов, индукцией апоптоза (1). Современные представления о роли и функциях РНКаз в клетках позволяют рассматривать эти ферменты как перспективную альтернативу традиционным химиотерапевтическим средствам в щадящей терапии злокачественных новообразований.
Среди ближайших известных аналогов - РНКаз с противоопухолевым действием - наиболее известна онконаза (РНКаза ооцитов лягушки Rana pipiens, торговая марка Alfacell Inc., США), проходящая III фазу клинических испытаний против мезотелиомы легких (патент США 5.559.212) (2). Установлены цитотоксические эффекты и ряда других РНКаз животного происхождения, таких как РНКаза семенников быка (BS-РНКаза) (3), катионный белок из эозинофильных гранул человека (4), по отношению к различным линиям опухолевых клеток. На способ лечения злокачественных опухолей у животных с использованием BS-РНКазы получен Европейский патент (ЕР 0670165 В1).
Введение препаратов онконазы и BS-РНКазы приводило к существенному уменьшению размера опухолей у животных, однако было показано, что BS-РНКаза оказывает выраженный токсический эффект: приводит к деградации тестикулярной ткани у самцов и нарушает созревание ооцитов у самок, обладает иммуносупрессивным действием, а онконаза оказывает значительное нефротоксическое действие, вызывая протеинурию и отек почек. Основными недостатками при использовании данных рибонуклеаз in vivo являются их высокие терапевтические дозы, выраженные побочные эффекты и значительное общетоксическое действие, а также высокая стоимость и недостаточная селективность.
Задачей, на решение которой направлено настоящее изобретение, является обоснование возможности использования рибонуклеазы Bacillus sp.ВКПМ В-9862 (биназа) как средства для селективной апоптической элиминации опухолевых клеток. Ранее было установлено, что биназа обладает апоптозиндуцирующим действием на клетки миелоидного лейкоза К562, ингибируя пролиферацию и вызывая апоптоз злокачественных клеток, в отличие от лимфоцитов периферической крови здоровых доноров (5). Однако из этих данных нельзя сделать вывод о действии биназы на различные опухолевые клетки и об отсутствии токсического действия биназы на нормальные ткани организма. Так, для онконазы было показано избирательное токсическое действие на клетки мезотелиомы легких, однако дальнейшие исследования выявили ее серьезный общий токсический эффект.
Техническое решение, которое может быть получено при осуществлении изобретения, заключается в применении РНКазы для апоптической элиминации опухолевых клеток.
Сущность объекта изобретения - РНКаза Bacillus sp. ВКПМ В-9862 как средство избирательной апоптической гибели опухолевых клеток.
Фермент, являющийся объектом изобретения, представляет собой гуанилспецифичную РНКазу с молекулярной массой 12,3 кДа, содержит 109 аминокислотных остатков, pI=9,5. РНКаза получена из культуральной жидкости Bacillus sp. ВКПМ В-9862 - продуцента внеклеточной щелочной РНКазы (патент РФ 2008127925/13).
Изобретение иллюстрируется примерами, которые не ограничивают объем и сущность притязаний, связанных с ним.
Пример 1. Апоптозиндуцирующее действие биназы на нормальные и опухолевые клетки крови.
Характеристику апоптогенного действия биназы проводят на культурах клеток Т-лимфобластного лейкоза Jurkar и CEMss и лимфоцитах, выделенных из периферической крови здоровых доноров. Выживаемость клеток детектируют с помощью теста на пролиферацию клеток WST-1. Клетки в состоянии апоптоза детектируют с помощью двойного окрашивания Аннексином-V, коньюгированным с флуоресцеином, и иоддидом пропидия (PI), что позволяет выявить клетки, находящиеся на различных стадиях апопотоза.
Для культивирования клеток Jurkat, СЕМсс и лимфоцитов применяют питательную среду RPMI 1640, содержащую 10% эмбриональной телячьей сыворотки, 2 мМ глутамина и по 100 единиц/мл пенициллина и стрептомицина. Клетки культивируют при 37°C в атмосфере 5% CO2.
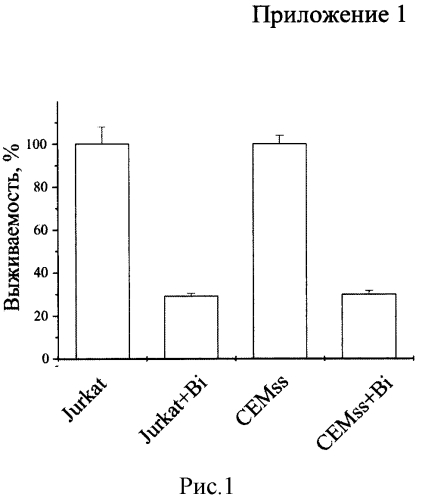
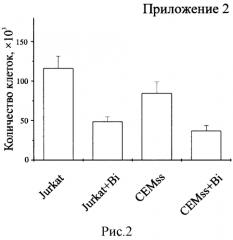
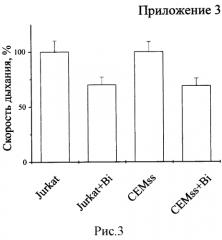
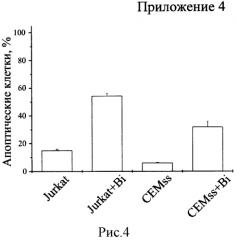
Биназа сходным образом действует на клетки Jurkat и CEMss. Выживаемость клеток обеих линий, обработанных биназой (+Bi) в концентрации 8 мкМ в течение 48 ч., уменьшается на 70% по сравнению с необработанными клетками (рисунок 1). В обоих случаях падение выживаемости обусловлено как значительным снижением числа клеток (рисунок 2), так и скорости их дыхания, определяемой как выживаемость, деленная на количество клеток (рисунок 3). При этом доля апоптических клеток в популяции для Jurkat увеличивается с 15% в контроле до 55% под действием биназы, а для CEMss с 6% до 32% (рисунок 4).
Чтобы оценить возможность индукции цитотоксических эффектов биназы в нормальных клетках человека, проводят исследование воздействия фермента на лимфоциты, выделенные из крови здоровых доноров. Биназа не оказывает влияния на жизнеспособность лимфоцитов в концентрации до 60 мкМ. Доля клеток в состоянии апоптоза при инкубировании лимфоцитов с ферментом соответствует таковой в образце без обработки РНКазой (11%).
Пример 2. Апоптозиндуцирующее действие биназы на нормальные и опухолевые нейрональные клетки.
Характеристику апоптогенного действия биназы проводят на культурах клеток нейробластомы SK-N-SH и SH-SY5Y и нейрональных стволовых клетках человека линии NSC-hTERT, подвергающихся дифференцировке. Клеточные культуры SK-N-SH, SH-SY-5Y и SK-N-AS выращивают на среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина, при температуре 37°C в атмосфере 5% CO2. Клетки NSC-hTERT культивируют в среде DMEM/F12, в которую добавлены 10 нг/мл человеческих рекомбинантных факторов EGF и bFGF, 2% заменителя сыворотки FetalCloneIII, 2 мМ глутамина, N2 Supplement, 0,11 мг/мл пирувата натрия и 40 ед./мл гентамицина. Культивирование клеток проводят при 37°C в атмосфере с 5% CO2 и 4% O2. Дифференцировку клеток NSC-hTERT проводят убиранием из среды факторов EGF и bFGF.
Через 48 ч инкубирования с биназой в концентрации 8 мкМ выживаемость клеток SK-N-SH, SH-SY5Y снижается на 40% и 52% соответственно. При этом доля апоптических клеток в популяции для SK-N-SH увеличивается с 8% в контроле до 30% под действием биназы, а для SH-SY5Y с 18% до 44%.
С целью оценки безопасности биназы в отношении нормальных клеток in vitro оценивают ее действие на дифференцированные клетки линии NSC-hTERT. В концентрации от 1 до 2,5 мкМ биназа не влияет на долю апоптических и некротических клеток в популяциях клеток NSC-hTERT. В концентрации 8 мкМ биназа снижает процент апоптических клеток в популяции NSC-hTERT с 7 до 5%, т.е. оказывает протекторный эффект.
Пример 3. Апоптозиндуцирующее действие биназы на нормальные и опухолевые клетки печени.
Характеристику апоптогенного действия биназы на нормальные и опухолевые клетки печени проводят на культуре клеток гепатоцитов HepaRG. Эти клетки в фазе активного роста являются моделью гепатокарциномы, а в состоянии монослоя моделируют нормальные клетки печени. Клетки HepaRG культивируют на питательной среде Уильяма, содержащей 4 мкг/мл инсулина, 50 мкМ гидрокортизона гемисукцината и 10% эмбриональной телячьей сыворотки. Дифференцировку клеток осуществляют добавлением 2% диметилсульфоксида.
Выживаемость клеток HepaRG, моделирующих гепатокарциному, в присутствии 2, 8 и 40 мкМ биназы снижается на 7, 18 и 38% соответственно. При этом количество апоптических клеток в популяциии увеличивается на 5, 15 и 30% соответственно.
Безопасность биназы для нормальных клеток печени, оцененная на гепатоцитах линии HepaRG в состоянии монослоя, показывает, что в концентрации до 2 мкМ биназа не влияет на долю апоптических и некротических клеток в популяциях исследованных клеток. В концентрации 8 мкМ биназа снижает процент апоптических клеток в популяции клеток HepaRG с 5 до 3%, т.е. как и в случае нормальных нейрональных клеток оказывает протекторный эффект. Большие концентрации биназы (до 60 мкМ) не влияют не апоптоз и выживаемость клеток печени.
Пример 4. Апоптозиндуцирующее действие биназы на клетки меланомы и нормальные фибробласты.
Апоптозиндуцирующее действие биназы на клетки меланомы проверяют на культурах клеток метастатической меланомы кожи Mel Is и В-16. В качестве нормальных фибробластов используют культуру клеток мышиных фибробластов SC-1. Клетки культивируют на среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ глутамина и по 100 Ед/мл пенициллина и стрептомицина при 37°C в атмосфере 5% CO2.
Биназа в концентрации 8 мкМ за 48 ч в два раза снижает пролиферацию клеток Mel Is и В-16. Выживаемость клеток Mel Is под действием биназы снижается на 65%, а количество апоптических клеток в популяции увеличивается в три раза. В случае клеток В-16 количество апоптических клеток в популяции увеличивается с 4 до 30% под действием биназы, а выживаемость клеток снижается на 80%.
Проверка токсического действия биназы на нормальные фибробласты SC-1 показывает, что под действием фермента не наблюдается увеличения количества апоптических клеток в популяции через 48 ч действия даже при концентрации биназы 60 мкМ.
Пример 5. Апоптозиндуцирующее действие биназы на клетки рака шейки матки.
Апоптозиндуцирующее действие биназы на клетки рака шейки матки проверяют на культурах клеток эпителиоидной карциномы шейки матки человека SiHa и Каски. Клетки культивируют на питательной среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина. Клеточные культуры выращивают при 37°C в атмосфере 5% CO2.
Инкубация клеток SiHa и Каски с биназой в концентрации 8 мкМ в течение 48 ч приводит к снижению числа клеток в популяции в 2,5 и 3 раза соответственно. При этом выживаемость клеток SiHa падает на 75%, а клеток Каски на 80%. Количество клеток в апоптозе возрастает с 3% в контроле до 35% под действием биназы в клетках SiHa, и с 6% в контроле до 29% в присутствии биназы в клетках Каски.
Таким образом, разработанное средство для селективной апоптической элиминации опухолевых клеток - рибонуклеаза Bacillus sp.ВКПМ В-9862, обладает выраженным апоптогенным действием в отношении малигнизированных клеток человека и животных, эффективно подавляя их рост и пролиферацию. Существенным преимуществом препарата биназы перед аналогичными средствами животного происхождения является отсутствие общей токсичности. То, что биназа не оказывает токсического эффекта на нормальные клетки крови, печени, нервной ткани и фибробласты, предполагает на уровне организма отсутствие гепатотоксичности, нефротоксичности, треммора мышц, потери сознания, ориентации в пространстве.
Разработанное средство перспективно с позиций его использования в таких отраслях, как медицина и ветеринария, где оно может составить основу создания новых высокоэффективных противоопухолевых средств щадящей терапии, обладающих значительным потенциалом коммерческого использования. Данная микробная РНКаза не требует больших затрат при производстве, поскольку является внеклеточным ферментом и обладает весомым потенциалом модификации средствами биоинженерии и молекулярной генетики.
Источники информации
1. Ильинская О.Н. Почему рибонуклеазы вызывают гибель раковых клеток / О.Н. Ильинская, А.А. Макаров // Молекулярная биология - 2005. - Т. 39. - №1. - С. 1-11.
2. Saxena S.K. Onconase and its therapeutic potential / S.K. Saxena, K. Shogen, W. Ardelt // Lab. Med. - 2003. - V.34. - P. 380-387.
3. Antignani A. Antitumor action of seminal ribonuclease, its dimeric structure, and its resistance to the ribonuclease inhibitor / A. Antignani, M. Naddo, M.V. Cubellis, A. Russo, G. D′Alessio // Biochemistry. - 2001. - V.40. - P. 3492-3496.
4. Maeda T. Growth inhibition of mammalian cells by eosinophil cationic protein / T. Maeda, M. Kitazoe, H. Tada, R. de Llorens, D.S. Salomon, M. Ueda, H. Yamada, M. Seno // Eur. J. Biochem.- 2002. - V.269. - N.I. - P. 307-316.
5. Zelenikhin P.V. Binase induces apoptosis of transformed myeloid cells and does not induce T-cell immune response / O.N. Ilinskaya, P.V. Zelenikhin,
I.Y. Petrushanko, V.A. Mitkevich, V.S. Prassolov, A.A. Makarov // Biochem Biophys Res Commun.- 2007. - V.361. - P. - 1000-1005.
Применение рибонуклеазы Bacillus sp. ВКПМ В-9862 в качестве средства для селективной апоптотической элиминации опухолевых клеток.