Антитела против gdf8 человека
Иллюстрации
Показать всеИзобретение относится к биохимии. Описаны выделенные антитела человека, или гуманизированные антитела, или их антигенсвязывающие фрагменты, которые специфически связываются с фактором 8 роста и дифференциации (GDF8) и блокируют активность GDF8. Представлена фармацевтическая композиция, содержащая описанное антитело или антигенсвязывающий фрагмент. Описан способ ингибирования активности GDF8 у пациента, включающий введение представленной фармацевтической композиции. Изобретение расширяет средства, использующиеся в терапевтических способах лечения состояний или нарушений, которые ослабляются или улучшаются в результате ингибирования GDF8. 7 н. и 13 з.п. ф-лы, 4 ил., 27 табл., 13 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антителам и их антигенсвязывающим фрагментам, которые являются специфическими в отношении фактора 8 роста и дифференциации (GDF8).
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Фактор 8 роста и дифференциации (GDF8), также известный как миостатин, является членом суперсемейства факторов роста TGF-β. GDF8 является отрицательным регулятором массы скелетных мышц, высокой степени экспрессируемым в ходе развития, и скелетных мышц взрослых.
GDF8 является высоко консервативным для видов, и аминокислотные последовательности GDF8 мыши и человека являются идентичными (нуклеотидная последовательность и аминокислотная последовательность GDF8 человека представлены в SEQ ID NO:338-339) (McPherron et al. 1977 Nature 387:83-90).
Ряд заболеваний человека, например, мышечная дистрофия, мышечная атрофия, синдром истощения мышечной массы, саркопения и кахексия, сопровождаются уменьшением или повреждением мышечной ткани, и ингибиторы GDF8 могут использоваться для лечения этих заболеваний или нарушений.
Антитела против GDF8 и способы лечения описаны, например, в патентах США № 6096506, 7320789 и 7807159, в заявках WO 2007/047112 и WO 2005/094446, в заявке на патент США № 2007/0087000, в патенте США № 7261893 и в заявке WO 2010/070094.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам человека или гуманизированным антителам и антигенсвязывающим фрагментам антител человека или гуманизированных антител, которые специфически связываются с фактором 8 роста и дифференциации (GDF8). Эти антитела характеризуются связыванием с GDF8 с высокой аффинностью и способностью к нейтрализации активности GDF8. Антитела могут быть полноразмерными (например, антителом IgG1 или IgG4) или могут содержать только антигенсвязывающую часть (например, Fab-, F(ab')2- или scFv-фрагмент), и могут быть модифицированы для оказания воздействия на выполняемые функции, например, для исключения остаточных эффекторных функций (Reddy et al. (2000) J. Immunol. 164: 1925-1933).
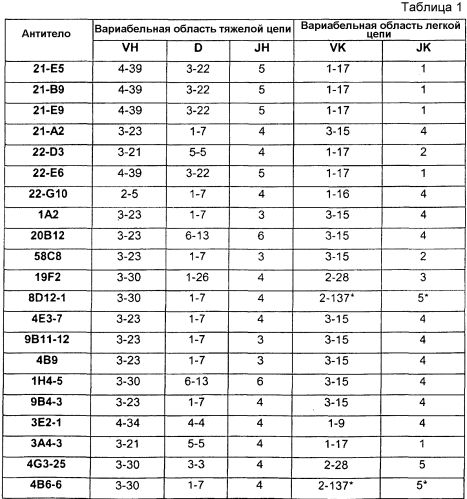
В одном из вариантов осуществления антитело по настоящему изобретению содержит аминокислотную последовательность вариабельной области тяжелой цепи (HCVR), выбранную из группы, состоящей из SEQ ID NO:2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 360 и 376, или в значительной степени идентичную ей последовательность.
В одном из вариантов осуществления антитело по настоящему изобретению содержит аминокислотную последовательность вариабельной области легкой цепи (LCVR), выбранную из группы, состоящей из SEQ ID NO:10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 322, 368 и 384, или в значительной степени идентичную ей последовательность.
В одном из вариантов осуществления антитело по настоящему изобретению содержит аминокислотную последовательность HCVR и аминокислотную последовательность LCVR, причем последовательности пар HCVR/LCVR выбраны из группы, состоящей из SEQ ID NO:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 114/322, 360/368 и 376/384.
Отличительным признаком настоящего изобретения служит также антитело человека или гуманизированное антитело или антигенсвязывающий фрагмент антитела, содержащее(ий) аминокислотную последовательность определяющего комплементарность участка 3 тяжелой цепи (HCDR3) и аминокислотную последовательность CDR3 легкой цепи (LCDR3), причем аминокислотная последовательность HCDR3 выбрана из группы, состоящей из SEQ ID NO:8, 24, 40, 56, 72, 88, 104, 120, 136, 152, 168, 184, 200, 216, 232, 248, 264, 280, 296, 312, 366 и 382, или в значительной степени идентичную ей последовательность, а аминокислотная последовательность LCDR3 выбрана из группы, состоящей из SEQ ID NO:16; 32, 48, 64, 80, 96, 112, 128, 144, 160, 176, 192, 208, 224, 240, 256, 272, 288, 304, 320, 328, 374 и 390, или содержащее(ий) в значительной степени идентичную ей последовательность. В другом варианте осуществления антитело или его фрагмент содержит пару аминокислотных последовательностей HCDR3/LCDR3, выбранную из группы, состоящей из SEQ ID NO:8/16, 24/32, 40/48, 56/64, 72/80, 88/96, 104/112, 120/128, 136/144, 152/160, 168/176, 184/192, 200/208, 216/224, 232/240, 248/256, 264/272, 280/288, 296/304, 312/320, 120/328, 366/374 и 382/390.
В соответствующем варианте осуществления антитело или его фрагмент, кроме того, содержит аминокислотные последовательности CDR1 тяжелой цепи (HCDR1) и CDR2 тяжелой цепи (HCDR2) и аминокислотные последовательности CDR1 легкой цепи (LCDR1) и CDR2 легкой цепи (LCDR2), причем аминокислотная последовательность HCDR1 выбрана из группы, состоящей из SEQ ID NO:4, 20, 36, 52, 68, 84, 100, 116, 132, 148, 164, 180, 196, 212, 228, 244, 260, 276, 292, 308, 362 и 378, или в значительной степени идентичную ей последовательность; аминокислотная последовательность HCDR2 выбрана из группы, состоящей из SEQ ID NO:6, 22, 38, 54, 70, 86, 102, 118, 134, 150, 166, 182, 198, 214, 230, 246, 262, 278, 294, 310, 364 и 380, или в значительной степени идентичную ей последовательность; аминокислотная последовательность LCDR1 выбрана из группы, состоящей из SEQ ID NO:12, 28, 44, 60, 76, 92, 108, 124, 140, 156, 172, 188, 204, 220, 236, 252, 268, 284, 300, 316, 324, 370 и 386, или в значительной степени идентичную ей последовательность; а аминокислотная последовательность LCDR2 выбрана из группы, состоящей из SEQ ID NO:14, 30, 46, 62, 78, 94, 110, 126, 142, 158, 174, 190, 206, 222, 238, 254, 270, 286, 302, 318, 326, 372 и 388, или в значительной степени идентичную ей последовательность. В другом варианте осуществления HCDR1, HCDR2 и HCDR3 выбраны из группы, состоящей из SEQ ID NO:36/38/40, 116/118/120, 228/230/232, 362/364/366 и 378/380/382; а LCDR1, LCDR2 и LCDR3 выбраны из группы, состоящей из SEQ ID NO:44/46/48, 124/126/128, 236/238/240, 370/372/374 и 386/388/390. Тем не менее, в другом варианте осуществления CDR тяжелой и легкой цепей выбрана из группы, состоящей из SEQ ID NO:36/38/40/44/46/48 (например, 21-E5), 116/118/120/124/126/128 (например, 8D12), 228/230/232/236/238/240 (например, 1A2), 362/364/366/370/372/374 (например, H4H1657N2) и 378/380/382/386/388/390 (например, H4H1669P).
В соответствующем варианте осуществления настоящее изобретение содержит антитело или антигенсвязывающий фрагмент антитела, которое(ый) специфически связывается с GDF8, причем антитело или фрагмент содержит CDR-домены тяжелой и легкой цепей, содержащиеся внутри последовательностей вариабельных доменов тяжелой и легкой цепей, выбранных из группы, состоящей из SEQ ID NO:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 114/322, 360/368 и 376/384. Способы и методы идентификации CDR внутри аминокислотных последовательностей HCVR и LCVR хорошо известны в данной области и могут использоваться для идентификации CDR внутри указанных аминокислотных последовательностей HCVR и/или LCVR, раскрытых в настоящем описании. Приводимые в качестве примера правила, которые могут использоваться для определения границ CDR, содержат, например, определение по Kabat, определение по Chothia, и определение в случае AbM. Вообще говоря, определение по Kabat основывается на вариабельности последовательностей, определение по Chothia основывается на местонахождении структурных петлевых участков, а определение в случае AbM является компромиссом между подходами Kabat и Chothia. См., например, Kabat, "Sequences of Proteins of Immunological Interest," National Institutes of Health, Bethesda, Md. (1991); AI-Lazikani et al., J. Mol. Biol. 273: 927-948 (1997); и Martin et al., Proc. Natl. Acad. Sci. USA 86: 9268-9272 (1989). В распоряжении также имеются общедоступные базы данных для идентификации последовательностей CDR внутри антитела.
Настоящее изобретение также относится к молекулам нуклеиновых кислот, кодирующим антитела или антигенсвязывающие фрагменты по настоящему изобретению. Настоящее изобретение также относится к рекомбинантным экспрессионным векторам, несущим кодирующие антитела нуклеиновые кислоты по настоящему изобретению, и клетки-хозяева, в которые такие векторы были введены, равно как и способы получения антител по настоящему изобретению путем культивирования клеток-хозяев по настоящему изобретению.
В одном из вариантов осуществления антитело по настоящему изобретению содержит HCVR, кодируемую нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1, 17, 33, 49, 65, 81, 97, 113, 129, 145, 161, 177, 193, 209, 225, 241, 257, 273, 289, 305, 359 и 375, или в значительной степени сходной с ней последовательностью, гомологичной ей по крайней мере на 95%.
В одном из вариантов осуществления антитело по настоящему изобретению содержит LCVR, кодируемую нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:9, 25, 41, 57, 73, 89, 105, 121, 137, 153, 169, 185, 201, 217, 233, 249, 265, 281, 297, 313, 321, 367 и 383, или в значительной степени сходной с ней последовательностью, гомологичной ей по крайней мере на 95%.
В одном из вариантов осуществления антитело по настоящему изобретению содержит аминокислотную последовательность HCVR и аминокислотную последовательность LCVR, причем последовательности пар HCV/LCVR кодируются парами молекул нуклеиновых кислот, выбранными из группы, состоящей из SEQ ID NO:1/9, 17/25, 33/41, 49/57, 65/73, 81/89, 97/105, 113/121, 129/137, 145/153, 161/169, 177/185, 193/201, 209/217, 225/233, 241/249, 257/265, 273/281, 289/297, 305/313, 113/321, 359/367 и 375/383.
Отличительным признаком настоящего изобретения служит также антитело человека или гуманизированное антитело или фрагмент антитела, содержащее(ий) HCDR3, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:7, 23, 39, 55, 71, 87, 103, 119, 135, 151, 167, 183, 199, 215, 231, 247, 263, 279, 295, 311, 365 и 381, или в значительной степени сходной с ней последовательностью, гомологичной ей на по крайней мере 95%, и LCDR3, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:15, 31, 47, 63, 79, 95, 111, 127, 143, 159, 175, 191, 207, 223, 239, 255, 271, 287, 303, 319, 327, 373 и 389, или в значительной степени сходной с ней последовательностью, гомологичной ей на по крайней мере 95%. В одном из вариантов осуществления совокупность HCDR3/LCDR3 кодируется парой нуклеотидных последовательностей, выбранной из группы, состоящей из SEQ ID NO:7/15, 23/31, 39/47, 55/63, 71/79, 87/95, 103/111, 119/127, 135/143, 151/159, 167/175, 183/191, 199/207, 215/223, 231/239, 247/255, 263/271, 279/287, 295/303, 311/319, 119/327, 365/373 и 381/389.
В соответствующем варианте осуществления антитело или фрагмент антитела, кроме того, содержит HCDR1 и HCDR2, и LCDR1 и LCDR2, причем HCDR1 кодируется нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:3, 19, 35, 51, 67, 83, 99, 115, 131, 147, 163, 179, 195, 211, 227, 243, 259, 275, 291, 307, 361 или 377, или в значительной степени сходной с ней последовательностью, гомологичной ей на по крайней мере 95%, HCDR2 кодируется нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:5, 21, 37, 53, 69, 85, 101, 117, 133, 149, 165, 181, 197, 213, 229, 245, 261, 277, 293, 309, 363 и 379, или в значительной степени сходной с ней последовательностью, гомологичной ей на по крайней мере 95%, LCDR1 кодируется нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:11, 27, 43, 59, 75, 91, 107, 123, 139, 155, 171, 187, 203, 219, 235, 251, 267, 283, 299, 315, 323, 369 и 385, или в значительной степени сходной с ней последовательностью, гомологичной ей по крайней мере на 95%, а LCDR2 кодируется нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:13, 29, 45, 61, 77, 93, 109, 125, 141, 157, 173, 189, 205, 221, 237, 253, 269, 285, 301, 317, 325, 371 и 387, или в значительной степени сходной с ней последовательностью, гомологичной ей на по крайней мере 95%. В одном из вариантов осуществления антитело или фрагмент антитела содержит CDR тяжелой и легкой цепей, кодируемые совокупностями последовательностей нуклеиновых кислот SEQ ID NO:35/37/39/43/45/47, 115/117/119/123/125/127, 227/229/231/235/237/239, 361/363/365/369/371/373 или 377/379/381/385/387/389.
Отличительным признаком настоящего изобретения служит также выделенное антитело или фрагмент антитела, которое(ый) специфически связывается с GDF8, содержащее(ий) CDR тяжелой и легкой цепи, выбранные из группы, состоящей из (a) HCDR1, содержащего аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO:329), где X1 представляет собой Gly; X2 представляет собой Phe; X3 представляет собой Thr; X4 представляет собой Phe; X5 представляет собой Ser; X6 представляет собой Ala или Ser; X7 представляет собой Phe или Tyr; X8 представляет собой Gly или Ala; (b) HCDR2, содержащего аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO:330), где X1 представляет собой Ile; X2 представляет собой Gly или Ser; X3 представляет собой Tyr или Gly; X4 представляет собой Ser или Asp; X5 представляет собой Gly; X6 представляет собой Gly; X7 представляет собой Ser или Asn; а X8 представляет собой Ala или Glu; (c) HCDR3, содержащего аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14 (SEQ ID NO:331), где X1 представляет собой Ser или Ala; X2 представляет собой Thr или Lys; X3 представляет собой Asp или Ile; X4 представляет собой Gly или Ser; X5 представляет собой Ala или His; X6 представляет собой Trp или Tyr; X7 представляет собой Lys или Asp; X8 представляет собой Met или Ile; X9 представляет собой Ser или Leu; X10 представляет собой Gly или Ser; X11 представляет собой Leu или Gly; X12 представляет собой Asp или Met; X13 представляет собой Val или Asp; X14 представляет собой Val или отсутствует; и (d) LCDR1, содержащего аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6 (SEQ ID NO:332), где X1 представляет собой Gln; X2 представляет собой Asp или Gly; X3 представляет собой Ile; X4 представляет собой Ser; X5 представляет собой Asp или Asn; а X6 представляет собой Tyr или Trp; (e) LCDR2, содержащего аминокислотную последовательность формулы X1-X2-X3 (SEQ ID NO:333), где X1 представляет собой Thr или Ala; X2 представляет собой Thr или Ala; а X3 представляет собой Ser; и (f) LCDR3-участка, содержащего аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO:334), где X1 представляет собой Gln; X2 представляет собой Lys или Gln; X3 представляет собой Ala или Tyr; X4 представляет собой Asp или Asn; X5 представляет собой Ser; X6 представляет собой Ala или Phe; X7 представляет собой Pro; X8 представляет собой Leu; и X9 представляет собой Thr.
Методика определения вышеуказанных консенсусных последовательностей (SEQ ID NO:329-334) показана на фиг. 4A и 4B.
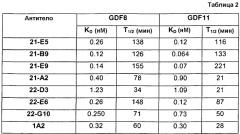
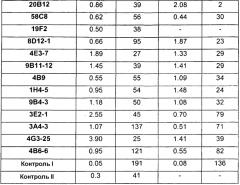
Отличительным признаком настоящего изобретения служит также полностью антитело человека или гуманизированное антитело или фрагмент антитела, которое связывается с CDF8 с аффинностью (выражаемой в виде константы диссоциации, «KD»), составляющей приблизительно 1 нМ или менее, как определено с помощью анализа с использованием поверхностного плазмонного резонанса (например, BIACORETM). В некоторых вариантах осуществления антитело по настоящему изобретению демонстрирует KD, составляющую приблизительно 700 пМ или менее; приблизительно 500 пМ или менее; приблизительно 320 пМ или менее; приблизительно 160 пМ или менее; приблизительно 100 пМ или менее; приблизительно 50 пМ или менее; приблизительно 10 пМ или менее, или приблизительно 5 пМ или менее.
В одном из вариантов осуществления настоящее изобретение относится к полностью антителу человека или гуманизированному моноклональному антителу (mAb), которое специфически связывается с GDF8 человека и ингибирует его, и демонстрирует IC50, составляющую менее или равную приблизительно 10 нМ; приблизительно 5 нМ или менее; приблизительно 3 нМ или менее; приблизительно 2 нМ или менее; приблизительно 1 нМ или менее; приблизительно 500 пМ или менее, или приблизительно 200 пМ, или менее, как определено с помощью исследования индуцируемой GDF8 люциферазной активности. Как показано в экспериментальной части ниже, некоторые из антител против GDF8 по настоящему изобретению блокируют активность близкородственных белков, таких как GDF11, с намного большей IC50, чем GDF8 в биологическом исследовании люциферазной активности. В одном из вариантов осуществления настоящее изобретение относится к антителу или антигенсвязывающему фрагменту антитела, которое демонстрирует IC50 в случае блокирования активности GDF11, превышающую в по крайней мере приблизительно 10 раз, по крайней мере приблизительно 50 раз, по крайней мере приблизительно 100 раз, по крайней мере приблизительно 200 раз, по крайней мере приблизительно 500 раз, по крайней мере приблизительно 1000 раз или по крайней мере приблизительно 1500 раз таковую в случае блокирования активности GDF8.
Настоящее изобретение относится к антителу против GDF8, характеризующемуся измененным профилем гликозилирования. В вариантах использования может быть эффективной модификация для удаления нежелательных сайтов гликозилирования, или антитело, в котором отсутствует составляющая в виде фукозы, присутствующая в олигосахаридной цепи, например, для усиления функции антителозависимой клеточноопосредованной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277: 26733). В случае других вариантов использования можно изменить галактозилирование для изменения комплементзависимой цитотоксичности (CDC).
Настоящее изобретение относится к антителам против GDF8, которые связываются со специфическими эпитопами GDF8 и способны к блокировке биологической активности GDF8. В первом варианте осуществления антитело по настоящему изобретению связывается с эпитопом зрелого белка GDF8 (SEQ ID NO:340) в пределах аминокислот с приблизительно 1 до приблизительно 109; с приблизительно 1 до приблизительно 54; с приблизительно 1 до приблизительно 44; с приблизительно 1 до приблизительно 34; с приблизительно 1 до приблизительно 24 и с приблизительно 1 до приблизительно 14. Во втором варианте осуществления антитело по настоящему изобретению связывается с одним или более эпитопов зрелого белка GDF8 (SEQ ID NO:340) в пределах аминокислот с приблизительно 35 до приблизительно 109; с приблизительно 45 до приблизительно 109; с приблизительно 55 до приблизительно 109; с приблизительно 65 до приблизительно 109; с приблизительно 75 до приблизительно 109; с приблизительно 85 до приблизительно 109; с приблизительно 92 до приблизительно 109 или с приблизительно 95 до приблизительно 109. В третьем варианте осуществления антитело или антигенсвязывающий фрагмент антитела связывается в эпитопе зрелого белка GDF8 человека с приблизительно аминокислотного остатка 48 до приблизительно 72; с приблизительно 48 до приблизительно 69; с приблизительно 48 до приблизительно 65; с приблизительно 52 до приблизительно 72; с приблизительно 52 до приблизительно 65 или с приблизительно 56 до приблизительно 65.
В соответствующем варианте осуществления настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которое(ый) конкурирует за специфическое связывание с GDF8 с другим антителом, содержащим комбинацию аминокислотных последовательностей HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3 - SEQ ID NO:36/38/40/44/46/48, 116/118/120/124/126/128, 228/230/232/236/238/240, 362/364/366/370/372/374 или 378/380/382/386/388/390. В одном из вариантов осуществления антитело или антигенсвязывающий фрагмент по настоящему изобретению конкурирует за специфическое связывание с GDF8 с другим антителом, содержащим пару аминокислотных последовательностей HCVR/LCVR - SEQ ID NO:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 94/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 114/322, 360/368 или 376/384. Тем не менее, в другом связанном с этим варианте осуществления настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которое(ый) распознает эпитоп GDF8, который распознается другим антителом, содержащим комбинацию аминокислотных последовательностей HCDR/LCDR - SEQ ID NO:36/38/40/44/46/48, 116/118/120/124/126/128, 228/230/232/236/238/240, 362/364/366/370/372/374 или 378/380/382/386/388/390. В одном из вариантов осуществления антитело или антигенсвязывающий фрагмент по настоящему изобретению распознает эпитоп GDF8, который распознается другим антителом, содержащим пару аминокислотных последовательностей HCVR/LCVR - SEQ ID NO:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 114/322, 360/368 или 376/384.
Настоящее изобретение также относится к композиции, содержащей рекомбинантное антитело человека или гуманизированное антитело против GDF8 человека и приемлемый носитель. Настоящее изобретение, кроме того, относится к векторам и клеткам-хозяина, содержащим векторы, которые содержат молекулы нуклеиновых кислот, кодирующие антитело человека против GDF8 по настоящему изобретению, а также к способам получения этих новых антител, включающим выращивание клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело против GDF8 по настоящему изобретению или фрагмент антитела, в условиях, дающих возможность получить белок и выделить полученный таким образом белок.
Настоящее изобретение также относится к способам ингибирования активности GDF8 с использованием антитела или его антигенсвязывающей части по настоящему изобретению. В одном из вариантов осуществления способ включает введение антитела или фрагмента антитела по настоящему изобретению человеку, страдающему нарушением, которое ослабляется в результате ингибирования активности GDF8. В предпочтительных вариантах осуществления человек, получающий лечение антителом или фрагментом антитела по настоящему изобретению, нуждается в улучшение гомеостаза глюкозы, уменьшении жировой массы, увеличении чувствительности к инсулину, улучшению функционирования почек и/или уменьшении жирового отложения. Антитело или фрагмент антитела по настоящему изобретению можно использовать для лечения, профилактики или подавления заболевания или состояния, характеризующегося уменьшением костной массы, содержащего остеопороз, остеопению, остеоартрит и переломы кости, лечения метаболического синдрома, противодействия истощению мышечной массы в результате длительного введения глюкокортикоида или стероидного гормона, или уменьшению мышечной массы, связанному с мышечной дистрофией, мышечной атрофией, синдромом истощения мышечной массы, саркопенией и кахексией.
Другие варианты и преимущества станут очевидными в результате ознакомления со следующим подробным описанием.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Иммуноблот ограниченного протеолиза GDF8 человека с помощью протеиназы K. Гели представляли собой 18% SDS-ПААГ для электрофореза в невосстанавливающих условиях с загрузкой 0,2 мкг GDF8 на каждую дорожку и использованием 2 мкг/мл любого из антител - контроля I (А), 1А2 (В) или 21-Е9 (С). Дорожка 1: время расщепления - 10 мин, 1 мкг GDF8, 0 мкг протеиназы К; Дорожка 2: время расщепления - 10 мин, 1 мкг GDF8, 1 мкг протеиназы К; Дорожка 3: время расщепления - 10 мин, 1 мкг GDF8, 6 мкг протеиназы К; Дорожка 4: время расщепления - 45 мин, 1 мкг GDF8, 0 мкг протеиназы К; Дорожка 5: время расщепления - 4 5 мин, 1 мкг GDF8, 1 мкг протеиназы К; Дорожка 6: время расщепления -4 5 мин, 1 мкг GDF8, 6 мкг протеиназы К.
Фиг. 2. Иммуноблот ограниченного протеолиза GDF8 человека с использованием больших доз протеиназы К. Гели представляли собой 18% SDS-ПААГ для электрофореза в невосстанавливающих условиях с загрузкой 0 или 4 мкг GDF8 на каждую дорожку и использованием 2 мкг/мл любого из антител - контроля I (А) или 1А2 (В). Дорожка 1: время расщепления - 16 ч, 0 мкг GDF8, 9 6 мкг протеиназы К; Дорожка 2: время расщепления - 16 ч, 4 мкг GDF8, 0 мкг протеиназы К; Дорожка 3: время расщепления - 16 ч, 4 мкг GDF8, 24 мкг протеиназы К; Дорожка 4: время расщепления - 16 ч, 4 мкг GDF8, 96 мкг протеиназы К; Дорожка 5: время расщепления - 1 ч, 4 мкг GDF8, 2 4 мкг протеиназы К; Дорожка 6: время расщепления - 1 ч, 4 мкг GDF8, 9 6 мкг протеиназы К; Дорожка 7: время расщепления 10 мин, 4 мкг GDF8, 0 мкг протеиназы К; Дорожка 8: время расщепления - 10 мин, 4 мкг GDF8, 24 мкг протеиназы К.
Фиг. 3А и 3В. Графики, демонстрирующие процент от исходных уровней глюкозы в динамике по времени у мышей, подвергнутых проверке на чувствительность к инсулину до (фиг .3А) и после (фиг. 3В) лечения антителом.
Фиг. 4А и 4В. Совмещение аминокислотных последовательностей
CDR тяжелой цепи (фиг. 4A) и CDR легкой цепи (фиг. 4B) приводимых в качестве примера антител против GDF8 H4H1657N2 и H4H1669P, демонстрирующее консенсусные последовательности, общие для этих последовательностей.
ПОДРОБНОЕ ОПИСАНИЕ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Перед описанием способов по настоящему изобретению следует отметить, что настоящее изобретение не ограничивается описываемыми конкретными способами и экспериментальными условиями, и такие способы и условия могут изменяться. Также следует понимать, что используемая в настоящем описании терминология служит в целях описания конкретных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения ограничен лишь прилагаемой формулой изобретения.
Используемые в этом описании изобретения и прилагаемой формуле изобретения формы единственного числа включают указания на множественное число, если только контекст явно не подразумевает иное. Таким образом, например, указание на “способ” включает один или более способов, и/или операций описываемого в настоящем описании типа, и/или которые станут очевидны квалифицированным в данной области специалистам после прочтения настоящего описания изобретения.
Если не указано иного, все технические и научные термины, используемые в настоящем описании, имеют значение, одинаковое с тем, в котором они обычно подразумеваются средним специалистом в области, к которой относится настоящее изобретение. Используемый термин «приблизительно», при использовании в отношении конкретного изложенного числового значения, означает, что это значение может отличаться от изложенного значения на более чем 1%. Например, используемое в настоящем описании выражение «приблизительно 100» включает 99 и 101, и все значения между ними (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
Хотя любые способы и материалы, аналогичные с описываемыми в настоящем описании способами или материалами или эквивалентные им, могут использоваться при осуществлении на практике или осуществлении настоящего изобретения, ниже описаны предпочтительные способы и материалы.
Определения
«Фактор-8 роста и дифференциации человека», «GDF8» и «миостатин» используются взаимозаменяемо для обозначения белка, кодируемого последовательностью нуклеиновой кислоты SEQ ID NO:338, и белка с аминокислотной последовательностью SEQ ID NO:339 (пропептид) и 340 (зрелый белок).
Используемый в настоящем описании термин «антитело», как предполагается, относится к молекулам иммуноглобулинов, содержащим четыре полипептидных цепи, две тяжелые (H) цепи и две легкие (L) цепи, связанные с помощью дисульфидных связей, а также их мультимерам (например, IgM). Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (в настоящем описании сокращенно HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (в настоящем описании сокращенно LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен (CL1). VH- и VL-области можно, кроме того, подразделить на участки гипервариабельности, называемые определяющими комплементарность участками (CDR), чередующиеся с областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, с расположением от амино-конца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В различных вариантах осуществления настоящего изобретения FR антитела против GDF8 (или его антигенсвязывающей части) могут быть идентичны последовательностям зародышевой линии человека, или они могут природно или искусственно модифицированными. Аминокислотную консенсусную последовательность можно определить на основе одновременного анализа двух или более CDR.
Используемый в настоящем описании термин «антитело» также содержит антигенсвязывающие фрагменты полноразмерных молекул антитела. Используемые в настоящем описании термины «антигенсвязывающая часть» антитела, «антигенсвязывающий фрагмент» антитела и т.п. содержат встречающийся в природе, ферментативно получаемый, синтетический или полученный с помощью методов генетической инженерии полипептид или гликопротеин, который специфически связывается с антигеном с образованием комплекса. Антигенсвязывающие фрагменты антитела можно получить, например, из полноразмерных молекул антител, используя любые подходящие стандартные способы, такие как протеолитическое расщепление или способы генетической инженерии для создания рекомбинантных молекул, содержащие манипулирование ДНК, кодирующей вариабельные и необязательно константные домены, и ее экспрессию. Такая ДНК известна и/или легкодоступна, например, из коммерческих источников, библиотек ДНК (содержащих, например, библиотеки антител в фагах), или ее можно синтезировать. ДНК можно подвергнуть секвенированию и химическому манипулированию или манипулированию с использованием способов молекулярной биологии, например, с целью приведения одного или более вариабельных и/или константных доменов в подходящую конфигурацию или с целью введения кодонов, создания остатков цистеина, модифицирования, добавления или делетирования аминокислот и т.д.
Неограничивающие примеры антигенсвязывающих фрагментов включают: (i) Fab-фрагменты; (ii) F(ab')2-фрагменты; (iii) Fd- фрагменты; (iv) Fv-фрагменты; (v) одноцепочечные Fv (scFv) молекулы; (vi) dAb-фрагменты и (vii) минимальные рекогниционные единицы, состоящие из аминокислотных остатков, которые имитируют гипервариабельный участок антитела (например, выделенный определяющий комплементарность участок (CDR)). В используемое в настоящем описании выражение «антигенсвязывающий фрагмент» также включены другие сконструированные молекулы, такие как диатела, триатела, тетратела и минитела.
Антигенсвязывающий фрагмент антитела, как правило, содержит по крайней мере один вариабельный домен. Вариабельный домен может быть любого размера или с любым составом аминокислот и будет, как правило, содержать по крайней мере один CDR, который расположен рядом или в рамке считывания с одной или более последовательностей каркасных областей. В антигенсвязывающих фрагментах, содержащих VH-домен, связанный с VL-доменом, VH- и VL-домены могут располагаться относительно друг друга в любом подходящем порядке. Например, вариабельная область может быть димерной и содержать димеры VH-VH, VH-VL или VL-VL. Альтернативно, антигенсвязывающий фрагмент антитела может содержать мономерный VH- или VL-домен.
В некоторых вариантах осуществления антигенсвязывающий фрагмент антитела может содержать по крайней мере один вариабельный домен, ковалентно связанный с по крайней мере одним константным доменом. Неограничивающие, приводимые в качестве примера конфигурации вариабельных и константных доменов, которые можно обнаружить в антигенсвязывающем фрагменте антитела по настоящему изобретению, включают: (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3 и (xiv) VL-CL. В случае любой конфигурации вариабельных и константных доменов, в том числе любой из приводимых в качестве примера конфигураций, перечисленных выше, вариабельные и константные домены могут быть связаны друг с другом либо непосредственно, либо с помощью полноразмерной или частичной шарнирной или линкерной области. Шарнирная область может состоять из по крайней мере 2 (например, 5, 10, 15, 20, 40, 60 или более) аминокислот, которые приводят к гибкому или полужесткому соединению между соседними вариабельными и/или константными доменами в одной полипептидной молекуле. Сверх того, антигенсвязывающий фрагмент антитела по настоящему изобретению может включать гомодимер или гетеродимер (или другой мультимер) любой из перечисленных выше конфигураций вариабельных и константных доменов в нековалентном соединении с одним другим мономерным VH- или VL-доменом и/или с одним или более мономерных VH- или VL-доменов (например, с помощью дисульфидной связи(ей)).
Как и в случае полноразмерных молекул антител, антигенсвязывающие фрагменты могут быть моноспецифическими или полиспецифическими (например, биспецифическими). Полиспецифический антигенсвязывающий фрагмент антитела, как правило, содержит по крайней мере два различных вариабельных домена, причем каждый вариабельный домен способен к специфическому связыванию с отдельным антигеном или с отличным эпитопом одного и того же антигена. Любой формат полиспецифического антитела, в том числе приводимые в качестве примера форматы биспецифического антитела, описываемые в настоящем описании, можно приспособить для применения в ситуации антигенсвязывающего фрагмента антитела по настоящему изобретению, используя стандартные способы, имеющиеся в данной области.
Антитела по настоящему изобретению могут функционировать в ходе комплементзависимой цитотоксичности (CDC) или антителозависимой клеточноопосредованной цитотоксичности (ADCC). «Комплементзависимая цитотоксичность» (CDC) относится к лизису экспрессирующих антиген клеток под действием антитела по настоящему изобретению в присутствии комплемента. «Антителозависимая клеточноопосредованная цитотоксичность» (ADCC) относится к клеточноопосредованной реакции, в ходе которой неспецифические цитотоксические клетки, экспрессирующие рецепторы Fc (FcR), (например, являющиеся природными киллерами (NK) клетки, нейтрофилы и макрофаги) распознают связавшееся антитело на поверхности клетки-мишени и в связи с этим приводят к лизису клетки-мишени. CDC и ADCC можно определить, используя исследования, которые хорошо известны и имеются в данной области. (См., например, патенты США № 5500362 и 5821337 и Clynes et al., Proc. Natl. Acad. Sci. (USA) 95: 652-656 (1998)).
Термин «специфически связывается», или тому подобный, означает, что антитело или его антигенсвязывающий фрагмент образует комплекс с антигеном, который является относительно стабильным в физиологических условиях. Специфическое связывание может характеризоваться константой диссоциации, составляющей 1×10-6 M или менее. Способы определения того, связываются ли две молекулы специфически, хорошо известны в данной области и содержат, например, равновесный диализ, поверхностный плазмонный резонанс и т.п. Например, антитело, которое «специфически связывается» с GDF8 человека, как используется в рамках по настоящему изобретению, содержит антитела, которые связываются с GDF8 человека или его частью (например, пептидом, содержащим по крайней мере 6 следующих друг за другом аминокислот SEQ ID NO: 340), с KD, составляющей менее чем приблизительно 1000 нМ, менее чем приблизительно 500 нМ, менее чем приблизительно 300 нМ, менее чем приблизительно 200 нМ, менее чем приблизительно 100 нМ, менее чем приблизительно 90 нМ, менее чем приблизительно 80 нМ, менее чем приблизительно 70 нМ, менее чем приблизительно 60 нМ, менее чем приблизительно 50 нМ, менее чем приблизительно 40 нМ, менее чем приблизительно 30 нМ, менее чем приблизительно 20 нМ, менее чем приблизительно 10 нМ, менее чем приблизительно 5 нМ, менее чем приблизительно 4 нМ, менее чем приблизительно 3 нМ, менее чем приблизительно 2 нМ, менее чем приблизительно 1 нМ или менее чем приблизительно 0,5 нМ, как определено в исследовании с использованием поверхностного плазмонного резонанса. (См., например, пример 3, в настоящем описании). Выделенное антитело, которое специфически связывается с GDF8 человека, может, однако, обладать перекрестной реактивностью с другими антигенами, такими как молекулы GDF8 других видов.
Термин антитело с «высокой аффинностью» относится к таким антителам, которые способны к связыванию с GDF8 с константной диссоциации (KD), составляющей приблизительно 10-8 M или менее, приблизительно 10-9 M или менее, приблизительно 10-10 M или менее, приблизительно 10-11 M или менее или приблизительно 10-12 M или менее, как определено с помощью поверхностного плазмонного резонанса, например, BIACORETM, или ELISA для определения аффинности в растворе.
Под термином «медленная скорость диссоциации» или «Koff» подразумевается, что антитело подвергается диссоциации от GDF8 с константой скорости, составляющей 1×10-3 сек-1 или менее, предпочтительно, 1×10-4 сек-1 или менее, как определено с помощью поверхностного плазмонного резонанса, например, BIACORETM.
«Нейтрализующее» или «блокирующее» антитело, как предполагается, относится к антителу, связывание которого с GDF8 приводит к ингибированию биологической активности GDF8. Это ингибирование биологической активности GDF8 можно оценить посредством определения одного или более индикаторов биологической активности GDF8. Оценку этих индикаторов биологической активности GDF8 можно осуще